Introducción
El garbanzo (Cicer arietinum L.) es la segunda leguminosa alimenticia más importante en el mundo, después del frijol (Phaseolus vulgaris L.). En Sinaloa, México, el cultivo de garbanzo es importante porque genera divisas al exportar casi toda su producción; este estado es el productor y exportador principal de garbanzo blanco de México (Guerrero et al., 2015). En el 2013, en Sinaloa se sembraron 61 600 ha con garbanzo blanco y la producción fue 103 645 Mg (SIAP, 2014). Un factor principal que limita el éxito de la producción de este cultivo, en el mundo, es la fusariosis vascular del garbanzo ocasionada por Fusarium oxysporum f. sp. ciceris (Jiménez y Jiménez, 2011). Las pérdidas causadas por el hongo van de 10 a 40 % de la cosecha anual, y puede devastar por completo al cultivo en condiciones favorables para el desarrollo de la enfermedad (Guerrero et al., 2015).
Este hongo es difícil de controlar porque resiste los principales fungicidas y fumigantes, y puede permanecer en estado latente en el suelo a través de las clamidiosporas, estructuras que representan el inóculo inicial para las epidemias en los siguientes ciclos de cultivo. En Sinaloa, la fusariosis vascular del garbanzo es la enfermedad más importante (Velarde et al., 2013), y el método de control principal es la aplicación de fungicidas y fumigantes al suelo. Sin embargo, algunos de estos productos pueden dañar los cultivos por efectos fitotóxicos y eliminar los organismos benéficos, ya que no son específicos. Esto y los problemas de seguridad y salud pública inherentes a la fabricación y uso de agroquímicos, así como la posible contaminación difusa a los cuerpos de agua subterráneos, causan la búsqueda y establecimiento de alternativas ecológicas de manejo de esta enfermedad. Por lo tanto, es importante identificar y estudiar cepas de microorganismos antagonistas nativos, que optimicen el éxito como agentes de biocontrol de la fusariosis vascular del garbanzo por su probada adaptación al ambiente de origen.
Trichoderma spp. y Bacillus spp. se han propuesto como agentes de control biológico, en especial contra fitopatógenos del suelo (Verma et al., 2007). Trichoderma spp. utiliza mecanismos de acción antagónica como micoparasitismo, lisis, antibiosis, competencia por nutrientes y espacio o inducción de resistencia, o ambos, en el hospedero (De la Garza, 1996). Bacillus spp. es una bacteria promotora de crecimiento vegetal, además de tener un efecto protector contra patógenos del suelo (Butt et al., 1999). El potencial de las especies del género Bacillus se demostró para la producción de antibióticos, enzimas, la solubilización de fosfatos (Chen et al., 2006) y la fijación biológica del nitrógeno (Ooi et al., 2008).
La hipótesis de este estudio fue que cepas bacterianas y fúngicas nativas son una alternativa para el control de la fusariosis vascular del garbanzo por su actividad inhibitoria frente a F. oxysporum f. sp. ciceris y su efecto promotor de crecimiento y vigor de las plantas de garbanzo que causará un mejor rendimiento de grano. Los objetivos fueron: 1) determinar el potencial de cepas bacterianas y cepas fúngicas, nativas de Sinaloa, como agentes de biocontrol de la fusariosis vascular del garbanzo en pruebas in vitro y en la planta; 2) identificar el mecanismo de control de las cepas fúngicas; 3) evaluar el efecto promotor de las cepas bacterianas y fúngicas en la altura, contenido de clorofila, peso de biomasa húmeda y seca en las plantas, así como en el rendimiento de grano.
Materiales y Métodos
Origen de los aislamientos
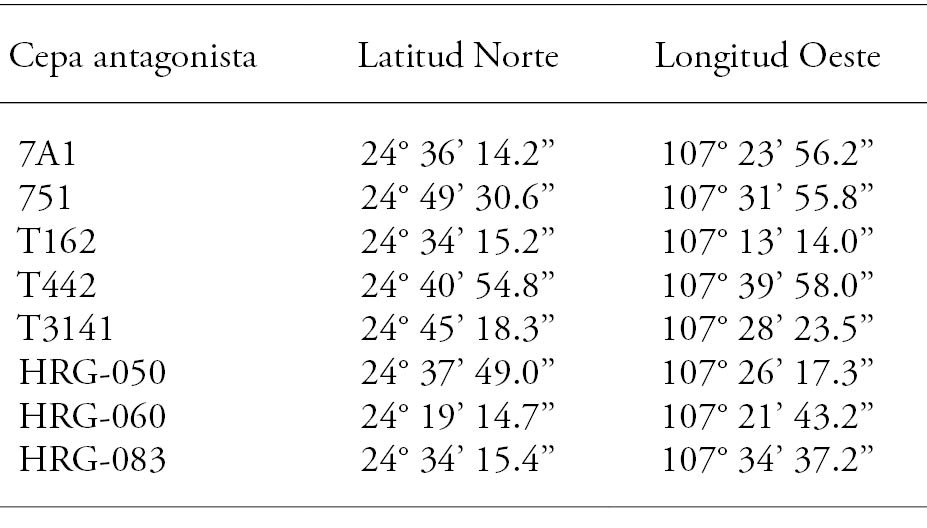
El aislamiento 303CS de F. oxysporum f. sp. ciceris raza 5 (número de accesión KJ000584 del GenBank) usado en el estudio fue proporcionado por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pesqueras. Como agentes de control biológico se usaron las siguientes cepas de la colección del Centro de Ciencias de Sinaloa (CCS): bacterias del género Bacillus sp. cepas T442, T3141; bacterias del género Pseudomonas sp. cepas T162, 7A1 y 751; hongos del género Trichoderma sp. cepas HRG-050, HRG-060 y HRG-083, previamente aisladas de campos cultivados con garbanzo y con presencia de la enfermedad (Cuadro 1).
Activación de los aislamientos
Las bacterias se cultivaron por asadas en placas Petri con medio de cultivo a base de Agar FLO (20 g mezcla de peptonas, 14 g agar-agar, 15 g K2HPO4, 15 g MgSO4 y 1.0 L H2O destilada) para las cepas de Pseudomonas; medio de agar nutritivo para Bacillus (5 g peptona de gelatina, 3 g extracto de carne, 15 g agar-agar, 1 L H2O destilada); para el crecimiento de las cepas fúngicas y la cepa de Foc raza 5 se usó el método de inclusión de porción (Leslie y Sumerell, 2006). Para lo anterior, discos de 1 cm de diámetro de cada cepa se colocaron en el centro de las placas Petri con medio de cultivo PDA (4.0 g infusión de papa, 20 g dextrosa, 15 g agar y pH final de 5.6±0.2). Las placas se incubaron a 28 °C; las bacterias 24 h y los hongos 5 d.
Pruebas de antagonismo in vitro de los antagonistas frente a Foc raza 5
La actividad antagónica de las cepas se estudió mediante la técnica de cultivo dual (Ezziyyani et al., 2004), en placas Petri con medio de cultivo PDA. En las confrontaciones de las cepas bacterianas frente a Foc raza 5, se colocó un disco de 1 cm de diámetro del fitopatógeno crecido en PDA en un extremo de la placa, y 3 d después se puso la cepa bateriana en el centro de la placa por asada gruesa. Para las cepas fúngicas antagonistas se usó el método de porción para la siembra (Howell, 2003): en un extremo se colocó un disco de 1 cm de diámetro de Foc raza 5 y 5 d después se sembró al otro extremo un disco del mismo tamaño del antagonista. Las placas inoculadas fueron incubadas 7 d a 28 °C. La evaluación de la capacidad antagónica de las cepas, se determinó mediante el Porcentaje de Inhibición del Crecimiento Radial (PICR), con la fórmula:
PICR=[(R1-R2)/100] (Suárez et al., 2008)
donde
PICR es el porcentaje de inhibición en el crecimiento del micelio del fitopatógeno.
R1 es el crecimiento radial mayor (radio del micelio del patógeno-testigo).
R2 es el radio menor (radio del micelio del patógeno en cultivo dual).
El grado de micoparasitismo ejercido por las cepas de Trichoderma se determinó con la superficie que colonizó en la caja Petri en presencia del fitopatógeno, según la escala de Bell et al. (1982) (Cuadro 2).
Las confrontaciones se observaron con microscopio óptico para determinar el mecanismo de antagonismo ejercido por Trichoderma sobre el hongo patógeno. Así mismo, se cuantificó el total de haustorios formados por las cepas de Trichoderma en los enfrentamientos con Foc a los 5 d después de la siembra, para lo cual se tomaron cinco muestras al azar de 1 cm2 de medio de la caja Petri con la confrontación entre el antagonista y Foc y se observó al microscopio.
El diseño experimental fue completamente al azar con cuatro repeticiones por tratamiento (Cuadro 3), cada repetición contenía una confrontación (unidad experimental). Con los datos se realizó un ANDEVA, y la prueba de comparación de medias de Tukey (p≤0.05) con SAS 9.0 (SAS Institute, 2002).
Producción del inóculo
La producción de inóculo de los microorganismos se realizó en matraces de 500 mL, tomando el material biológico con asada y bajo condiciones asépticas, dentro de una campana de flujo laminar y utilizando como medio de cultivo para Pseudomonas 300 mL de caldo de soya tripticaseina (17 g peptona de caseína, 3 g peptona de soya, 5 g NaCl, 2.5 g K2HPO4, 2.5 g dextrosa y pH final de 7.3±0.2); para Bacillus se empleó 300 mL de caldo nutritivito (5 g peptona, 3 g extracto de carne y pH final 6.9±0.2); para la producción de inóculo de Trichoderma se empleó 300 mL de agar papa dextrosa (PDA). Los matraces inoculados con su respectiva cepa se incubaron 5 d a 28 °C, con agitación de 150 rpm. Su contendido se colocó en tubos (Falcón) de 50 mL y centrifugó a 3800 rpm por 20 min a temperatura ambiente, y se cosechó la biomasa. Luego, semillas de garbanzo Blanco Sinaloa 92 fueron tratadas con una concentración de 1×108 ufc mL-1 con las cepas bacterianas usando el método de Mc Farland 139 (Ortigoza y Ruiloba, 1998) y la estandarización de suspensiones bacterianas se realizó por el método de turbidez. Con las cepas fúngicas, las semillas fueron tratadas a una concentración de 1×108 conidios mL-1 utilizando el método de la cámara de Neubauer (Ferron, 1981).
Experimento en invernadero
Las semillas inoculadas se sembraron en macetas con 12 L de sustrato (Peat Moss). Previo a la siembra, el sustrato (esterilizado en autoclave) se inoculó con F. oxysporum f. sp. ciceris (Foc) raza 5 con una concentración de 1×108 conidios mL-1. El diseño experimental fue completamente al azar con cinco repeticiones por tratamiento (Cuadro 3); cada repetición tenía 10 macetas, y cada maceta contenía dos plantas (20 plantas por repetición). La siembra se efectuó en diciembre de 2013; el riego se realizó 15 d después de la siembra, y se empleó la solución nutritiva de Murashige-Skoog (1962).
Las variables de respuesta evaluadas fueron: vigor de la planta, estimado por el porcentaje de desarrollo y flacidez; marchitez en follaje, considerando su porcentaje de clorosis; podredumbre en raíz, evaluado en porcentaje de necrosis con escalas subjetivas de estimación visual (Cuadro 4). También se evaluó el verdor en planta mediante el contenido de clorofila de las hojas usando un SPAD 502 (Spectrum Technologies, Inc.); altura de planta (cm), desde la base del tallo hasta la parte más alta de la planta; biomasa húmeda (g); y peso de biomasa seca (g) de plantas deshidratadas en estufa a 80 °C por 24 h. Además se evaluaron diámetro de tallo (mm) mediante un vernier digital y rendimiento (g planta-1) en una balanza digital.
Análisis de datos
Con los datos de porcentaje de inhibición se efectuó una prueba de normalidad y homogeneidad de varianza, y las medias se compararon con la prueba de Tukey (p≤0.05), para lo cual se usó SAS 9.0 (SAS Institute, 2002). La prueba de Kruskal Wallis se usó para los datos obtenidos de los tratamientos en invernadero de las variables de respuesta no paramétricas (vigor de la planta, marchitez de follaje y podredumbre en raíz), con sus réplicas por tratamiento. Para los datos de variables paramétricas (altura, diámetro de tallo, contenido de clorofila, peso fresco, peso seco y rendimiento), se realizó un ANDEVA y prueba de comparación de medias de Tukey (p≤0.05) con SAS 9.0 (SAS Institute, 2002).
Resultados y Discusión
Actividad antagónica de las cepas bacterianas y fúngicas
El análisis estadístico mostró que el crecimiento radial in vitro de F. oxysporum f. sp. ciceris (Foc) raza 5 disminuyó (p≤0.05) de 80.07 % a 38.89 % en la evaluación frente a los microorganismos de control biológico (Cuadro 5). La mayor inhibición (80.07 %) del crecimiento radial (PICR) contra Foc se observó en la confrontación de la cepa HRG-060 y fue diferente (p≤0.05) al PICR de las otras cepas antagonistas. Respecto a lo anterior, Michel-Aceves et al. (2005) reportan inhibiciones de 16.40 % a 77.80 % al evaluar in vitro aislados nativos de Trichoderma frente a F. oxysporum f. sp. lycopersici y de 13.10 % a 94.40 % para S. rolfsii. Respecto a las cepas bacterianas, el mayor PICR se observó en la cepa T442, la cual inhibió a Foc en 59.26 %.
Cuadro 5 Inhibición del crecimiento micelial in vitro de Foc raza 5 frente a los microorganismos nativos.
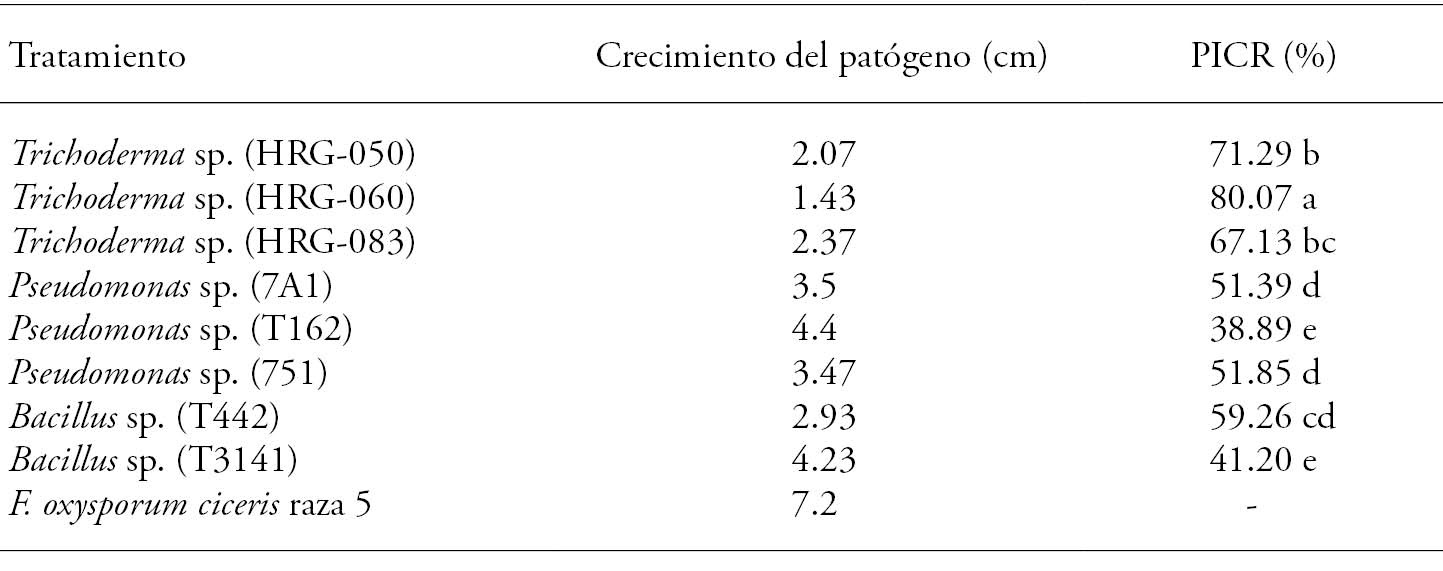
Letras diferentes indican diferencias estadísticamente significativas (Tukey; p≤0.05).
La cepa de Trichoderma HRG-060 colonizó el 100 % de la superficie del medio crecido con Foc 3 d después de la inoculación y las cepas HRG-050 Y HRG-083 lo hicieron al cuarto día, por lo que se ubicaron en el grado 1 de antagonismo de la escala de Bell et al. (1982). Según Guédez et al. (2012). Esto indica alto grado de agresividad de las cepas y son más agresivas que las cepas de Trichoderma spp. (Sánchez García et al., (2017), las cuales colonizaron el 100 % de la superficie del medio creciendo sobre fitopatógenos de F. solani, F. oxysporum y F. verticillioides a los 10 d después de la inoculación.
Durante los enfrentamientos con Foc, la cepa HRG-060 formó 123±15 haustorios cm-2 por enfrentamiento, mientras que las cepas HRG-050 y HRG-083 formaron 49±12 y 58±9 haustorios cm-2 por enfrentamiento, respectivamente. La mayor cantidad de haustorios formados por la cepa de Trichoderma HRG-060 permitió destacar su mayor eficiencia sobre F. oxysporum f. sp. ciceris, ya que facilitó la entrada en las hifas y el micoparasitismo sobre Foc. Esto muestra la alta capacidad de inhibición de crecimiento micelial de las cepas de Trichoderma, en especial la cepa HRG-060, que formó mayor cantidad de haustorios que las otras cepas fungicas.
El mecanismo de control ejercido por las cepas de Trichoderma sobre Foc fue por micoparasitismo: las hifas de Trichoderma se adhirieron sobre las hifas y fiálides de Foc, formaron haustorios y penetraron la hifa. Estos resultados son similares a los observados por Kexiang et al. (2002), quienes reportaron que el crecimiento del micelio del patogéno se suprimió por micoparasitismo.
Para Trichoderma hay diferentes tipos de interacción hifal como parasitismo, y se consideran una potencial como biorreguladores de hongos del suelo (Infante, 2009), como el enrollamiento y penetración de hifas de Trichoderma en hifas de F. oxysporum f. sp. cubense, y penetración en hifas de Pythium sp. y R. solani. Rivero (2008) evaluó cuatro aislamientos de Trichoderma sobre Alternaria padwickii, Bipolaris oryzae, Curvularia lunata y Phoma sp. y obtuvo una alta capacidad competitiva, con dos o más tipos de interacción hifal, excepto en Phoma sp.
Efecto protector de los microorganismos de control biológico
El aislamiento de F. oxysporum f. sp. ciceris utilizado en nuestro estudio tiene una agresividad alta al ocasionar una podredumbre de 93.27 % de la raíz de las plantas de control positivo (Cuadro 6).
El vigor de las plantas del tratamiento T7 (Trichoderma sp. HRG-060) fue mayor a los otros tratamientos (Cuadro 6) y las plantas del T3 (Pseudomonas sp. T162) tuvieron el vigor menor (p≤0.05). En los otros tratamientos las plantas presentaron valores mayores que el testigo y el control negativo. La menor marchitez ocurrió en las plantas de los tratamientos cuyas semillas fueron inoculadas con las cepas de Trichoderma (T6, T7 y T8), y fue menor (p≤0.05) a la marchitez en las plantas de T5 (control positivo) y de T11 (Benomilo). El menor porcentaje de podredumbre de raíz se presentó en las plantas de T7 (Trichoderma sp. HRG-060), y fue inferior a la sintomatología presentada en las plantas de T5 (control positivo) y T11 (Benomilo) en 41 y 19 % respectivamente (Cuadro 6). Asimismo, la presencia de la enfermedad en las plantas de T2, T6, T8, T9 y T10 fue similar al presentado en las plantas de T11 e inferior a T5 (Cuadro 6).
Cuadro 6 Efecto protector sobre la fusariosis vascular del garbanzo bajo condiciones de invernadero.
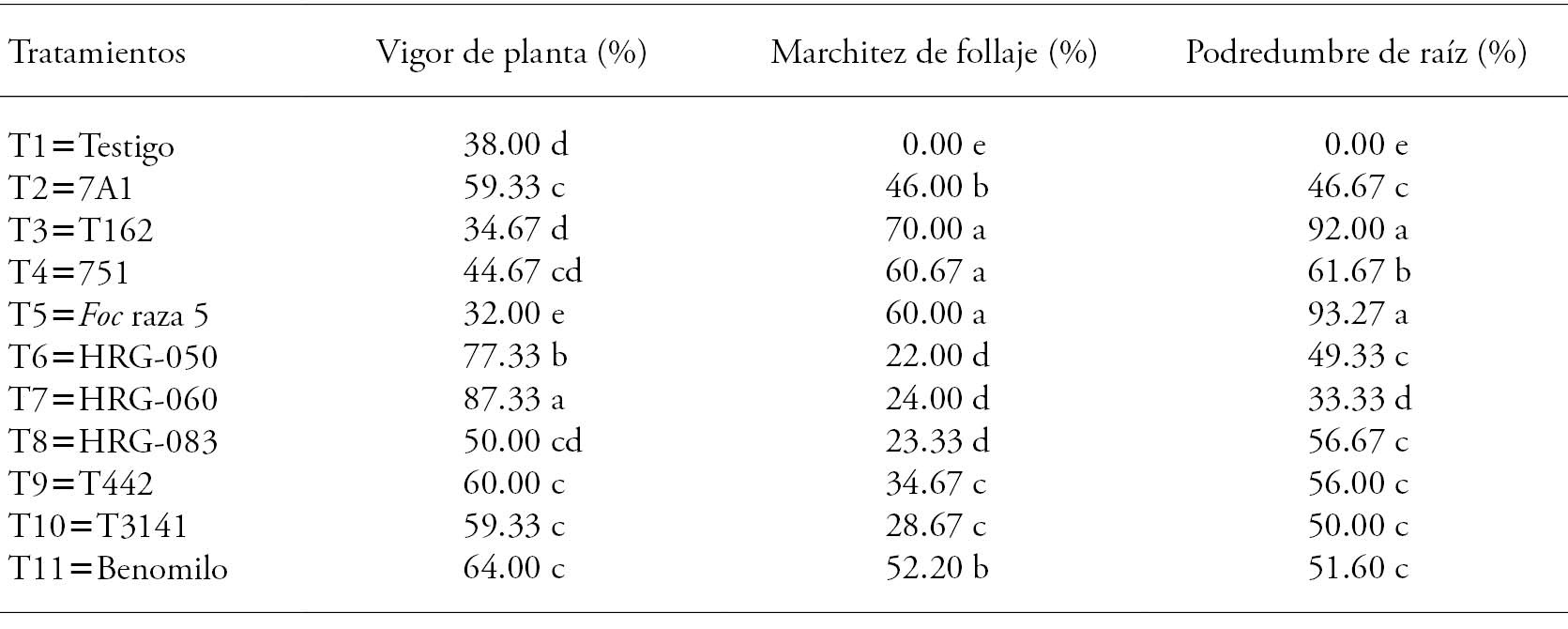
Medias con letras diferentes en cada variable indican diferencias estadísticamente significativas (Tukey; p≤0.05).
El mayor efecto protector contra la fusariosis vascular en el bioensayo en invernadero fue con el tratamiento de la cepa Trichoderma HRG-060 (Cuadro 5), la cual tuvo también el mejor PICR (80.07 %). El PICR las cepas HRG-050 y HRG-083 fue 71.29 67.13 %, respectivamente, pero no hubo efecto protector bueno en las plantas de garbanzo inoculadas con Foc. Lo anterior no coincide con la recomendación de Sanchez-García et al. (2017), de que las cepas con control in vitro bueno también lo ejercen in vivo en las plantas inoculadas y recomiendan que las pruebas in vitro son una buena herramienta de estimación del control biológico en plantas.
Los buenos resultados obtenidos de las medias de PICR, de las cepas nativas de Trichoderma, pueden deberse a la coadaptación de los antagonistas con los hongos patógenos, pues provenían de climas y hábitat similares (Andrews, 1992). Por lo tanto, se especula que en las pruebas en invernadero no hubo el reconocimiento suficiente entre Foc y las cepas de Trichoderma HRG-050 y HRG-083 mediante la interacción de lectinas-carbohidratos, las cuales aglutinan células que interaccionan con la superficie celular del patógeno y propician micoparasitismo (Infante et al., 2009), por lo cual no hubo el mismo nivel de micoparasitismo que en las pruebas in vitro. Lo anterior confirma que la coadaptación entre el hongo antagonista y el hongo patógeno es necesaria para realizar el control (Baker y Cook, 1974). Por ello es importante realizar las pruebas en la planta para probar el potencial verdadero de los agentes de control biológico. En todos los tratamientos el patógeno se aisló una vez más desde el tejido necrótico de todas las plantas inoculadas y se confirmó morfológicamente como la misma cepa inoculada. No se observaron síntomas en los controles no inoculados.
Promoción del crecimiento vegetal por los antagonistas bacterianos y fúngicos
Las plantas de T7 (Trichoderma sp. HRG-060) fueron las más altas y superiores en 26 y 57 % con respecto a las plantas del testigo (T1) y del control positivo (T5) (Cuadro 7); el diámetro de tallo mayor se presentó en T4, T7 y T10. El contenido de clorofila en las plantas de T9 (Bacillus sp. T442) y T4 (Pseudomonas sp. 751) fue superior a los otros tratamientos (p≤0.05). El peso de la biomasa húmeda fue superior p≤0.05) en las plantas de T9 (Bacillus sp. T442) respecto a las del T1 (testigo), T5 (control positivo) y T11 (Benomilo). En los otros tratamientos, excepto T2 (Pseudomonas sp. 7AI) y T3 (Pseudomonas sp. 162), el peso de la biomasa húmeda fue mayor, respecto a las plantas de T1 (testigo) y T11 (Benomilo), donde las plantas de T9 (Bacillus sp. T442) obtuvieron el mayor peso de la biomasa húmeda. Así mismo, el peso de biomasa seca tuvo un aumento significativo en las plantas de T9 (Bacillus sp. T442) con respecto a las plantas de los otros tratamientos.
Cuadro 7 Efecto de la inoculación de semillas con los microorganismos bacterianos y fúngicos en los parámetros de crecimiento de plantas de garbanzo.
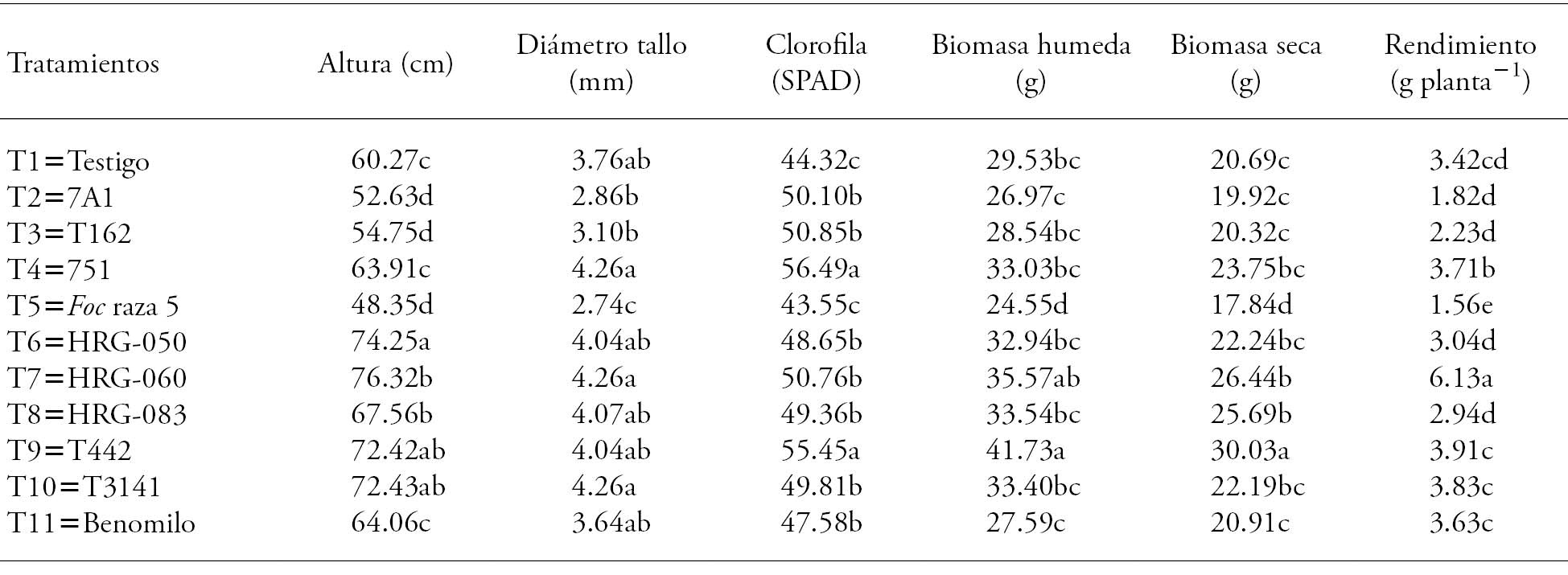
Medias con letras diferentes en cada variable son estadísticamente significativas (Tukey; p≤0.05).
Las plantas de T9 (Bacillus sp. T442) tuvieron los mayores valores de contenido de clorofila, peso de biomasa húmeda y peso de biomasa seca, pero las plantas de T7 (Trichoderma sp. HRG-060) mostraron un aumento significativo (p≤0.05) de rendimiento de grano con respecto a los otros tratamientos (Cuadro 7) y hubo una relación significativa (R2=0.91) entre el control de la enfermedad en la planta y el rendimiento de producción de grano. En nuestro estudio una mayor producción de biomasa (húmeda y seca) y mayor cantidad de clorofila no se traduce en mayor rendimiento de grano. Al respecto, Howell (2003) y Mohiddin et al. (2010) indican que las especies de Trichoderma durante interacciones con plantas promueven el aumento en el rendimiento en las plantas y contribuyen a la resistencia o tolerancia de enfermedades. Mohiddin et al. (2010) señalan que Trichoderma se localiza fuera y dentro de la rizósfera, donde puede colonizar y proteger las raíces. Trichoderma no sólo protege a la planta sino que la ayuda en su desarrollo; según Stefanova (2007), el tratamiento de semillas de tabaco con Trichoderma reduce los contaminantes externos como Rhizopus stolonifer.
Diversas sustancias que promueven el crecimiento vegetal son producidas por ciertos microorganismos rizosféricos, entre ellos, bacterias del género Bacillus y hongos del género Trichoderma, y pueden influir directa o indirectamente sobre el metabolismo y fisiología de la planta (Bhattacharyya y Jha, 2012), mediante la síntesis y excreción de sustancias fitoestimuladoras, como fitohormonas y compuestos orgánicos volátiles que refuerzan la inmunidad vegetal (Ahmad et al., 2008; Ambreen y Shahida, 2010). Por ello es importante estudiar la interacción de la cepa Trichoderma HRG-060 con la planta de garbanzo e inferir sobre el mayor rendimiento de grano.
Conclusiones
La cepa nativa de Trichoderma sp. HRG-060 destacó por la mayor inhibición micelial in vitro y por su capacidad de colonizar el 100 % de superficie del micelio crecido del patógeno en tres días. Esta alta agresividad de la cepa fue dada por la formación de mayor número de haustorios, lo cual facilitó ejercer el micoparasitismo sobre las hifas del patógeno. Esta cepa indujo el mayor aumento del rendimiento, pero Bacillus sp. T442 propició la mayor producción de clorofila y peso de biomasa húmeda y seca. La cepa de Trichoderma sp. HRG-060 representa un agente de control biológico contra Fusarium oxysporum f. sp. ciceris.
Asimismo, nuestro estudio muestra que las pruebas in vitro y en plantas son necesarias para identificar microorganismos con potencial de control biológico.











 text in
text in