Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.51 no.6 Texcoco ago./sep. 2017
Fitociencia
CONTENIDO DE FENOLES TOTALES Y CAPACIDAD ANTIOXIDANTE DE UVAS NO NATIVAS PARA VINO CULTIVADAS EN ZACATECAS, MEXICO
1Facultad de Agronomía. Universidad Autónoma de Zacatecas. 98160. Carretera Zacatecas-Guadalajara Km. 6. Ejido “La Escondida”, Zacatecas, Zacatecas, México.
2Departamento de Nutrición. Universidad Autónoma de Zacatecas. 98160. Carretera Zacatecas-Guadalajara Km. 6. Ejido “La Escondida”, Zacatecas, Zacatecas, México.
3Facultad de Ciencias Químicas. Programa de Químico en Alimentos. Universidad Autónoma de Zacatecas. 98160. Carretera Zacatecas-Guadalajara Km. 6. Ejido “La Escondida”, Zacatecas, Zacatecas, México.
La producción en Zacatecas, México, de uvas (Vitis vinifera L.) no autóctonas para vino ha aumentado en los últimos años, pero no hay información de su composición química. Los polifenoles de las uvas se asocian con efectos beneficiosos en la salud debido a su capacidad antioxidante. Por lo tanto, el objetivo de este estudio fue evaluar el contenido de fenoles totales (TPC) y la capacidad antioxidante (AC) de las uvas no nativas para vino cultivadas en Zacatecas, México. El AC y el TPC de cuatro variedades de uva blanca y cuatro de uva roja se evaluaron. El diseño experimental fue completamente al azar con tres repeticiones y los datos se analizaron con ANDEVA y se compararon con la prueba de Tukey (p≤0.05). La correlación de Pearson y la regresión lineal se calcularon para TPC y AC. El TPC fue significativamente mayor en las variedades rojas Rubired y las blancas Furmint. La AC (con el método ABTS) tuvo correlación significativa con TPC (R2=0.8304). Las variedades Petite Syrah y Rubired de uva roja, tuvieron potencial antioxidante significativo (p≤0.05) alto y estuvo asociado con su contenido alto de compuestos bioactivos. Los valores obtenidos en este estudio muestran que las uvas para vino con contenido funcional alto pueden cosecharse en el estado de Zacatecas, las variedades no autóctonas tuvieron capacidades mayores que los valores reportados en el país de origen para cada variedad respectiva.
Palabras clave: cultivares de uva para vino; fitoquímicos; actividad antioxidante
The production of non-native wine grapes (Vitis vinifera L.) in Zacatecas, Mexico has increased in recent years; however, information about their chemical composition is not yet available. Polyphenols are associated with the antioxidant capacity of grapes due to their beneficial health effects. Therefore, the aim of this study was to evaluate the total phenolic content (TPC) and the antioxidant capacity (AC) of non-native wine grapes grown in Zacatecas, México. The AC and TPC of 4 white grape varieties and 4 red grape varieties were analyzed. Experimental design was completely randomized with three replications and the data was analyzed using ANOVA and compared with Tukey test (p≤0.05). Pearson’s correlation and linear regression were calculated for the TPC and the AC. Total phenolic content was significantly higher in red varieties of Rubired and white varieties of Furmint. The AC (using the ABTS method) was significantly correlated with the TPC (R2=0.8304). Red grape varieties, Petite Syrah and Rubired had a significant (p≤0.05) higher antioxidant potential which is associated with their higher content of bioactive compounds. The values obtained in this study show that wine grapes with a high functional content can be harvested in the state of Zacatecas, non-native varieties resulted in higher capacities than the values reported in the country of origin for each respective variety.
Key words: wine grape cultivars; phytochemicals; antioxidant activity
Introducción
La uva (Vitis vinifera L.) es uno de los principales cultivos frutícolas en el mundo, con muchos cultivares que varían en características como sabor y color, con o sin semillas, asociadas al contenido de compuestos fenólicos y a su capacidad antioxidante. Las uvas son una de las principales fuentes de compuestos fenólicos en comparación con otras frutas y hortalizas (Mulero et al., 2015). Los compuestos fenólicos son una parte integral de la dieta humana y se consideran compuestos biológicamente activos que no son nutrientes (Subramani et al., 2002, Mulero et al., 2015) y constituyen uno de los grupos más numeroso y distribuido ampliamente de los productos naturales del reino vegetal. Ellos tienen una función muy importante en la composición de las uvas y los vinos, y contribuyen a las principales propiedades sensoriales, como color, astringencia y amargor (Puértolas et al., 2010). Estos compuestos se identificaron y cuantificaron en frutos y vegetales, y muestran correlación alta con la actividad antioxidante (Soares, 2002; Einbond et al., 2004). Los polifenoles se clasifican en dos grupos principales: los no-flavonoides (ácidos hidroxibenzoico e hidroxicinámico y sus derivados, estilbenos y alcoholes fenólicos) y flavonoides (antocianinas, flavanoles, flavonoles y dihidroflavonoles) (Fanzone et al., 2012).
Las propiedades biológicas de los polifenoles se atribuyen a su potente actividad antioxidante, quelante de metal y antiradical (Wu et al., 2010; Šeruga et al., 2011). También, los compuestos fenólicos reducen el riesgo de enfermedades crónicas, eliminan los radicales libres que inducen la relajación vascular, y tienen propiedades antiinflamatorias, anticancerígenas, antivirales y bactericidas (Gris et al., 2011).
La mayoría de los datos en la literatura sobre la composición fenólica y la actividad antioxidante de las uvas corresponde a variedades producidas en Francia, Italia, España, EUA, Turquía, Chile, Brasil y Argentina. En México, 75 % de la producción se consume como uva, 22 % es para la producción de vino, jugos y mermeladas y 3 % es para la producción de pasas. En 2012, Sonora produjo 80 % del total de las uvas en México y Zacatecas se ubicó en segundo lugar con 7.8 %; pero la información del contenido nutricional y de fenoles totales y la actividad antioxidante de las uvas producidas en Zacatecas es escasa. Por lo tanto, el objetivo de este estudio fue determinar el contenido de fenoles totales y la actividad antioxidante de las variedades no autóctonas producidas en el Departamento de Agricultura de la Universidad Autónoma de Zacatecas.
Materiales y Métodos
Materia prima
Uva blanca de las variedades Furmint, Palomino, Semillon y Sauvignon Vert y variedades rojas Cabernet Sauvignon, Merlot, Rubired y Petite Syrah se cosecharon para el estudio. El diseño de la plantación permitió 3 m de separación entre filas y 1.5 m entre plantas, la densidad fue de 2600 plantas por unidad de producción. Además, un sistema de cordón bilateral permitió exposición óptima al sol. Este diseño de la plantación se utilizó para las variedades rojas y blancas. La temporada de cultivo inició en marzo y finalizó en agosto de 2015. Todas las uvas se almacenaron en refrigeración (hasta 12 h), se enjuagaron con agua destilada y se secaron con toallas de papel antes de las evaluaciones.
Análisis
En las muestras se determinó el contenido de humedad (AOAC, 1997, 2013) y de sólidos solubles de la fase líquida de las muestras (°Brix) a 20 °C (refractómetro Atago NAR-3T, Tokio, Japón). El pH se midió con un pH-metro digital (Denver Instruments pH Meter TP 214, Alemania). La acidez total se midió por valoración potenciométrica con NaOH (0.1 N) y se expresó en mg del ácido principal (ácido tartárico, TA) (AOAC, 1997).
Extracción de compuestos fenólicos
Los compuestos fenólicos se extrajeron (Tomás-Barberán et al., 2001) con homogenización por 10 min de 35 g de la muestra de uva, con 40 mL de metanol, 10 mL de HCl 6 N y 2 mg de NaF para inactivar las polifenol oxidasas y evitar la degradación de fenoles. Después de la extracción, la mezcla se centrifugó (2701 x g, 4 °C) por 10 min. El sobrenadante se almacenó (24 h) en viales opacos a 4 °C hasta el análisis.
Determinación del contenido de fenoles totales (TPC)
El contenido de fenoles totales (TPC) se cuantificó con la prueba Folin-Ciocalteu (Li et al., 2006); 250 𝜇L de extracto se mezclaron con 15 mL de agua desionizada y 1.25 mL de reactivo Folin-Ciocalteu para fenoles. Después de 5 min se añadieron 3.75 mL de Na2CO3 (7.5 %) y se aforaron a 25 mL con agua desionizada. La absorbancia se midió a 765 nm en un espectrofotómetro UV-Vis (Termo Scientifc 10S, Termo Fisher Scientifc Inc, EE.UU.). Los resultados se expresaron en mg de ácido gálico (mg GAE 100 g-1 de uva fresca).
Capacidad antioxidante (AC) + capacidad secuestrante ABTS
El mismo extracto obtenido para cuantificar TPC se usó para evaluar AC. La AC se determinó mediante modificación de la técnica espectrofotométrica desarrollada por Re et al. (1999), usando ABTS + radical (Sigma) generado por 2.45 mM de persulfato de potasio (K2S2O8). La mezcla estuvo en oscuridad, a temperatura ambiente (~20 °C), por 16 h antes de usarla; después se diluyó la ABTS + solución, para generar absorbancia de 0.7±0.1 a 734 nm. Luego se mezclaron 100 𝜇L de extracto de uva con 900 𝜇L de la ABTS + disolución diluida y la absorbancia se midió a 734 nm. Los resultados se expresaron como actividad antioxidante equivalentes a unidades µmol de Trolox (TEAC) 100 g-1 de muestra fresca. Todos los experimentos se reprodujeron tres veces.
Capacidad antioxidante (AC) y actividad secuestrante DPPH
El método descrito por Brand-Williams et al. (1995) se utilizó para analizar AC de las muestras, con una modificación ligera: 100 𝜇L de extracto de uva se añadieron a 1 mL de 2,2-difenil-1-picrilhidrazil (DPPH) mM (3 mg 100 mL-1 en solución metanólica). La actividad secuestrante de los radicales libres, utilizando la reacción de radicales libres DPPH, se evaluó con la absorbancia a 515 nm, después de 2.5 min de reacción a 20 °C, en un espectrofotómetro. Los resultados se expresaron en 𝜇mol equivalentes de Trolox 100 g-1 de muestra fresca.
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar con tres repeticiones. Todos los análisis se realizaron por triplicado y los resultados se expresaron como medias ± desviación estándar. Para determinar diferencias estadísticamente significativas entre las variedades se realizó ANDEVA unidireccional y, si era significativo, se aplicó la prueba de Tukey (p≤0.05). Los valores AC y TPC se analizaron mediante correlación de Pearson y regresión lineal. Todos los análisis estadísticos se realizaron con Statgraphics® Centurion XV (Statpoint Technologies Inc., Warrenton, VA, EE.UU.).
Resultados y Discusión
La uva Palomino tuvo el contenido mayor de humedad y el menor valor de sólidos solubles (°Brix). Esto último debido al comportamiento reproductivo de la planta, que tendió a tener menos fruto por vid, densidad mayor por racimo y menos semillas por uva, lo que resultó en un contenido menor de sólidos solubles. Las uvas Rubired tuvieron el pH menor y la acidez titulable mayor (mg de ácido tartárico 100 g-1) (Cuadro 1). Esto se debió a la falta de días-grado calor (HDD) y tal vez requirió 7 d más para completar el ciclo intermedio de producción. El pH indica la fuerza de los ácidos en el mosto (Blouin y Guimberteau, 2003) y la acidez es el resultado de procesos fisiológicos complejos en los que la respiración tiene una función importante: los ácidos se usan como metabolitos para la respiración durante el crecimiento y la maduración en algunos frutos (Dorey et al., 2016). Otros estudios han intentado vincular una sola variable climática con la acidez del fruto, es el caso de la temperatura que se relacionó con la acidez de la uva (Etienne et al., 2013). En las uvas, los ácidos tartárico y málico constituyen casi la totalidad de los ácidos orgánicos (Saxton et al., 2009). Según el ANDEVA no hubo diferencias significativas (p≤0.05) en el contenido de humedad entre las variedades de uva roja. Las otras variables sí mostraron diferencias significativas (p≤0.05) en las uvas rojas y blancas.
Cuadro 1 Variables físicoquímicas de variedades de uva blanca y roja para vino.
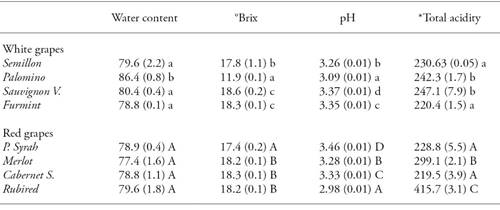
*Acidez total: mg de ácido tartárico 100 g-1. Letras minúsculas diferentes en una columna indican diferencias estadísticamente significativas entre las uvas blancas (Tukey; p≤0.05). Letras mayúsculas diferentes indican diferencias estadísticamente significativas entre las uvas rojas (Tukey; p≤0.05).
Las uvas rojas mostraron valores más altos de TPC comparadas con las uvas blancas y las uvas Rubired tuvieron la concentración mayor (607.6 mg GAE 100 g-1), le siguieron Merlot (537.1 mg GAE 100 g-1), Petite Syrah (488.8 mg GAE 100 g-1) y Cabernet Sauvignon (321.9 mg GAE 100 g-1) (Figura 1).
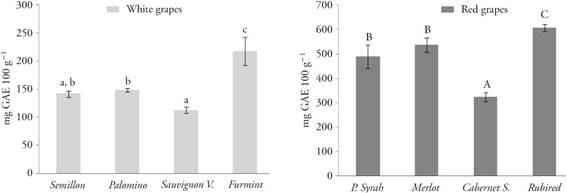
Figura 1 Contenido de fenoles totales (mg GAE 100 g-1) en variedades de uva blanca y roja para vino. Los datos son medias ± DE (n=3). Letras minúsculas diferentes en las barras indican diferencias estadísticamente significativas entre uvas blancas (Tukey; p≤0.05). Letras mayúsculas diferentes en las barras indican diferencia estadísticamente significativa entre uvas rojas (Tukey; p≤0.05).
Entre las variedades de uva blanca, Furmint tuvo el TPC mayor (218 mg GAE 100 g-1), le siguió Palomino (148.5 mg GAE 100 g-1), Semillon (142 mg GAE 100 g-1) y Sauvignon Vert (112.7 mg GAE 100 g-1) (Figura 1).
La composición fenólica de las variedades de uva depende de varios factores, como el potencial intrínseco de cada variedad (Rodríguez Montealegre et al., 2006; Ruberto et al., 2007; Obreque-Slier et al., 2010; Costa et al., 2015). Debido a las diferencias entre los cultivares, el contenido de fenoles varía entre las especies de uva (Rebello et al., 2013). Las condiciones climáticas son particularmente importantes para el cultivo de la vid; el calor, las sequías y la intensidad luminosa son algunos factores ambientales que influyen en el metabolismo fenólico y en el desarrollo de la composición química de la uva (Teixeira et al., 2013). En nuestro estudio, las diferencias entre uvas del mismo color se atribuyen a la variedad, ya que no hubo diferencias climáticas o geográficas. Según Mazza et al. (1999), los factores varietales determinan concentración, distribución y acumulación de polifenoles en las uvas. Además, los polifenoles totales en las variedades de uva blanca son menores que en las uvas rojas, ya que las variedades blancas no sintetizan antocianinas y polifenoles. Factores como temperatura, disponibilidad de agua, exposición al sol de los racimos y tiempo de la vendimia durante la maduración de las bayas influyen en la síntesis de esos compuestos en las uvas (Ivanova et al., 2011). En los climas más cálidos, la exposición alta a la luz puede aumentar la concentración de fenoles y antocianinas (Roubelakis-Angelakis y Kliewer, 1986). La exposición al sol se considera de primordial importancia para la producción de vino de alta calidad. Pero no está claro si el efecto sobre la composición de los frutos depende de la luz visible, de la luz ultravioleta, o de ambas (Keller y Torres-Martinez, 2004; Schreimer et al., 2012). Por ejemplo, cualquier práctica cultural que favorezca la exposición de los racimos de uva a la luz solar en el viñedo aumenta la acumulación de flavonoles. Esto ocurre igualmente en las uvas blancas y rojas (Teixeira et al., 2013).
Merlot mostró 37 % más GAE que lo reportado por Abe et al. (2007), quienes determinaron 337 mg 100 g-1. Panceri et al. (2014) reportaron valores 89 % (59.28 mg GAE 100 g-1) y Burin et al. (2014) 85 % (83.1 mg GAE 100 g-1) menores. Además, en la variedad Cabernet Sauvignon se observó diferencia de 79.1 % y 76 % en TPC respecto a lo reportado por Panceri et al. (2014) y Burin et al. (2014) de 67.4 y 76.5 mg GAE 100 g-1, respectivamente. Los resultados de nuestro estudio en la uva Petite Syrah difirieron en 21 % respecto a los de Abe et al. (2006) (388 mg GAE 100 g-1).
Las uvas rojas mostraron AC mayor (𝜇mol TEAC 100 g-1) que las uvas blancas, independiente del método utilizado (DPPH o ABTS) (Cuadro 2). Entre las uvas rojas, Petite Syrah presentó AC mayor, le siguieron las variedades Merlot, Cabernet Sauvignon y Rubired. Entre las uvas blancas, Palomino mostró AC mayor cuando se evaluó por el método ABTS, y Furmint con el método DPPH. Los valores de AC para Cabernet Sauvignon fueron 191.1 𝜇mol TEAC 100 g-1 con el método DPPH y 213 𝜇mol TEAC 100 g-1 con el método ABTS (Burin et al., 2014), mientras que Panceri et al. (2014) obtuvo 182.2 𝜇mol TEAC 100 g-1 con el método DPPH y 195 𝜇mol TEAC 100 g-1 con ABTS. Los valores CA de Merlot fueron 166.6 𝜇mol TEAC 100 g-1 utilizando DPPH y 231.6 𝜇mol TEAC 100 g-1 con ABTS (Panceri et al., 2013).
Cuadro 2 Valores y desviación estándar de la capacidad antioxidante (mg TEAC 100 g-1) de variedades de uva blanca y roja para vino.
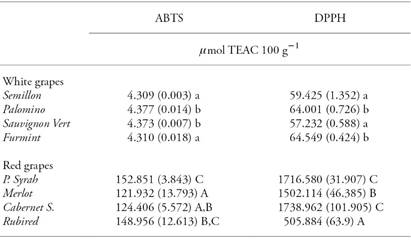
Letras minúsculas diferentes en una columna indican diferencias estadísticamente significativas entre las uvas blancas (Tukey; p≤0.05). Letras mayúsculas diferentes en una columna indican diferencias estadísticamente significativas entre las uvas rojas (Tukey; p≤0.05).
Cabe destacar que los valores menores de AC en todas las variedades se cuantificaron con el método ABTS. Pero los estudios de Burin et al. (2014) con uvas rojas y blancas, de variedades de V. vinifera L. y V. labrusca L., Xu et al. (2010) con uvas blancas y rojas, Burin et al. (2011) con el vino tinto y Toaldo et al. (2013) con jugo de uva indicaron valores mayores de actividad antioxidante usando el método ABTS.
En nuestro estudio, AC con el método ABTS mostró correlación mayor (R2=0.8304) con TPC (Figura 2), y el modelo mostró un buen ajuste para TPC y AC. Esto concuerda con los resultados de Tagliazucchi et al. (2010), quienes verificaron que la capacidad antioxidante de las uvas depende de la composición fenólica. En contraste, la correlación entre TPC y DPPH fue menor (R2=0.415).
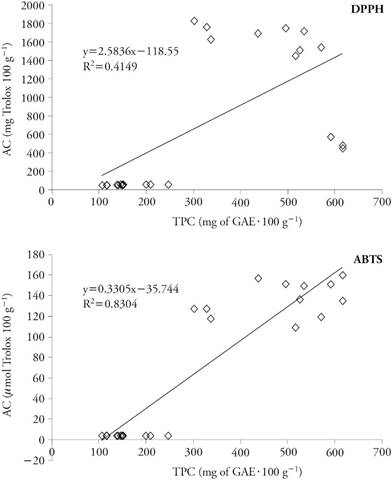
Figura 2 Relación entre capacidad antioxidante (𝜇mol Trolox 100 g-1) y compuestos fenólicos totales (mg GAE 100 g-1) de variedades de uva blanca y roja para vino.
Las propiedades biológicas de los compuestos fenólicos incluyen efectos antibacterianos, antimicóticos, y acciones cardioprotectoras y anticancerígenas. La composición de los fenoles en las uvas cambia con la variedad, la especie, la estación y los factores ambientales y de manejo, como las condiciones del suelo, el clima y la carga de los cultivos. El contenido de fenol totales influye en AC de los productos derivados de uva, que a la vez depende principalmente de la variedad de uva (Burin et al., 2014). Aunque, Nixdorf y Hermosín-Gutiérrez (2010) observaron lo contrario, ausencia de correlación y correlación negativa entre TPC y AC.
Conclusiones
Las variedades de uva adaptadas a las condiciones climáticas de la ciudad de Zacatecas mostraron valores similares o incluso mayores en TPC y AC que los publicados por otros autores en uvas de otros países. El contenido de fenoles totales fue significativamente mayor en las variedades Rubired de color rojo y en las blancas de Furmint. Entre todas las muestras, las variedades de uva roja, en especial Petite Syrah y Rubired, tuvieron potencial antioxidante mayor, asociado a su contenido mayor de compuestos bioactivos. La actividad antioxidante mostró buena correlación con TPC. Las variedades de uva analizadas representan una opción adecuada para el cultivo de uvas para vino en Zacatecas. Esto ayudaría a diversificar los tipos de vinos producidos en ese estado
Literature Cited
Abe, L. T., R.Vieria-Da Mota, F. M. Lajolo, and M. I. Genovese. 2007. Phenolic compounds and antioxidant activity of Vitis labrusca and Vitis vinifera cultivars. Food Sci. Technol. (Campinas) 27: 394-400. [ Links ]
AOAC, 1997. Official Methods of Analysis, 16th ed. Association of Official Analytical Chemists, Washington, DC. [ Links ]
Blouin, J., y G. Guimberteau. 2003. Maduración y Madurez de la Uva. Mundiprensa, Madrid. 157 p. [ Links ]
Brand-Williams, W., M. E. Cuvelier, and C. Berset. 1995. Use of a free radical method to evaluate antioxidant activity. LWT-Food Sci. Technol. 22: 25-30. [ Links ]
Burin, V.M., L.L.F. Costa, J.P. Rosier, and M.T. Bordignon-Luiz. 2011. Cabernet Sauvignon wines from two different clones, characterization and evolution during bottle ageing. LWT-Food Sci. Technol. 44: 1931-1938. [ Links ]
Burin, V.M., N.E. Ferreira-Lima, C.P. Panceri, and M.T. Bordignon-Luiz. 2014. Bioactive compounds and antioxidant activity of Vitis vinifera and Vitis labrusca grapes: Evaluation of different extraction methods. Microchem. J. 114: 155-163. [ Links ]
Costa, E., J.F. da Silva, F. Cosme, and A.M. Jordão. 2015. Adaptability of some French red grape varieties cultivated at two different Portuguese terroirs: Comparative analysis with two Portuguese red grape varieties using physicochemical and phenolic parameters. Food Res. Int. 78: 302-312. [ Links ]
Dorey E., P. Fournier, M. Léchaudel, and P. Tixier. 2016. A statistical model to predict titratable acidity of pineapple during fruit developing period responding to climatic variables. Sci Hort. 210: 19-24. [ Links ]
Einbond, L.S., K.A. Reynertson, X.D. Luo, M.J. Basile, and E.J. Kennelly. 2004. Anthocyanin antioxidants from edible fruits. Food Chem. 84: 23-28. [ Links ]
Etienne, A., M. Genard, P. Lobit, D. Mbeguie-A-Mbeguie, and C. Bugaud. 2013. What controls fleshy fruit acidity? A review of malate and citrate accumulation in fruit cells. J. Exp. Bot. 64 (6), 1451-1469. [ Links ]
Fanzone, M., F. Zamora, V. Jofré, M. Assof, C. Gómez-Cordovés, and A. Peña-Neira. 2012. Phenolic characterisation of red wines from different grape varieties cultivated in Mendoza province (Argentina). J. Sci. Food Agric. 92: 704-718. [ Links ]
Gris, E.F., F. Mattivi, E.A. Ferreira, U. Vrhovsek, R.C. Pedrosa, and M.T. Bordignon-Luiz. 2011. Proanthocyanidin profile and antioxidant capacity of Brazilian Vitis vinifera red wines. Food Chem . 126: 213-220. [ Links ]
Ivanova V., M. Stefova, B. Vojnoski, Á. Dörnyei, L. Márk, V. Dimovska, T. Stafilov, and F. Kilár. 2011. Identification of polyphenolic compounds in red and white grape varieties grown in R. Macedonia and changes of their content during ripening. Food Res. Int . 44: 2851-2860. [ Links ]
Keller M., and N. Torres-Martinez. 2004. Does UV radiation affect winegrape composition? Acta Hortic. 640: 313-319. [ Links ]
Li, B.B., B. Smith, and Md. M. Hossain. 2006. Extraction of phenolics from citrus peels: II. Enzyme-assisted extraction method. Sep. Purif. Tech. 48: 189-196. [ Links ]
Mazza, G., L. Fukumoto, P. Delaquis, B. Girard, and B. Ewert. 1999. Anthocyanins, phenolics, and colour of Cabernet Franc, Merlot, and Pinot Noir wines from British Columbia. J. Agric. Food Chem. 47: 4009-4017. [ Links ]
Mulero J., G. Martínez, J. Oliva, S. Cermeño, J.M. Cayuela, P. Zafrilla, A. Martínez-Cachá, and A. Barba. 2015. Phenolic compounds and antioxidant activity of red wine made from grapes treated with different fungicides. Food Chem . 180: 25-31. [ Links ]
Nixdorf, S.L., and I. Hermosín-Gutiérrez. 2010 Brazilian red wines made from the hybrid grape cultivar Isabel: phenolic composition and antioxidant capacity. Anal. Chim. Acta. 659: 208-215. [ Links ]
Obreque-Slier, E., R. López-Solís, L. Castro-Ulloa, C. Romero-Díaz, and Peña-Neira,A. 2012. Phenolic composition and physicochemical parameters of Carménère, Cabernet Sauvignon, Merlot and Cabernet Franc grape seeds (Vitis vinifera L.) during ripening. LWT-Food Sci.Technol. 48: 134-141. [ Links ]
Panceri, C.P., T.M. Gomes, J.S. De Gois, D.L.G. Borges, and M.T. Bordignon-Luiz. 2013. Effect of dehydration process on mineral content, phenolic compounds and antioxidant activity of Cabernet Sauvignon and Merlot grapes. Food Res. Int. 54: 1343-1350. [ Links ]
Puértolas, E., G. Saldaña, S. Condón, I. Álvarez, and J. Raso. 2010. Evolution of polyphenolic compounds in red wine from Cabernet Sauvignon grapes processed by pulsed electric fields during aging in bottle. Food Chem . 119: 1063-1070. [ Links ]
Re, R., N. Pellegrini, A. Proteggemnte, A. Pannala, M. Yang, and C. Rice-Evans. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biol. Med. 26: 1231-1237. [ Links ]
Rebello, L.P.G. et al. 2013. Phenolic composition of the berry parts of hybrid grape cultivar BRS Violeta (BRS Rubea-IAC 1398-21) using HPLC-DAD-ESI-MS/MS. Food Res. Int . 54: 354-366. [ Links ]
Rodríguez-Montealegre, R., R. Romero-Peces, J. L. Chacón-Vozmediano, J. Martínez- Gascueña, and E. García-Romero. 2006. Phenolic compounds in skins and seeds of ten grape Vitis vinifera varieties grown in a warm climate. J. Food Compos. Anal. 19: 687-693. [ Links ]
Roubelakis-Angelakis K. A., and W. MKliewer. 1986. Effects of exogenous factors on phenylalanine ammonia-lyase activity and accumulation of anthocyanins and total phenolics in grape berries. Am. J. Enol. Vitic. 37: 275-280. [ Links ]
Ruberto, G., A. Renda, C. Daquino, V. Amico, C. Spatafora, C. Tringali, and N. De Tommasic. 2007. Polyphenol constituents and antioxidant activity of grape pomace extracts from five Sicilian red grape cultivars. Food Chem . 100: 203-210. [ Links ]
Saxton, V.P., G.L. Creasy, A.M. Paterson, M.C.T. Trought. 2009. Behavioral responses of European blackbirds and Australasian silvereyes to varying acid and sugar levels in artificial grapes. Am. J. Enol. Vitic . 60: 82-86. [ Links ]
Schreiner M. et al. 2012. UV-B-induced secondary plant metabolites-Potential benefits for plant and human health. Crit. Rev. Plant Sci. 31: 229-240. [ Links ]
Šeruga, M., I. Novak, and L. Jakobek. 2011. Determination of polyphenols content and antioxidant activity of some red wines by differential pulse voltammetry, HPLC and spectrophotometric methods. Food Chem . 124: 1208-1216. [ Links ]
Soares, S.E. 2002. Ácidos fenólicos como antioxidantes. Rev. Nutrição, 15: 71-81. [ Links ]
Subramani, S., C.A. Casimir, and G. Krewer. 2002. Phenolic compounds and antioxidant capacity of Georgia-Grown blueberries and blackberries. J. Agric. Food Chem . 50: 2432-2438. [ Links ]
Tagliazucchi D., E. Verzelloni, D. Bertolini, and A. Conte. 2010. In vitro bio-accessibility and antioxidant activity of grape polyphenols. Food Chem . 120: 599-606. [ Links ]
Teixeira, A., J. Eiras-Dias, S.D. Castellarin, and H. Gerós. 2013. Berry phenolics of grapevine under challenging environments. Int. J. Mol. Sci. 14: 18711-18739. [ Links ]
Toaldo, I.M., O. Fogolari, G.C. Pimentel, J.S. Gois, D.L.G. Borges, V. Caliari, and M.T. Bordignon-Luiz. 2013. Effect of grape seeds on the polyphenol bioactive content and elemental composition by ICP-MS of grape juices from Vitis labrusca L. LWT-Food Sci. Technol . 53: 1-8. [ Links ]
Tomás-Barberán, F.A., M. I. Gil, P. Cremin, A. L.Waterhouse, B. Hess-Pierce, and A.A. Kader. 2001. HPLC-DAD-ESIMS analysis of phenolic compounds in nectarines, peaches, and plums. J. Agric. Food Chem . 49: 4748-4760. [ Links ]
Xu C., Y. Zhang, L. Cao, and J. Lu. 2010. Phenolic compounds and antioxidant properties of different grape cultivars grown in China. Food Chem. 119: 1557-1565 [ Links ]
Recibido: Octubre de 2016; Aprobado: Mayo de 2017











 texto en
texto en 


