Introducción
Hibiscus sabdariffa L. (Malvaceae) es una especie vegetal originaria de África, que durante la época colonial se dispersó a otras regiones tropicales y subtropicales aptas para su cultivo (Morton, 1987). En México se adaptó en una extensión territorial amplia para su cultivo comercial, y la producción nacional anual de cálices deshidratados es 6950 t cosechados principalmente en los estados de Guerrero, Michoacán, Oaxaca, Puebla y Nayarit (SIAP, 2015).
Los cálices son la estructura vegetal más valorada de H. sabdariffa, porque en ellos se acumulan antioxidantes, pigmentos y ácidos orgánicos, compuestos que en gran medida determinan su valor comercial (Patel, 2014). En México el principal uso de los cálices es la elaboración de extractos (fríos, infusiones y decocciones) para preparar bebidas refrescantes, debido a sus atractivas características de color, palatabilidad (Fasoyiro et al., 2005), efectos antioxidantes (Tsai et al., 2002; Prenesti et al., 2007) y propiedades medicinales (Reyes-Luengas et al., 2015; Herrera-Arellano et al., 2007).
Los compuestos fitoquímicos que sobresalen en jamaica son las antocianinas, ácidos orgánicos y otros flavonoides (Sindi et al., 2014; Fernández-Arrollo et al., 2011), cuyas propiedades antioxidantes se evaluaron in vitro e in vivo (Ojeda et al., 2010; Herrera-Arellano et al., 2004). Las industrias alimentaria, farmacéutica y cosmética tienen interés en genotipos de H. sabdariffa con características específicas de calidad en color, acidez y contenido de fitoquímicos (Patel, 2014).
Por ser una especie introducida al país, el estudio de su variación genética se ha limitado principalmente a describir el desempeño de variedades en las regiones donde son cultivadas. Pero ante el interés creciente de tener variedades sobresalientes en color y sabor, se han creado programas de mejoramiento genético para generar genotipos con mayor rendimiento y características sobresalientes en calidad de sus cálices deshidratados y extractos acuosos (Borrás-Linares et al., 2015; Salinas-Moreno et al., 2012).
Al respecto, Borrás-Linares et al. (2015) y Christian y Jackson (2009) reportaron que el factor genotipo influye en las características de color, contenido de fitoquímicos y actividad antioxidante de los cálices, mientras que Juliani et al. (2009) mostraron que el contenido de fitoquímicos en jamaica es afectado por el sitio de producción. Sin embargo, en los estudios hechos en México no se elucidó la interacción genotipo×ambiente, como la determinaron Ottai et al. (2004) en variedades y sitios de África, mediante variables de calidad como antocianinas, acidez total, pH, sólidos solubles totales, aminoácidos y azúcares, y mostraron que el ambiente de producción afecta la calidad de los cálices en una magnitud que difiere entre genotipos; es decir, demostraron la importancia de la interacción genotipo×ambiente en el rendimiento y calidad de la jamaica.
El objetivo de esta investigación fue caracterizar 53 genotipos de jamaica cultivados en cinco localidades mexicanas de los estados con mayor superficie en producción, considerando características de color (luminosidad, tonalidad y saturación de color), contenidos de antocianinas, fenoles solubles totales, pH y acidez titulable, para cálices deshidratados, y para sus extractos acuosos, con el fin de cuantificar la magnitud de los efectos de genotipo y ambiente, y la interacción genotipo×ambiente. Al respecto, se postula que con los resultados se podrán identificar variedades de jamaica sobresalientes en calidad, los ambientes que la mejoran y las combinaciones sobresalientes de genotipo y ambiente.
Materiales y Métodos
Primero se cosecharon cálices deshidratados de 53 genotipos de jamaica, contrastantes en color de cáliz (rojo claro y rojo oscuro), todos ellos crecidos y cosechados en cinco localidades representativas de los estados de mayor producción en el país, conforme a sus métodos locales: Ayutla de Libres, Guerrero (16° 57’ 57” N y 99° 05’ 38” O; 400 m; 28.0 °C de temperatura media anual; 1400 mm de lluvia anual), Los Limones, San Miguel Chimalapa, Oaxaca (16° 01’ 34.27” N y 97° 29’ 34.95” O; 280 m; 26.8 °C de temperatura media anual; 1150 mm de lluvia anual), Chiautla de Tapia, Puebla (18° 17’ 57’’ N y 98° 36’ 10’’ O; 900 m; 24.8 °C de temperatura media anual; 900 mm de lluvia anual), Comala, Colima (19° 18’ 19.36” N y 103° 45’ 12.03” O; 610 m; 26.4 °C de temperatura media anual; 1118 mm de lluvia anual), y Xalisco, Nayarit (21° 27’ 2.71” N y 104° 53’ 55.94” O; 960 m; 23.0 °C de temperatura media anual; 1232 mm de lluvia anual). Los datos climáticos fueron tomados del sitio de CONAGUA del Servicio Meteorológico Nacional (http://smn1.conagua.gob.mx/index.php?option=com_content&view=article&id=42&Itemid=28). La variación ambiental estudiada incluyó diferencias climáticas, edáficas, y de manejo pre-cosecha y pos-cosecha.
Preparación de los extractos acuosos
En cada muestra la extracción se hizo conforme al método establecido por Galicia-Flores et al. (2008); se colocaron 2.5 g de cálices en base seca en un vaso de precipitados de 600 mL, al que se adicionaron 100 mL de agua destilada, la mezcla se llevó a ebullición por 15 min, y el extracto se separó de los cálices por decantación. El procedimiento de extracción se repitió una vez bajo las mismas condiciones, y al final se mezclaron los dos extractos; el volumen acumulado se aforó a 200 mL con agua destilada y se filtró con papel Whatman No. 4; con los extractos acuosos preparados se hicieron las determinaciones fitoquímicas, de color y químicas.
Color
En la superficie de los cálices deshidratados se midió directamente con un colorímetro Hunter Lab MiniScan XE Plus (modelo 45/0-L) en la escala CIE L*a*b*, con iluminante D65 y un ángulo 10°, en cinco repeticiones. Previo a la medición, los cálices fueron introducidos en una bolsa plástica negra para evitar la interferencia de luz. Con los valores de a* y b* se calcularon los valores de tonalidad (hue) y de saturación de color (croma) (McGuire, 1992). En los extractos acuosos el color se midió en cuatro repeticiones, cada una en 50 mL depositados en una copa de cristal (accesorio No. 04-7209-00), a la que se introdujo un aro negro que en su parte superior sostenía un disco blanco con 90 % de reflectancia (accesorio No. 02-4579-00), la copa de cristal fue cubierta con una trampa de luz (accesorio No. 04-7209-00), y se tomó la lectura con el colorímetro Hunter Lab MiniScan XE Plus, una calibración de iluminante D65 y un ángulo 10°; el cálculo de tonalidad y saturación de color se realizaron de la misma forma que para los cálices deshidratados.
Contenido total de antocianinas (CTA)
En cuatro repeticiones de los extractos acuosos se midió CTA mediante la absorbancia registrada en un espectrofotómetro de placas modelo Epoch (BioTek Instrument®) con microplacas (Costar®) de 96 pozos, modificado de Galicia-Flores et al. (2008), para usar 300 µL del extracto diluido y leer su absorbancia a 510 nm. El CTA se calculó con una ecuación de regresión lineal obtenida de la curva patrón de cianidina 3-glucósido (Polyphenols®, Nw), empleada como estándar para su cuantificación. El CTA fue expresado en mg equivalentes de cianidina 3-glucósido por 100 g de muestra seca (mg EC3G 100 g-1 MS).
Fenoles solubles totales (FST)
En cuatro repeticiones se cuantificó con el método de Folin-Ciocalteu (Singleton y Rossi, 1965), con modificaciones para realizar el desarrollo de color en microplacas como se describe a continuación: a 240 µL de agua destilada se adicionaron 15 µL del extracto a analizar y 15 µL del reactivo Folin-Ciocalteu (Sigma Aldrich®) 0.25 N, se dejó reaccionar por 3 min en oscuridad y se neutralizó con 30 µL de carbonato de sodio 1 N (Na2CO3, J. T. Baker®). La muestra se dejó en reposo a temperatura de cuarto por 2 h en oscuridad, y se midió la absorbancia en el espectrofotómetro de placas a 765 nm. Ácido gálico se utilizó como estándar, a partir del cual se elaboró una curva patrón para cuantificar el contenido de FST expresado en mg equivalentes de ácido gálico por 100 g de muestra seca (mg EAG 100 g-1 MS).
Acidez titulable (AT) y pH
La AT se determinó por duplicado con el método de la AOAC (1984), en una alícuota de 10 mL depositada en un vaso de precipitados de 600 mL al que se adicionaron 200 mL de agua destilada para diluir la coloración de la muestra y observar el vire de la fenolftaleína. La titulación se hizo con NaOH 0.1 N (J. T. Baker®). La AT se calculó en miliequivalentes del ácido cítrico (0.064). El pH se determinó por duplicado, con un potenciómetro Denver Instrument UB10, calibrado con amortiguadores (J. T. Baker®) de pH 4 y 7 para mediciones en medios ácidos.
Análisis estadísticos
Con datos de cada variable se realizó un análisis combinado a través de ambientes para cuantificar los efectos de varianza de genotipo (G), de ambiente (A) y su interacción (G×A). Además las medias se compararon (Tukey, p≤0.05) entre genotipos y localidades para identificar las más sobresalientes. Los análisis estadísticos univariados se hicieron con SAS System Versión 9.0. Con los promedios de las variables se usaron análisis de componentes principales (ACP) y de conglomerados (AC) por el método de enlace completo, empleando distancias euclidianas para agrupar los 53 genotipos en función de sus características de color. Después se agruparon los genotipos en función de su contenido de CTA, FST, AT y pH, para identificar los genotipos sobresalientes. En los análisis multivariados se utilizó Minitab® 17.1.0.
Resultados y Discusión
Todas las variables cambiaron significativamente (p≤0.01) por efecto del genotipo (G), del ambiente (A) y por la interacción (G×A), (Cuadro 1). Los contenidos de compuestos antioxidantes, CTA y FST en cálices fueron influenciados por el genotipo, el cual explicó 72 y 44 % de la variación debida a tratamientos, respectivamente. La interacción G×A representó 19 y 29 % de la variación total en las mismas variables, por lo cual fue el segundo factor importante en la acumulación de estos fitoquímicos en los cálices deshidratados. El efecto de ambiente representó 9 y 27 % de la variación.
Cuadro 1 Sumas de cuadrados estimadas mediante análisis estadísticos combinados de 53 genotipos de Hibiscus sabdariffa L., cultivados en cinco ambientes (localidades). Los porcentajes se calcularon con respecto a la suma de cuadrados de tratamientos.
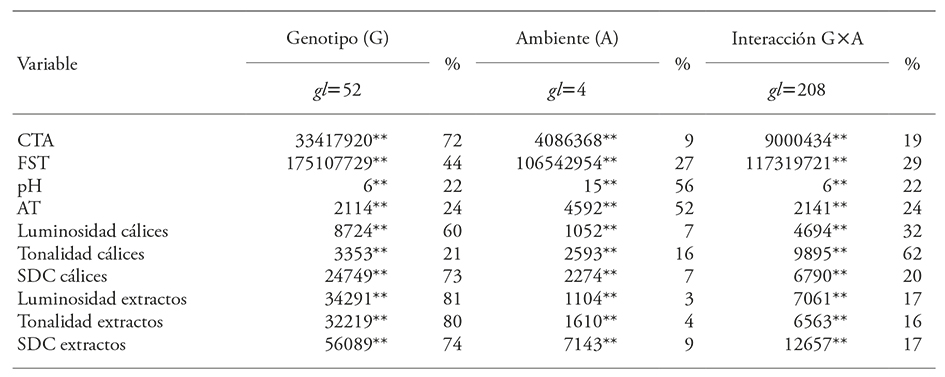
**p≤0.01. CTA: contenido total de antocianinas; FST: fenoles solubles totales; AT: acidez titulable; SDC: saturación de color.
Ottai et al. (2004) reportaron fuerte dependencia del genotipo (94 %) en el CTA y el 6 % restante dependió del ambiente de producción (A) y de la interacción G×A. Esta marcada dependencia del genotipo pudiera deberse a que este estudio se hizo con tres genotipos, dos de cálices rojos (uno claro y uno oscuro) y uno de cálices blancos (carente de antocianinas), y posiblemente en ambientes poco contrastantes. Para FST no se encontró información que relacione su concentración con los factores genotipo, ambiente o su interacción G×A.
En cambio, las variables asociadas con el sabor o palatibilidad, pH y AT, fueron afectadas por el ambiente de producción (las cinco localidades) en 56 y 52 %, respectivamente (Cuadro 1). En conjunto, el genotipo y la interacción G×A afectaron en proporciones semejantes a estas dos variables. Es decir, la acidez y al sabor son características con mayor dependencia del ambiente y la interacción, que del genotipo. Estos resultados difieren de los obtenidos por Ottai et al. (2004) en pH, porque ellos reportaron mayor dependencia del genotipo (53 %) que de la localidad (40 %). Tal diferencia se puede deber a que el número de genotipos y ambientes evaluados fue menor en África que en México, pero sí concuerdan con AT considerando que el efecto del ambiente fue el más importante en la variación de AT.
En los extractos acuosos el factor genotipo tuvo un efecto de 74 a 81 % en luminosidad, tonalidad y saturación del color (Cuadro 1). En los cálices deshidratados los valores de luminosidad y saturación de color variaron de 72 a 76 %, por efecto del genotipo, pero la tonalidad fue más dependiente de la interacción G×A (62 %). Es decir, en las variables de color predominó el efecto del genotipo, y las características de color son altamente heredables y serían estables a través de ambientes.
Esta información sugiere que si la finalidad de los cálices de jamaica es para obtener fitoquímicos, la mayor ganancia se logra al seleccionar genotipos rojo oscuro, considerando que sean sobresalientes en la síntesis y acumulación de CTA y FST. Para obtener cálices con mayor acidez titulable será conveniente producirlos en ambientes donde los genotipos expresen mayor síntesis de ácidos orgánicos.
Variación en color de cálices deshidratados y de extractos acuosos
El ACP y el AC permitieron clasificar a los 53 genotipos en dos grupos con base en la coloración rojo oscuro y rojo claro (Figura 1), los cuales correspondieron con la clasificación visual por color de cálices. Borrás-Linares et al. (2015) clasificaron en cinco grupos a los cálices de H. sabdariffa en función del contenido de antocianinas. La clasificación de los genotipos en función de la coloración de cálices es común, pero muchas veces se realiza de manera visual ubicándolos en dos categorías, rojo oscuro y rojo claro. En menor proporción están los genotipos con cálices de color verde-amarillo (Juliani et al., 2009; Christian and Jackson, 2009; Babalola et al., 2001). Resalta la estrecha relación entre el contenido de antocianinas y el color de los cálices (Wrolstad, 2004).
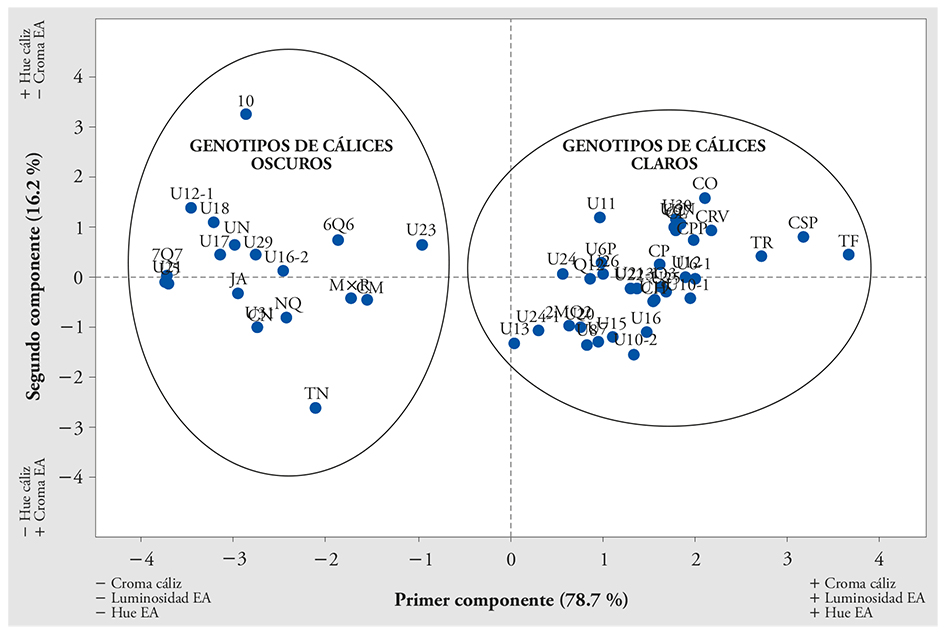
Figura 1 Agrupamiento de 53 genotipos de Hibiscus sabdariffa L. de acuerdo con sus valores de luminosidad, tonalidad y saturación de color en cálices deshidratados y extractos acuosos.
El grupo de color rojo oscuro (GCRO) quedó integrado por 19 genotipos (Figura 1) (Tempranilla Negra, Jersey Acriollada, Negra UAN, Criolla Morada, Negra Quiviquinta, China, Morada×Roja, UAN 5, UAN 12-1, UAN 16-2, UAN 17, UAN 18, UAN 21, UAN 23, UAN 29, UAN 31, 6Q6, 7Q7 y 10), caracterizado por un intervalo de luminosidad en sus cálices deshidratados de 12.5 a 14.8 %, y 13.7 % en promedio. Los valores de tonalidad oscilaron de 17.6 a 26.2°, y 21.5° en promedio. La saturación de color varió de 6.3 a 10.4 unidades, y 8.3, en promedio. En los extractos, la variación en luminosidad fue muy similar a la de en cálices deshidratados.
Los 34 genotipos de color rojo claro (GCRC) fueron: 2MQ2, 3Q3, Colima, Coneja, Criolla Huajicori, Criolla Precoz, Criolla Puebla Precoz, Criolla Roja Violeta, Criolla Súper Precoz, Q12, Tempranilla Flor, Tempranilla Roja, UAN 10-1, UAN 10-2, UAN 11, UAN 12, UAN 13, UAN 15, UAN 16, UAN 19, UAN 20, UAN 21-1, UAN 22, UAN 24, UAN 24-1, UAN 25, UAN 26, UAN 27, UAN 30, UAN 6 Novillero, UAN 6 Puga, UAN 6-1, UAN 7 y UAN 8 (Figura 1). En este grupo la luminosidad en cálices deshidratados fue de 15.7 a 22.2 %, y 18.5 % en promedio. La tonalidad varió de 19.9 a 24.9°, y 22.2° en promedio; y saturación de color de 11.5 a 23.2 unidades, y 16.3 en promedio. Los extractos acuosos mostraron rangos similares de valores en luminosidad, tonalidad y saturación.
Aunque el número de genotipos fue inferior en el grupo de cálices color rojo oscuro, la amplia dispersión de valores mostró que la variación genética entre genotipos fue mayor a la observada en los genotipos de color rojo claro con relación a la tonalidad de sus cálices deshidratados y saturación de color en extractos acuosos. Esto es de interés en los programas de mejoramiento genético, por la expresión de mayor variabilidad genética y variedad de tonalidades en los cálices y extractos.
El efecto del ambiente en los descriptores de color de cálices deshidratados y extractos acuosos fue significativo (p≤0.01) (Cuadro 2). La luminosidad de cálices deshidratados mostró los valores más bajos en genotipos cultivados en Nayarit (15.0±3.0 %), comparados con las otras cuatro localidades. En los extractos acuosos hubo diferencias en luminosidad entre los cinco ambientes evaluados; los de Colima (21.9±7.0 %) fueron los genotipos más luminosos, en contraste a los de Guerrero que fueron los más oscuros (19.1±7.0 %).
Cuadro 2 Efecto del ambiente en los valores de luminosidad (L), tonalidad (T) y saturación de color (SDC) en cálices deshidratados y extractos acuosos de 53 genotipos de Hibiscus sabdariffa L., cada uno crecido en cinco localidades.
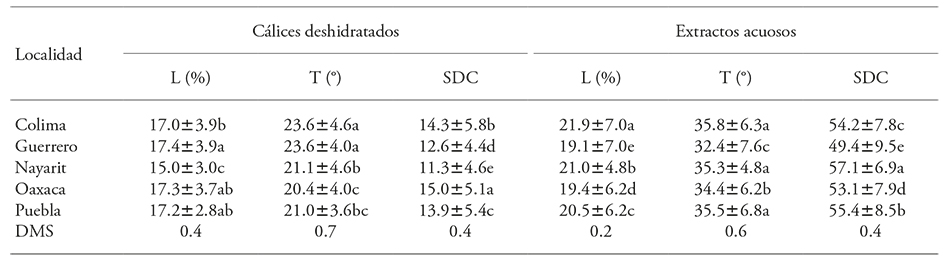
Valores con diferente letra en una columna son estadísticamente diferentes (p≤0.05). DMS: Diferencia mínima significativa.
Los cálices producidos en Nayarit, Oaxaca y Puebla (20.4±4.0 a 21.1±4.6°) tuvieron una tonalidad roja más definida comparados con los de Colima y Guerrero (23.6±4.6 y 23.6±4.0, respectivamente). La saturación de color de cálices y extractos fue mayor en Oaxaca (15.0±5.1), seguida de Colima (14.3±5.8) y Puebla (13.9±5.4), y los valores más bajos fueron en Nayarit (11.3±4.6). En los extractos acuosos la tonalidad fue más definida en los genotipos cultivados en Oaxaca (34.4±6.2) y Guerrero (32.4±7.6).
Características fitoquímicas
Los genotipos con mayor contenido total de antocianinas (CTA) fueron de color rojo oscuro (Cuadro 3): UAN 18, Negra UAN, UAN 17, UAN 21, UAN 12-1, UAN 29, UAN 5 y 10, con una variación de 608±206 a 757±178 mg EC3G 100 g-1 MS. Las variedades UAN 30, UAN 25, UAN 15, UAN 19, UAN 27, Tempranilla Roja, UAN 6-1, UAN 6 Novillero, Tempranilla Flor y Criolla Súper Precoz, de cálices claros, registraron el contenido más bajo en esta fracción fenólica (163±51 a 228±74 mg EC3G 100 g-1 MS). Valores semejantes están reportados para variedades de H. sabdariffa provenientes de Guerrero y Oaxaca (Salinas-Moreno et al., 2012; Galicia-Flores et al., 2008).
Cuadro 3 Contenido promedio de antocianinas, fenoles solubles totales, pH y acidez titulable en extractos acuosos de 53 genotipos de Hibiscus sabdariffa de cálices color rojo crecidas en cinco ambientes (localidades). En cada columna las negritas marcan los valores máximos de cada variable, y en subrayado los valores mínimos.
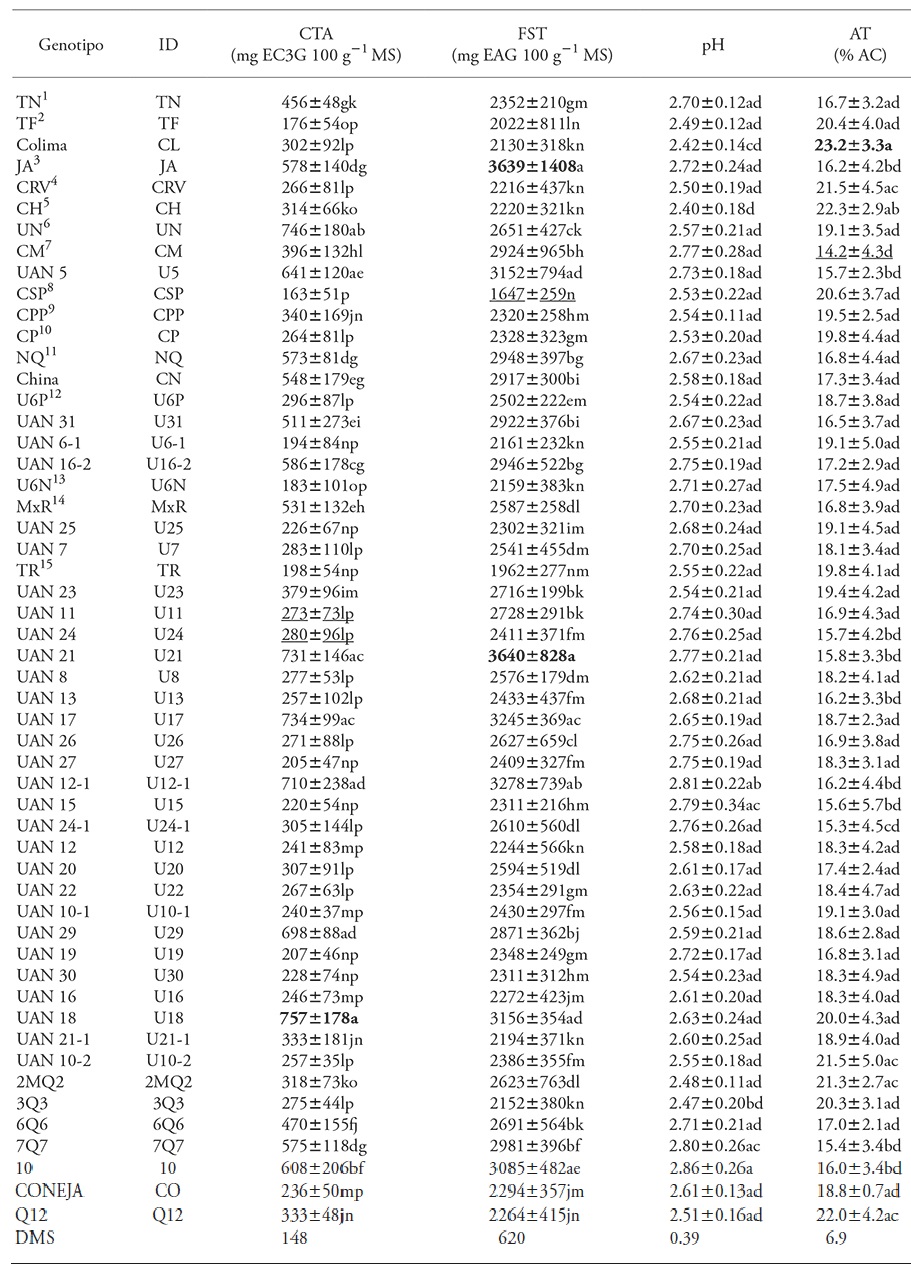
Valores con diferente letra en una columna son estadísticamente diferentes (p≤0.05). DMS: Diferencia mínima significativa. CTA: contenido total de antocianinas; FST: fenoles solubles totales; AT: acidez titulable; AC: ácido cítrico. 1Tempranilla Negra; 2Tempranilla Flor; 3Jersey Acriollada; 4Criolla Roja Violeta; 5Criolla Huajicori; 6Negra UAN; 7Criolla Morada; 8Criolla Súper Precoz; 9Criolla Puebla Precoz; 10Criolla Precoz; 11Negra Quiviquinta; 12UAN 6 Puga; 13UAN 6 Novillero; 14Morada×Roja; 15Tempranilla Roja
Los genotipos UAN 21, Jersey Acriollada, UAN 12-1, UAN 17, UAN 18, UAN 5, 10, 7Q7, Negra Quiviquinta, UAN 16-2, Criolla Morada, UAN 31, China y UAN 29 de cálices rojo oscuro, destacaron por su alto contenido de fenoles solubles totales (FST) (3640±828 a 2871±362 mg EAG 100 g-1 MS) (Cuadro 3). En especial Jersey Acriollada (3639 mg EAG 100 g-1 MS) y UAN 21 (3640 mg EAG 100 g-1 MS) tuvo contenidos semejantes al del genotipo Sudán (3650 mg EAG 100 g-1 MS), valorado en México por su alto contenido de antioxidantes (Reyes-Luengas et al., 2015).
Los genotipos con menor contenido de FST fueron los de cálices rojo claro, en especial Criolla Huajicori, Criolla Roja Violeta, UAN 21-1, UAN 6-1, UAN 6 Novillero, 3Q3, Colima, Tempranilla Flor, Tempranilla Roja y Criolla Súper Precoz (2220±321 - 1647±259 mg EAG 100 g-1 MS). Los genotipos superiores en CTA no necesariamente destacaron en FST, y viceversa, como también lo reportan Christian y Jackson (2009). Lo anterior sugiere que genotipos que no destacan por su contenido en CTA lo pueden hacer en FST. Pero también hay genotipos con contenidos altos de ambos antioxidantes, como UAN 21, Jersey Acriollada, UAN 12-1, UAN 17, UAN 18, UAN 5, 10, 7Q7 y Negra Quiviquinta.
Los contenidos de FST en los 53 genotipos mexicanos evaluados fueron semejantes a los reportados para genotipos nacionales (Reyes-Luengas et al., 2015) y para genotipos cultivados en Jamaica (Christian y Jackson, 2009). Entre los de color rojo oscuro, el genotipo Jersey Acriollado fue el más inestable como lo demuestra su alta desviación estándar a través de ambientes (±1408 mg EAG 100 g-1 MS), en contraste con los genotipos China, Morada×Roja, Tempranilla Negra y UAN 23 que mostraron desviaciones estándar moderadas de ±199 a 300 mg EAG 100 g-1 MS, por lo cual fueron más estables. La variación en los genotipos claros fue de ±179 a ±811 mg EAG 100 g-1 MS, donde Tempranilla Flor, 2MQ2 y UAN 26 fueron los genotipos más inestables a través de localidades. Estos resultados muestran que los cálices de color rojo oscuro contienen más fitoquímicos antioxidantes que los de color rojo claro, equivalente a 2.3 veces más CTA y 1.3 veces en FST.
Las dos variables importantes en la palatabilidad de los extractos acuosos de los cálices fueron pH y acidez titulable con diferencias significativas (p≤0.05) entre genotipos (Cuadro 3). Esta fluctuación del pH (2.40±0.18 a 2.86±0.26) es conveniente para preservar la estabilidad estructural del catión flavilio en las antocianinas, las cuales confieren la tonalidad roja brillante característica de los extractos acuosos (Prenesti et al., 2007; Wrolstad, 2004). Los extractos de los genotipos UAN 10, UAN 12-1, 7Q7, UAN 15, Criolla Morada, UAN 24-1, UAN 24, UAN 26 y UAN 11 fueron los más afectados por el ambiente, ya que cambios en la desviación estándar de su pH desde ±0.34 a ±0.22 a veces causó pH de 3.0 o superiores, que redujeron la estabilidad de la coloración roja brillante en los extractos acuosos.
La variación de AT expresada como porcentaje de ácido cítrico entre genotipos fue de 14.2±4.3 a 23.2±3.3 % (Cuadro 3). Los de mayor porcentaje y por ende más palatables fueron Colima, Criolla Huajicori, Q12, Criolla Roja Violeta, UAN 10-2, 2MQ2, Criolla Súper Precoz, Tempranilla Flor y 3Q3, con valores de 20.3±3.13 y 23.2±3.26 %. Los genotipos con los porcentajes más bajos en AT fueron 10, UAN 21, UAN 5, UAN 24, UAN 15, 7Q7, UAN 24-1 y Criolla Morada (16.0±3.4-14.2±4.3 %). Los valores promedio de AT de las variedades rojo oscuro (17.0 %) y las de rojo claro (18.9 %) fueron muy cercanos. Los valores de desviación estándar en AT mostraron que el efecto del ambiente de producción fue mayor en esta variable, ya que a través de localidades varió de ±0.68 a ±5.71 % de ácido cítrico. En esta variable UAN 15 y UAN 6-1 fueron los más inestables por una variación grande de ±5.0 a ±5.71 %; en contraste, el genotipo Coneja fue más estable a través de ambientes con desviación estándar de ±0.7 %.
Clasificación integral de genotipos por calidad fisicoquímica
Al agrupar a los 53 genotipos en función de sus características antioxidantes y acidez mediante la aplicación de ACP para CTA, FST, pH y AT, se obtuvo que los dos primeros componentes explicaron 94.0 % de la varianza detectada en los extractos acuosos. El primer componente (CP1), constituido por FST y AT, explicó 68.8 % de la varianza total; el CP2 aportó 25.2 % de la varianza restante debido al CTA y pH. Con el análisis de conglomerados los 53 genotipos de H. sabdariffa se clasificaron en seis categorías (Figura 2).
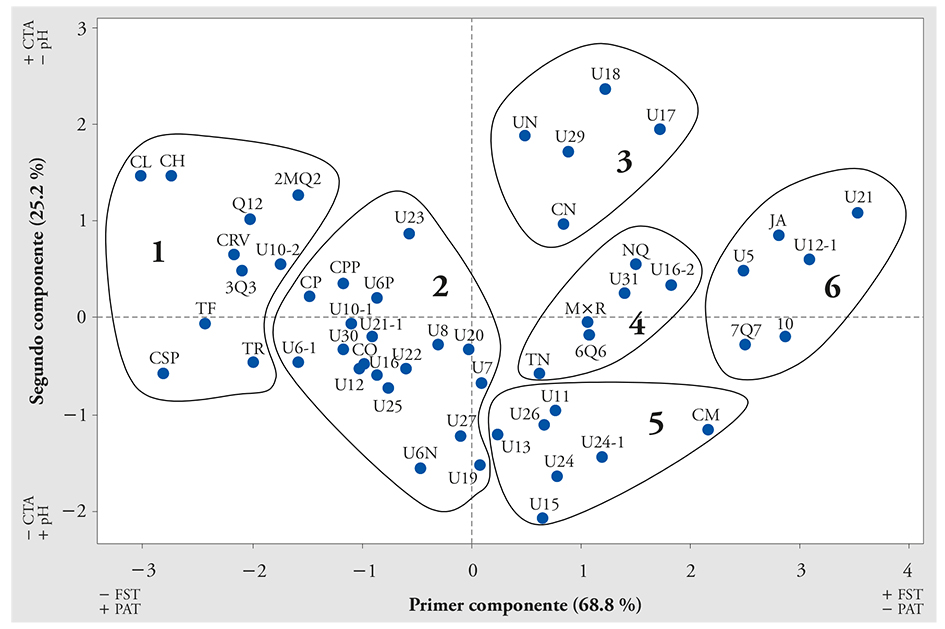
Figura 2 Agrupamiento de 53 genotipos de Hibiscus sabdariffa L. de acuerdo con su contenido total de antocianinas, fenoles solubles totales, pH y acidez titulable.
Los conglomerados 3 (Negra UAN, China, UAN 17, UAN 19 y UAN 18) y 6 (Jersey Acriollada, UAN 5, UAN 21, UAN 12-1, 7Q7 y 10) agruparon a los genotipos con mayor contenido de CTA y FST, pero los genotipos del conglomerado 3 tuvieron una AT mayor que los del grupo 6 (Cuadro 4). En cambio, los del grupo 1 (Tempranilla Flor, Colima, Criolla Roja Violeta, Criolla Huajicori, Criolla Súper Precoz, Tempranilla Roja, UAN 10-2, 2MQ2, 3Q3 y Q12) registraron mayor AT, aunque sus contenidos de CTA y FST fueron los más bajos de los 53 genotipos. El conglomerado 2 que agrupó a la mayor cantidad de genotipos (Criolla Puebla Precoz, Criolla Precoz, UAN 6 Puga, UAN 6-1, UAN 6 Novillero, UAN 25, UAN 7, UAN 23, UAN 8, UAN 27, UAN 12, UAN 20, UAN 22, UAN 10-1, UAN 19, UAN 30, UAN 16, UAN 21-1 y Coneja), mostró un bajo contenido de CTA y FST, y valores intermedios de AT.
Cuadro 4 Comparación del contenido total de antocianinas (CTA), fenoles solubles totales (FST), pH y acidez titulable (AT), en seis grupos de genotipos de Hibiscus sabdariffa L.
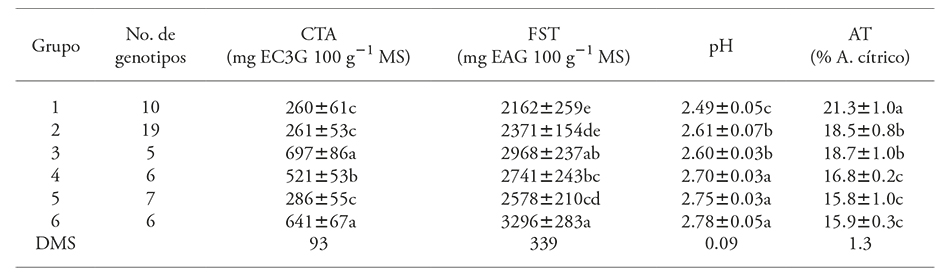
Valores con diferente letra en una columna son estadísticamente diferentes (p≤0.05). DMS: Diferencia mínima significativa.
El conglomerado 4 (Tempranilla Negra, Negra Quiviquinta, UAN 31, UAN 16-2, Morada×Roja y 6Q6) tuvo valores intermedios de CTA y FST con porcentajes bajos de acidez, mientras que los genotipos en el conglomerado 5 (Criolla Morada, UAN 11, UAN 24, UAN 13, UAN 26, UAN 15 y UAN 24-1) tuvieron valores bajos en CTA y AT, pero intermedios en FST.
Entre localidades (ambientes), los genotipos crecidos en Nayarit destacaron por inducir la mayor acumulación de CTA (492±224 mg EC3G 100 g-1 MS) y de FST (3114±747 mg EAG 100-1 MS), en comparación con las demás localidades (Cuadro 5). Los contenidos más bajos en CTA se encontraron en Colima y Guerrero (327±180 y 322±172 mg EC3G 100 g-1 MS), y los más bajos en FST ocurrieron en Colima y Puebla (2296±551 y 2281±476 EAG 100 g-1 MS), respectivamente.
Cuadro 5 Efecto del ambiente (localidad) en el contenido total de antocianinas (CTA), fenoles solubles totales (FST), pH y acidez titulable (AT) en 53 genotipos de Hibiscus sabdariffa L.
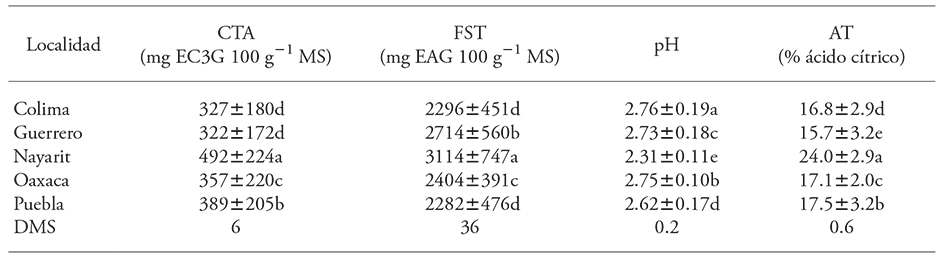
Valores con diferente letra en una columna son estadísticamente diferentes (p≤0.05). DMS: Diferencia mínima significativa.
El pH y la AT fueron las variables más influenciadas por el ambiente o localidad de producción (p≤0.01) (Cuadro 5). La variación de pH a través de ambientes fue de 2.31±0.11 a 2.76±0.19, en Nayarit y Colima respectivamente. La AT varió 15.7±3.2 % en Guerrero hasta 24.0±2.9 % en Nayarit. A diferencia de las variables fitoquímicas, la variación del pH fue mayor en Colima, seguida de Guerrero y Puebla. En AT la mayor variación fue en Guerrero y la menor en Oaxaca.
Conclusiones
Entre los 53 genotipos evaluados de H. sabdariffa, destacó UAN 21 por altos contenidos de fenoles solubles totales y antocianinas totales, que son compuestos antioxidantes, combinada con una baja acidez titulable. Con acidez titulable alta y contenidos altos de antocianinas y de FST destacan los genotipos con cálices de color oscuro que tuvieron contenido mayor de fitoquímicos que los de cálices rojo claro, mientras que estos últimos mostraron mayor porcentaje de acidez titulable. Entre ambientes de producción destacaron los genotipos procedentes de Xalisco, Nayarit, por sus cálices con los valores más altos de CTA, FST y AT, en comparación con los demás sitios evaluados. El genotipo, el ambiente y su interacción G×A tienen efectos significativos en la variación de la calidad de los cálices de H. sabdariffa, donde el genotipo fue el factor más importante en CTA y FST, mientras que el efecto de ambiente (localidad) fue el principal responsable de la variación en la acidez de los extractos acuosos.











 text in
text in 


