Introducción
La hoja es, en la mayoría de las plantas, el principal órgano fotosintético y realiza funciones importantes relacionadas con la transferencia de radiación y flujo de gases (Dornbusch y Andrieu, 2010). El tamaño del área foliar es relevante en la mayoría de los estudios ecofisiológicos, por ser indicador del crecimiento y desarrollo de la planta y por estar relacionado con la intercepción de radiación solar, intercambio de CO2, evapotranspiración y eficiencia fotosintética (Backhaus et al., 2010; Misle et al., 2013).
Los métodos para medir el área foliar incluyen el uso de papel milimétrico, gravimetría, planimetría manual y fotoeléctrica, registro de largo y ancho (Pandey y Singh, 2011) o mediante la combinación de dos o más de estos procedimientos y análisis con regresión lineal para obtener modelos empíricos, que facilitan e incluso permiten estimar el área foliar de manera no destructiva y con exactitud, pero la estimación es errónea cuando la variación en el tamaño y forma de la hoja es amplia (Bylesjö et al., 2008). Además, los métodos convencionales son laboriosos y tardados (Chaudhary et al., 2012; Varma y Osuri, 2013), pues miden por separado cada hoja.
El área foliar medida con equipos electrónicos es una medición directa, con precisión de mm2, y hay equipos portátiles aunque su uso es complicado cuando las hojas son pequeñas, como en trigo, o están en las primeras etapas de su desarrollo (Cogliatti et al., 2010). Otra limitante en México es el precio, y algunos como el Li-Cor 3000® (LI-COR BioSciences, Lincoln, Nebraska, USA) no proporcionan perímetro, ni largo y ancho de la hoja.
El procesamiento y análisis de imágenes digitales (AID) es una alternativa para evaluar el tamaño de las hojas, ya que la digitalización se puede realizar con dispositivos poco costosos, como escáneres de escritorio (Varma y Osuri, 2013). También permite medir color, el cual es indicador del estado nutricional, sanidad y senescencia de las hojas (Riccardi et al., 2014; Wang et al., 2014), variables que se estiman o evalúan con el SPAD 502® (Soil Plant Analysis Development. Konica-Minolta Inc. Osaka, Japan). Easlon y Bloom (2014) señalan que los métodos basados en el AID son rápidos, precisos, y están desplazando a equipos que utilizan la obstrucción de la luz para estimar el área foliar.
Las características morfológicas y del color de las hojas se pueden obtener en forma directa o indirecta con el programa comercial Matlab® (MathWorks, Inc. Natick, Massachusetts, USA), que tiene un uso amplio (Dornbusch y Andrieu, 2010; Price et al., 2011; Ali et al., 2012; Corney et al., 2012; Chaudhary et al., 2012; Wang et al., 2014). El programa libre de mayor uso para el registro de dichas variables es ImageJ (Warman et al., 2011; Green et al., 2012; Schneider et al., 2012; Maloof et al., 2013; Easlon y Bloom, 2014; Sauceda et al., 2015).
El área foliar se puede obtener con programas específicos y gratuitos como Black Spot Leaf, creado en Python (Python Software Foundation), que funciona en MS-DOS® (Microsoft Corporation, Redmond, Washington, USA), y sólo registra el área total por imagen (Varma y Osuri, 2013). El programa LAMINA, desarrollado en Java®, reporta el área, el largo, el ancho y la pérdida de área foliar (Bylesjö et al., 2008). Easy Leaf Area, escrito en Phyton, mide área total por imagen, el área y largo por hoja (Easlon y Bloom, 2014). LeafJ, un complemento para ImageJ, proporciona el área y las dimensiones de la hoja y del peciolo (Maloof et al., 2013).
El inconveniente de esos programas es que no registran el color de las hojas y ocupan la intervención del usuario en varias partes del proceso, lo cual requiere tiempo. Por ello se necesita una mayor automatización, que facilite y apresure la medición de las hojas, lo que motivó el desarrollo de una rutina, en el programa ImageJ, para medir el área y color foliar (Macf-IJ) mediante imágenes digitales. El objetivo del este estudio fue describir en detalle el funcionamiento de Macf-IJ y comparar la precisión y rapidez con las de otros métodos. La hipótesis fue, que con Macf-IJ se pueden obtener con exactitud, y en un solo paso, las variables morfológicas y de color foliar.
Materiales y Métodos
Macf-IJ es una rutina o macro desarrollada en ImageJ 1.50b, la cual se integra como un botón a la barra de herramientas, o bien como una instrucción seleccionable en el menú plugins; de ambas maneras permite procesar y analizar con un sólo clic imágenes individuales o todas las contenidas dentro de una carpeta. Requiere imágenes de hojas digitalizadas con escáner de cama plana, de preferencia, aunque no necesario, que no estén en contacto con los bordes del cristal, guardadas en formato de imagen jpeg u otro (tiff, bmp, pgm, png). El uso de imágenes digitales fotográficas necesita de fondo blanco, captura con la mayor nivelación posible de la cámara y que incluya un objeto color rojo en la imagen para referencia de la escala.
El método necesita el pluging o complemento Color_Transformer.java para registrar el color en el espacio CIELab, el cual es más popular para medir la reflectancia y transmitancia de los objetos (Graeff et al., 2008), y de acuerdo con Rodríguez et al. (2012), se utiliza en colorímetros, espectrofotómetros y radiómetros. El uso de dicho espacio permite la comparación de valores de color entre dispositivos que analizan la coloración (Whan et al., 2014).
La rutina establece la escala en forma automática, con base en la resolución de la imagen. Define las medidas requeridas con la instrucción Set Measurements.... El procesamiento para obtener las dimensiones de la hoja consiste en duplicar la imagen original y convertir la nueva imagen a escala de grises a 8 bits (run(“8-bit”)), luego efectúa la segmentación mediante el ajuste de los umbrales de color con el método por defecto (setAutoThreshold (“Default”)); lo anterior crea una imagen binaria que permite discriminar entre el fondo (negro) y las hojas o regiones de interés (blanco). El análisis de partículas de las imágenes se realiza con la función Analyze Particles…, con restricción por tamaño de 0.5 a 500 cm2 y se excluyen los agujeros dentro de la lámina foliar y añade las regiones de interés al manejador (Roi Manager).
El color en el espacio RGB se obtiene de la imagen original. Para ello es necesario separar los tres canales mediante la instrucción Make Composite, o bien en el espacio CIELab (medida más utilizada por los colorímetros comerciales), mediante la transformación del RGB con el uso del complemento Color_Transformer; en ambos casos para cada componente del color se ejecuta el análisis de las regiones de interés añadidas al manejador (roiManager(“Measure”)). En cada hoja se registra el área (cm2), largo (cm), ancho (cm), perímetro (cm), y circularidad (0 a 1); así como también la intensidad del rojo (R), verde (G), azul (B) y el promedio del color (RGB). El conjunto de observaciones para cada variable se almacena en matrices (arrays), para después utilizarlas en un cuadro de resultados personalizado.
Los resultados se guardan automáticamente en un archivo delimitado por comas (.csv), con el prefijo Resultados Área Foliar, más el nombre de la imagen procesada (sin la extensión jpg). Este archivo es abierto por cualquier hoja electrónica de cálculo (MS Excel®, Gnumeric, OpenCalc OpenOffice y LibreOffice Calc). En la primera columna, nombrada Muestra, se identifica el nombre de la imagen, la duración (s), fecha y hora del muestreo. También se genera un cuadro de resumen llamado Resumen Área Foliar, que muestra el total de hojas analizadas, el promedio del tamaño de las hojas (cm2), largo (cm), ancho (cm), perímetro (cm), circularidad (0 a 1), color y el tiempo (s) requerido para el análisis de cada imagen.
La precisión y rapidez de Macf-IJ se comparó con el integrador Li-Cor 3000® y con los programas Black Spot Leaf y Digimizer 4.3.5® (MedCalc Software bvba; Ostend, Belgium), este último mide el color, es de distribución libre y facilita el análisis de imágenes. El tiempo se registró para cada caso. Al azar se recolectaron hojas frescas de 13 especies (Cuadro 1) en las áreas verdes del Colegio de Posgraduados, Campus Montecillo, Estado de México, y se identificaron con base en la descripción morfológica de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO, 2009). El área de cada hoja se obtuvo con el integrador y después se digitalizaron con un escáner multifuncional marca HP® modelo M1132 MFP.
Las imágenes de las hojas se guardaron en formato jpeg a color (RGB), con resolución de 300 ppp y dimensiones de 2550 x 3507 pixeles. El tiempo promedio para obtener la imagen fue 40 s y el peso por archivo fue alrededor de 655 Kb. El color foliar en el espacio CIELab y RGB se evaluó en las 13 especies (datos no mostrados), pero con el fin de obtener deducciones útiles y prácticas para la comparación del color (RGB) se utilizó la especie Rhynchosia minima (L.) DC, o frijolillo, debido a que por efecto de virosis presentaba hojas de colores verde intenso, amarillo y moteado; en estas hojas también se midió el contenido relativo de clorofila con el SPAD 502® y en ambos casos se registró el tiempo.
El área de siete figuras geométricas se obtuvo en forma manual y con el Li-Cor 3000® se midieron al menos en 30 ocasiones, los resultados se compararon con el AID de dichas figuras escaneadas a resolución de 100, 150, 200, 300 y 400 ppp y con fotografías obtenidas con cámara digital marca Fujifilm® modelo Finepix Z20fd (Fujifilm Corporation, China) y guardadas en formato jpeg. La captura se realizó en condiciones de luz natural a la sombra, con un fondo blanco, y se utilizó un objeto circular de color rojo, con diámetro de 3.09 cm, como referencia para calibrar la escala y luego discriminarla del análisis por restricción de circularidad. El tiempo requerido por fotografía fue 3.5 s más 1.5 s utilizados para mostrarla en pantalla y con tamaño medio de 1.08 MB. El análisis de las imágenes fue en el sistema operativo Windows 8® de 64 bits, en un equipo con procesador Intel Pentium® G630 a 2.7 GHz y 3 GB de RAM.
El análisis de los resultados se hizo con InfoStat 2014 (Di Rienzo et al., 2014), mediante la prueba descrita por Shapiro y Wilk (1965) para determinar normalidad y la prueba de Bartlett (1937) para comprobar la homogeneidad de varianzas (estadística paramétrica) de las variables evaluadas, que no se cumplieron para la variable tiempo (s) y en ésta se realizó la transformación recíproca; se analizó con ANDEVA y prueba de comparación de medias por Tukey (p≤0.05) para el tiempo requerido en la obtención del color y del CRC. Las otras variables se comparan entre métodos mediante estadísticas descriptivas, correlación simple de Pearson (r), coeficientes de determinación (R2), raíz del error cuadrático de la media (RECM) y error relativo medio (ERM).
Resultados y Discusión
El área de la misma muestra analizada con Li-Cor 3000® presentó variación en las figuras de menor tamaño, aunque inferior a 8.96 %, mientras que con el uso de fotografías y Macf-IJ la variación fue menor a 1.82 % (Cuadro 2). El triángulo pequeño tuvo el mayor error relativo medio (ERM=2.43 %) entre el integrador y la obtención manual de la superficie, con desviación estándar (DE) de 7.45 %. Easlon y Bloom (2014) reportan un ERM de -11.56 % ± 2.16 % con el uso del Li-Cor 3000®, por lo cual señalan que es menos conveniente que el AID para medir el área de hojas pequeñas.
En nuestros resultados el ERM fue bajo y similar entre el Li-Cor 3000® y el AID de fotografías (Cuadro 2) debido a que se repitió la lectura con el integrador cuando se consideró errónea, lo cual sucedió hasta en un 23.3 % de los casos para el triángulo pequeño. En las figuras de menor tamaño el error fue porque la unión de la banda transparente del integrador proyecta sombra que es considerada como área, situación que afecta en menor proporción a las figuras de mayor superficie, pero de manera eventual en éstas ocurrió pérdida por doblamiento. Otra fuente de error al registrar hojas individuales es omitir el reinicio de la memoria del integrador.
Cuadro 2 Estadísticas descriptivas del área de siete figuras geométricas, obtenida con Li-Cor 3000® y AID (Macf-IJ) de fotografías digitales.
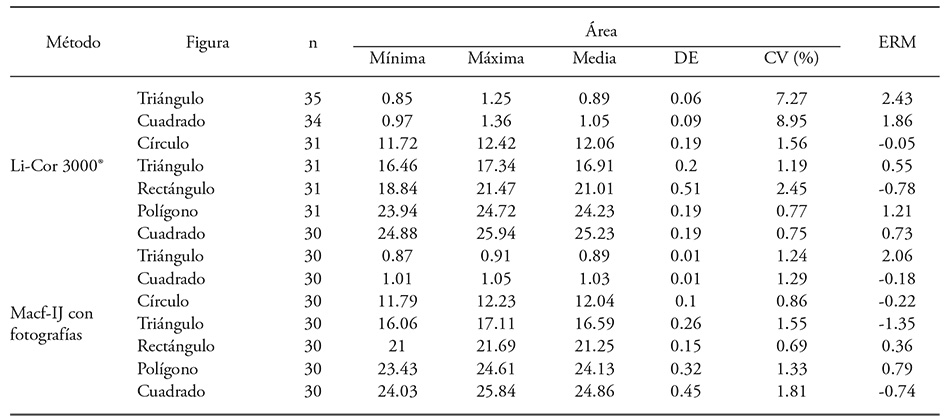
N: número de observaciones; DE: desviación estándar; CV: coeficiente de variación; ERM: error relativo medio con respecto a la medición manual.
El área de las figuras geométricas presentó alta correlación entre los valores obtenidos de manera manual y con el Li-Cor 3000® (R2=0.999, p≤0.001), con error relativo medio (ERM) de 0.83 % y desviación estándar (DE) de 1.08 %. Entre el programa Digimizer® y la obtención manual el ERM fue -0.50 % ±0.85 (DE) y R2=0.999 (p≤0.001), mientras que con Macf-IJ fue de 0.32 % ±1.0 y R2=0.999 (p≤0.001). Los valores de ERM obtenidos en nuestro estudio son inferiores que los reportados por Easlon y Bloom (2014), quienes al comparar el área estimada por gravimetría con la evaluada con ImageJ obtuvieron ERM de 1.67 % y 7.21 %, indican que el área fue sobrestimada con ImageJ debido a sombras producidas al escanear, y que éstas no se eliminaron previo al análisis de la imagen por implicar el uso del programa GIMP (GNU Image Manipulation Program). Dicho argumento no es práctico ni necesario porque con ImageJ es posible discriminar entre el fondo de la imagen y las hojas u objetos de interés.
La mayor exactitud con respecto a la medición manual se tuvo con imágenes escaneadas y analizadas con Macf-IJ (RECM=0.08), seguido por Digimizer® (Cuadro 3). Estos resultados concuerdan con Ali et al. (2012), quienes obtuvieron mayor correspondencia entre la medición manual del área de cinco figuras geométricas y la metodología de análisis de imágenes Optileaf (desarrollada con Matlab®), en comparación con Li-Cor 3100®.
Cuadro 3 Comparación del área obtenida en forma manual, con el Li-Cor 3000® y mediante análisis de imágenes (300 ppp) de siete figuras geométricas.
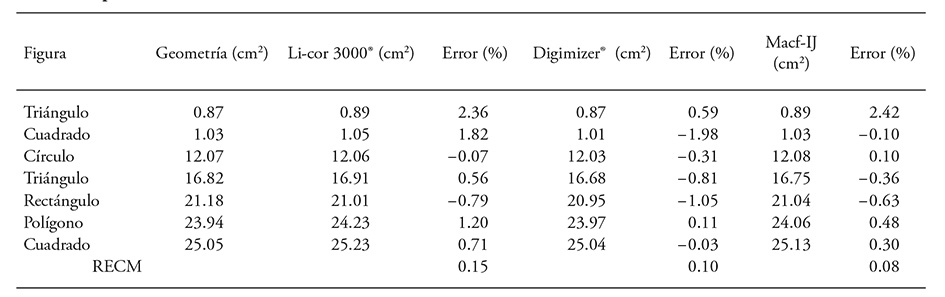
RECM: raíz del error cuadrático de la media.
Las diferencias porcentuales del área en las cinco resoluciones de imágenes fueron menores a 0.25 % con respecto al cálculo manual; en relación con Li-Cor 3000® el error relativo medio fue 0.91 % a 1.08 % (Cuadro 4). El área de las figuras geométricas en todas las resoluciones muestra exactitud con la medición manual (RECM≤0.056) y también comparado con el integrador, aunque el RECM se incrementa alrededor del doble (Cuadro 4). El coeficiente de determinación entre el área observada en cada resolución y la obtención por geometría fue 1, y con Li-Cor 3000® fue 0.999. Estos resultados son similares a los descritos por Bradshaw et al. (2007), quienes reportan un R2 de 0.972 entre el área de hojas de soya (Glycine max L.) registrada con integrador (Li-Cor 3100®) y el análisis con Adobe® Photoshop® (Adobe Systems Incorporated, San José, CA.) de imágenes con resolución de 300, 600 y 1200 ppp.
Cuadro 4 Diferencias porcentuales y RECM entre el área obtenida con Macf-IJ en una imagen a diferente resolución comparado con el método manual y con Li-Cor 3000®.
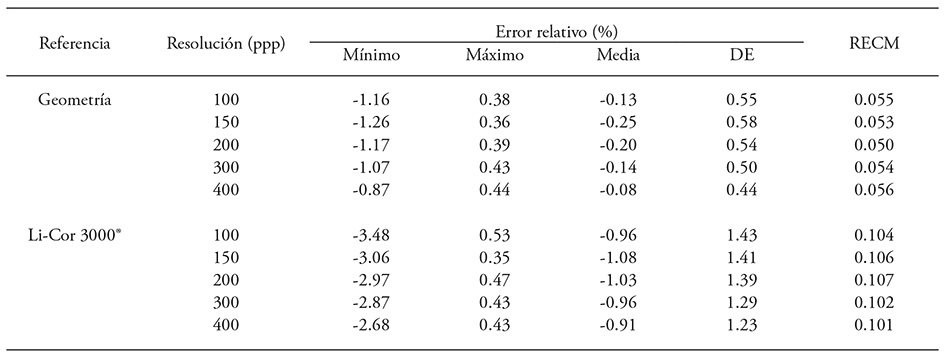
n = 7; DE: desviación estándar; RECM: raíz del error cuadrático de la media.
La obtención de imágenes de 100 ppp ocupó 17.5 s, mientras que la digitalización a 150, 200 y 300 ppp duró de 36.4 s a 40.3 s, y para 400 ppp fue 106.8 s. Existe una estrecha relación entre la resolución y el tiempo de requerido para el AID con Macf-IJ (r=0.99, p≤0.01), lo cual coincide con Dornbusch y Andrieu (2010), quienes mencionan que el tiempo de procesamiento depende del tamaño y resolución de la imagen. También concuerda con Chen et al. (2011) quienes reportan que para obtener el área de hojas de Euonymus japonicus Thunb a mayor resolución de las fotografías digítales se incrementa la duración del AID con Adobe® Photoshop®. Así, el uso de imágenes escaneadas con resolución menor a 300 ppp, reduciría tiempo en digitalización, en el AID y en tamaño de archivo.
Para la mayoría de las especies, el área foliar registrada con Li-Cor 3000® presentó alta correlación con la obtenida mediante Macf-IJ; con excepción de cinco de las gramíneas, el R2 fue mayor a 0.98 (Cuadro 5). Green et al. (2012) señalan resultados similares, ya que obtuvieron un R2 de 0.979 entre el área en hojas de Brassica rapa obtenida con el programa PhenoPhyte y la registrada con un integrador. También coincide con la alta correlación (r=0.999) entre el área medida con optileaf y el Li-Cor 3100® en 40 hojas de diferente forma y tamaño indicada por Ali et al. (2012). Chaudary et al. (2012) también obtuvieron una precisión superior a 99 % entre el área de 70 hojas medidas con Matlab 2010a® y mediante estimación con papel milimétrico. Green et al. (2012) reportaron una relación estrecha entre los registros de área con PhenoPhyte e ImageJ (r=0.998), lo cual concuerda con los coeficientes aquí observados entre Digimizer® y Macf-IJ (Cuadro 5).
Cuadro 5 Coeficiente de determinación y RECM entre el área foliar obtenida con Li-Cor 3000® y mediante el AID (300 ppp) de hojas recolectadas en 13 especies de plantas.
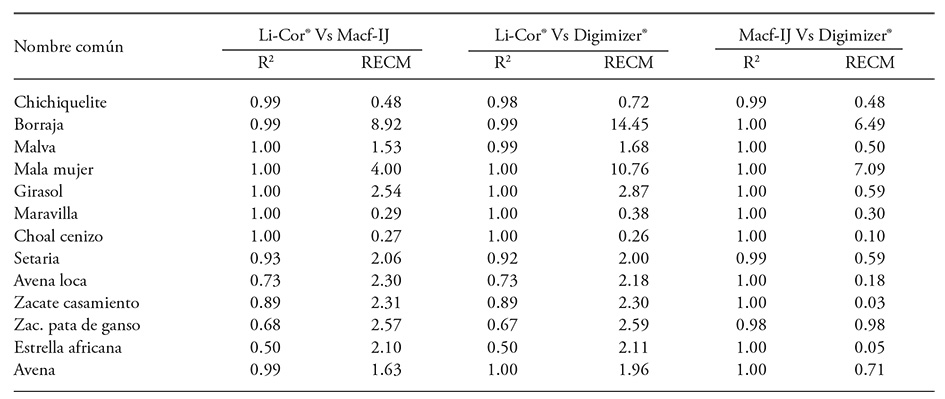
RECM: raíz del error cuadrático de la media.
Las hojas de mala mujer y de borraja son difíciles de medir con Li-Cor 3000®; las primeras poseen espinas duras y agudas, y sólo se usaron 15 muestras para evitar un eventual daño a la banda transparente del Li-Cor 3000®, y fue necesario invertir tiempo para solventar dicha situación. Las hojas de borraja se doblan al pasar por la banda transparente, y cuando ocurrió, se repitió el proceso e implicó mayor tiempo (23.4 s). Pese a ello hubo pérdida en el registro del área, lo cual se refleja en mayor valor del RECM (Cuadro 5). Ambos casos no fueron relevantes en el AID, pero sí aumentaron el tiempo requerido para digitalización, debido al mayor tamaño de la lámina foliar (Cuadro 6) ya que sólo se pudo capturar una o dos hojas por imagen.
Cuadro 6 Área foliar promedio y tiempo requerido para su registro con Li-Cor 3000® y mediante AID (300 ppp) de hojas recolectadas de 13 especies de plantas.
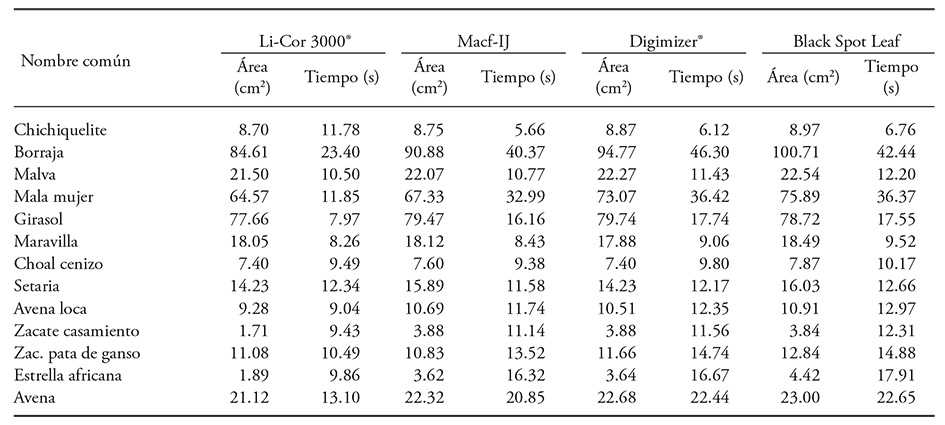
Los pastos casamiento y estrella africana presentaron menor área foliar al medirse con Li-Cor 3000® (Cuadro 6). La diferencia con respecto al AID fue 55.8 % y 47.8 %, respectivamente, porque las hojas se doblan a lo largo de la nervadura central. Una situación similar fue reportada en trigo por Sauceda et al. (2015), quienes señalan que la medición correcta del área foliar con el AID es difícil cuando las hojas de este cereal se marchitan y pierden turgencia. Tal inconveniente se soluciona mediante la fijación de las láminas foliares con cinta adhesiva transparente, pero el proceso requiere más tiempo. Dicha propuesta también evita la sobre posición de las hojas (Dornbusch y Andrieu, 2010). En gramíneas el enrollamiento de las hojas representa un problema serio para el registro del área foliar con Li-Cor 3000®. Los valores medios de área foliar por especie obtenidos con Black Spot Leaf y Macf-IJ presentan una R2=0.994 (p ≤0.001), aunque el programa Black Spot Leaf sobrestimó el área foliar en la mayoría de los casos (Cuadro 6).
El tiempo promedio utilizado por hoja con el Li-Cor 3000® fue 11.35±3.95 s, mientras que con Macf-IJ fue 16.07 ±10.03 s, con Digimizer® fue 17.45±11.57 s y con Black Spot Leaf fue 17.57±10.58 s, aunque sin diferencia significativa (p>0.134). Estos resultados no coinciden con O’neal et al. (2002), quienes reportan que para registrar el área total y dañada de cinco hojas de soya (Glycine max L.) el tiempo fue menor con AID (3:25±0:03, min:s) en comparación con Li-Cor 3000® (6:10±0:10). Macf-IJ permite registrar área, ancho, largo, perímetro y color (RGB) de la hoja en 41.4 s por imagen (tiempo que incluye la digitalización más el análisis). Esta duración es similar a la señalada por Easlon y Bloom (2014) para la captura de la imagen con cámara digital que ocupó cerca de 35 s y el análisis con Easy Leaf Area requirió 5 s, pero contrasta con la reportada por Davidson (2011) de que para digitalizar con escáner se necesita unos 5 min más 3 min para el análisis con ImageJ. Dicha diferencia en parte se debe a que la metodología propuesta por este autor es seleccionar en la imagen cada hoja a medir, mientras que con Macf-IJ la identificación y las medidas de las hojas son automáticas. Con el uso de fotografías la captura fue en 6.0 s y el análisis con Macf-IJ en 3.87 s, lo cual es menor que el tiempo señalado por Easlon y Bloom (2014).
Las características de tamaño, resolución de la imagen, el programa, equipo de cómputo utilizado, así como la forma de realizar el procesamiento (manual o automatizado), reflejan lo complejo del análisis o cantidad de variables procesadas que determinan el tiempo requerido para el AID. La obtención del color en CieLab necesitó alrededor de 7.5 s; es decir, cerca de 80 % más tiempo que medirlo en el espacio RGB (1.4 s). Según Dornbusch y Andrieu (2010), para registrar la forma de la hoja con base al ancho y la distancia utilizaron cerca de 15 s con el programa MATLAB 7.04® en un equipo con procesador INTEL® Xeon® (2 GHz).
La duración también depende del tamaño de las láminas foliares, debido a que entre más pequeñas sean, mayor es la cantidad de hojas que se pueden digitalizar en una sola imagen. En chichiquelite se registró el tiempo menor (5.59 s) de digitalización por hoja (requirió sólo dos imágenes para capturar 40 hojas), lo cual junto con el procesamiento suman 5.66 s. En choal cenizo se necesitaron en total 9.38 s por hoja, y para maravilla se ocuparon 8.43 s (Cuadro 6). En los casos mencionados se obtuvieron tres imágenes como máximo, por lo que una limitante de la metodología cuando se utilizan imágenes escaneadas es el número de hojas que se pueden digitalizar a la vez, pero con la ventaja de obtener el largo, ancho, perímetro, circularidad y color.
El contenido relativo de clorofila (CRC) obtenido con el sensor SPAD 502® mostró estrecha asociación con el canal verde (G) (r=-0.946, p≤0.01). La relación también es fuerte con el canal rojo (R) y el canal azul (B), con valores de correlación de -0.941 y -0.881, respectivamente. Los coeficientes de correlación entre los canales del espacio de color RGB obtenido con Digimizer® y el CRC fueron -0.939, -0.942 y -0.811 en ese orden, para el rojo, verde y azul. La pendiente negativa coincide con lo reportado en arroz (Oryza sativa L.) por Wang et al. (2014), quienes encontraron coeficientes de correlación más bajos al comparar el CRC con el color rojo (r=-0.68), el verde (r=-0.67) y el azul (r=-0.48); también indican que el análisis de color es un método sencillo para evaluar estado del nitrógeno en plantas de arroz. Además, Teoh et al. (2012) reportan alta asociación entre el CRC con el color rojo (r=-0.97) y con respecto al verde (r=-0.82) en hojas de arroz. La misma tendencia se presentó cuando Riccardi et al. (2014) compararon el color (RGB) de imágenes fotográficas y el CRC, con la concentración de clorofila foliar, obtenida por extracción de pigmentos de hojas de amaranto (Amaranthus sp.) y quinua (Chenopodium quinoa Willd.), y la mayor correlación fue entre los valores RGB y la concentración de clorofila foliar (r=-0.96) que la mostrada entre ésta y el CRC obtenido con el SPAD 502® (r=0.92).
El análisis de las dimensiones y la coloración de las hojas con Macf-IJ necesitó menor tiempo (4.43 s) con respecto a la obtención del CRC (p≤0.001), incluso cuando con este último se realizó una sola lectura por foliolo. Así, en hojas de frijolillo con tamaño promedio de 10.35 cm2 se usó 24.2 s por cada una, en hojas de 4.72 cm2 aumentó a 30.15 s, y al realizar con el SPAD 502® tres lecturas por foliolo, en estas mismas hojas, el tiempo incrementó a 49.52 y 59.22 s, de manera respectiva (DMS=7.53, p≤0.05), pero con tres mediciones por foliolo la precisión mejoró entre el CRC y el verde, pues el coeficiente de determinación, con una sola lectura fue 0.893 y pasó a 0.927, el rojo aumentó de 0.881 a 0.917, y el azul de 0.774 a 0.867. Lo anterior denota la importancia del tamaño de las hojas en la medición del CRC y la relevancia del número de observaciones necesarias con SPAD 502®, para lograr una mayor confianza en las lecturas; es decir, que sean representativas de la condición real de cada hoja. Chang y Robison (2003) mencionan que para obtener un valor del CRC confiable, en hojas de maíz, se requieren múltiples mediciones con el SPAD 502®, pero que éstas implican mayor tiempo.
El sensor SPAD 502® no midió hojas o parte de éstas de color amarillo por completo, lo cual ocurrió cuando el componente de color verde (G), obtenido con AID, presentó un valor superior a 150, lo cual es un inconveniente cuando la hoja presenta áreas cloróticas como en Rhynchosia minima (L.) DC., ya que provocan lecturas fallidas (el sensor SPAD 502® marca error) que aumentan el tiempo requerido para obtener el CRC. También la intensa variación de color en la lámina foliar afecta la relación entre los componentes del color (RGB) y las lecturas del SPAD 502®, porque este sensor mide una pequeña área de la hoja (6.0 mm2) y la posición del sensor en las pinzas (12 mm) limita su alcance de medición en las hojas. De acuerdo con Ali et al. (2012), el grosor de las hojas, estrés biótico y enfermedades afectan estas lecturas. Según Riccardi et al. (2014), los valores RGB obtenidos a través de fotografías digitales directamente en campo, representa un método rápido, más efectivo y de menor costo que el uso del SPAD 502® para estimar el contenido de clorofila en hojas de amaranto y quinua.
Conclusiones
Macf-IJ es un método fácil y rápido para medir con precisión el color y el área de las hojas mediante imágenes escaneadas y fotografía digital, con la ventaja de que el procesamiento y análisis es automatizado, proporciona las dimensiones de las hojas y permite registrar el color de toda la lámina foliar. La hipótesis de que Macf-IJ mide con exactitud y en un solo paso, las variables morfológicas y de color foliar fue confirmada
Macf-IJ mide más rápido el color en hojas pequeñas, como las de Rhynchosia minima (L.) DC., que la obtención del contenido relativo de clorofila con SPAD 502®. Además, medir la coloración con Digimizer® y Macf-IJ presenta ventaja especialmente cuando existen áreas cloróticas o variación del color en la lámina foliar.











 texto en
texto en 



