Introducción
El arroz (Oryza sativa L.) es uno de los cultivos más importantes en la población mundial por ser una de las principales fuentes de alimento y para suplir su demanda en la próxima década será necesario producir de 8 a 10×106 Mg más de la produción actual de este cereal (Seck et al., 2012). Para satisfacer la demanda de este alimento debe aumentarse la producción en la misma área de cultivo y enfrentar el cambio climático, lo cual implica aplicar estrategias como mejorar la calidad del suelo y el manejo preciso de las prácticas agrícolas (Uribe-Vélez, 2011; García de Salamone et al., 2012). La aplicación de fertilizantes químicos es efectiva para proveer al suelo de nutrientes, pero un aporte excesivo tiene un efecto negativo en el ambiente a corto y largo plazo, tal es el caso de la emisión de óxido nitroso a la atmósfera y la contaminación del agua con nitratos, ya que se dispersan en la escorrentía o se convierten en formas insolubles no asimilables por las plantas (Halpern et al., 2014).
Norte de Santander es un departamento de Colombia importante en la producción agrícola, pero su modelo de producción convencional ha permanecido por más de 40 años en regiones como el distrito de riego del Río Zulia. Éste se caracteriza, como en el resto del país, por el monocultivo, el laboreo excesivo, el uso continuo de fertilizantes y pesticidas sintéticos, lo cual afecta las propiedades físicoquímicas de estos suelos (Cuevas, 2012). Lo anterior ocasiona desequilibrio ecológico del agroecosistema, con disminución de la población de organismos benéficos, incremento de población de arvenses, fitopatógenos y plagas, acidificación de los suelos, disminución del contenido de materia orgánica y reducción de la actividad biológica de los microorganismos benéficos (Cañón et al., 2009). En este grupo de microorganismos se encuentran las rizobacterias promotoras del crecimiento vegetal o PGPR (del inglés Plant Growth Promoting Rhizobacteria), las cuales destacan por sus efectos benéficos para las plantas y, en consecuencia, para los ecosistemas por diversos mecanismos como la fijación biológica de nitrógeno, solubilización de fosfatos y micronutrientes, producción de fitohormonas y otros metabolitos asociados al biocontrol de patógenos como antibióticos y sideróforos, producción de quitinasas e inducción de resistencia en las plantas (Ahemad y Khan, 2012; Son et al., 2014).
Los microorganismos adaptados a una región determinada pueden preferirse en la selección de aislamientos para el desarrollo de inoculantes destinados a cultivos regionales, ya que podrían ser más competitivos que las bacterias foráneas o introducidas (Karagöz et al., 2012). El desarrollo de biofertilizantes debe iniciarse con el aislamiento de microorganismos de interés y la caracterización de los mecanismos asociados con la promoción del crecimiento vegetal (Vanegas et al., 2011). Hay investigaciones orientadas al aislamiento e identificación de cepas de rizobacterias en arroz (De Souza et al., 2012; Sahoo et al., 2013), maíz (Zea mays L.) (López-Ortega et al., 2013), hortalizas (Coriandrum sativum L. y Lattuca sativa L.) (Cárdenas et al., 2013), y banano (Musa paradisiaca) (Andrade et al., 2014). Estas cepas fueron caracterizadas según actividades promotoras del crecimiento vegetal como la síntesis de ácido indolacético, solubilización de fosfatos, fijación de biológica de nitrógeno y producción de sideróforos. Al final del proceso se seleccionan los microorganismos con efectos benéficos en los cultivos. Por lo anterior, el objetivo de esta investigación fue aislar bacterias asociadas a plantas de arroz cultivadas en suelos del distrito de riego del Río Zulia (Norte de Santander), determinar su potencial como bacterias promotoras del crecimiento vegetal y seleccionar las más promisorias para el desarrollo de biofertilizantes que incrementen el rendimiento de los cultivos regionales.
Materiales y Métodos
Aislamiento de rizobacterias
Toma de muestras
Las muestras de suelo rizosférico tomadas del cultivo de arroz corresponden a diez parcelas en las veredas El 52 (área 1), Matecaña (área 2, 3 y 10), Limoncito (área 4), San Roque (área 5 y 6), Gorgona (7 y 8) y Buena Esperanza (área 9), las cuales están ubicadas en el distrito de riego del Río Zulia (Norte de Santander). Este distrito se encuentra entre 68 y 120 m de altitud y tiene un clima cálido húmedo con temperaturas entre 27 y 34 °C y humedad relativa de 70-90 % y clasificación según Holdrige de bosque húmedo tropical (bh-T) (IGAC, 2006). El muestreo se realizó en un recorrido en zigzag tomando 10 submuestras, cercanas a 1 kg, de cada parcela a una profundidad de 20 cm en cultivos de 50 y 80 d después de la siembra. Las muestras se procesaron en el Laboratorio de Investigaciones en Biología Aplicada de la Universidad Francisco de Paula Santander.
Aislamiento de bacterias del género Azotobacter
El aislamiento se realizó sembrando de 10 a 30 gránulos de suelo rizosférico en agar Ashby (Aquilanti et al., 2004). Los cultivos se incubaron a 32 °C hasta obtener crecimiento abundante de colonias viscosas con pigmento amarillento, verde o marrón alrededor de los granos de suelo. Estas colonias se sembraron en nuevo agar Ashby hasta obtener cultivos puros. En los aislamientos se realizó la tinción de Gram para confirmar desarrollo de células Gram negativas y quistes característicos de éste género.
Aislamiento de bacterias del género Pseudomonas
El aislamiento se realizó con la metodología de diluciones seriadas de suelo rizosférico en solución salina (0.85 % de NaCl). Las placas de agar King B (King et al., 1954) fueron inoculadas con 100 µL de las diluciones 10-2 a 10-7 y se incubaron a 32 °C hasta el crecimiento de colonias con formación de pigmento soluble a su alrededor. Las colonias se sembraron en un nuevo agar King B hasta obtener el cultivo puro. Después se realizó tinción de Gram para confirmar el desarrollo de células con forma de bacilos Gram negativos. Las colonias en agar King B se expusieron a luz ultravioleta para observar la presencia del pigmento fluorescente, característico de las especies de este género.
Los aislamientos se conservaron usando el método de viales en refrigeración con solución salina estéril (0.85 % de NaCl) (Sarmiento et al., 2013).
Caracterización de los aislamientos de las rizobacterias según actividades de promoción del crecimiento vegetal
Activación de los microorganismos
Los aislamientos conservados en solución salina estéril se activaron en agar Ashby y agar King B para los géneros Azotobacter y Pseudomonas, respectivamente, y se incubaron a 32 °C hasta el crecimiento de las colonias. Con los cultivos viables obtenidos se realizó la evaluación cuantitativa de las actividades promotoras de crecimiento vegetal.
Preparación de inóculos bacterianos
Desde una cepa de cada aislamiento se preparó un inóculo en 50 mL de caldo DYGS (Radwan et al., 2005) y se incubó 24 h a 32 °C. Una suspensión de 10 mL de este cultivo se transfirió a un tubo y se centrifugó 10 min a 4124 g. El sobrenadante se descartó y se adicionaron 10 mL de amortiguador fosfato estéril (0.06 M y pH 7.0) para resuspender las células y ajustar la concentración celular a una D.O.605nm=0.5 en un espectrofotómetro Spectroquant NOVA60. Estas suspensiones celulares obtenidas de cada aislamiento se usaron para determinar la producción de ácido indolacético (AIA), actividad solubilizadora de fosfatos, fijación biológica de nitrógeno y síntesis de sideróforos.
Determinación de la producción ácido indolacético (AIA)
De la suspensión celular ajustada se tomaron 100 µL y se inocularon en 25 mL de caldo DYGS más un suplemento de 0.15 g L-1 de triptófano y 0.2 g L-1 de NH4Cl. Los cultivos se incubaron en oscuridad a 120 rpm y 32 °C. Cada aislamiento se inoculó en tres réplicas y se instaló un testigo sin inocular en las mismas condiciones. Después de 72 h de incubación, 10 mL del caldo microbiano se centrifugaron 10 min a 4124 g. La determinación de compuestos indólicos se realizó adicionando 1 mL del sobrenadante y 4 mL de reactivo de Salkowsky (5 mL de FeCL3·6H2O [0.5M] en 250 mL de HCLO4 [35 %] para un volumen de 500 mL), hasta obtener una coloración rosada. La absorbancia de las muestras se leyó a 525 nm en el espectrofotómetro Spectroquant NOVA60. La concentración de compuestos indólicos se calculó con la ecuación de regresión lineal de la curva de calibración construida con siete concentraciones de ácido indolacético, AIA (25, 50, 100, 150, 200, 250 y 300 mM) (Cárdenas et al., 2010).
Determinación de actividad solubilizadora de fosfatos
La determinación de P disponible se realizó según el método de Bray II, adaptada para cultivos bacterianos (Cárdenas et al., 2013). De la suspensión celular ajustada a una D.O.605nm=0.5 de cada aislamiento como ya se describió, se tomaron 100 µL y se inocularon en 25 mL de caldo SRS (Sundara-Rao y Sinha, 1963) con fosfato tricálcico como fuente de P insoluble. Los cultivos se incubaron 48 h a 30 °C, a 120 rpm. Cada aislamiento se inoculó en tres réplicas y se instaló un testigo sin inocular bajo las mismas condiciones. Después de la incubación se centrifugaron 10 mL del cultivo microbiano a 4124 g por 10 min. La extracción de P disponible se realizó en 10 mL del sobrenadante con la adición de 10 mL de la solución extractora (1.11 g de NH4F y 25 mL de HCl [4N] en un volumen de 1 L) y se agitaron 1 min. Luego se tomó un 1 mL de esta solución y se adicionaron 9 mL de la solución coloreadora (5 mL de la solución A y 2 mL de solución B en 200 mL de agua destilada) (Solución A: 30 g (NH4)6MO7O24·4H2O en 100 mL de agua destilada y 0.728 g de K(SbO)C4H4O6·½H2O en 160 mL de agua destilada. Solución B: 3.05 g de ácido ascórbico en 25 mL de agua destilada). La lectura de la absorbancia (605 nm) en espectrofotómetro se realizó después de 15 min de la reacción. La concentración de P disponible (µg de P2O5 mL-1) que indica la capacidad de solubilización de fosfatos, se calculó usando la ecuación de regresión lineal de la curva de calibración construida a partir de concentraciones de KH2PO4: 5, 10, 20, 30, 40 y 50 µg mL-1.
Evaluación de la fijación biológica de nitrógeno
La determinación de la fijación de nitrógeno (N) por las cepas de rizobacterias aisladas se realizó según la metodología de micro-Kjeldhal (Kuss et al., 2007) con modificaciones. De la suspensión celular ajustada a una D.O.605nm=0.5, de cada aislamiento como ya se describió, se inocularon 1000 µL en viales con 10 mL de medio semisólido JMV semisólido (g L-1 de medio: Manitol 5.0; KH2PO4 0.6; MgSO4·7H2O 0.2; NaCl 0.1; CaCl2·2H2O 0.2; solución de micronutrientes 2 mL (g L-1: CuSO4·5H2O 0.04; ZnSO4·7H2O 1.20; H3BO3 1.40; Na2MoO4·H2O 1.00; MnSO4·H2O 1.18); azul de bromotimol 2 mL (solución 0.5 % en 0.2N KOH); FeEDTA 4 mL (solución 1.64 %); solución de vitaminas 1 mL (biotina 10 mg y piridoxol-HCl 20 mg en 100 mL); pH 4.0-4.5; agar 2.5) para Pseudomonas sp. y medio semisólido Ashby para Azotobacter sp. Este procedimiento se realizó por triplicado. Después del crecimiento bacteriano se realizó lisis celular colocando los viales en autoclave por 1 min a 15 libras de presión. De la suspensión resultante se adicionaron 5 mL en un tubo para la digestión de toda la muestra para transformar todo el N orgánico a una forma mineral (NH+3). La digestión se realizó con la adición de 4 mL de ácido sulfúrico concentrado y 10 mL de peróxido de hidrógeno 30 % (V/V) al tubo que contenía la muestra. Los tubos se colocaron en el equipo de digestión a una temperatura inicial de 180 °C por 120 min y luego 60 min a 375 °C. Después, los tubos del digestor se retiraron y se aforó su contenido a 50 mL con agua destilada. Luego se leyeron las muestras en el espectrofotómetro HACH DR/2000 para cuantificar el N total (Nt) transformado a NH+3. La cuantificación del Ntotal se realizó en 1 mL del producto de la digestión al cual se adicionaron 2 mL del reactivo de Nessler en presencia de una gota de catalizador y una gota de alcohol polivinílico; se obtuvieron coloraciones amarillas que se compararon con la curva de calibración estándar del equipo. El cálculo de Nt fijado se presentó en µg mL-1.
Determinación de la síntesis de sideróforos
De la suspensión celular ajustada a una D.O.605nm=0.5, de cada aislamiento como ya se describió, se tomaron 2.5 mL y se inocularon en 50 mL de Caldo Simon y Tesmann (g L-1 de caldo: ácido málico 10; NaCl 5.8; KCl 3.7; CaCl2·2H2O 0.15; Tris 12.1; cloruro de magnesio 0.1; cloruro de amonio 1.1; Na2SO4 0.142; K2HPO4 0.272; pH 6.8). Los cultivos bacterianos se incubaron a 120 rpm a 32 °C por 5 d. Cada aislamiento se inoculó en tres réplicas y se instaló un testigo sin inocular bajo las mismas condiciones. De los cultivos se tomaron 10 mL de caldo y se llevaron a tubos de centrífuga para realizar la determinación de sideróforos producidos. La centrifugación se realizó a 4124 g por 10 min. La cuantificación de los sideróforos se realizó en 1 mL del sobrenadante con la adición de 1 mL de una solución de 5 mM de perclorato férrico en 0.14 M de ácido perclórico. Una vez obtenida la reacción, se leyó la absorbancia en espectrofotómetro a 525 nm. La concentración de sideróforos se calculó usando la ecuación de regresión lineal de la curva de calibración construida con cinco concentraciones (5, 20, 50, 80, 100 µg mL-1) de un sideróforo tipo hidroxamato (mesilato de deferroxiamina, SIGMA) con la solución de perclorato férrico y leídas en el mismo espectrofotómetro.
Análisis estadístico
Para cada variable de promoción del crecimiento vegetal se realizó un ANDEVA y las medias de los tratamientos se comparron con la prueba de Tukey (p≤0.05) con el programa IBM SPSS Statistics 19. Los valores obtenidos de la media de tres repeticiones de las características promotoras del crecimiento vegetal para cada aislamiento, se compararon entre sí y con nueve controles diseñados: 1) con el valor superior en la producción de ácido indolacético (Ctrl AIA), 2) el valor superior en solubilización de fosfatos (Ctrl SP), 3) en síntesis de sideróforos (Ctrl Sider) y, 4) en fijación biológica de N (Ctrl FBN). También se diseñaron tres controles con niveles intermedios en todas las actividades promotoras del crecimiento vegetal evaluadas (Ctrl Medio_1, Ctrl Medio_2, Ctrl Medio_3), y dos con los mayores y menores valores obtenidos en todas las actividades (Ctrl+ y Ctrl-). Las similitudes entre estos valores se estimaron según la Distancia Euclídea, se agruparon por el método de las medias entre grupos y se representaron gráficamente en un dendrograma con el programa IBM SPSS Statistics 19 (Hernández et al., 2004). Esta metodología permite clasificar los aislamientos según sus valores en cada una de las actividades promotoras del crecimiento vegetal evaluadas para seleccionar aquellos que presenten las medias más cercanas a los controles diseñados. Los aislamientos seleccionados continuaron con el proceso de identificación molecular.
Identificación molecular de las rizobacterias por el gen 16S ADNr
Los aislamientos seleccionados de Pseudomonas fueron cultivados en caldo Luria Bertani a 150 rpm a 30 °C por 18 h y los del género Azotobacter se cultivaron en caldo DYGS a 150 rpm por 30 h. La extracción del ADN se realizó a 1 mL del cultivo, utilizando el KIT Isolated II Genomic DNA de Bioline. La verificación de la calidad del ADN extraído se realizó mediante electroforesis horizontal en gel de agarosa al 1 % (P/V) a 120 V por 90 min, empleando TBE 0.5 X como amortiguador de corrimiento. La amplificación del gen 16S ADNr se realizó en 50 µL de una mezcla de reacción compuesta por 5 µL de amortiguador (1x), MgCl2 (2 mM), dNTP (200 µM), iniciadores 27F (5’ AGAGTTTGATCMTGGCTCAG 3’) (1 µM) y 1492R (5’ TACGGYTACCTTGTTACGACTT 3’) (1 µM) (Rohwer et al., 2002); 1.25 U de Taq DNA polimerasa y 1 µL de ADN molde (muestra del aislamiento). Las condiciones del termociclador fueron: un ciclo inicial de denaturación (94 °C por 5 min), 30 ciclos de denaturación (94 °C por 30 s), anillaje (57 °C por 45 s) y extensión (72 °C por 90 s) y extensión final (72 °C por 7 min). Los fragmentos amplificados se observaron mediante electroforesis en gel de agarosa al 2 % en TAE acondicionado con 0.5 µg mL-1 de bromuro de etidio. El producto amplificado se envió a secuenciación a Corpogen y el resultado se analizó con BLAST (Basic Local Alignment Search Tool) y EMBL (European Molecular Biology Laboratory).
Resultados y Discusión
Aislamiento de rizobacterias pertenecientes a los géneros Azotobacter y Pseudomonas
Diez aislamientos presuntivos del género Azotobacter y 32 de Pseudomonas según sus características fenotípicas, se obtuvieron a partir de las muestras de suelo rizosférico. Las colonias de Azotobacter fueron seleccionadas por presentar crecimiento viscoso y abundante, con pigmentación amarillenta y café y presencia de células Gram negativas con formación de quistes. Este crecimiento viscoso de Azotobacter está asociado con su producción de exopolisacáridos (EPS), como el alginato el cual participa en el enquistamiento de las células como mecanismo de protección y de polihidroxibutirato (PHB) que es el principal material que constituye la reserva de carbono y energía de estas células bacterianas y está relacionado con la fijación biológica de nitrógeno, debido a que protege a la enzima nitrogenasa contra la alta concentración de oxígeno (Gauri et al., 2012).
Los aislamientos del género Pseudomonas sp. fluorescentes se seleccionaron por la formación de un pigmento amarillo-verdoso difusible en agar King B y presencia de bacilos Gram negativos. Los pigmentos son moléculas tipo sideróforos de bajo peso molecular que actúan como agentes quelantes de Fe, considerados muy importantes en la nutrición vegetal (Aguado-Santacruz et al., 2012). Bacterias del género Pseudomonas están en la rizósfera de suelos arroceros y colonizan los tejidos de las plantas de arroz, lo cual indica su comportamiento asociativo y endófito (Sivakamasundari y Usharani, 2012). Phetcharat y Duangpaeng (2012) obtuvieron desde varios tejidos de plantas de arroz, 34 aislados identificados como Pseudomonas sp. y en menor cantidad, rizobacterias pertenecientes a los géneros Bacillus, Azotobacter y Enterobacter. Habibi et al. (2014) reportan las especies Pseudomonas veronii, P. putida, P. monteilii y P. mandelii como endófitas del arroz, y Souza et al. (2015) encontraron asociados a este cultivo, aislamientos pertenecientes a los géneros Burkholderia, Enterobacter y Pseudomonas. Estos resultados se relacionan con los obtenidos en nuestro estudio y muestran una marcada ocurrencia de Pseudomonas en suelos arroceros. Pero Chennappa et al. (2014) y Sahoo et al. (2013) también reportan el aislamiento de especies de Azotobacter, sobre todo en suelos con pH más cercano a la neutralidad. Esto permite inferir que existen varios factores que influyen en la diversidad microbiana de estos suelos y que la obtención de pocos aislados del género Azotobacter se puede relacionar con la naturaleza ácida de los suelos de donde fueron tomadas las muestras, los cuales se caracterizaron por ser de fuerte (4.23) a moderadamente (5.60) ácidos.
Caracterización de actividades asociadas a la promoción de crecimiento vegetal
Los 42 aislamientos bacterianos obtenidos presentaron todas las actividades de promoción de crecimiento vegetal evaluadas, aunque algunos se destacan en unas de estas características (Cuadro 1).
Cuadro 1 Características relacionadas con la promoción del crecimiento vegetal en las bacterias aisladas.
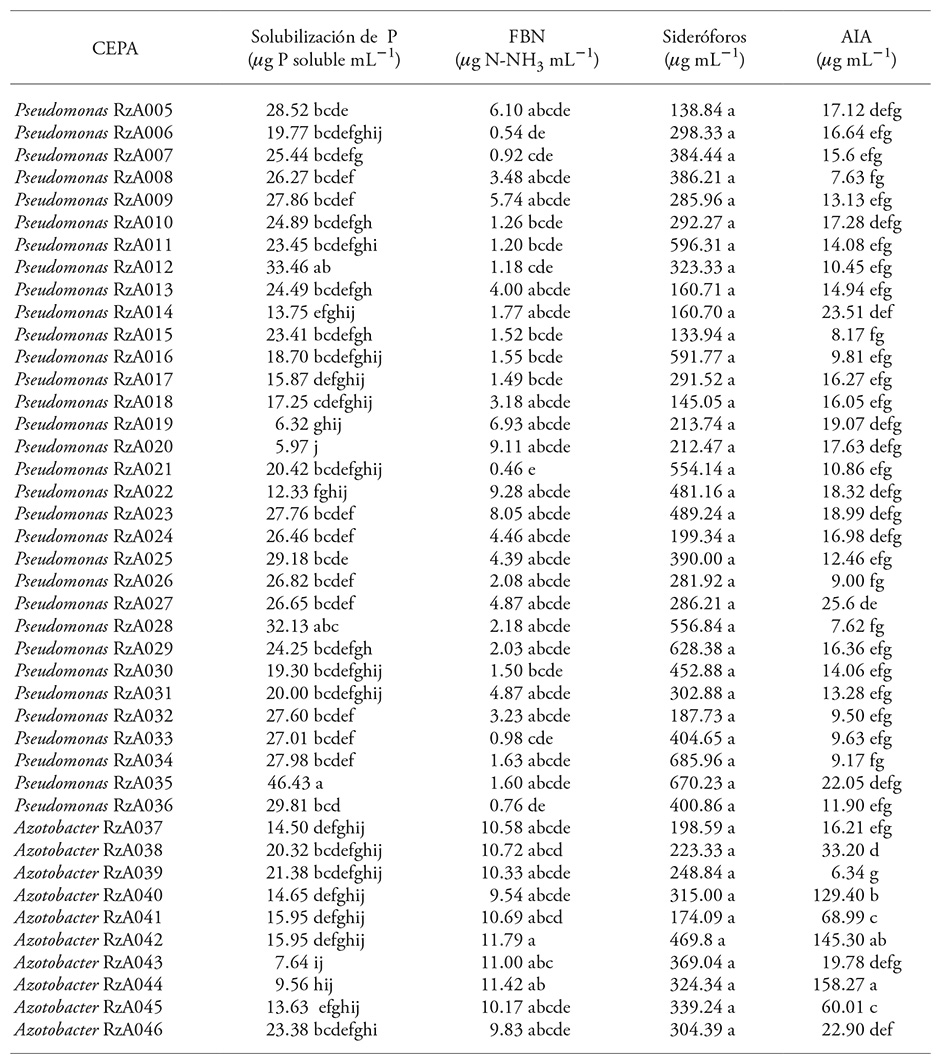
Media de tres repeticiones. Medias con diferente letra en una columna son estadísticamente diferentes (Tukey; p≤005).
Producción de ácido indolacético (AIA)
La síntesis de AIA de los aislamientos de Azotobacter varió de 6.34 a 158.27 µg mL-1. Los valores tuvieron gran variabilidad, pero muestran la capacidad productora de compuestos indólicos por este género bacteriano. El valor máximo fue obtenido por el aislamiento Azotobacter RzA044 (158.27 µg mL-1), el cual sólo presentó similitud con la cepa Azotobacter RzA042 (145.30 µg mL-1) y fue cercano al valor máximo registrado por Sahoo et al. (2013) con una producción cercana a 180 µg mL-1 de una cepa de A. vinelandii aislada de un suelo arrocero de la India. Los demás aislamientos fueron similares entre sí, conformando grupos donde destacaron los aislamientos Azotobacter RzA040 y Azotobacter RzA041. Hussein y Joo (2015) también registraron en cepas de Azotobacter aisladas de Panax ginseng una producción de 32.29 y 46.68 µg mL-1, los cuales son cercanos a los obtenidos por los aislamientos Azobacter RzA038 y RzA045. Barua et al. (2012) reportan una producción de 23.16 µg mL-1 de compuestos indólicos de una cepa de Azotobacter vinelandii aislada de suelos forestales de la India, lo cual es similar a los obtenidos por las cepas Azobacter RzA043 y RzA046.
La variabilidad de producción de AIA entre bacterias del mismo género también es reportada en otras investigaciones. Escobar et al. (2011) registraron un rango de producción de ácido indolacético de 11.99 a 57.99 µg mL-1 por cepas de Azotobacter aisladas de raíces y suelo rizosférico de hortalizas.
La síntesis de AIA de los aislamientos de Pseudomonas osciló de 7.62 a 25.6 µg mL-1, y las cepas RzA014, RzA027 y RzA035 sobresalieron, pero varios aislamientos no fueron diferentes (p>0.05). Estos valores son cercanos a los reportados por Malik y Sindhu (2011) con un rango de producción de ácido indolacético de 10.2 y 31.2 µg mL-1 en especies de Pseudomonas fluorescentes aisladas de cultivos de garbanzo. Lavakush et al. (2014) reportan 10 a 18 µg mL-1 de AIA por cepas de Pseudomonas putida y Pseudomonas fluorescens aisladas de suelos arroceros. En otras investigaciones la producción de AIA es superior a la obtenida en nuestro estudio (37 µg AIA mL-1) de un aislamiento de P. mandelii obtenido de suelo cultivado con arroz (Habibi et al., 2014), y 35.9 a 47.54 µg AIA mL-1 de Pseudomonas fluorescentes aisladas de Panax ginseng (Hussein y Joo, 2015).
Los amplios rangos de producción de compuestos indólicos reportados muestran la importancia de cuantificar esta actividad PGPR en los aislamientos obtenido, porque su capacidad de síntesis puede variar debido a su diversidad genética y a las condiciones ambientales que encuentran para llevarla a cabo (Karagöz et al., 2012).
Solubilización de fosfatos
Los aislamientos que registraron mayores valores de P disponible en el caldo de cultivo SRS, fueron los del género Pseudomonas con valores entre 5.97 y 46.43 µg mL-1 de P disponible, destacándose los aislamientos RzA028 (33.13 µg mL-1), RzA012 (33.46 µg mL-1) y RzA035 (46.43 µg mL-1), los cuales fueron similares estadísticamente (Cuadro 1). Los resultados registrados en todos los aislamiento de Pseudomonas fueron similares a los reportados en P. putida (40 µg mL-1 de P disponible) y P. pseudoalcaligens (45 µg mL-1 de P disponible) aisladas de suelos marginales de la India con escasa vegetación (Patel et al., 2012), así como por cepas de Pseudomonas sp. aisladas de cultivo de algodón con menos de 20 µg mL-1 de P disponible; por P. otitidis aisladas de planta de olivo (6.55 µg mL-1) y P. otitidis de planta de sésamo (7.63 µg mL-1) (Saber et al., 2015). Pero son valores inferiores con respecto a otras especies de Pseudomonas rizosféricas, como P. chlororaphis con 154.1 µg mL-1 (Yu et al., 2012) y P. putida con 140 y 150 µg mL-1 (Lavakush et al., 2014).
Los aislados del género Azotobacter presentaron una producción de P soluble entre 7.64 y 23.38 µg mL-1 en el medio de cultivo líquido. Los valores obtenidos por los aislamientos de Azotobacter fueron similares a los registrados en el medio cultivado con 13 de los 32 aislamientos de las rizobacterias del género Pseudomonas fluorescentes. También coincidieron con la disponibilidad de P en el medio de cultivo registrada por la actividad fosfatodisolvente de cepas de A. chrococcum (18.63 µg mL-1 P disponible) (Abd El-Fattah et al., 2013) y superiores a los reportados por Escobar et al. (2011) en cepas de Azotobacter aisladas de tomate (0.46-2.46 µg mL-1 de P disponible).
El género Pseudomonas se caracteriza por presentar alta capacidad fosfatosolubilizadora, aunque también hay valores significativos en esta actividad biofertilizante en aislamientos de Azotobacter (161.11 y 151.32 µg mL-1; Rojas-Tapias et al., 2012), y de A. chrococcum (41.3 y 93.72 µg mL-1; López-Ortega et al., 2013). Por lo anterior, estas rizobacterias son microorganismos muy importantes para la planta porque pueden aumentar directamente la disponibilidad de P por mecanismos de solubilización y mineralización y en suelos alcalinos, mediante la disminución del pH, ocasionada por la producción de ácido láctico, acético, oxálico, malónico, maléico, pirúvico, propiónico, glucónico, cítrico, succínico, tartárico, fumárico y trans-aconítico (Park et al., 2011; Marschner et al., 2011).
Fijación biológica de nitrógeno
Los aislamientos evaluados presentaron una variación en la cantidad de Ntotal de 0.46 a 11.79 µg mL-1 N-NH3. El aislado con el valor mayor de fijación biológica de N fue Azotobacter RzA042, pero los demás aislamientos de Azotobacter registraron valores superiores (9.54-11.79 µg mL-1 N-NH3) con respecto a Pseudomonas (0.46-9.28 µg mL-1 N-NH3). Abdel-Aziez et al. (2014) reportaron una fijación biológica de N de 11.11-200 µg mL-1 N-NH3 por bacterias del género Azotobacter. El género Pseudomonas es también fijador de N, en especial las especies P. putida PS9 (Ahemad y Khan, 2012), P. fluorescens y P. mendocina (Karagöz et al., 2012).
Azotobacter es el principal grupo de bacterias heterotróficas fijadoras de N de vida libre asociadas con las plantas, las especies de este género pueden fijar al menos 10 mg N g-1 de carbohidrato, y la actividad fijadora de N es mayor en cepas asociadas con arroz que con otros cultivos similares (Sahoo et al., 2013), por lo cual se infiere que este género tiene un gran potencial biofertilizante a cultivos de arroz. En nuestro estudio, aunque los valores de Ntotal variaron entre los aislados, todos presentaron actividad fijadora de N, la cual es una de las características principales de las rizobacterias promotoras de crecimiento vegetal.
Producción de sideróforos
No hubo diferencias significativas, aunque los aislamientos con mayor producción numérica de sideróforos fueron Pseudomonas sp. RzA034 y RzA035 desde 685.96 a 670.23 µg mL-1, y los aislados del género Azotobacter produjeron valores menores de 174.09 a 469.80 µg mL-1. Especies del género Pseudomonas producen sideróforos del tipo hidroxamato, como ferribactina, pseudobactina y otros de tipo catecol como la pioverdina, para secuestrar el Fe III de su entorno cuando está en condiciones deficientes y con esto limitan el crecimiento de fitopatógenos, actuando como un mecanismo de biocontrol (Aguado-Santacruz et al., 2012). Por esto es importante seleccionar los aislados con esta característica fisiológica para obtener un beneficio indirecto de la actividad de promoción de crecimiento vegetal por estas rizobacterias. Abdel-Aziez et al. (2014) reportan una producción de 11.3-59 µg mL-1 de sideróforos por cepa de Azotobacter. Aunque no es frecuente encontrar evaluaciones cuantitativas de la síntesis de sideróforos por este género, se ha reportado la producción de varios sideróforos tipo biscatecolato denominado azotoquelín, con una gran afinidad por el Mo, V, Cu, Zn (Bellenger et al., 2007), y triscatecolato protoquelín con afinidad por el Fe III, Mn II y Cu II (Harrington et al., 2012). Estos autores indican que los sideróforos mencionados están asociados a la captura de iones Mo y V requeridos por el complejo enzimático de la nitrogenasa en el proceso de fijación de nitrógeno atmosférico.
Selección de rizobacterias por sus actividades promotoras de crecimiento vegetal
Los 42 aislamientos obtenidos se clasificaron según sus actividades PGPR con la comparación de los nueve controles diseñados a partir de los valores obtenidos. El dendrograma construido por el agrupamiento según resultados de las medias, presentó la conformación de dos grupos (I y II) (Figura 1). En el grupo I se obtuvo un subgrupo IA conformado por dos subrugpos (IA1 y IA2). El IA1 incluyó dos grandes subgrupos, el IA1a y IA1b con 7 y 9 aislamientos, respectivamente. El IA1b incluyó los controles de solubilización de fosfatos (Ctrl SP), fijación biológica de N (Ctrl FBN) y el testigo negativo (Ctrl-), lo cual indica que los nueve aislamientos vinculados a este subgrupo registraron valores superiores solo en la actividad de FBN o solubilización de fosfatos, pero muy bajos en la actividades de producción de AIA y sideróforos, similar a Ctrl-.
En el subgrupo IA2 sólo se vinculó el testigo de producción de AIA (Ctrl AIA) porque ningún aislamiento presentó solo un valor superior en la actividad de síntesis de producción de AIA. En el subgrupo IB se conformaron tres subgrupos (IB1, IB2 y IB3). En el subgrupo IB1 se conformaron los subgrupos IB1a, IB1b y IB1c, en los dos primeros se incluyeron nueve aislamientos y en el último se vinculó solo el control medio 2 (CtrlMedio2) que se diseñó con los valores ubicados con un 60 % aproximado de los mayores valores en P disponible (27.86 mg L-1), Ntotal (7.07 µg mL-1 N-NH3), ácido indolacético (94.96 mg L-1) y sideróforos (402.14 mg L-1). En el subgrupo IB2 se asoció el aislamiento RzA040 del género Azotobacter, el cual registró un valor cercano al Control Medio 2 (CtrlMedio2), por lo cual se seleccionó como promisorio en la promoción del crecimiento vegetal. El subgrupo IB3 vinculó 10 aislamientos y el Control Medio 1 que se diseñó con 50 %, aproximado, de los mayores valores en P disponible (18.57 mg L-1), Ntotal (4.72 µg mL-1 N-NH3), ácido indolacético (63.31 mg L-1) y sideróforos (670.23 mg L-1). De este subgrupo se seleccionó el aislamiento RzA027 de Pseudomonas sp. fluorescentes por presentar valores similares al Control Medio 1.

Figura 1 Dendrograma de similitudes en las actividades promotoras de crecimiento vegetal por los aislamientos de Azotobacter y Pseudomonas.
El grupo II se conformó por dos subgrupos (IIA y IIB). En el subgrupo IIA se clasificó el aislamiento RzA042 de Azotobacter y el Control Medio 3 (CtrlMedio3) que se diseñó con 80 %, aproximado, de los mayores valores en P disponible (37.14 mg L-1), Ntotal (9.43 µg mL-1 N-NH3), ácido indolacético (126.62 mg L-1) y sideróforos (536.18 mg L-1). De este subgrupo se seleccionó el aislamiento RzA042 de Azotobacter por presentar valores similares al Control Medio 3.
En el subgrupo IIB se conformaron los subgrupos IIB1 y IIB2. En el IIB1a se asociaron los aislamiento RzA034 y RzA035 de Pseudomonas así como, el control de producción de sideróforos (Ctrl Sider) donde se encuentra el mayor contenido de sideróforos (685.96 mg L-1). De este grupo se seleccionó el aislamiento Pseudomonas RzA035 por representar los mayores valores de producción de sideróforos y solubilizacion de fosfatos e intermedios en fijación biológica de N y síntesis de AIA. En el subgrupo IIB2 se vinculó solo el Control positivo (Ctrl+), lo cual indica que ningún aislamiento registró los valores mayores en las cuatros actividades promotoras de crecimiento vegetal evaluadas.
Los cuatro aislamientos seleccionados para la identificación molecular fueron las cepas Pseudomonas RzA027 y RzA035, Azotobacter RzA040 y RzA042, por presentar valores representativos en las cuatro características promotoras del crecimiento vegetal evaluadas, y se considera que son promisorias para continuar con el proceso del desarrollo de biofertilizantes para el cultivo de arroz en la región.
Identificación molecular de los aislamientos de Azotobacter y Pseudomonas seleccionados
Las cuatro cepas presentaron una banda de 1500 pb en la amplificación de gen 16S ADNr (Figura 2). El análisis de la similitud entre las secuencias de los nucleótidos obtenidos y los depositados en la base de datos del GenBank usando el análisis BLAST, mostró que los aislamientos pertenecen a la subclase Gamma Proteobacterias de la familia Pseudomonadaceae y están relacionados con los géneros Azotobacter y Pseudomonas (Cuadro 2).
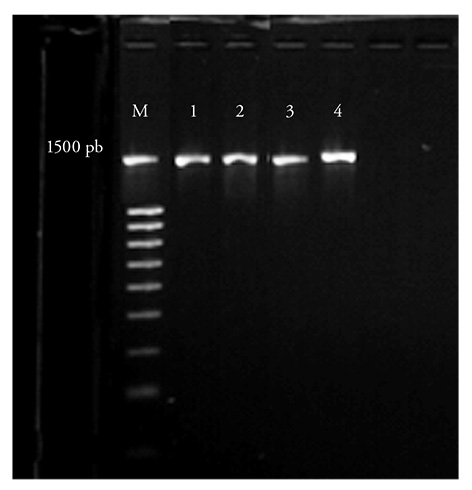
Figura 2 Amplificación del gen 16S ADNr. (M) 1500 pb DNA LADDER Biotium; (1) Pseudomonas RzA027; (2) Pseudomonas RzA035; (3) Azotobacter RzA040; (4) Azotobacter RzA042.
Conclusiones
En el distrito de riego del río Zulia de Norte de Santander se aislaron rizobacterias de los géneros Azotobacter y Pseudomonas con caracterísiticas promotoras del crecimiento vegetal que se pueden utilizar en el desarrollo de biofertilizantes para su aplicación en los cultivos de arroz regionales. Los cuatro aislamientos seleccionados por presentar valores en las características promotoras de crecimiento vegetal similares a los controles diseñados, deberán ser evaluadas en campos cultivados con arroz para determinar su efecto en el crecimiento de las plantas y en el rendimiento del cultivo.











 texto en
texto en 



