Introducción
La mancha angular de la hoja ocasionada por Xanthomonas fragariae (Kennedy y King, 1962) es una enfermedad del cultivo de la fresa (Fragaria×ananassa Duch) que reduce el rendimiento, principalmente cuando la bacteria infecta el cáliz (Wyenandt y Nitzsche, 2013), ocasiona su decoloración y la pérdida de su valor comercial (Roberts et al., 1997). La infección bacteriana es sistémica y está sujeta a cuarentena en diversos países porque pueden ser asintomáticas, lo cual favorece el movimiento de material vegetativo infectado a largas distancias (CABI/EPPO, 2015; Koike et al., 2005). En México, el cultivo de fresa tiene importancia socioeconómica y los principales estados productores son Michoacán, Baja California, Guanajuato y Jalisco (SIAP, 2014). Xanthomonas fragariae se reportó por primera vez en Michoacán en 2014 (Fernández-Pavía et al., 2014). Pero no hay estudios sobre la variabilidad genética entre cepas de este patógeno en las zonas productoras de fresa en México. El conocimiento de la variabilidad genética de la bacteria o de su epidemiología puede aportar herramientas importantes para generar estrategias eficientes de manejo de la enfermedad.
El análisis filogenético de los genes hrp y gyrB se utiliza para conocer la variabilidad genética en otras especies del género Xanthomonas (Yin et al., 2008; Young et al., 2008; Almeida et al., 2010), por lo cual el estudio de estos genes podría aportar información relevante sobre la variabilidad genética entre poblaciones de X. fragariae y su relación con la severidad de la enfermedad mancha angular de la hoja en diferentes genotipos de fresa. El conocimiento de la variabilidad genética es un elemento básico para determinar el impacto económico que pueden ocasionar diferentes poblaciones del patógeno en condiciones ambientales específicas del país y delimitar zonas de producción donde se detecten cepas con mayor severidad para evitar el cultivo de fresa; o bien, para establecer medidas de manejo o de movilización de material propagativo más estrictas.
Todas las variedades cultivadas de fresa son susceptibles a la infección por X. fragariae; sin embargo, algunas pueden mostrar menor grado de susceptibilidad, por lo que la búsqueda de estos materiales es importante para desarrollar programas de mejoramiento genético y enfocar el manejo de la enfermedad con estos materiales en zonas con elevada fuente de inóculo del patógeno. Por lo tanto, el objetivo de esta investigación fue conocer la variabilidad genética de 14 aislamientos de X. fragariae de regiones del centro de México y evaluar su severidad en dos variedades comerciales y cinco genotipos de fresa.
Materiales y Métodos
Material vegetal y aislamiento de la bacteria
El tejido foliar de fresa se recolectó en huertas comerciales de los estados de Michoacán (Tupátaro, Tangancícuaro, Jacona y Santiago de Tangamandapio), Jalisco (Ciudad Guzmán, Tapalpa) y Puebla (San Salvador del Seco) con lesiones acuosas delimitadas por las nervaduras, que son síntomas característicos de la mancha angular de la hoja. El fluido bacteriano se tomó en tejido enfermo y tejido sano adyacente y se sembró en cajas Petri con medio de cultivo Wilbrink (Koike, 1965, citado por Vandroemme et al., 2008). Las cajas se incubaron a 25±1 °C hasta observar crecimiento bacteriano con el cual se hicieron siembras en el mismo medio hasta obtener colonias puras, pequeñas, de color blanco sedoso, brillantes, mucoides y apariencia viscosa. Los aislamientos bacterianos puros se preservaron en tubos criogénicos con caldo nutritivo y glicerol al 40 % a -20 °C.
Pruebas de patogenicidad
Los aislamientos de X. fragariae se inocularon individualmente en dos plantas de fresa var. Monterrey de 4 semanas de edad establecidas en macetas con suelo estéril según el método propuesto por Maas et al. (2000). Las plantas inoculadas se mantuvieron en cámara de crecimiento a 25-27 °C con humedad relativa de 50 a 65 % y fotoperiodo de 16 h luz. Cada 24 h se observaron para registrar el período de incubación y a los 15 d después de la inoculación se midió el tamaño de la lesión en las hojas inoculadas.
Extracción de ADN bacteriano
El ADN bacteriano se extrajo desde colonias puras aisladas de nuevo desde las plantas inoculadas con 72 h de crecimiento en medio de cultivo Wilbrink, con el protocolo descrito por Minas et al. (2011). El ADN obtenido se suspendió de nuevo en agua destilada estéril y se conservó a -20 °C.
Análisis filogenético
Segmentos de los genes hrp y gyrB a partir del ADN se amplificaron mediante PCR con los iniciadores y las condiciones de PCR usadas por Roberts et al. (1996) y Young et al. (2008), que amplifican fragmentos de 537 pb y 865 pb, respectivamente. Los amplicones se purificaron y enviaron a secuenciar a Macrogen Inc. (Seúl, Corea). Las secuencias obtenidas se editaron con el programa BioEdit Sequence Alignment Editor, generándose las secuencias consenso que después se alinearon con el software CLUSTALW incluido en el programa Molecular Evolutionary Genetics Analysis (MEGA 6) (Tamura et al., 2011). Las secuencias se editaron, 414 pb y 529 pb para los genes hrp y gyrB se obtuvieron, y se concatenaron para tener un segmento con una longitud de 943 pb. Un árbol filogenético se construyó con el programa MEGA 6 por el método Neighbour-joining. Las distancias evolutivas se obtuvieron por el método de Tamura 3-parameter model usando bootstrap con 10 000 repeticiones. Las secuencias editadas se depositaron en la base de datos del GenBank®.
Escala diagramática de severidad
Se recolectaron 200 hojas trifoliadas de fresa con diferentes niveles de daño por mancha angular. Las hojas se escanearon con una resolución de 200 dpi en una multifuncional HP (Officejet Pro 276dW®, USA). Las imágenes obtenidas se analizaron con el software Assess 2.0 (The American Phytopathological Society, St Paul MN, USA) para determinar el porcentaje de área foliar dañada. Una escala diagramática de severidad de síntomas se desarrolló de acuerdo con la ley de agudeza visual de Weber-Fechner considerando los límites inferior y superior de severidad de la enfermedad detectada en campo. Seis niveles de severidad se establecieron con el programa 2LOG v.1.0 a partir del porcentaje de daño más alto, considerando el punto medio de cada nivel para ubicar imágenes representativas (Mora-Aguilera et al., 2000, citado por Saucedo-Carabez et al., 2014).
Evaluación de la severidad en genotipos de fresa
El aislamiento bacteriano 12XfMxJal se seleccionó porque mostró menor periodo de incubación en las pruebas de patogenicidad ya descritas, para evaluar la susceptibilidad de las variedades comerciales de fresa Fortuna y Festival, así como de los genotipos Frag53, Frag40, FragLa, FragMa y FragSp. Una suspensión bacteriana de 3×108 UFC mL-1 de agua estéril fue preparada y se usaron dos métodos de inoculación: 1) inyección: 10 plantas de cada variedad comercial y genotipo se inocularon según la metodología de Maas et al. (2000), y 2) aspersión: se asperjaron 10 plantas por material hasta punto de goteo siguiendo la metodología de Bestfleisch et al. (2015). El experimento se estableció en campo bajo túneles de plástico.
Las plantas con ambos métodos de inoculación se observaron cada 24 h durante 11 d para registrar el período de incubación y después cada 4 d durante cuatro semanas para evaluar la severidad mediante la escala desarrollada.
El diseño experimental fue de bloques completos al azar. Con los datos de severidad se realizó un ANDEVA y las medias se compararon con la prueba de Tukey (p≤0.05) usando SAS (SAS System for Windows v9.0). Con los datos de incidencia se obtuvo el área bajo la curva del progreso de la enfermedad para cada material evaluado (LANREF-Mora-Aguilera, COLPOS)3 .
Resultados y Discusión
Pruebas de patogenicidad
En los estados de Michoacán, Jalisco y Puebla se obtuvieron 14 aislamientos de X. fragariae (Cuadro 1), desde hojas con síntomas de mancha angular. Todos los aislamientos fueron patogénicos en plantas de fresa (var. Monterrey) y causaron manchas acuosas en el sitio de inoculación (Figura 1), que son síntomas típicos de la infección natural por la bacteria. El período de incubación osciló entre 3 y 5 d, y el período menor de incubación fue con los aislamientos 2XfMxMich y 12XfMxJal (Cuadro 1).
Cuadro 1 Origen e identificación de los aislamientos de Xanthomonas fragariae, período de incubación y tamaño de lesión registrada en plantas de fresa var. Monterrey.

†Michoacán, ¶Jalisco, §Puebla.
Análisis filogenético
El análisis de las secuencias de los segmentos de los genes hrp y gyrB agrupó en una sola rama a los 14 aislamientos de nuestro estudio con uno de Australia (GenBank Accession HQ223085) (Figura 2), lo cual indica que son muy similares entre sí. Los aislamientos de X. fragariae infectaron a las plantas de fresa var. Monterrey con un período de incubación de 5 d, pero en los aislamientos 2XfMxMich y 12XfMxMich fue de 3 d. Estas diferencias muestran variabilidad genética inherente de esta especie bacteriana. Aunque hubo diferencias biológicas, no se identificaron genéticamente con las regiones de los genes estudiados. Stöger et al. (2008) estudiaron la variabilidad genética de aislamientos de X. fragariae mediante Repetitive Sequence-based PCR (rep-PCR), Enterobacterial Repetitive Intergenic Consensus (ERIC) y Amplified Fragment Length Polymorphism (AFLP) sin encontrar diferencias entre ellos. Pero estudios donde se analizaron los genes hrp y gyrB para especies de bacterias fitopatógenas, incluyendo otras especies del género Xanthomonas, fueron consistentes y mostraron variabilidad genética entre ellas (Yin et al., 2008; Young et al., 2008; Almeida et al., 2010). En nuestra investigación, los resultados del análisis de las secuencias parciales de los genes hrp y gyrB de los 14 aislamientos de X. fragariae, no mostraron variabilidad a pesar de las diversas condiciones ambientales, variedades, manejo del cultivo y otros factores, donde se recolectaron las muestras. Lo anterior puede indicar diversidad genética baja, probablemente por un origen común de los aislamientos introducidos a México, o porque hay un número reducido de secuencias de los genes hrp y gyrB en la base de datos del GenBank de esta especie y que permitan detectar diferencias en estas regiones del genoma. Ahora se realiza la secuenciación del genoma completo de estos aislamientos para obtener mayor claridad acerca de la interacción genotipo/severidad de los síntomas inducidos, así como posibles estudios filo-geográficos de los mismos.
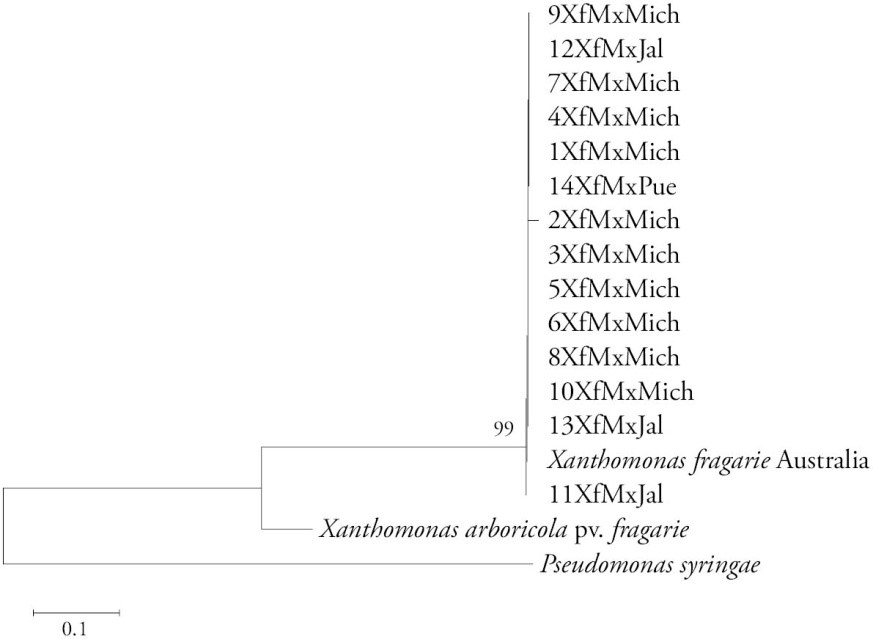
Figura 2 Árbol generado con el método Neighbour-joining. Las distancias evolutivas se obtuvieron por el método de Tamura 3-parameter model usando bootstrap con 10 000 repeticiones a partir de secuencias de nucleótidos concatenados con regiones parciales de los genes hrp y gyrB de 14 aislamientos de Xanthomonas fragariae. La barra indica el número de sustituciones por sitio. Sólo se muestran valores de boostrap mayores a 80%.
Escala diagramática
La escala diagramática diseñada tuvo seis niveles de severidad en los que se indica el rango de área foliar afectada. Esta escala se integró con una imagen que muestra el porcentaje de daño calculado con el software y que es representativa de cada nivel con el propósito de facilitar la evaluación del daño en campo (Figura 3).

Figura 3 Escala diagramática diseñada para evaluar la severidad de Xanthomonas fragariae en genotipos de fresa.
El uso de este tipo de escala reduce la subjetividad en las estimaciones de la gravedad de una enfermedad y es un elemento indispensable en estudios epidemiológicos (Menge et al., 2013). Bestfleisch et al. (2015) propusieron una escala de severidad para X. fragariae de nueve niveles no usada con frecuencia debido quizá al número de niveles y porque el daño se ilustra con dibujos en blanco y negro. Para otras enfermedades hay escalas de severidad con cinco o seis niveles, las cuales tienen valores aceptables de precisión y exactitud en la validación (Menge et al., 2013; Freitas et al., 2014). La escala propuesta en nuestra investigación muestra una secuencia progresiva del avance del área foliar afectada, con imágenes que proporcionan de manera clara el nivel de daño ocasionada por esta bacteria en las localidades estudiadas. (La versión impresa muestra las figuras en escala de grises y la versión electrónica a color).
Evaluación de severidad
Durante el período de evaluación (septiembre-octubre de 2015) se registraron temperaturas diurnas de 16-28 °C y nocturnas de 18-28 °C, con humedad relativa de 44-99 %. Los siete genotipos evaluados de fresa resultaron susceptibles a X. fragariae al ser inoculados por inyección o aspersión.
Inoculación por inyección
Con este método se observaron lesiones acuosas y necróticas que formaron una mancha angular delimitada por las nervaduras. El 100 % de plantas mostraron síntomas a los 11 d después de la inoculación en todos los genotipos y hubo variación entre los periodos de incubación de 4, 6, 9 y 11 d. El área bajo la curva del progreso de la enfermedad fue variable entre los diferentes genotipos, y el genotipo FragLa tuvo el menor valor (31.82) de severidad (Figura 4).
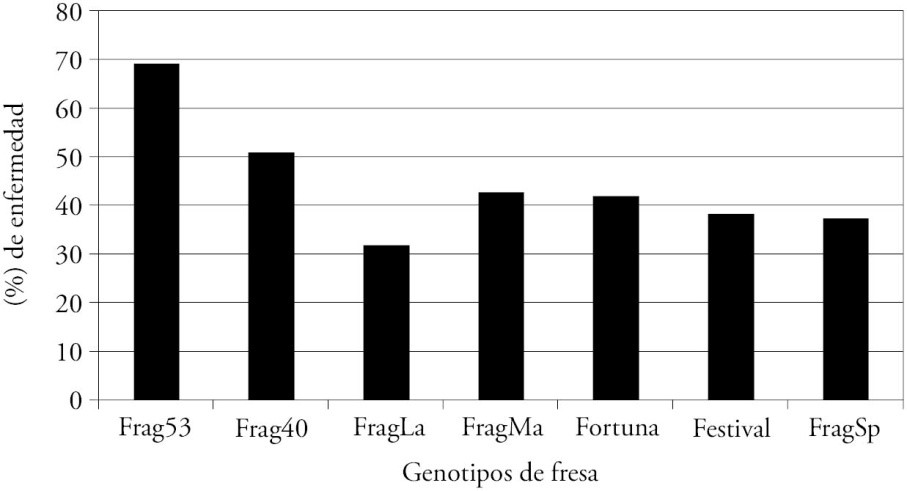
Figura 4 Área bajo la curva del progreso de la enfermedad en siete genotipos de fresa inoculados por inyección con Xanthomonas fragariae.
En todos los casos, las lesiones aumentaron progresivamente de tamaño durante el experimento. A los 34 d después de la inoculación (ddi) el genotipo Frag53 tuvo el mayor valor seguido de la variedad Festival; los otros genotipos fueron estadísticamente similares (p>0.05; Cuadro 2). A los 18 ddi los genotipos Frag53 y Fortuna fueron similares (p>0.05) y desde los 22 ddi se comportaron de manera diferente (p≤0.05) hasta finalizar la evaluación.
Cuadro 2 Tamaño de lesiones (cm) ocasionadas por Xanthomonas fragariae en hojas de siete genotipos de fresa inoculadas por inyección.
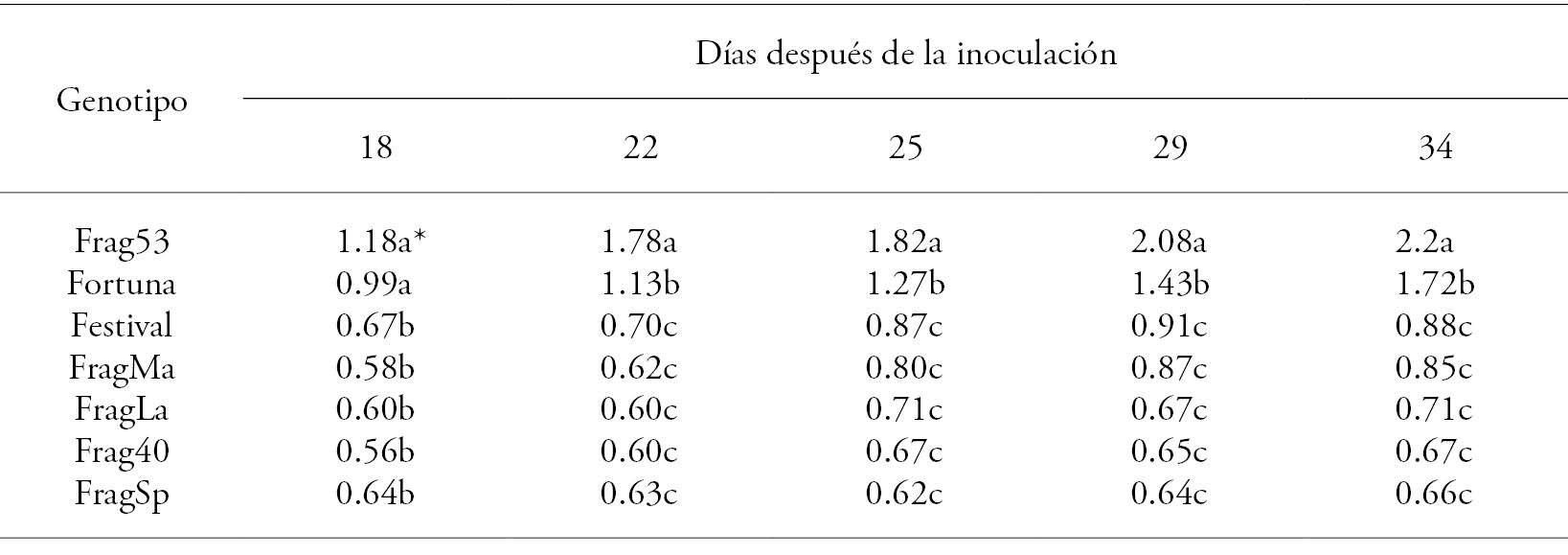
*Tratamientos con letra diferente son estadísticamente significativos (Tukey, p≤0.05).
Las lesiones foliares en las plantas inoculadas fueron de dos tipos: 1) manchas necróticas irregulares rodeadas por un halo amarillo que generalmente llegaba a cubrir la totalidad de la lámina foliar (Figura 5A), y 2) lesiones necróticas bordeadas por tejido acuoso (Figura 5B). Solo en el genotipo FragLa el 65 % de los sitios de inoculación mostró un tercer tipo de lesión de manchas necróticas (Figura 5C) y limitadas al área de inoculación, similar a las producidas en una reacción de hipersensibilidad (RH). La RH es considerada la máxima expresión de resistencia de las plantas al ataque por patógenos y se define como una muerte rápida de las células vegetales asociada con la restricción del crecimiento del patógeno, que se reconoce por la presencia de una o varias células muertas con coloración café en el sitio de infección (Greenberg y Yao, 2004; Sanzón y Zavaleta-Mejía, 2011). Además, las plantas en las que se produce una RH poseen cierto grado de resistencia al patógeno que la indujo (Vlot et al., 2008). Diferentes especies de bacterias fitopatógenas como Pseudomonas syringae, Erwinia amylovora y Ralstonia solanacearum, entre otras, poseen elicitores que disparan la RH (Grant y Mansfield, 1999). Según, Bestfleisch et al. (2015), las plantas de fresa son más susceptibles a X. fragariae en etapas tempranas de desarrollo y, al madurar, presentan cierta resistencia que puede ser más evidente con el tiempo.

Figura 5 Síntomas producidos en siete genotipos de fresa inoculados por inyección con X. fragariae. A) Manchas necróticas irregulares rodeadas por un halo amarillo que generalmente cubren la lámina foliar, B) Mancha necrótica con tejido acuoso en la zona de avance de la lesión, C) Lesiones necróticas que no aumentaron de tamaño, D) Plantas testigo inoculadas con agua destilada esterilizada, sin daño aparente.
Inoculación por aspersión
Con este método se observó consistentemente un mismo tipo de síntoma de manchas angulares acuosas (Figura 6A) que coalescieron con el tiempo formando áreas necróticas de mayor tamaño bordeadas por tejido con coloración amarillo (Figura 6B). Este tipo de lesiones fueron diferentes de las observadas en las plantas inoculadas por inyección. Los primeros síntomas se observaron a los 7 ddi. El análisis estadístico no mostró diferencias significativas (p>0.05) en severidad entre los materiales de fresa inoculados por aspersión con X. fragariae.

Figura 6 Síntomas observados en siete genotipos de fresa inoculados por aspersión con X. fragariae. A) Manchas angulares inicialmente acuosas que necrosaron con el tiempo, B) Lesiones necróticas con halo amarillo con cierta zona de avance de la lesión.
Los dos métodos de inoculación en nuestra investigación fueron eficientes para infectar los genotipos de fresa. No obstante, con la inoculación por aspersión se observaron síntomas similares a los que ocurren en el ambiente natural.
En experimentos se ha obtenido cierto control de la bacteria con tratamientos térmicos, esterilización de superficie por inmersión de plántulas en cloro+radiación ultravioleta (UV-C) y remoción de hojas y peciolos en plantas de vivero (Turechek y Peres, 2009; Turechek et al., 2013). El mejoramiento genético como un método más de manejo de esta enfermedad podría ser una herramienta valiosa que requiere la evaluación y selección constante de genotipos con características agronómicas deseables, así como la valoración de la resistencia o tolerancia a la bacteria. Por tanto, es necesario continuar las evaluaciones de los materiales de fresa para seleccionar genotipos mejor adaptados a este patosistema con X. fragariae, que proporcionarán alternativas que contribuyan a un manejo eficiente de la enfermedad. En México es incipiente el desarrollo de técnicas de selección de materiales de fresa resistentes o con cierto grado de tolerancia a la mancha angular de la hoja debido a su reciente introducción en el país.
En nuestro estudio se evaluaron dos formas de inoculación de X. fragariae que en otros trabajos se reportan de manera separada. Si bien en ambos casos hubo infección, el período de incubación con la inoculación por inyección fue menor por lo que puede ser más conveniente utilizar este método de inoculación en programas de selección al reducir el tiempo de evaluación de los materiales genéticos.
Conclusiones
La secuenciación parcial de los genes hrp y gyrB mostró una alta similitud genética entre 14 aislamientos de Xanthomonas fragariae de diferentes localidades del Centro de México.
Todos los genotipos de fresa evaluados resultaron susceptibles a Xanthomonas fragariae. Pero FragMa y FragLa mostraron los valores menores de severidad de síntomas, y pueden constituir fuentes de genes con potencial para usarse en programas de mejoramiento genético para el cultivo de fresa en México.
El genotipo FragLa mostró evidencias de reacción de hipersensibilidad en el 65 % de los sitios de inoculación, por lo que será estudiado con mayor profundidad para encontrar genes involucrados en esta reacción.











 texto en
texto en 



