Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.51 n.2 Texcoco Feb./Mar. 2017
Fitociencia
Identificación de variables correlacionadas con el daño por frío en Pitahaya (Hylocereus undatus Haworth)
2Fitotecnia. Universidad Autónoma Chapingo. 56230. Chapingo, Estado de México.
La pitahaya (Hylocereus undatus) es altamente perecedera y susceptible a daños por frío (DF). El objetivo del presente trabajo fue medir un conjunto de variables bioquímicas, fisiológicas, físico-químicas y físicas en frutos de pitahaya gradualmente dañadas por frío y medir el grado de correlación que tiene cada una con este tipo de daño. Las pitahayas se almacenaron hasta 30 d a 2 ó 7±1 °C HR de 90±6 %), y después se mantuvieron hasta 7 d a 22±4 °C y HR 60±8 %. La evaluación visual de DF se realizó mediante una escala hedónica de cinco puntos después del almacenamiento refrigerado y la transferencia de los frutos a 22±4 °C. En muestras de los frutos se determinó acidez titulable (AT), sólidos solubles totales (SST), relación SST/AT, actividad de superóxido dismutasa (SOD), glutatión reductasa (GR), piruvato descarboxilasa (PDC), alcohol deshidrogenasa (ADH), pérdida de peso, contenido de liberación, fuga de electrolitos (LE), translucidez, ángulo de tono, índice de saturación de color y firmeza. De estas variables AT, SOD, contenido de etanol, FE y translucidez tuvieron correlación positiva con el DF (rs=0.61, 0.65, 0.53, 0.83 y 0.68).
Palabras clave: Estrés; pitahaya; postcosecha; almacenamiento refrigerado; daños por frío
The pitahaya (Hylocereus undatus) is highly perishable and susceptible to chilling injury (CI) The objective of this study was to measure a set of biochemical, physiological, physical-chemical and physical variables in gradually chilling injured pitahaya fruits and assess the degree of correlation of each one with this damage. Pitahayas were stored at 2 or 7±1 °C and 90±6 % RH for up to 30 d, and then held at 22±4 °C and 60±8 % RH for up to 7 d. A visual evaluation of CI was conducted using a five point hedonic scale after storage and transfered to 22 °C. Titratable acidity (TA), total soluble solids, TSS/TA ratio, superoxide dismutase activity (SOD), glutathione activity (GR), piruvate decarboxylase (PDC), alcohol deshydrogenase activity (ADH), weight loss, ethanol content, electrolyte leakage (EL), translucency, hue, chroma, and firmness were analysed in fruit samples. Of which, TA, SOD, ethanol content, EL, and translucency were positively correlated with CI (rs=0.61, 0.65, 0.53, 0.83, and 0.68).
Key words: Stress; pitahaya; postharvest; refrigerated storage; chilling injury
Introducción
La pitahaya (Hylocereus undatus) es un fruto globoso, con forma elipsoidal a ovalada, 10 a 12 cm de diámetro, pulpa blanca y numerosas semillas pequeñas, masticables, color negro y dispersas en la pulpa; la cáscara varía del rojo a rojo purpura y está cubierta por brácteas salientes de forma triangular, dispuestas más o menos helicoidalmente. La pulpa es dulce, a veces un poco ácida, de aroma suave y fragancia delicada. Por su atractiva apariencia externa se considera uno de los frutos más bellos del mundo (Centurión et al., 1999). Este producto tiene gran importancia económica y sus precios en el mercado internacional llegan a 5 USD kg-1 (Viet and Thanh, 2014; Osuna-Enciso et al., 2016), pero es altamente perecedero. Según Osuna et al. (2011) la vida de anaquel de la pitahaya es de 6 a 10 d si se almacena entre 20 y 26 °C y hasta 20 d a 5 °C (Freitas and Mitcham, 2013), por lo que es necesario evaluar prácticas para optimizar su calidad poscosecha (Nerd et al., 1999).
El almacenamiento en frío es el principal método para frenar el deterioro de los productos y mantener el valor nutricional (Cantín et al., 2010). Sin embargo, el almacenamiento refrigerado de especies vegetales de origen tropical o subtropical causan alteraciones fisiológicas conocidas como daños por frío (DF), que afectan negativamente la calidad de estos frutos, e impide su comercialización, debido al deterioro de tejidos (Soleimani and Bodbodak, 2014; Wismer, 2003). Según Morris (1982) entre los síntomas de DF está la alteración de la actividad metabólica, que aumenta los intermediarios respiratorios anaeróbicos y otras alteraciones que causan la aparición de sabores desagradables. Kader (2002) menciona que los signos comunes de DF incluyen cambios de color interno y externo (decoloración, oscurecimiento), hundimientos en la cáscara, áreas acuosas, maduración heterogénea o incapacidad para adquirirla, desarrollo de sabores extraños y condiciones que favorecen la incidencia acelerada de hongos organismos que causan y pudriciones. Este desorden se estudió en especial en productos con importancia económica, como cítricos, aguacate y mango (Ramaswamy, 2015). Sin embargo, la investigación de este desorden fisiológico en otros frutos menos importantes es menor. En la pitahaya, los estudios reportan mediciones de DF a partir de variables subjetivas (cuya distribución es discreta) que usan escalas hedónicas y pruebas de estadística no paramétrica. Hay ciertas técnicas aplicadas en varios frutos con algún éxito para reducir o mitigar DF, como el calentamiento intermitente (Wang, 2010; Soleimani and Bodbodak, 2014) o la atmósfera modificada o controlada (Thompson, 2010; Wang, 2010; Bill et al., 2014). En nuestro estudio se identificaron variables que reflejan de manera muy precisa y confiable el grado del daño. El criterio de selección para conformar el conjunto de variables fue escoger aquellas relacionadas al DF en otros estudios (Mittler, 2002; Corrales-García y Canché-Canché, 2008; Balois-Morales et al., 2013). Otras variables se escogieron porque pueden explicar este desorden debido a su propia naturaleza. Si dentro del conjunto de todas las variables propuestas alguna de ellas se correlaciona significativamente con el DF, entonces, al aumentar la severidad del daño habrá un cambio proporcionalmente mayor en tal variable.
Materiales y Métodos
Cosecha y almacenamiento de frutos
Frutos de pitahaya en madurez comercial se cosecharon en Santa Clara Huiziltepec, Puebla (México). Los frutos se transportaron al laboratorio a temperatura ambiente (22±4 °C), donde se desinfectaron con agua corriente (pH: 7.72) ozonificada 6 min (690 mL ozono min-1), con un burbujeador de ozono (FAGON®, modelo biozo3n 2000). Los frutos a refrigerar se colocaron en cajas de plástico con polipropileno expandido (desinfectado) con perforaciones y se almacenaron 24 h a 10±2 °C (90±6 % HR), para eliminar el calor de campo. Después los frutos se almacenaron a 2 o 7±1 °C (90±6 % HR) por 15 o 30 d. Después de la frigoconservación, los frutos se transfirieron a temperatura ambiente (22±4 °C y 60±8 % HR) por 8 o 3 d para los frutos refrigerados durante 15 ó 30 d, respectivamente. Los frutos no refrigerados (testigo) se evaluaron al inicio y al final de su almacenamiento por 15 d a temperatura ambiente (22±4 °C). Entonces se evaluaron ocho tratamientos y dos testigos, cada uno tuvo cuatro repeticiones y la unidad experimental fue un fruto.
Daño por frío (DF) como variable de referencia
Esta evaluación consistió en la inspección visual de los síntomas de DF, en los frutos refrigerados y en los no refrigerados. El DF se evaluó con una escala hedónica de cinco puntos, donde 0 = fruto sin daño (0 % daño), 1 = presencia de hundimientos muy pequeños y dispersos en menos del 25 % de la superficie del fruto, 2 = presencia de hundimientos evidentes en más del 50 % del fruto, 3= presencia de hundimientos unidos entre ellos, formando áreas de tamaño considerable, de color beige y en más del 75 % de la superficie del fruto y, 4 = presencia de hundimientos de grandes áreas de color marrón en más del 75 % de la superficie del fruto. Los frutos con registro de 2 serían considerados no comercializables.
Variables
Variables bioquímicas
El contenido de sólidos solubles totales se determinó en el jugo del fruto, con un refractómetro electrónico (ATAGO®, pocket), con una escala de 0 a 32 %, a 20 °C. Los resultados se reportaron como % de SST. La AT se cuantificó en 10 g de pulpa macerada en 50 mL de agua destilada y titulada con 0.01 N de NaOH, los resultados fueron reportados como g de ácido málico 100 g-1 de tejido. La relación SST/AT se calculó. La actividad de la enzima SOD se determinó de acuerdo con el método aplicado por Balois-Morales et al. (2008), la actividad de la glutation reductasa (GR) con el método propuesto por Hodges et al, 1997 y la actividad de la enzima piruvato descarboxilasa (PDC) y alcohol deshidrogenasa (ADH) se determinó con el método empleado por Botondi et al. (2012). SOD se extrajo a partir de 0.5 g de pulpa congelada y homogenizada (IKA LABORTECHNIK, T-25, EUA), con 5 mL de solución extractora (amortiguadora de fosfatos 1 M pH 7.8), la mezcla se centrifugó con una centrífuga marca Sorvall (RC-5B) durante 30 min a 22617 G a 4 °C. La absorbancia del sobrenadante se determinó a 560 nm en un espectrofotómetro digital (Thermo Fisher Scientific, Genesys 10-S, USA). A 3 mL de solución amortiguadora de fosfatos (J.T. Baker, México) 0.1 M pH 7.8 [con EDTA 0.01 mM, 3.66 mL de L-metionina, 2.44 mL de NBT y 1.83 mL de Triton X-100 (Sigma®)] en un volumen final de 66 mL) se adicionó 0.5 mL del sobrenadante y 0.03 mL de riboflavina (Sigma), esta mezcla de reacción se iluminó 7 min a 21±2 °C con una lámpara con luz fluorescente de 20 watts Grolux y se determinó la absorbancia. La actividad enzimática se calculó en unidades internacionales por gramo de peso fresco (U g-1). Cada unidad de SOD es igual a la cantidad del sobrenadante que fotoinhibe la formación de 50 % de formazán a partir de azul de nitro tetrazolium. Para la actividad de la GR se extrajeron 0.2 g de pulpa congelada con 5 mL de solución extractora [solución amortiguadora de fosfato, 1M pH 7.8 con polivinilpirrolidona al 1 % (Sigma)]. La mezcla se centrifugó 30 min a 22617 G a 4 °C. Para determinar la actividad de la GR, 0.2 g de pulpa congelada fueron homogenizados con 5 mL de solución extractora [solución amortiguadora de fosfato 1M pH 7.8, con 1 % polivinilpirrolidona al 1 % (Sigma®)]. La mezcla fue centrifugada a 4 °C por 30 min a 22 617 g. Para determinar la actividad, 0.730 mL de solución amortiguadora de fosfato (100 mM pH 7.8), 0.1 mL de glutatión oxidado 100 mM, 0.1 mL de EDTA 15 mM, 0.02 mL 10 mM NADPH (Sigma) y 0.05 mL del sobrenadante del extracto enzimático se colocaron en una celda de cuarzo de 1 mL. La absorbancia se midió a 340 nm y la actividad de GR se reportó como mM de NADPH oxidado g-1 de tejido. Para el análisis de la actividad de la PDC, la oxidación del NADH fue evaluada como el decremento de la absorbancia a 340 nm con un espectrofotómetro. La reacción opuesta (reducción) se midió para la ADH. Para obtener el extracto enzimático se homogeneizaron 5 g de pulpa con 10 mL de KH2PO4 (amortiguador) pH 7.5 con la adición de 2 mM de tiamina pirofosfato (TPP), 2 mM de MgCl2 (J.T. Baker) y 1 mM de 2-mercaptoetanol; el homogeneizado se centrifugó a 22617 G durante 20 min a 4 °C y el sobrenadante se usó como extracto enzimático para medir las actividades de PDC y ADH. La PDC fue medida por acoplamiento de la descarboxilación del piruvato con la oxidación de NADH por la ADH. La prueba se realizó con 0.4 mL de la mezcla pH 7.5 100 mM, 0.1 mL de TPP 10 mM, 0.1 mL de MgCl2 10 mM, 0.1 mL de NADH 2.6 mM, 0.1 mL de ADH (con 2 U mL-1), 0.1 mL del extracto enzimático y la subsecuente adición de 0.1 mL de piruvato de sodio (J.T. Baker) 200 mM. La actividad de ADH se evaluó por la reducción del NAD+ a 340 nm, con 0.680 mL de solución amortiguadora con KOH-glicina 100 mM (pH 9.0), 0.07 mL de NAD+ 11.4 mM, 0.150 mL de etanol 2 M (Sigma) y 0.1 mL del extracto enzimático. Las actividades enzimáticas se reportaron como µM de PDC o ADH mg-1 proteína, se determinaron por el método de Bradford (Bradford, 1976), usando albúmina de bovino (Sigma) para la curva estándar; 100 µL de extracto en 5 mL de solución de Bradford [100 mg de coomassie (Sigma), 50 mL 95 % etanol (J.T. Baker), y 100 mL de ácido fosfórico (J.T. Baker), esta solución se diluyó a un volumen final de 1 L de agua destilada], y después de 12 min estas soluciones se midieron en un espectrofotómetro a 595 nm.
Variables fisiológicas
La pérdida de peso (la pérdida acumulada) por fruto se determinó (cuatro frutos por tratamiento) con los pesos inicial y final, en una balanza electrónica con una precisión de 0.1 g. El etanol se midió mediante cromatografía de gases en muestras del espacio de cabeza, como lo describe Davis y Chase, 1969. La muestra de pulpa (5 g) se puso en un vial de vidrio de 25 mL, se selló de inmediató, se congeló con N2 líquido, y se mantuvo congelado a -20 °C hasta su análisis. Para la cuantificación, las muestras congeladas se incubaron 10 min en baño maría a 60 °C, se homogeneizaron por 1 min (dentro del tubo sellado) y se tomó una muestra gaseosa del espacio de cabeza de cada vial con una jeringa (1 mL) y se inyectó a un cromatógrafo de gases Varian Star 3400® (USA), columna SS empacada Poropak N, 2 m x 3 mm de diámetro externo y 2 mm de diámetro interno, equipado con un detector TCD (detector de conductividad térmica) y FID (detector de ionización de flama). Las temperaturas del cromatógrafo fueron 160, 170, 170 y 170 °C en columna, inyector, auxiliar y detector, respectivamente; el gas de arrastre fue He. Una curva de calibración se preparó con estándares comerciales (J. T. Baker) y los resultados se reportaron en mg·100 g-1.
Variable fisicoquímica
Liberación de electrolitos (LE). Esta variable se midió con el método de Pérez et al. (2004) con modificaciones. Cuatro porciones circulares o rodajas se obtuvieron de cáscara de 2 cm de diámetro y aproximadamente 1 mm de grosor con un sacabocados de cobre y una navaja de acero inoxidable, se mantuvieron en 30 mL de agua destilada por 24 h en un tubo de ensayo de 80 mL, y la conductividad eléctrica (CE, µS) se midió con un conductivímetro (OAKTON, CON 400 series, Singapur). Los tubos se colocaron en baño maría a 80 °C por 30 min, se enfriaron hasta 21 °C y la CE se midió de nuevo. Los datos de CE se usaron para calcular la FE con la siguiente ecuación:
donde CE1: conductividad inicial y CE2: conductividad total.
La FE se reportó como % y refleja el daño en membrana (Sharom et al., 1994).
Variables físicas
La translucidez es un cambio del color blanco característico de la pulpa de la pitahaya a una apariencia acuosa o traslúcida en la pulpa al cortar el fruto transversalmente por la parte ecuatorial. La translucidez se expresó como porcentaje de pulpa que tuvo apariencia translúcida. El matiz (hue) e intensidad (chroma) se evaluaron en el exocorpo, de acuerdo con la metodología de McGuire (1992) usando un colorímetro (Hunter Lab, modelo MiniScanTM XE Plus No. 45/O-L, EUA, serie 5348). Las ecuaciones usadas para calcular hue y chroma fueron las siguientes:
La firmeza del exocarpo se determinó en un texturómetro (Stable Micro Systems, TA-XT2I, Reino Unido) con una celda de carga de 5 kg, y una medición de punción se aplicó a 20 °C (con una sonda de aguja Batch No. 3426 de 2 mm de diámetro) en la superficie del fruto (de la sección ecuatorial) a una tasa de 1 mm·s-1 y a una profundidad de 5 mm. Los resultados representan la fuerza (N) necesaria para penetrar el exocarpo.
Análisis estadístico
El diseño experimental fue completamente al azar, los resultados se analizaron con ANDEVA, las medias se compararon con la prueba de Tukey (p≤0.05) y una correlación de Spearman entre el DF y las variables bioquímicas, fisiológicas, fisicoquímicas y físicas, usando SAS 9.1 (SAS/STAT®2002) para Windows. Los tratamientos fueron: 1) frutos almacenados 15 d en refrigeración a 2±1 °C; 2) frutos almacenados 15 d en refrigeración at 2±1 °C y luego 7 d a 22±4 °C; 3) frutos almacenados 15 d en refrigeración a 7±1 °C; 4) frutos almacenados 15 d en refrigeración a 7±1 °C y luego 7 d a 22±4 °C; 5) frutos almacenados 30 d en refrigeración at 2±1 °C; 6) frutos almacenados 30 d en refrigeración a 2±1 °C y luego 3 d a 22±4 °C; 7) frutos almacenados 30 d en refrigeración a 7±1 °C; 8) frutos almacenados 30 d en refrigeración a 7±1 °C y luego 3 d a 22±4 °C; como testigos, 9) frutos recién cosechados, y 10) frutos almacenados 15 d at 22±4 °C.
Resultados y Discusión
Daños por frío
En ninguno de los frutos refrigerados se observaron síntomas de DF al término de (15 d) de almacenamiento, pero después de 7 d de permanecer a temperatura ambiente (22±4 °C) los frutos previamente almacenados a 2 °C presentaron un DF significativamente más severo que los almacenados a 7±1 °C (Figura 1). Al término del periodo largo de almacenamiento (30 d) los frutos a la temperatura mayor aún no mostraban síntomas visibles de DF, en cambio, los refrigerados a 2±1 °C mostraban el máximo DF; este daño no aumentó después de transferir a la temperatura ambiente. Los frutos previamente refrigerados a 7±1 °C tuvieron un aumento en la severidad de DF, pero el daño fue significativamente menor al observado en los frutos almacenados a 2 °C.
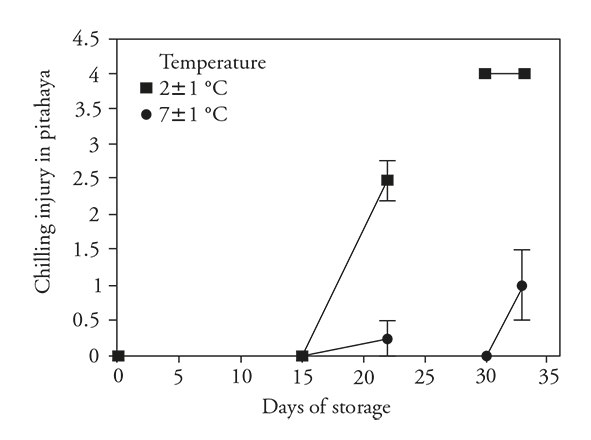
Figura 1 Daño por frío (± desviación estándar) en frutos de pitahaya (Hylocereus undatus H.) almacenados 15 d en refrigeración y después 7 d a temperatura ambiente, o 30 d en refrigeración y después 3 d a temperatura ambiente.
Mientras los frutos permanecieron refrigerados durante 15 d, el desarrollo de estos procesos de deterioro se evitaron. Sin embargo, después de transferencia 7 d a condiciones ambientales, estos procesos de deterioro y se manifestaron los síntomas de DF. Estos resultados son similares a los de García et al. (2005) y Balois-Morales et al. (2013), en los cuales los síntomas de DF no se expresan hasta después de transferir los frutos de pitahaya de la temperatura muy fría a una más calurosa (~20 °C).
Los procesos de deterioro también se detuvieron en los frutos 15 y 30 d a 7±1 °C, pero la severidad de los síntomas de DF después de transferirse a temperatura ambiente fue significativamente mayor para el periodo de refrigeración más largo. El aumento del periodo de almacenamiento a esta temperatura moderadamente baja, aumentó la severidad del DF. Los frutos almacenados a 2±1 °C por 30 d ya tenían síntomas severos de DF esta condición y, por lo tanto, no hubo más desarrollo de síntomas después de transferir la temperatura ambiente.
Estos resultados mostraron que a mayor estrés (menor temperatura o mayor exposición a temperatura baja), severidad mayor del DF. Rodriguez-Rodríguez et al. (2005) reportan aumentos de DF en Selenicereus megalanthus al aumentar el periodo de almacenamiento a 8 °C, (hasta el día 23); asimismo, Corrales-García y Canché-Canché (2008) señalan que en Hylocereus undatus el DF fue más severo en los frutos almacenados a 4 °C durante 21 d que en los almacenados 5, 10 o 16 d.
Acidez titulable
Como se esperaba, en los frutos no refrigerados hubo un descenso significativo en la acidez de las pitahayas, lo que coincide con lo observado por Osuna et al. (2011) y Magaña et al. (2013). Según Žnidarčič y Požrl (2006) y Álvarez et al. (2009), este descenso de acidez se debe a que los ácidos orgánicos se usan en el metabolismo respiratorio o convertidos en azúcares. La refrigeración durante 15 d no cambio este metabolismo (Figura 2), pero la disminución fue menor que la observada en los frutos no refrigerados; esto sugiere que la refrigeración redujo la pérdida de acidez al disminuir el metabolismo (Wismer, 2003). Además se encontró que al transferir los frutos a temperatura ambiente la acidez aumentó.
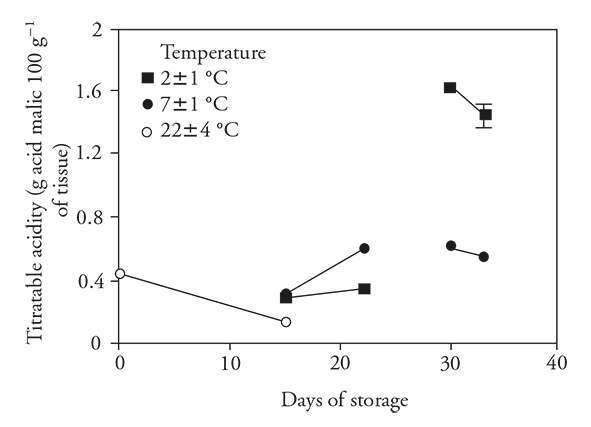
Figure 2 Acidez titulable (± desviación estándar) en frutos de pitahaya (Hylocereus undatus H.) almacenados 15 d a temperatura ambiente, 15 d en refrigeración y después 7 d a temperatura ambiente, ó 30 d en refrigeración y después 3 d a temperatura ambiente.
Aunque TA se redujo después de 15 d, hubo un aumento importante en refrigeración por 30 d. El aumento en TA fue mayor en los frutos almacenados a 2±1°C que a 7 °C. Cuando los frutos se transfirieron a condiciones ambientales la acidez descendió en ambos grupos.
Durante la frigoconservación y asociado con el metabolismo respiratorio reducido, la pitahaya acumuló ácidos orgánicos. Luego, con la transferencia a condiciones ambientales hubo acumulación de ácidos orgánicos en algunos casos (15 d a 7±1 °C), debido talvez a la inhibición de la enzima malato deshidrogenasa (en el ciclo de Krebs), la cual es susceptible de remoción desde la mitocondria de frutos enfriados, como en camote (Kozukue y Ogata, 1972; Famiani et al., 2015).
Con base en los resultados aquí presentados y lo reportado por Wang (1994), el aumento de la AT durante la refrigeración podría interpretarse como un síntoma claro de DF. Thorne y Efiuvwevwere (1988) reportaron un efecto similar en frutos de Lycopersicon esculentum Mill, en los que AT se aumentó con el almacenamiento a temperaturas bajas (menores a 13 °C), en tomate refrigerados 30 d. Navarro-López et al. (2012) encontraron que los almacenados a 4 °C incrementaron su AT más que los almacenados a 10 °C. En nuestro estudio se obtuvo una correlación positiva (rs =0.61) TA y el DF en pitahaya, por lo que esta variable puede ser un indicador útil para medir el DF en pitahaya (Cuadro 1).
Cuadro 1 Correlación entre síntomas del daño por frío (DF) y variable de respuesta (bioquímicas, fisiológicas, fisicoquímicas y físicas) en frutos de pitahaya frigoconservados (15 o 30 d a 2 o 7 +/-1oC, con 90+/-6% HR) y no refrigerados (0 o 15 d a 22+/-4 oC, com 60+/-8 % HR)
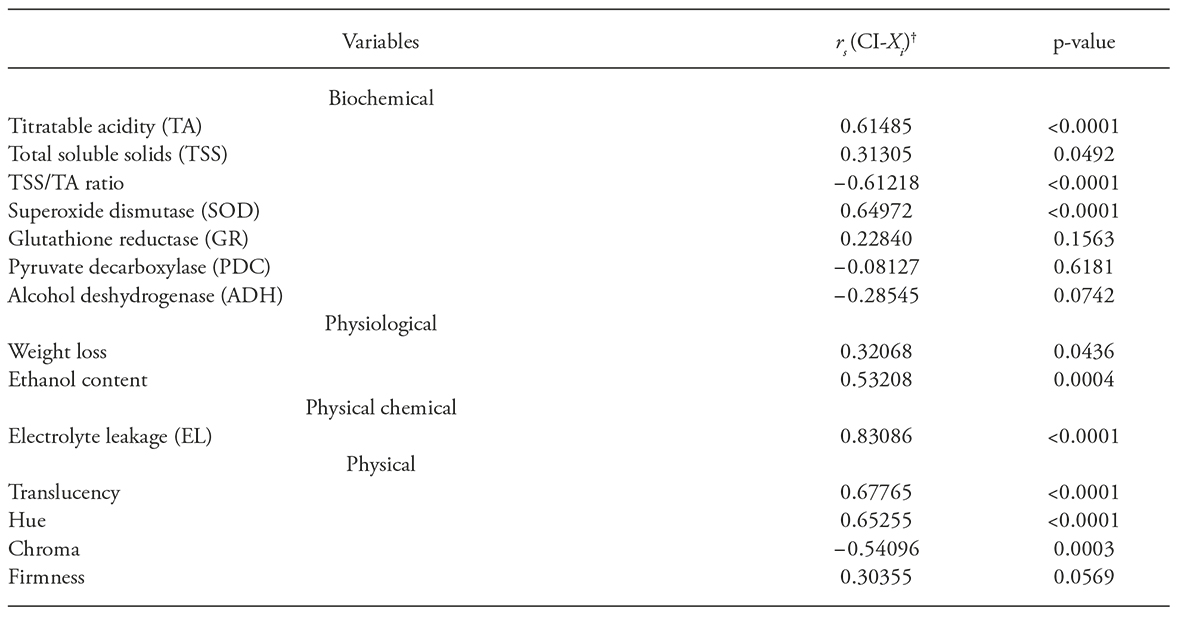
†rs: Correlación Spearman; CI: dañno por frio, and Xi: variable de respuesta.
Sólidos solubles totales
Valores mayores de SST (superiores a los iniciales) se obtuvieron con la temperatura menor (2 °C, Cuadro 2). Esto podría relacionarse a la hidrólisis del mucílago del fruto, lo que causa aumento de los sólidos solubles, como ocurre en tuna (Lakshminarayana et al., 1979). Incrementos similares (20 % en frutos almacenados 15 d a 8 °C) están reportados por Rodriguez-Rodríguez et al. (2005) en frutos de Selenicereus megalanthus. Además, frutos de Hylocereus undatus almacenados a 4 °C mostraron valores mayores de SST que en frutos almacenados a 13 °C (Centurión et al., 1999); estos autores mencionan una posible relación de los SST con los DF. Sin embargo, en nuestro estudio no se encontró correlación significativa entre estas variables.
Cuadro 2 Respuesta de sólidos solubles totales (SST), relación SST/AT; actividad enzimática de glutatión reductasa (GR), piruvato descarboxilasa (PDC), y alcohol deshidrogenasa (ADH); pérdida de peso, hue chroma y firmeza en frutos de pitahaya almacenadas durante 15 a 30 d (a 7 y 7oC) o almacenados a estas temperaturas más un período de 7 y 3 d, respectivamente, a temperatura ambiente (22 oC). Dos testigos se incluyeron (inicial y 15 d a 22 oC).

Cada valor es promedio de cuatro repeticiones y tratamientos con letras diferentes en un renglón son estadísticamente diferentes (p≤0.05).
Relación SST/AT
Las pitahayas testigo (antes del almacenamiento en frío) mostraron un valor promedio de la relación SST/AT de 33.49 y después de 15 d de almacenamiento, este valor aumentó significativamente, independiente de la temperatura. Sin embargo, cuando el período de almacenamiento aumentó (30 d), hubo una fuerte disminución de los valores de esta variable (menor a los valores de referencia), lo que se consideró un efecto negativo, dado que la relación SST/AT se propuso como indicador de buen sabor y de la calidad de la pitahaya, en particular cuando esta variable tiene un valor de 40 (Nerd et al 1999, To et al., 2002). En nuestro estudio es notable que al aumentar el período de almacenamiento (30 d), particular a 2 °C, se obtuvo una menor relación SST/AT, lo cual sugiere que estas condiciones estaban relacionadas con la severidad del DF (rs=0.61).
Actividad de la superóxido dismutasa
La actividad de SOD aumentó en los frutos refrigerados y no refrigerados durante 15 d (Figura 3), aunque, el aumento de la actividad en los frutos refrigerados no fue tan marcado. Hubo un aumento marcado en la actividad de SOD cuando los frutos se transfirieron de refrigerados a temperatura ambiente.

Figura 3 Actividad enzimática de superóxido dismutasa (± desviación estándar) en frutos de pitahaya (Hylocereus undatus H.) almacenados durante 15 d a temperatura ambiente, 15 d en refrigeración y después durante 7 d a temperatura ambiente; 30 d en refrigeración y después durante 3 d a temperatura ambiente.
Con el almacenamiento prolongado a 30 d a 2±1 °C hubo un aumento importante de la actividad de esta enzima, mientras que la actividad fue más estable en los frutos almacenados a 7±1 °C. Después del periodo de ambientación la actividad de esta enzima aumentó en los frutos almacenados en ambas temperaturas, con mayor actividad en frutos transferidos desde 2±1 °C una a temperatura ambiente. La actividad de esta enzima pudo ser estimulada por la presencia de especies reactivas de oxígeno (ROS) como radicales superóxido, peróxido de hidrógeno, radicales hidroxilo y simple oxígeno (Mittler, 2002). Esto se observó en frutos de origen tropical y subtropical durante el almacenamiento en frío (Aquino-Bolaños y Mercado-Silva, 2004).
El incremento de la actividad de la SOD se reportó en rambután almacenado a 10 °C (Shao et al., 2013) y en pitahayas almacenadas 21 d a 3 °C y luego mantenidas 4 d a 22 °C (Balois-Morales et al., 2007). Con estos antecedentes y la correlación positiva entre DF y actividad de SOD (r s =0.65), se puede proponer la alta actividad de la SOD como un índice de estrés por frío y que es una variable útil para medir DF.
Glutatión reductasa
Aunque la actividad de GR está relacionada con la tolerancia al DF, por la eliminación de ROS (Soleimani and Bodbodak, 2014), los resultados de nuestro estudio muestran que la actividad de GR no tiene correlación significativa con DF (Cuadro 2), ya que los frutos (30 d a 7 °C más 3 d a 22 ± 4 ° C) con la mayor actividad de la GR no fueron los más dañados, y aquellos con mayor daño mantuvieron una actividad de GR similar a la de frutos recién cosechados. Estos resultados son contrarios a los reportados en mangos (Wang et al., 2008) y en duraznos (Wang et al., 2006), debido porque estos mostraron baja actividad de la GR en condiciones de DF.
Piruvato descarboxilasa
La actividad enzimática de la PDC no mostró correlación significativa con DF, ya que la fruta con mayor DF mostró actividad similar (baja) a la inicial (Cuadro 2). Sin embargo, hubo un aumento después de 15 d de almacenamiento refrigerado, incluso a temperatura ambiente. De hecho, el aumento de la actividad PDC es el comportamiento natural en la maduración de la naranja (Bruemmer y Roe, 1985) y fresa (Moyano et al., 2004). Estos resultados permiten concluir que aunque el PDC promueve la vía de fermentación en respuesta al estrés biótico y abiótico (Tadege et al., 1999), no es una variable consistente para medir el DF en pitahaya.
Alcohol deshidrogenasa
Dado que la ADH es responsable de la reducción de acetaldehído a etanol (Botondi et al, 2012) también se esperaba una correlación de la actividad de ADH con DF; sin embargo, esta correlación no se observó. Es notable que el período de almacenamiento mostró mayor efecto, ya que los frutos almacenados un período más prolongado (30 d) mostraron la menor actividad (Cuadro 2). Aparentemente, en los primeros días de almacenamiento (después de 15 d) el sistema antioxidante estuvo activo; sin embargo, cuando el almacenamiento en frío se prolongó (después de 30 días), esto pudo haber detenido la actividad de la ADH (Botondi et al., 2012). De acuerdo con lo anterior, la inducción de la expresión génica para ADH principalmente después del inicio de la maduración en tomates y en bayas de uva, es un regulador potencial de la producción de etanol en respuesta a una señal del proceso de maduración (Or et al., 2000).
Pérdida de peso
La pérdida de peso aumento cuando el período de almacenamiento se prolongó y cuando los frutos refrigerados se transfirieron a temperatura ambiente ésta fue aún mayor (Cuadro 2). Esto se debió más a un mayor déficit de presión de vapor a temperatura ambiente que en refrigeración (Muy et al., 2004), y no por DF. Estos resultados son consistentes con los reportados por Magaña et al. (2004), quienes encontraron que la pérdida de peso fue aumentando con el tiempo de almacenamiento refrigerado (hasta 24 % de pérdida de peso a 8 °C) y con el tiempo del período de ambientación posterior al periodo de refrigeración después (3 y 6 d a 26 ± 2 °C: 9.43 y 13.8 %, respectivamente).
Concentración de etanol
Durante el almacenamiento refrigerado los contenidos de etanol no aumentaron con respecto a los frutos no refrigerados (Figura 4). Tampoco aumentó cuando los frutos se transfirieron a temperatura ambiente después de 15 d de refrigeración. Sin embargo, al transferir después de 30 d de refrigeración hubo un gran aumento del contenido de etanol en los frutos en las dos temperaturas.
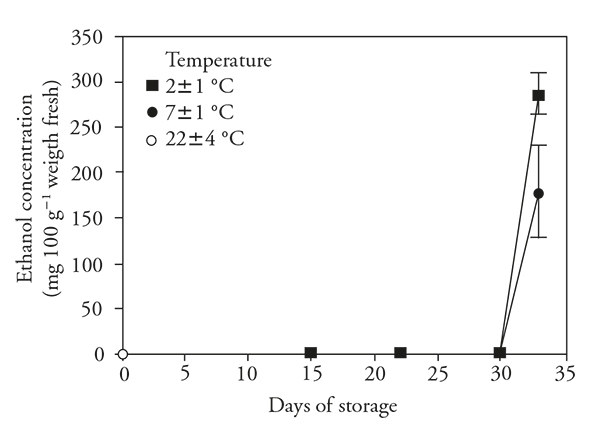
Figura 4 Concentración de etanol (± desviación estándar) en frutos de pitahaya (Hylocereus undatus H.) almacenados 15 d a temperatura ambiente, 15 d en refrigeración y después 7 d a temperatura ambiente; 30 d en refrigeración y después 3 d a temperatura ambiente.
Los cambios en las concentraciones de etanol indican que las bajas temperaturas no fueron estresantes durante un período corto, pero si lo fueron para el período prolongado de 30 d.
Cuando los frutos se transfirieron de una temperatura baja a una mayor, posiblemente se activó el metabolismo anaerobio (reactivación de PDC y ADH), porque el contenido de etanol fue significativamente mayor en los frutos a 3 d después de ser transferidos, especialmente en los frutos previamente refrigerados a 2±1 °C. Esto sugiere que la mayor producción de este metabolito se debió a la combinación del mayor periodo de refrigeración y la baja temperatura. García et al. (2005) en Cucumis melo, Corrales-García y Canché-Canché (2008) en Hylocereus undatus y Tietel et al. (2010) en Citrus reticulata también reportan aumentos en el contenido de etanol al prolongar el almacenamiento a bajas temperaturas.
El aumento de etanol sólo se produjo bajo condiciones ambientales después de 30 d de refrigeración, lo cual indica que la producción se inhibió bajo refrigeración y se favoreció a temperatura ambiente. Esto fue reportado en pitahaya (Corrales-García y Canché-Canché, 2008).
El etanol y el acetaldehído se estudió como productos del metabolismo anaerobio, ya que se producen cuando los frutos se mantienen en condiciones de bajo oxígeno (Kennedy et al., 1992; Geigenberger, 2003). Sin embargo, Kimmerer y Koslowski (1982) determinaron que la producción de acetaldehído y etanol no sólo ocurre en respuesta a la restricción de oxígeno, sino que puede ser activada cuando los frutos se someten a otros tipos de estrés. La acumulación de estos metabolitos puede ser un posible indicador de DF (Forney y Jordan (1996).
Con base en estos reportes y en la evidencia de la producción de etanol después de almacenamiento de pitahaya a bajas temperaturas, es probable que estos frutos sufrieran estrés y en consecuencia se dañaron por frío. La correlación de Spearman también sugiere una correlación positiva (rs =0.53) entre DF y la producción de etanol.
Liberación de electrolitos
El aumento de LE fue significativo de FE en la cáscara de los frutos no refrigerados (Figura 5), y este cambio probablemente corresponda a un proceso natural y evidencia de la senescencia en los frutos. Los cambios en la LE implican un desorden fisiológico irreversible. Esta variable fue estable en los frutos refrigerados evitando el inicio aparente de la senescencia. Sin embargo, al transferir los frutos a 22±4 °C la LE aumentó, lo cual sugiere que el cambio de una temperatura menor (2 o 7±1 °C) a una mayor (22±4 °C) causó la manifestación del daño a las membranas.
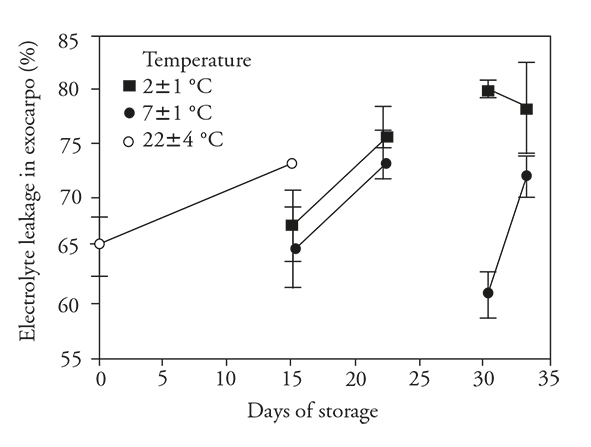
Figure 5 Liberación exocarpo de electrolitos (± desviación estándar) en frutos de pitahaya (Hylocereus undatus H.) almacenados 15 d a temperatura ambiente, 15 d en refrigeración y después 7 d a temperatura ambiente; 30 d en refrigeración y después 3 d a temperatura ambiente.
La LE en el exocarpo de los frutos almacenados a cualquiera de las bajas temperaturas por 15 d permaneció similar a la de los frutos recién cortados. Sin embargo, con el almacenamiento por 30 d a 2±1 °C hubo un aumento significativo de ésta, mientras que la LE de los almacenados a 7±1 °C permaneció baja, lo cual sugiere que ocurrió un daño en los frutos almacenados a la temperatura menor. En el periodo de ambientación, cuando la refrigeración fue a 2±1 °C la LE se mantuvo elevada pero ya no aumentó, mientras que los frutos refrigerados a 7±1 °C mostraron un aumento moderado. Esto sugiere que los frutos almacenados a 7±1 °C no mostraron mucho estrés ya que la LE tuvo un nivel semejante al mostrado por los frutos no refrigerados, mientras que los frutos almacenados a 2±1 °C no pudieron mantener la integridad de su membrana a esa baja temperatura.
La LE es muy importante porque cuando es suficientemente baja se asegura estabilidad metabolica; sin embargo, un aumento de la LE puede ser nocivo porque favorece el aumento de compuestos en el citoplasma que pueden inhibir las funciones celulares, probablemente como factores desacoplantes de la fosforilación oxidativa. Un aumento de la LE es indeseable y ese incremento se puede interpretar como indicador de DF, porque en nuestro estudio tuvo alta correlación (r s =0.83) con DF.
Los resultados de nuestro estudio son consistentes con los de Pérez et al. (2004) y Dea et al. (2010), quienes reportan que el aumento de la FE, conductividad eléctrica o fugas de electrolitos fue un indicador de daño a la membrana (Sharom et al., 1994). Esto posiblemente ocurrió a causa del DF, ya que la LE, conductividad eléctrica o fuga de electrolitos también aumentan significativamente en algunos frutos como la granada (Ramezanian et al., 2010) y el mango (Dea et al. (2010) almacenados a temperaturas bajas o dañados. El aumento de la conductividad eléctrica en el exocarpo de la pitahaya puede ser una variable fiable para determinar si un fruto está dañado por frío y en cual grado.
Translucidez
La translucidez aumentó en los frutos almacenados 15 d a temperatura ambiente (22±4 °C). Similarmente, los frutos refrigerados bajo ambas condiciones de temperatura mostraron aumento de translucidez, pero el aumento fue menor que el observado en los frutos almacenados a temperatura ambiente (Figura 6). Al parecer la refrigeración redujo este defecto. Al transferir los frutos a condiciones ambientales, sólo los previamente refrigerados a 2±1 °C tuvieron un aumento ulterior en la translucidez.
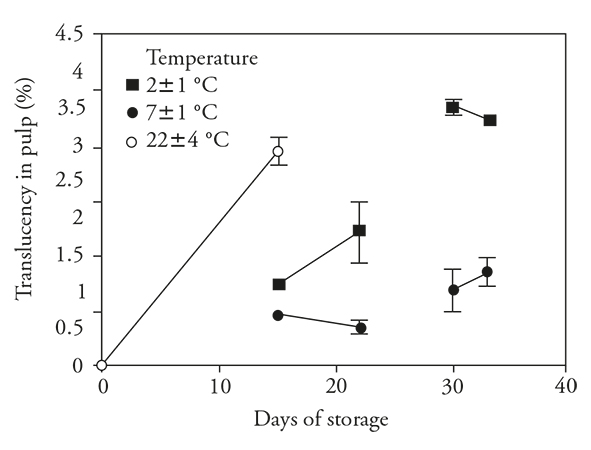
Figure 6 Translucidez (± desviación estándar) en frutos de pitahaya (Hylocereus undatus H.) almacenados durante 15 d a temperatura ambiente, 15 d en refrigeración y después 7 d a temperatura ambiente; 30 d en refrigeración y después durante 3 d a temperatura ambiente.
En los frutos almacenados a 7±1 °C por 30 d, hubo un aumento ligero en la translucidez durante la refrigeración y luego un aumento menor después de la transferencia. Con fruta almacenada 30 d a 2±1 °C, hubo el desarrollo máximo de la translucidez, aún en condiciones de almacenamiento refrigerado. Esto se puede considerar una respuesta al estrés causado por las temperaturas bajas de almacenamiento, y puede estar relacionado con los cambios de la LE y sus consecuencias para el funcionamiento celular normal, como ya se discutió. Esto resultó en un cambio en el color blanco de la pulpa a una apariencia translúcida. Según Soler (1994), la translucidez es causada por desaparición de los espacios gaseosos intercelulares de la pulpa.
La translucidez elevada en frutos almacenados en refrigeración a 2±1 °C, temperatura que causa síntomas de DF en pitahaya, indica que está asociada con la manifestación de este desorden. La translucidez tuvo correlación positiva (r s =0.68) con el DF y es una variable que se puede usar para identificar el comienzo del DF en pitahaya.
Nerd et al. (1999) reportan que la translucidez fue un síntoma de DF además del ablandamiento, picado, oscurecimiento y pérdida de sabor. Estos autores también señalan que estos síntomas se desarrollan rápido cuando los frutos de H. undatus y H. polyhizus se almacenan a 6 °C por 2 semanas y luego se conservan a 20 °C. To et al. (2002) reportan translucidez alta en frutos de pitahaya (almacenados a 4 y 6 °C) y en otros frutos susceptibles a DF (Raimbault et al., 2011 y, Singh y Singh, 2013.
Ángulo hue (color sólido)
Frutas con el DF más alto mostraron el hue más alto (excepto los frutos almacenados 15 d a 7 °C y un período adicional de 7 d a 22±4 °C) (Cuadro 2); esto sugiere una tendencia a colores anaranjados, en detrimento del color rojo. Esto es lógico, porque las bajas temperaturas causan maduración irregular (Kader, 2007) y, así, una alteración del color. Aunque se obtuvo una correlación positiva (r s =0.65) entre el ángulo hue y DF, de acuerdo con información evaluada previamente en este estudio, se encontró que esta variable no es confiable para medir DF en pitahayas.
Chroma (intensidad)
Esta variable disminuyó cuando los frutos se almacenaron a 2 °C, independiente del período de almacenamiento (Cuadro 2). Esto sugiere que el color rojo perdió pureza, lo que afecta la calidad; sin embargo, no todos estos frutos mostraron DF. Aunque Corrales-García y Canché-Canche (2008) propusieron que la incapacidad de las pitahayas para aumentar la saturación de color podría interpretarse una manifestación de DF, como con la variable mencionada, no es posible confirmar su confiabilidad para evaluar la DF.
Firmeza
Los aumentos de la firmeza se relacionaron con el período de almacenamiento (Cuadro 2), lo que se podría deber a pérdida de humedad o la manera para determinar la firmeza. Estos resultados son contrarios a los reportados por Balois-Morales et al. (2013), quienes encontraron que la firmeza es una característica estable en pitahaya durante el almacenamiento refrigerado o a temperatura ambiente.
Conclusiones
Las variables consistente y positivamente correlacionadas con DF fueron AT, SOD, contenido de etanol, FE y translucidez. Por lo tanto, al aumentar la gravedad del daño (temperatura más baja y período de almacenamiento más largo), hubo un cambio proporcionalmente mayor en estas variables. La expresión de variables correlacionadas se observó cuando los frutos fueron transferidos a temperatura ambiente después de los períodos de almacenamiento refrigerado (15 o 30 d).
Literature Cited
Álvarez-Herrera, J., G., A. Galvis J., and E. Balaguera-López H. 2009. Determinación de cambios físicos y químicos durante la maduración de frutos de champa (Campomanesia lineatifolia R. & P.). Agron. Colomb. 27: 253-259. [ Links ]
Aquino-Bolaños E., N., and E. Mercado-Silva. 2004. Effects of polyphenol oxidase and peroxidase activity, phenolics and lignin content on the browning of cut jicama. Postharvest Biol. Techn. 33: 275-283. [ Links ]
Balois-Morales R., M. T. Colinas-León, C. B. Peña-Valdivia, S. H. Chávez-Franco, y I. Alia-Tejacal. 2007. Sistema de estrés oxidativo, fenoles-polifenol oxidasa-peroxidasa, de frutos de pitahaya (Hylocereus undatus) almacenados con frío. Rev. Chapingo Ser. Hortic. 13: 115-120. [ Links ]
Balois-Morales R., M. T. Colinas-León, C. B. Peña-Valdivia, S. H. Chávez-Franco, y I. Alia-Tejacal. 2008. Sistema enzimático antisenescencia, catalasa-superóxido dismutasa, de frutos de pitahaya (Hylocereus undatus) almacenados con frío. Rev. Chapingo Ser. Hortic . 14: 295-299. [ Links ]
Balois-Morales R., C. B. Peña-Valdivia, and V. B. Arroyo-Peña. 2013. Symptoms and sensitivity to chilling injury of pitahaya (Hylocereus undatus (Haw.) Britton & Rose) fruits during postharvest. Agrociencia 47: 795-813. [ Links ]
Bill M., D. Sivakumar, K. Thompson, A. and L. Korsten, 2014. Avocado fruit quality management during the postharvest supply chain. Food Rev. Int. 30: 169-202. [ Links ]
Botondi, R., V. Russo, and F. Mencarelli. 2012. Anaerobic metabolism during short and long term storage of kiwifruit. Postharvest Biol. Techn . 64: 83-90. [ Links ]
Bradford M., M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-254. [ Links ]
Bruemmer J., H. and B. Roe. 1985. Pyruvate dehydrogenase activity during ripening of Hamlin oranges. Phytochemistry 24: 2105-2106. [ Links ]
Cantín C., M., H. Crisosto C., A. Ogundiwin E., T. Gradziel, J. Torrents, and A. Moreno M. 2010. Chilling injury susceptibility in an intra-specific peach [Prunus persica (L.) Batsch] progeny. Postharvest Biol. Techn . 58: 79-87. [ Links ]
Centurión Y., A. et al. 1999. Variación de las principales características de la pitahaya (Hylocereus undatus) durante su maduración postcosecha. Hort. Méx. 7: 419-425. [ Links ]
Corrales-García, J., and E. Canche-Canche. 2008. Physical and physiological changes in low-temperature-stored pitahaya fruit (Hylocereus undatus). J. Prof. Assoc. Cactus Dev. 8: 108-119. [ Links ]
Davis P., L., and G. Chace Jr. W. 1969. Determination of alcohol in citrus juice by gas chromatographic analysis of headspace. HortScience 4: 117. [ Links ]
Dea S., K. Brecht J., C. N. Nunes M., and A. Baldwin E. 2010. Occurrence of chilling injury in fresh-cut ‘Kent’ mangoes. Postharvest Biol. Techn . 57: 61-71. [ Links ]
Famiani F., A. Battistelli, S. Moscatello, J. G. Cruz-Castillo, y R.Walker P. 2015. Ácidos orgánicos acumulados en la pulpa de los frutos: ocurrencia, metabolismo y factores que afectan sus contenidos-una revisión. Rev. Chapingo Serie Hortic. 21: 97-128. [ Links ]
Forney C., F., and A. Jordan M. 1996. Stress-induced ethanol production in fresh fruit and vegetables. HortScience 31: 635-635. [ Links ]
Freitas S., T., and E. J. Mitcham. 2013. Quality of pitaya fruit (Hylocereus undatus) as influenced by storage temperature and packaging. Sci. Agric. 70: 257-262. [ Links ]
García S., M. L., I. Vargas-Arispuro, A. A. Gardea B., M. H. Tiznado, y M. A. Martínez-Téllez. 2005. Daño por frío en melón Cantaloupe en dos estados de madurez. Rev. Fitotec. Mex. 28: 161-170. [ Links ]
Geigenberger P. 2003. Response of plant metabolism to too little oxygen. Curr. Opin. Plant Biol. 6: 247-256. [ Links ]
Hodges D., M., J. Andrews C., A. Johnson D., and I. Hamilton R. 1997. Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize lines. J. Exp. Bot. 48: 1105-1113. [ Links ]
Kader, A. 2007. Postharvest biology and t echnology: An overview. In: Kader A. A. (ed.). Postharvest Technology of Horticultural Crops. Div. Agr. Nat. Res., University of Calif., California, USA. pp: 39-47. [ Links ]
Kennedy R., A., E. Rumpho M., and C. Fox T. 1992. Anaerobic metabolism in plants. Plant Physiol. 100: 1-6. [ Links ]
Kimmerer, T., and T. Kozlowski. 1982. Ethylene, ethane, acetaldehyde and ethanol production by plants under stress. Plant Physiol . 69: 840-847. [ Links ]
Kozukue, N., and K. Ogata. 1972. Physiological and chemical studies of chilling injury in pepper fruits. J. Food Sci. 37: 708-711. [ Links ]
Lakshminarayana S., L. Sosa A., and F. Barrientos-Pérez. 1979. The development and postharvest physiology of the fruit of prickly pear (Opuntia amyclaea Tenore). In: Inglet G., E., and G. Charalalambus (eds). Tropical Foods: Chemistry and Nutrition. Academic Press, New York. pp. 69-93. [ Links ]
Magaña B., W., E. Sauri D., J. García C., y C. Saucedo V. 2013. Variaciones bioquímicas-fisiológicas y físicas de las frutas de pitahaya (Hylocereus undatus) almacenadas en ambiente natural. Rev. Iberoamer. Tec. Postcosecha 14: 21-30. [ Links ]
Magaña W., M. I. Balbín, J. Corrales, A. Rodríguez, C. Saucedo, E. Cañízares, y E. Sauri. 2004. Efecto de la frigoconservación en el comportamiento fisiológico de frutas de pitahaya (Hylocereus undatus Haworth). Cul. Trop. 25: 33-39. [ Links ]
McGuire R., G. 1992. Reporting of objective color measurements. HortScience 27:1254-1255. [ Links ]
Mittler R. 2002. Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7:405-410. [ Links ]
Morris L., L. 1982. Chilling injury of horticultural crops: an overview. HortScience 17:161-162. [ Links ]
Moyano, E. et al. 2004. Comparative study between two strawberry pyruvate decarboxylase genes along fruit development and ripening, post-harvest and stress conditions. Plant Sci.166: 835-845. [ Links ]
Muy R., D., J. Siller C., J. Díaz P., y B. Valdéz T. 2004. Efecto de las condiciones de almacenamiento y el encerado en el estatus hídrico y la calidad poscosecha de pepino de mesa. Rev. Fitotec. Mex. 27: 157-165. [ Links ]
Navarro-López E., R., R. Nieto-Ángel, J. Corrales-García, M. R. García-Mateos, y A. Ramírez-Arias. 2012. Calidad poscosecha en frutos de tomate hidropónico producidos con agua residual y de pozo. Rev. Chapingo Ser. Hortic . 18: 263-277. [ Links ]
Nerd A., F. Gutman, and Y. Mizrahi. 1999. Ripening and postharvest behavior of fruits of two Hylocereus species (Cactaceae). Postharvest Biol. Techn . 17: 39-45. [ Links ]
Osuna E., T. et al. 2011. Calidad postcosecha de frutos de pitahaya (Hylocereus undatus Haw.) cosechados en tres estados de madurez. Rev. Fitotec. Mex . 34: 63-72. [ Links ]
Osuna E., T. et al. 2016. Fenología reproductiva, rendimiento y calidad del fruto de pitahaya (Hylocereus undatus (How.) Britton y Rose) en el valle de Culiacán, Sinaloa, México. Agrociencia, 50: 61-78. [ Links ]
Or E., J. Baybik, A. Sadka, and A. Ogrodovitch. 2000. Fermentative metabolism in grape berries: isolation and characterization of pyruvate decarboxylase cDNA and analysis of its expression throughout berry development. Plant Sci . 156: 151-158. [ Links ]
Pérez L., A., C. Saucedo V., M. L. Arévalo G., y A. Muratalla L. 2004. Efecto del grado de madurez en la calidad y vida poscosecha de ciruela mexicana (Spondias purpurea L.). Rev. Fitotec. Mex. 27: 133-139. [ Links ]
Raimbault A., K., P. A. Marie-Alphonsine, J. P. Horry, M. Francois-Haugrin, K. Romuald, and A. Soler. 2011. Polyphenol oxidase and peroxidase expression in four pineapple varieties (Ananas comosus L.) after chilling injury. J. Agric. Food Chem. 59: 342-348. [ Links ]
Ramaswamy H., S. 2015. Post-harvest Technologies of Fruits & Vegetables. DEStech Publications, Inc. Pensilvania, USA. 364 p. [ Links ]
Ramezanian A., M. Rahemi, M. Maftoun, B. Kholdebarin, S. Eshghi, S. M. Reza and V. Tavallali. 2010. The ameliorative effects of spermidine and calcium chloride on chilling injury in pomegranate fruits after long-term storage. Fruits 65: 169-178. [ Links ]
Rodriguez-Rodríguez D., A. et al. 2005. Effect of two ripening stages and two storage temperatures on the postharvest behaviour of yellow pitahaya (Selenicereus megalanthus Haw.). Rev. Fac. Nac. Agron, Medellín 58: 2837-2857. [ Links ]
Sharom M., C. Willemot, and J. Thompson E. 1994. Chilling injury induces lipid phase changes in membranes of tomato fruit. Plant Physiol . 105: 305-308. [ Links ]
Shao Y., J. Xie, P. Chen, and W. Li. 2013. Changes in some chemical components and in the physiology of rambutan fruit (Nephelium lappaceum L.) as affected by storage temperature and packing material. Fruits 68: 15-24. [ Links ]
Singh S., P., and Z. Singh. 2013. Controlled and modified atmospheres influence chilling injury, fruit quality and antioxidative system of Japanese plums (Prunus salicina Lindell). Int. J. Food Sci. Tech. 48: 363-374. [ Links ]
Soler A. 1994. Déviation de la maturation chez l’ananas: le «jaune» ou translucidité. I: Caractéristiques physiques et chimiques du fruit translucide. Fruits 49: 5-15. [ Links ]
Tadege M., I. Dupuis, and C. Kuhlemeier. 1999. Ethanolic fermentation: new functions for an old pathway. Trends Plant Sci. 4: 320-325. [ Links ]
Tietel Z. et al. 2010. Effects of wax coatings and postharvest storage on sensory quality and aroma volatile composition of ‘Mor’mandarins. J. Sci. Food Agric. 90: 995-1007. [ Links ]
To L., V., N. Ngu, D. Duc N., and T. T. Huong H. 2002. Dragon fruit quality and storage life: Effect of harvest time, use of plant growth regulators and modified atmosphere packaging. Acta Hort. 575: 611-621. [ Links ]
Thompson A., K. 2010. Controlled Atmosphere Storage of Fruits and Vegetables. CAB International: UK. 288 p. [ Links ]
Thorne S., N., and J. O. Efiuvwevwere B. 1988. Changes in organic acids in chilled tomato fruit (Lycopersicon esculentum Mill). J. Sci. Food Agric. 44: 309-319. [ Links ]
Viet K., N., and L. T. Thanh T. 2014. Green trade barriers and vietnam’s agricultural and fishery export. J. Globalization Stud. 5: 69-80. [ Links ]
Wang C., Y. 1994. Chilling injury of tropical horticultural commodities. HortScience 29: 986-988. [ Links ]
Wang C., Y. 2010. Alleviation of chilling injury in tropical and subtropical fruits. Acta Hort. 864: 267-273. [ Links ]
Wismer W., V. 2003. Low temperature as a causative agent of oxidative stress in postharvest crops. In: Hodges M. D. (ed). Postharvest Oxidative Stress in Horticultural Crops. Food Products Press. New York, USA. pp: 55-68. [ Links ]
SAS®. 2006. SAS/STAT User’s Guide. Institute Inc. Statistical Analysis Systems Institute. Version 9.1th Ed. Cary, NC.: SAS Institute Inc. [ Links ]
Soleimani A., M., and S. Bodbodak. 2014. Postharvest heat treatment for mitigation of chilling injury in fruits and vegetables. Food Bioprocess Tech. 7: 37-53. [ Links ]
Žnidarčič D., and T. Požrl. 2006. Comparative study of quality changes in tomato cv. ‘Malike’(Lycopersicon esculentum Mill) whilst stored at different temperatures. Acta Agric. Slovenica 87: 235-243. [ Links ]
Recibido: Octubre de 2015; Aprobado: Septiembre de 2016











 text in
text in 


