Introducción
El ácaro rojo de las palmas, Raoiella indica Hirst (Acari: Tenuipalpidae), es la plaga más importante e invasiva introducida en América (Amaro y Gomes, 2012; Dowling et al., 2012; Kane et al., 2012). Esta plaga se dispersó rápido en los países del Caribe (Rodrígues et al., 2007; Roda et al., 2008), Florida, EE.UU. (Cocco y Hoy, 2009), México (NAPPO, 2009), Brasil (Navia et al., 2011), Colombia (Carrillo et al., 2011) y Venezuela (Vásquez y De Moraes, 2013). La presencia de R. indica en la región neotropical afecta principalmente a cultivos de importancia económica, como palma de coco (Cocos nucifera L.), plátanos (Musa spp.) y flores tropicales de la familia Heliconiaceae (Amaro y Gomes, 2012; Carrillo et al., 2012; Dowling et al., 2012; Kane et al., 2012).
Con la detección de esta plaga en México, el Gobierno Federal, a través del Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA), implementó la campaña contra el ácaro rojo de las palmas. El propósito fue reducir los niveles de infestación y mitigar el riesgo de dispersión hacia zonas agrícolas del territorio nacional. La estrategia operativa incluye muestreo, diagnóstico y control de focos de infestación mediante podas sanitarias y aplicación de acaricidas (SENASICA, 2013). No obstante, esta plaga se ha diseminado en el país (SENASICA, 2015).
El control químico de los ácaros es crucial en los programas de manejo integrado de plagas en el mundo y es poco probable que se elimine pronto (Van Leeuwen et al., 2015). Además, los tratamientos químicos son útiles para controlar brotes poblacionales (Fountain et al., 2010) o mitigar su dispersión (De Assis et al., 2013). Un reto es que el control químico debe orientarse al uso de acaricidas inocuos o poco perjudiciales para la fauna benéfica y los mamíferos, y persistencia ambiental corta (Dekeyser, 2005; Van Leeuwen et al., 2015).
Los ácaros incluyen especies plagas con potencial alto para desarrollar resistencia a los acaricidas (Whalon et al., 2008). Los acaricidas se aplican con frecuencia mayor que otros plaguicidas, porque los ácaros tienen fecundidad alta y su ciclo de vida es corto, lo cual conduce al desarrollo rápido de resistencia (Van Leeuwen et al., 2010). La recomendación para demorar el desarrollo de la resistencia incluye acciones como alternancia, secuenciación, rotación y uso de mezclas de compuestos con mecanismos de acción diferentes (Marcic, 2012). Por lo tanto, el desafío principal para el control químico efectivo es reconocer la toxicidad base de los acaricidas locales. Es necesario diversificar el mecanismo de mortalidad mediante la rotación de los acaricidas con mecanismos diferentes de acción (Whalon et al., 2008). El uso de un ingrediente activo único para el control de plagas seguirá propiciando resistencia acelerada (Whalon et al., 2008).
Las investigaciones del potencial de los predadores naturales de R. indica en México no son concluyentes, y en la campaña contra el ácaro rojo de las palmas todavía se aplican acaricidas (SENASICA, 2015). Los acaricidas recomendados y autorizados temporalmente por la Comisión Federal para la Protección contra Riesgos Sanitarios son abamectina, spiridiclofen y azufre (COFEPRIS) (SENASICA, 2013). Esta recomendación está basada en la información generada en Brasil (De Assis et al., 2012), Puerto Rico y EE.UU. (Rodrigues y Peña, 2012). Nuestra hipótesis fue que las poblaciones locales de R. indica presentan respuesta diferente a esos acaricidas. Además, algunos de los productos químicos recomendados no están autorizados o disponibles en México. Con estos antecedentes, el objetivo del presente estudio fue determinar las concentraciones letales a 50 % y 90 % de los acaricidas comerciales disponibles en México contra R. indica. Esta información es necesaria para resolver situaciones de emergencia para el control químico de esta plaga y establecer las bases de una estrategia para el uso racional de acaricidas.
Materiales y Métodos
Recolecta y manejo de Raoiella indica
Los especímenes de R. indica se obtuvieron de foliolos de palma de coco infestados en forma natural en el Campo Experimental de la División Académica de Ciencias Agropecuarias de la Universidad Juárez Autónoma de Tabasco, ubicado en el km 25 de la carretera Villahermosa-Teapa en el municipio de Centro, Tabasco. Los foliolos se colocaron en bolsas de polietileno, se trasladaron al laboratorio de Sanidad Vegetal de la misma institución, se mantuvieron en una cámara de cría a 28 ±2 °C y 50±10 % de humedad relativa y se usaron el mismo día de la recolecta. De estas muestras se obtuvieron hembras adultas, con cuerpo oval, más grandes que las otras formas biológicas de esta especie, con manchas oscuras en el dorso y opistosoma redondeado (Kane et al., 2012; Navia et al., 2013). Además, solo se seleccionaron especímenes de color rojo carmín intenso para usar hembras relativamente jóvenes.
Recolecta y preparación del material vegetal
En el mismo sitio de recolecta de R. indica se obtuvieron muestras de foliolos sanos de palma de coco, se limpiaron con un pincel No. 4 y se revisaron minuciosamente con un microscopio para asegurarse que no tuvieran síntomas de enfermedad, ácaros o insectos depredadores. Los foliolos se cortaron en porciones de 2.5 x 4 cm, se colocaron en cajas Petri de 9 cm de diámetro y se mantuvieron en las condiciones ambientales ya mencionadas.
Acaricidas evaluados
Los acaricidas seleccionados son productos químicos para uso agrícola y control de diferentes especies de ácaros fitófagos de frutales, hortalizas y ornamentales; todos tienen registro vigente en la (COFEPRIS, 2015) y se venden en el área de estudio (Cuadro 1). Los acaricidas se usaron según las recomendaciones en la literatura (Dekeyser, 2005; Marcic, 2012; Sparks and Nauen, 2015; Van Leeuwen et al., 2015) y en etiquetas de los producto. Acariciadas que sólo afectan los estados inmaduros se descartaron porque los bioensayos se realizaron en ácaros adultos.
Cuadro 1 Características de los acaricidas evaluados contra adultos del ácaro rojo de la palmas Raioiella indica.

†Comité de Acciòn de Resistencia a los Inseticidas (IRAC) (Sparks y Nauen, 2015). ¶ Whalon et al. (2016).§ Uso restringido (COFEPRIS, 2015).
Bioensayos preliminares
Las pruebas se realizaron de acuerdo al método no. 4 de las series de métodos para pruebas de susceptibilidad del Comité de Acción de Resistencia a los Insecticidas (IRAC) (IRAC, 2009). De forma preliminar, para cada uno de los 14 acaricidas se prepararon concentraciones diluidas en un factor de 10: 0.0001, 0.001, 0.01, 0.1, 1, 10, 100 y 1000 mg de ingrediente activo por litro de solución y un testigo de agua destilada. La unidad experimental fue una porción de lámina foliar de 2.5 x 4 cm de foliolo de palma, sumergida por 5 s en la solución acaricida o agua. Las porciones se secaron 20 min a temperatura ambiente, se colocaron con la cara abaxial sobre una placa de acrílico de 5 x 5 cm, con un orificio de 2.5 cm de diámetro en el centro, y sus bordes se fijaron con cinta adhesiva a la placa. Luego se colocaron 10 hembras sobre el área abaxial de la lámina foliar limitada por el orificio del acríclico. Para confinar los ácaros a este espacio, se colocó otra placa de acrílico del mismo tamaño y los bordes de ambas placas se sellaron con cinta adhesiva. Esta unidad experimental representó una repetición y se colocó sobre una capa de algodón húmedo dentro de una caja Petri. Cada tratamiento tuvo tres repeticiones y 30 ácaros en total por concentración de acaricida. El total de ácaros vivos y muertos se cuantificó después de 24 h de aplicar los compuestos. Los ácaros que no se movieron al perturbarse por 5 s, con un pincel No. 000 (Helle y Overmeer, 1985), se consideraron muertos. Para cada acaricida se determinó el intervalo de concentración que ocasiona de 0 a 100 % la mortalidad. Los acaricidas (Cuadro 1) que no produjeron el 100 % de mortalidad con 1000 mg de ingrediente activo por litro fueron descartados para los bioensayos finales.
Bioensayos finales
De acuerdo con los resultados de los bioensayos preliminares de toxicidad, en esta etapa solo se evaluaron 10 acaricidas: fenazaquin, milbemectina, abamectina, dicofol, acequinocyl, fenpyroximate, propargite, clorhidrato de formetanato, azufre y bifentrina. Con base en la mortalidad por concentración de acaricida y el intervalo de concentraciones que produjeron entre cero y 100 % de mortalidad en los bioensayos preliminares, una o varias concentraciones (en escala logarítmica) por producto químico se intercalaron; así, las concentraciones por acaricida fueron seis o siete. Como tratamiento testigo se utilizó agua destilada en lugar de acaricida. La aplicación y evaluación de acaricidas fue similar a la del bioensayo preliminar. Para cada concentración de acaricida se evaluaron tres repeticiones, y 30 hembras adultas en total, incluyendo el testigo. Todo el procedimiento se repitió dos veces e incluyó 60 ácaros en total por concentración de acaricida (Robertson et al., 2007).
Análisis estadístico
Con los datos de mortalidad se realizó un análisis Probit (Finney, 1971) después de la corrección de los datos de mortalidad en el testigo (Abbott, 1925). El procedimiento de Proc Probit (SAS Institute Inc, 2009), se utilizó para estimar las concentraciones letales 50 % (CL50) y 90 % (CL90), y sus límites respectivos de confianza al 95 %. También se calculó la proporción de toxicidad al 90 % (PT), dividiendo el valor estimado al nivel de la CL90 de cada producto acaricida entre el valor del producto acaricicida más tóxico (Robertson et al., 2007). La toxicidad de cada acaricidas se consideró significativamente diferente si sus límites de confianza al 95 % no se traslaparon.
Resultados y Discusión
El ajuste de los datos de mortalidad de R. indica al modelo Probit fue adecuado (c2, p>0.05) (Cuadro 2). La mortalidad de ácaros en los testigos fue nula, excepto en el de abamectina, que tuvo 5 %. Las concentraciones estimadas que causaron 50 y 90 % de mortalidad (CL50 y CL90) y los intervalos de confianza al 95 % para CL90 indicaron que los acaricidas más tóxicos fueron fenazaquin y milbemectina, seguidos por abamectina y difocol. Los menos tóxicos fueron acequinocyl, fenpyroximate, propargite, clorhidrato de formetanato, azufre y bifentrina (Cuadro 2). De acuerdo con los valores CL90 y sus límites de confianza, las toxicidades de fenazaquin y milbemectina fueron iguales. Ambos acaricidas fueron 20 y 27 veces más tóxicos que abamectina y dicofol, respectivamente (Cuadro 2). Estos resultados coincidieron con los obtenidos por De Assis et al. (2013) en Roraima, Brasil, con 10 acaricidas, en condiciones de laboratorio, e identificaron a abamectina y milbemectina como los más tóxicos para adultos de R. indica.
Cuadro 2 Toxicidad de 10 acaricidas comerciales para adultos del ácaro de la palma Raioella indica en Tabasco, México
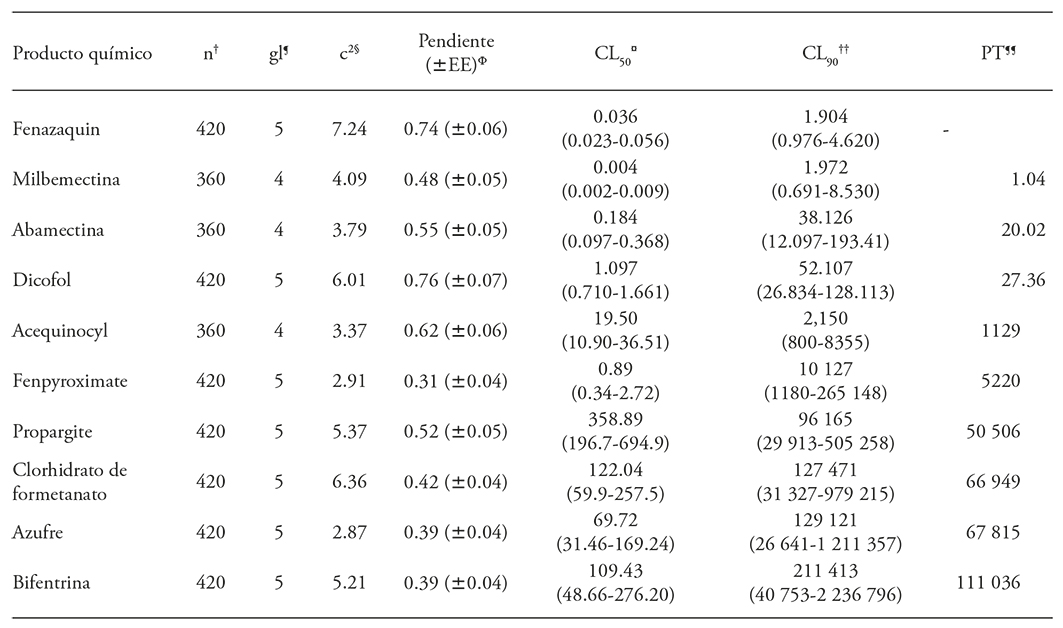
† Total de hembras en el bioensayo ¶ Grados de libertad § Valor de Chi-cuadrada (p>0.05) φ Error estándar de la media ¤ Concentración letal 50(CL50). †† Concentración letal 90 (CL90), en mg de i. a. L-1 con sus intervalos de confianza al 95 % ¶¶ Proporción de toxicidad al nivel de CL90
Debido a los resultados de bioensayos preliminares spiridiclofen, spiromesifen, bifezanate y amitraz se descartaron del ensayo final porque no produjeron 100 % de mortalidad de adultos de R. indica a la concentración máxima de 1000 ppm. Una causa probable es que spiridiclofen y spiromesifen son más tóxicos para huevecillos y estados inmaduros que para adultos, y el efecto en la reducción de la fecundidad y fertilidad en las hembras es relativamente lento (Marcic, 2012). Según De Assis et al. (2012), entre 10 acaricidas evaluados contra adultos de R. indica el spiromesifen fue el menos tóxico. Pero Dekeyser (2005) indicó que spiridiclofen y spiromesifen afectan a todos los estados de desarrollo de una gama amplia de ácaros fitófagos. El acaricida bifenazate también es clasificado como inhibidor del desarrollo de ácaros y es un producto químico activo contra los estados móviles y huevecillos Tetranychus urticae y otras especies (Dekeyser (2005). Amitraz es acaricida con toxicidad baja para T. urticae (Dennehy et al., 1993) y los acaricidas que afectan los estados inmaduros de los ácaros podrían mejorar su efecto contra R. indica en condiciones in situ, donde están todos los estados de desarrollo.
La pendiente de las líneas de regresión concentración-mortalidad de los acaricidas contra los adultos de R. indica varió de 0.31 a 0.74 (Cuadro 2), similar al intervalo de 0.39 a 1.69 observado por De Assis et al. (2012) en bioensayos con acaricidas y la misma especie. Estos valores son relativamente bajos comparados con los obtenidos con abamectina en nueve poblaciones de T. urticae (variación de 1.62 a 2.38) (Monteiro et al., 2015) y abamectina, bifezanate, dicofol, propargite y spiromesifen contra la misma especie (variación de 1.25 a 11.24) (Latheef y Hoffmann, 2014). De acuerdo con Lagunes-Tejeda y Vázquez-Navarro (1994), la pendiente es un estimador adecuado de la heterogeneidad de la población en estudio y, a menor pendiente, heterogeneidad mayor de los datos. Según, Robertson et al. (2007), hay evidencia de que los organismos en una población heterogénea presentan diferencias cuantitativas mayores en los niveles de desintoxicación enzimática. Es probable que ejemplares adultos de R. indica de campo, con edades de la población y las condiciones nutricionales variables, hayan afectado la pendiente en nuestro estudio.
Un problema para el control químico de ácaros fitófagos es su potencial alto para desarrollar resistencia a los acaricidas (Whalon et al., 2008). Así, Sawicki y Denholm (1987) definieron al manejo de resistencia a plaguicidas como un conjunto de estrategias con la premisa básica de conservar la susceptibilidad a los plaguicidas mediante su uso racional y la restricción de tratamientos para prevenir la selección de individuos resistentes, y prolongar la vida útil de los productos. Aunque los resultados de un bioensayo no se pueden utilizar para determinar la dosis para aplicar en campo, ya que una determinación de laboratorio no considera las pérdidas por arrastre, fotodescomposición, termorregulación y escape del insecto (Lagunes-Tejeda et al., 2009), sí se puede comparar la toxicidad de los acaricidas evaluados para los organismos bajo estudio (De Assis et al., 2012). De acuerdo con nuestros resultados, fenazaquin, abamectina, milbemectina y dicofol podrían incluirse en un programa de manejo químico de R. indica en Tabasco.
En condiciones de campo, dicofol fue considerado acaricida efectivo para reducir la población de R. indica en palmas de coco en Río Piedras, Puerto Rico; y en Florida, EE.UU. las aspersiones de abamectina y mitalic R. indica en palmas de coco (Rodrigues y Peña, 2012). En el 2013, el acaricida abamectina fue autorizado temporalmente por COFEPRIS en la campaña contra el ácaro rojo en México (SENASICA, 2013). Consideramos que fenazaquín, milbemectina, abamectina y dicofol podrían autorizarse para el control químico emergente de R. indica, ya que estos acaricidas se usan contra otras especies de ácaros fitófagos con importancia económica en México (Carrillo et al., 2012). La efectividad biológica de estos acaricidas debe realizarse en campo, para reconocer el momento adecuado de aplicación y determinar cómo reducir el impacto sobre los antagonistas naturales de R. indica.











 texto en
texto en 


