Introducción
Los métodos para el control de enfermedades incluyen el uso de genotipos resistentes, prácticas culturales, compuestos volátiles, extractos de plantas, control químico y control biológico (Nashwa et al., 2008). El control químico es uno de los más utilizados y, en la mayoría de los casos, causa contaminación ambiental, su costo es elevado y su control no es selectivo; esto afecta la sobrevivencia de microorganismos antagonistas. El control biológico es una alternativa complementaria eficiente y económica para el control de enfermedades foliares y las ocasionadas por patógenos en el suelo (Infante et al., 2009). El género Trichoderma incluye varias especies que sirven como agentes de control biológico con efecto estimulante en los cultivos e inductor de resistencia sistémica a diferentes patógenos en plantas (Harman, 2004). La identificación de esta especie y su caracterización es crucial para aplicarlo adecuadamente en el control biológico específico de patógenos en los cultivos agrícolas. Los métodos de identificación morfológica de especies de Trichoderma se han reforzados con técnicas moleculares, como la identificación de las regiones ITS1 e ITS2 separadas por el gen 5.8S del rRNA ribosomal (ITS, Internal Transcribed Spacer). El resultado es la reclasificación de cepas de este hongo (White et al., 1990; Kullnig et al., 2001; Druzhinina et al., 2006). Cepas de T. harzianum se reubicaron en especies como T. asperellum, T. atroviride y T. longibrachiatum (Lieckfeldt et al., 1999; Hermosa et al., 2000; Kullnig et al., 2001) y T. atroviride o T. viride se reubican como T. asperellum (Watanabe et al., 2005).
Trichoderma es un hongo antagonista, con mecanismos de acción en los patógenos que le permite controlar su crecimiento, y por tanto la enfermedad, por competencia directa por espacio y nutrientes, producción de metabolitos, antibióticos y parasitismo directo en los hongos (micoparasitismo) (Ezziyyani et al., 2004a). Las especies de este hongo se utilizan en el mundo para el control de enfermedades fungosas, como Trichoderma harzianum, T. asperellum, T. atroviride, T. gamsii y T. polysporum (Samuels et al., 2010; Schuster y Schmoll, 2010), porque se aíslan fácil y su crecimiento es rápido en sustratos diferentes (Howell, 2003; Ezziyyani et al., 2004a; González et al., 2012). Sin embargo, los hongos antagonistas, como Trichoderma spp., en el control de hongos patógenos que ocasionan pudriciones de raíz es limitado, porque las interacciones del antagonista con el patógeno no se han caracterizado. Los hongos fitopatógenos que causan pudriciones de raíz en los cultivos con importancia económica, forman parte de un consorcio integrado por Fusarium spp., Rhizoctonia sp., Sclerotium sp. y Pythium sp. (Bolkan, 1980). Las especies de Fusarium spp. se adaptan y desarrollan varias condiciones, por lo que su eliminación o control puede ser un gran reto (Mitra y Lele, 1981).
La hipótesis fue que la identificación y caracterización antagónica de Trichoderma spp. en hongos patógenos, causantes de pudriciones de raíz, define su eficiencia en el control biológico. Los objetivos del estudio fueron: 1) identificar la especie de las cepas de Trichoderma a través de la amplificación de las regiones ITS1 e ITS2, separadas por el gen 5.8S del ARN ribosomal (ITS, Internal Transcribed Spacer); 2) la secuenciación de los amplicones y caracterizarlas por su actividad antagónica en cepas patogénicas del cultivo de frijol (Phaseoulus vulgaris L.), como R. solani, Fusarium oxysporum, F. verticillioides y F. solani con diferente agresividad; y 3) proporcionar información para determinar si las cepas antagonistas de Trichoderma controlan eficientemente a los hongos patógenos de la raíz en este cultivo.
Materiales y Métodos
Obtención de aislados fúngicos de Fusarium spp., Rhizoctonia solani y Trichoderma spp.
El muestreo de suelo se realizó en una parcela cultivada con maíz y frijol en el ciclo primavera-verano 2013, en el Campo Experimental Bajío (CEBAJ) del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Celaya, Guanajuato (20° 34’ 33.44” N, 100° 4’ 19.24” O y 1775 msnm).
El muestreo, de 90 muestras de aproximadamente 250 g, se realizó con el método zig-zag, con tomas de muestra de suelo a 5, 10 y 15 cm de profundidad. Las muestras se diluyeron 1/1000 en agua doble destilada estéril y 0.25 mL de la dilución se agregó a cajas Petri estériles (Star® Dish) con medio agar-agua (2 %, Bioxon®) (AA). Las cajas se mantuvieron en condiciones naturales de luz y oscuridad, a 23-25 °C y se analizaron 48 y 72 h después con un microscopio compuesto, con objetivos de aumento de 40X a 400X (Leica CME®), para observar germinación de esporas o formación de colonias de hongos. De los hongos desarrollados se extrajo un fragmento de la colonia o punta de hifa, se transfirió a cajas Petri con medio papa dextrosa agar (PDA, Bioxon®) para purificarlos, identificarlos y conservarlos.
Purificación, identificación y conservación de cepas
Los aislados se purificaron por cultivo monoconidial, por suspensión conidial en medio AA. Después de 24 h se observó la germinación de conidios, y con con observación al microscopio compuesto se extrajo un conidio germinado; este se cultivó en medio PDA. Los géneros Rhizoctonia, Fusarium y Trichoderma se identificaron morfológicamente con las claves dicotómicas morfológicas de Barnett y Hunter (1988). Las especie de las cepas del genero Fusarium, se identificaron con las claves de Nelson et al. (1983). Solo las siete cepas de Trichoderma se identificaron con técnicas moleculares con la amplificación de las regiones ITS1 e ITS2, separadas por el gen 5.8S del ARN ribosomal (ITS, Internal Transcribed Spacer) (White et al., 1990; Kullnig et al., 2001; Druzhinina et al., 2006). La amplificación por PCR se realizó con los iniciadores ITS4 e ITS5 (Bellemain et al., 2010). Los fragmentos amplificados se secuenciaron por el Laboratorio de Diagnóstico Integral Fitosanitario del Colegio de Posgraduados (Campus Montecillos, Texcoco, Estado de México).
Las cepas de Fusarium spp., R. solani y Trichoderma spp. se conservaron colocando discos de colonia en tubos Falcon® de 15 mL, con aceite mineral al 100 %, a 4 °C. Las siete cepas de Trichoderma y una de R. solani se mantuvieron en estado activo en cajas Petri con PDA y las cinco cepas de Fusarium en medio de cultivo synthetic low-nutrient agar (SNA) (Spezieller Nahrstoffarmer Agar) (glucosa 0.2 g L-1, sacarosa 0.2 g L-1, KH2PO4 1.0 g L-1, KNO3 1.0 g L-1, MgSO4 7H2O 0.5 g L-1, KCl 0.5 g L-1, 1 N NaOH 0.6 mL L-1, agar 23.0 g L-1, (Nirenberg, 1976).
Cepas patogénicas y antagonistas
Cinco cepas del género Fusarium (Fsol-1, Fvert-4, Fsol-9, Foxy-23, Foxy-43) y una de R. solani se analizaron. La selección de las cepas patogénicas se estableció por pruebas de patogenicidad en plantas de frijol cv. Montcalm, que es susceptible a pudriciones de raíz (Schneider y Kelly, 2000; Cichy et al., 2007; Michcrop.com, 2016). Semillas del cv. Montcalm se germinaron en charolas con turba (Sunhine 3 Mix®), en invernadero. Quince días después de la siembra las plantas se extrajeron de las charolas, el sustrato se eliminó con agua y se les seccionó un tercio de la raíz. Diez plantas por cada cepa de Fusarium spp. se sumergieron en inóculo con 25 conidios mL-1 (Schneider y Kelly, 2000) por 4 min (Castellanos et al., 2011). Las plantas se trasplantaron en macetas con capacidad de 1 L y el sustrato mencionado antes. Granos de trigo infestados con la cepa de R. solani se utilizaron como inóculo y se aplicaron cinco granos, cada grano como unidad formadora de colonia (UFC) por cada una de las 10 plantas de frijol a los 15 días de la germinación (Mora, 1996). Las plantas inoculadas se mantuvieron en invernadero a 28-32 °C y luz natural, con riegos cada 3 días; las plantas control fueron del cv. Montcalm sin inocular. La evaluación de las plantas para ambos patógenos se realizó 28 días después de la inoculación, con la escala del CIAT (plantas con valores de 1 a 3 se consideraron resistentes; con 4 a 6 moderadamente susceptibles y con 7 a 9 susceptibles) (CIAT, 1987).
Las cepas de Trichoderma analizadas fueron siete (Tri-1, Tri-2, Tri-3, Tri-4, Tri-5, Tri-6 y Tri-7), seis de ellas (Tri-1, Tri-2, Tri-3, Tri-4, Tri-6 y Tri-7) se obtuvieron del suelo muestreado y Tri-5 la proporcionó CINVESTAV-Unidad Irapuato.
Antibiosis de Trichoderma spp.
La preselección de la capacidad inhibitoria de las cepas de Trichoderma hacia los hongos fitopatógenos se realizó con el método de papel celofán (Dennis y Webster, 1971) modificado, con un diseño al azar y tres repeticiones (cada una fue una caja Petri). La prueba determina la capacidad de Trichoderma para inhibir el crecimiento de micelio de las cepas de Fusarium spp. y R. solani. Círculos de papel filtro Whatman®, del tamaño de una caja de Petri (90 mm de diámetro), esterilizados en autoclave (121 °C por 15 min), se colocaron sobre medio de cultivo PDA, en condiciones asépticas; un disco de 7 mm de diámetro de cada cepa de Trichoderma se colocó en la parte central de la caja. Las cajas se mantuvieron a 22-25 °C por 48 h. Luego, el disco de papel se retiró cuidadosamente. El centro de la misma caja se inoculó con otro disco con el hongo fitopatógeno, las cajas se mantuvieron a la misma temperatura y por el mismo periodo. Cada día se midió el crecimiento radial (mm), hasta que el testigo (patógeno inoculado en cajas Petri, sin papel Whatman®) llenó la caja. El porcentaje de inhibición del crecimiento radial (PICR) de Fusarium y R. solani se calculó según la fórmula: PICR = [(D1-D2)/D1] X 100 (Worasatit et al., 1994); donde D1: diámetro de la colonia del patógeno en PDA sin Trichoderma y D2: diámetro de la colonia del patógeno en la caja donde antes creció Trichoderma sobre papel Whatman®. Los aislados con porcentajes mayores a 55 % se seleccionaron para la prueba de confrontaciones in vitro (Michel-Aceves et al., 2005) y definir su potencial antagónico.
El micoparasitismo que ejercen las cepas de Trichoderma se determinó con la superficie que colonizó en la caja Petri, en presencia del fitopatógeno, según la escala de Bell et al. (1982), donde: 1) Trichoderma coloniza el 100 % de la superficie del medio y crece sobre el fitopatógeno; 2) Trichoderma coloniza dos terceras partes de la superficie del medio de cultivo y limita el crecimiento del fitopatógeno; 3) Trichoderma y el fitopatógeno colonizan cada uno la mitad de la superficie, ningún hongo domina; 4) el fitopatógeno coloniza dos terceras partes de la superficie del medio y limita el crecimiento de Trichoderma; y 5) el fitopatógeno coloniza el 100 % de la superficie del medio y crece sobre Trichoderma.
Potencial antagónico de los aislamientos preseleccionados de Trichoderma
Las confrontaciones de las siete cepas de Trichoderma con las seis cepas de los patógenos se hicieron por triplicado, con la técnica de cultivos apareados en cajas Petri con PDA. Un disco colonia de 7 mm de diámetro de cada cepa de Trichoderma y otro disco colonia de los hongos fitopatógenos se colocaron equidistantes a ± 6.0 cm entre microorganismo.
El crecimiento radial de ambas colonias se cuantificó cada 24 h para determinar el número de días necesarios para que se realizara el primer contacto entre las hifas del antagonista y el patógeno. El nivel de antagonismo se clasificó con la escala de Bell et al. (1982).
Análisis estadístico
Los datos de cada bioensayo se analizaron con ANDEVA y prueba de comparación de medias de Duncan (p≤0.05); los tratamientos no relacionados se compararon para establecer un orden de méritos, con el paquete estadístico SAS, versión 9.1 (SAS Institute Inc., 2009).
Análisis filogenético
Las secuencias de los ITS se analizaron con BLAST (Basic Local Alignment Search Tool) (Morgulis et al., 2008) en el NCBI (National Center for Biotechnology Information). Los árboles filogenéticos de Trichoderma se realizaron por el método estadístico Neighbor-Joining, con el modelo de Kimura-2-parameter; los valores bootstrap se calcularon a partir de 1000 repeticiones (Chaverri et al., 2003). El alineamiento múltiple de secuencias se realizó con Clustal W del programa MEGA 7.0 (Molecular Evolutionary Genetics Analysis) (Kumar et al., 2016).
Resultados y Discusión
De las 90 muestras de suelo se identificó la especie de 42 aislamientos, de los géneros Fusarium spp., R. solani y Trichoderma spp.
Identificación de patógenos y antagonistas
Identificación de Fusarium y Rhizoctonia solani
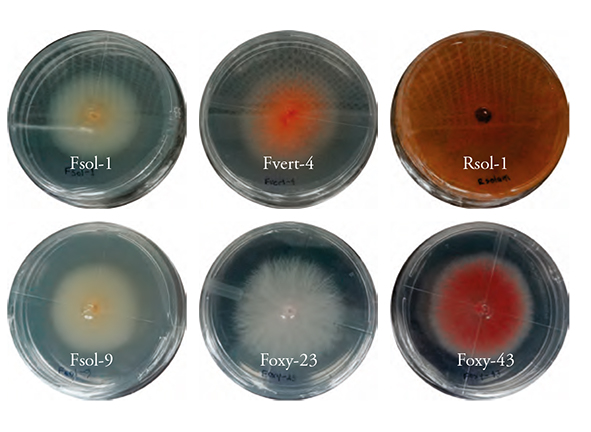
Seis cepas de hongos fitopatógenos, F. solani (Fsol-1 y Fsol-9), F. oxysporum (Foxy 23 y Foxy-43), F. verticillioides (Fvert-4), se analizaron con las claves de Nelson et al. (1983) y R. solani, según las claves dicotómicas de Barnett y Hunter (1988) (Figura 1).
Identificación morfológica de Trichoderma
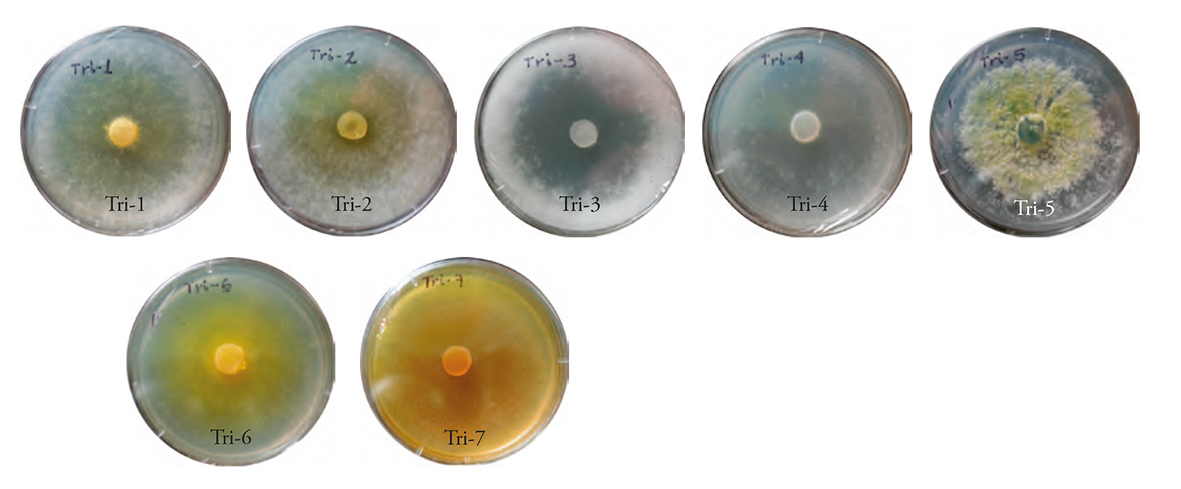
De las siete cepas se identificaron por su morfología cinco de T. harzianum y dos a T. asperellum. Las características fenotípicas en todas las cepas fueron color de los conidióforos hialino, conidios unicelulares ovoides, formando racimos terminales pequeños de color hialino o verde amarillento, y coloración de la colonia en medio de cultivo PDA. Las cepas fueron denominadas Tri-1 al Tri-7.
La colonia de las cepas Tri-1 y Tri-2 mostraron coloración blanco-amarillenta y aspecto algodonoso; en contraste, la de Tri-3 y Tri-4 fue blanca. Solo Tri-3 formó micelio con aspecto algodonoso. Tri-5 fue la única que mostró coloración verde-amarillento y Tri-6 y Tri-7 amarilla y crecimiento de micelio plano (Figura 2). Lo anterior concuerda con lo descrito por Infante et al. (2009), de que la mayoría de las colonias de Trichoderma fueron blancas, algunas se tornaron verde oscuro, verde amarillento o amarillo, el crecimiento del micelio de algunas cepas es ralo y muy fino, por lo que su apariencia fue de colonia plana (la versión impresamuestra las figuras en escala de grises y la versión eletrónica a color).
Identificación molecular de Trichoderma
Los análisis de las secuencias de ADN para la identificación molecular de las especies de Trichoderma mostraron porcentaje alto de identidad con varias muestras de T. asperellum y T. harzianum. La de Tri-3 y Tri-5 coincidió 100 % con T. asperellum; el resto de las cepas mostró 95 y 100 % de identidad con T. harzianum (Cuadro 1).
Cuadro 1 Identificación morfológica y molecular de las regiones ITS1 e ITS2 en siete cepas de Trichoderma. Todas las cepas con E-value=0.0.

*National Center for Biotechnology Information.
La identificación y caracterización antes se basaban en rasgos morfológicos. Ahora, el análisis molecular, como la secuenciación del rRNA, permite mayor precisión en la identificación de especies (Martin y Rygiewicz, 2005; Watanabe et al., 2005; Guigón-López et al., 2010). La ubicación taxonómica de las cepas es fundamental porque es el inicio para mejorar el diseño de evaluaciones de su actividad biológica y determinar el desarrollo de sus mecanismos de acción. Esta información en conjunto permite una selección eficiente de los organismos que podrían utilizarse en el biocontrol de patógenos de plantas, por su función antagonista.
El dendrograma agrupó las siete cepas de Trichoderma en dos clusters: 1) T. asperellum (Tri-3 y Tri-5), y 2) T. harzianum (Tri-1, Tri-2, Tri-4, Tri-6 y Tri-7) (Figura 3). La presencia de T. harzianum fue predominante (71.42 %) respecto a T. asperellum (28.57 %). Esto podría esperarse ya que T. harzianum es la especie aislada con frecuencia mayor en el mundo, por su adaptación y distribución cosmopolita (Chaverri y Samuels, 2003; Sosa et al., 2014).
Pruebas de patogenicidad de Fusarium y R. solani
Las plantas de frijol inoculadas con los patógenos Fusarium spp. y R. solani mostraron patogenicidad diferente, según la escala visual del CIAT (CIAT, 1987). La reacción de las plantas a Rsol-1 fue “susceptibilidad”, con promedio de 7; las plantas inoculadas con Foxy-23, Foxy-43 y Fsol-1 fueron moderadamente susceptibles, con promedio de 6 y las inoculadas con Fsol-9 y Fvert-4 moderadamente susceptibles con valor de 4 y 6, respectivamente. Las plantas testigo no mostraron daño tanto en la raíz como en el hipocotilo (Figura 4).

Figura 4 Patogenicidad de Fusarium spp. y Rhizoctonia solani en frijol cv. Montcalm. Fso-1 y Fso-9: F. solani, Fox-4: F. verticillioides, Fox-23 y Fox-43: F. oxysporum, Rsol: R. solani y testigo: sin inóculo. Las plantas muestran niveles de daño basado en la pudrición y densidad de raíz e hipocótilo, 28 días después de la inoculación. Las plantas testigo sin daño en hipocótilo y raíz mostraron densidad radicular normal.
Preselección de cepas antagonistas: Antibiosis
Los metabolitos, como quitinasas, glucanasas y otras proteínas de resistencia que producen las cepas antagónicas de Trichoderma en el medio de cultivo inhiben el crecimiento de los hongos fitopatógenos (Elad et al., 1982; Baker y Griffin, 1995; Elad, 2000; El-Katatny et al., 2001). Ese crecimiento se evalúa como porcentaje de inhibición del crecimiento micelial. El porcentaje de inhibición del crecimiento micelial de los patógenos Fusarium y R. solani por Trichoderma demuestra la presencia del mecanismo. En el presente ensayo la inhibición promedio del crecimiento micelial fue entre 72.3 y 87.5 %, y el antagonismo fue tipo 2 (Cuadro 2).
Cuadro 2 Inhibición (%) del crecimiento radial de Fusarium oxysporum, F. verticillioides, F. solani y Rhizoctonia solani por Trichoderma.
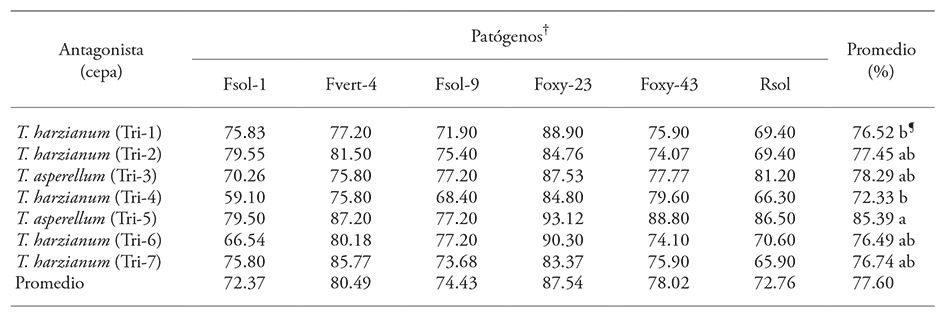
†Fsol: F. solani, Fvert: F. verticillium, Foxy: F. oxysporum, Rsol: R. solani, ¶Medias con diferente letra son estadísticamente diferentes (Duncan p≤0.05)
Trichoderma asperellum (Tri-5) inhibió más a todos los patógenos (p≤0.0001), con promedio de 85.39 %; las cepas restantes de Trichoderma no mostraron diferencia significativa y el intervalo PICR sobre los fitopatógenos fue 72.37 a 78.02 % (Figura 5, Cuadro 2). El patógeno que presentó PICR mayor por las siete cepas de Trichoderma fue F. oxysporum (Foxy-23) con promedio de 87.5 %; el patógeno que presentó menor inhibición por las cepas de Trichoderma fue F. solani (Fsol-1) con 72.37 % (Cuadro 2).

Figura 5 Porcentaje de Inhibición del Crecimiento Radial (PICR) de Fusarium spp. y Rhizoctonia solani por Trichoderma spp. en prueba de cultivos apareados.
Ya que las siete cepas en el presente estudio inhibieron más de 70 % el crecimiento micelial de Fusarium spp. y R. solani, es probable que haya participación de enzimas hidrolíticas en la reacción inhibitoria (Yedidia et al., 2000; dos Reis-Almeida et al., 2007) por lo que puede postularse a estas cepas como inhibidoras potenciales de hongos fitopatógenos de suelo. Otros estudios en campo e invernadero permitirán validar su efecto antagónico en otros cultivos de importancia agrícola.
El PICR de los patógenos de las cepas nativas de antagonistas, en la prueba de preselección, fue superior a 70 %; esto mostró su potencial para confrontar los patógenos al inhibir el crecimiento radial y puede deberse a que las cepas nativas de Trichoderma compiten con los patógenos en el mismo nicho ecológico (Andrews, 1992).
Confrontaciones entre Trichoderma spp., Fusarium spp. y R. solani
El PICR de las siete cepas de Trichoderma sobre los hongos patógenos fue variable y dependió de los organismos involucrados en la confrontación (p≤0.0001). Los valores medios fueron 69.84 a 82.05 % (Figura 5). Las cepas de Trichoderma en conjunto inhibición de 74.1 % sobre los patógenos (Figura 5). Destacó PICR de Rsol-1, que se obtuvo de la acción de las cepas de Trichoderma, con 69.84 %. Esto puedo deberse a la velocidad de crecimiento micelial de Rsol-1 similar a Trichoderma. En todas las confrontaciones ambos hongos compitieron por espacio y nutrientes y fue notable el contacto del antagonista con el patógeno, donde Trichoderma colonizó los patógenos F. solani y R. solani. T. asperellum (Tri-5) inhibió el crecimiento vegetativo de F. solani (Fsol-1) (Figura 6A) y R. solani (Figura 6B) mostró hiperparasitismo ya que invadió prácticamente todas las colonias de ambos patógenos y esporuló sobre ellas. Trichoderma harzianum (Tri-6) también colonizó a R. solani (Rsol-1) (Figura 6C) y F. solani (Fsol-1) (Figura 6D); pero, la invasión fue menor que en T. asperellum, y sólo inhibió el crecimiento del fitopatógeno.
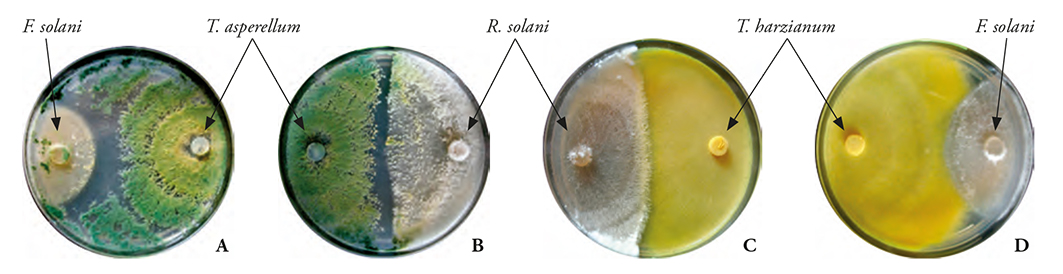
Figura 6 Confrontación de T. asperellum (Tri-5) y T. harzianum (Tri-6) sobre Fusarium solani (Fsol-1) y R. solani. Donde A: T. asperellum sobre F. solani, mostró un micoparasitismo total a los 9 días después de la inoculación; B: mostró micoparasitismo casi total de T. asperellum sobre R. solani a los 7 días de la inoculación; C: micoparasitismo de T. harzianum sobre R. solani a los 7 días de la inoculación; D: Colonización de T. harzianum sobre F. solani a los 10 días de la inoculación. Las flechas en color rojo indican el límite de micoparasitismo de Trichoderma spp. en los hongos patógenos.
Los resultados de las siete cepas de Trichoderma, confrontadas contra Fusarium, se ubicaron en el grado 1 de antagonismo de la escala de Bell et al. (1982). Todas las cepas de Trichoderma colonizaron 100 % de la superficie del medio creciendo sobre los fitopatógenos F. solani, F. oxysporum y F. verticillioides 10 días después de la inoculación. Esto evidenció la capacidad antagónica alta de los aislamientos. El antagonismo entre Trichoderma y R. solani se ubicó también en el grado 1, 7 días después de la inoculación. La inhibición de este último fue mayor a 90 %, con masas de esporas sobre el hongo patógeno, más allá de la línea divisoria entre Trichoderma y R. solani (Figura 6B). Esto indicó que todas las cepas de Trichoderma pueden crecer rápido aún en presencia de patógenos con alta agresividad, como R. solani. Esta característica evidenció el potencial antagónico y mostró que a mayor superficie colonizada por el antagonista mayor será el dominio sobre el patógeno. También, conferirá ventaja competitiva por el espacio antes de mostrar su potencial tóxico y micoparasítico en condiciones in vitro (Küçük, y Kivanç, 2004). Lo anterior permite plantear que el antagonismo entre microorganismos dependerá de la acción biotrófica o necrotrófica del antagonista, producción de enzimas extracelulares, correspondientes a la composición y estructura de las paredes celulares de los hongos parasitados y virulencia del patógeno (Infante et al., 2009).
La actividad para el antagonismo de Trichoderma no fue estadísticamente diferente (medias PICR de 73.1 a 76.4 %). La coincidencia en el intervalo de medias de PICR, entre las siete cepas nativas de Trichoderma, puede deberse a la coadaptación de los antagonistas con los hongos patógenos, pues todos los microorganismos en este estudio provenían de climas y hábitat similares (Andrews, 1992). La capacidad alta de inhibición del crecimiento micelial de las cepas de Trichoderma permite destacar su eficiencia sobre los hongos causantes de enfermedades radiculares y confirma que la coadaptación de hongos antagonistas y hongos patógenos se requiere para que lo anterior se cumpla (Baker y Cook, 1974).
Las confrontaciones que tuvieron interacción ocurrieron rápido (3 a 4 días después del primer contacto). Las cepas de Trichoderma invadieron a las de los patógenos (Figura 7). Estos resultados son similares a los observados por Ezziyyani et al. (2004b), quienes encontraron que la zona de intersección de T. harzianum frente a P. capsici aumentó con el tiempo, y este evento lo acompañó la destrucción de micelio de P. capsici. Kexiang et al. (2002) indicaron que la zona de intersección por los antagonistas (T. harzianum y T. atroviride) y la inhibición de crecimiento micelial del patógeno (Botryosphaeria berengeriana f. sp. piricola) aumentó con el tiempo, y el crecimiento del micelio del patógeno se suprimió por micoparasitismo.
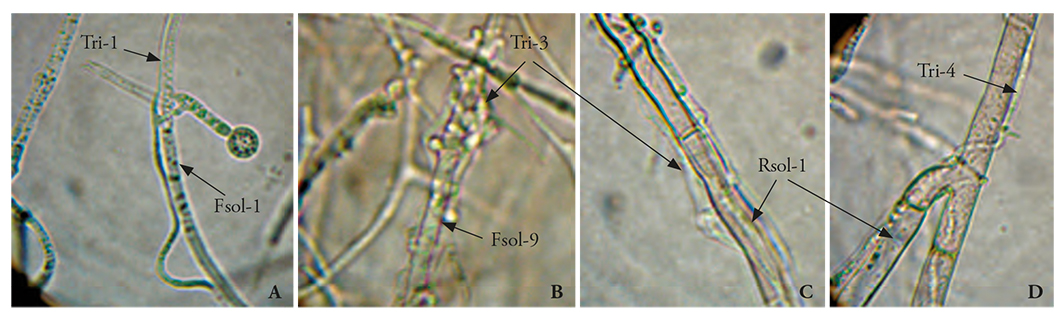
Figura 7 Micoparasitismo de Trichoderma spp. en pruebas de cultivos duales. A) Tri-1 vs. Fsol-1 (100X); B) Tri-3 vs. Fsol-9 (100X); C) Tri-3 vs. R. solani (400X); D) Tri-4 vs. R. solani (400X).
El nivel de antagonismo está dado principalmente por el mecanismo de micoparasitismo. Los resultados de nuestro estudio fueron similares a los de Michel-Aceves et al. (2013), quienes documentaron que la inhibición de 6 de 12 aislados de Trichoderma fue de 10 a 94.4 % del crecimiento radial de Sclerotium rolfsii. El micoparasitismo de Trichoderma sobre los patógenos fue notable; en general, las siete cepas de Trichoderma parasitaron a los cinco patógenos; pero las cepas de T. asperellum (Tri-3 y Tri-5) mostraron formación mayor de haustorios sobre las hifas de Fusarium spp. y R. solani. Las formas de parasitar de Trichoderma spp. sobre los patógenos se observó con microscopio. Las hifas de T. harzianum (Tri-1) se adhirieron a las hifas y fiálides de F. solani (Fsol-1) (Figura 7A), formaron haustorios y penetraron la hifa; mientras que T. asperellum (Tri-3) formó gran cantidad de haustorios en hifas de Fsol-9 y parasitó y comprimió (Figura 7B). Las hifas de T. asperellum (Tri-3) penetraron, formando haustorios sobre hifas de R. solani (Figura 7C); T. harzianum (Tri-4) formó haustorios, penetró y creció como parásito dentro de hifas de R. solani 10 a 12 días después del inicio de la confrontación (Figura 7D). Michel-Aceves et al., 2005) mencionaron que existe una correlación positiva entre la cantidad de enzimas y el porcentaje de micoparasitismo por el antagonista, y la reducción de la enfermedad en plantas afectadas. Esto coincide con lo que se observó con las cepas de T. asperellum y T. harzianum; T. asperellum formó más haustorios, con lo que facilitó la entrada y el micoparasitismo de las hifas del patógeno; para T. harzianum se especula que no hubo reconocimiento suficiente entre Trichoderma y el patógeno, mediante la interacción de lectinas-carbohidratos, las cuales aglutinan células que interaccionan con la superficie celular del patógeno y propician micoparasitismo (Infante et al., 2009); por tanto, no existió el mismo nivel de micoparasitismo que con T. asperellum.
Los resultados de patogenicidad y antagonismo mostraron significancia (r=0.41, p=0.05); R. solani mostró patogenicidad mayor en planta y fue el patógeno con menor inhibición in vitro por las cepas de Trichoderma. Los antagonistas y patógenos inoculados en las plantas de frijol tendrían comportamiento similar al que se presentó en las confrontaciones in vitro; por lo que, estas confrontaciones son una herramienta de aproximación para definir el nivel de control biológico de las especies de Trichoderma ante la presencia de hongos patógenos del suelo.
Conclusiones
Las siete cepas de T. harzianum y T. asperellum identificadas morfológicamente y molecularmente mostraron niveles diferentes micoparasitismo en confrontaciones con los patógenos de raíz de frijol Fusarium spp. y R. solani. La cepa Tri-5 T. asperellum destacó por la inhibición mayor de crecimiento micelial y radial. El PICR promedio de la acción de todas las cepas de Trichoderma sobre Rsol-1 fue inferior al promedio general, pero T. asperellum por su capacidad antagónica fue capaz de invadir al patógeno en 90 %. Esta característica se corroboró por la formación de más haustorios por T. asperellum, que facilitaron la entrada y el micoparasitismo de las hifas del patógeno.











 texto em
texto em