Introducción
La fresa (Fragaria×ananassa Duch.) es una planta de la familia Rosaceae y destaca por su contenido de vitamina C, taninos, flavonoides, antocianinas, catequina, quercetina, kaempferol y ácidos orgánicos (Kessel, 2012). El cultivo de la fresa tiene importancia socioeconómica para México, por su gran demanda de mano de obra y porque genera una proporción considerable de los ingresos por exportaciones frutícolas (Sánchez, 2008).
Los principales estados productores de fresa en México son Michoacán con 5896 ha y Baja California con 2273.30 ha sembradas (SIAP, 2014). En la región de Zamora, Michoacán, las variedades más cultivadas son Festival con 32 % de la superficie total, Camino Real con 28 % y Aromas con 20 %. En la zona Norte-Centro de México, las variedades Camino Real, Camarosa y Festival cubren 97 % de la superficie total (Sánchez, 2008).
El género Phytophthora es un oomiceto, está entre los principales agentes causales de enfermedad y es el responsable directo de pérdidas económicas altas en el cultivo de la fresa. La humedad relativa elevada, humedad abundante del suelo y la temperatura de 25 a 30 °C aumentan la severidad de Phytophthora capsici (Granke et al., 2012; Sanogo y Bosland, 2013; Callaghan et al., 2016). Las plantas hospedantes infestadas con Phytophthora spp. muestran frecuente marchitamiento, clorosis y resquebrajamiento de tallo, por lo que se debilitan, son susceptibles a otros patógenos y mueren (Dorantes et al., 2008).
Los exudados de la raíz de plantas de fresa colonizadas con Hongos Micorrízicos Arbusculares (HMA) reducen la esporulación de Phytophthora fragariae (Norman y Hooker, 2000). En plantas de fresa micorrizadas hay tolerancia a la marchitez causada por Fusarium oxysporum, pero se conoce poco de los mecanismos de tolerancia a la enfermedad en plantas micorrizadas (Matsubara et al., 2012). La micorriza arbuscular y las bacterias promotoras de crecimiento vegetal (PGPR’s) tienen efecto protector contra enfermedades causadas por algunos patógenos de raíz como Phytophthora capsici, Erwinia carotovora y Pseudomonas syringae (Dorantes et al., 2008).
El objetivo de este estudio fue evaluar la premicorrización con Rhizophagus intraradices e inoculación con las rizobacterias Pseudomonas tolassi, Bacillus pumilus, y Paenibacillus sp. en la supresión de la marchitez causada por P. capsici en fresa. Dado que la inoculación de los microorganismos biocontroladores por separado reduce la incidencia del oomiceto, se hipotetizó que la inoculación conjunta aumentará su efectividad al disminuir la incidencia y severidad de la marchitez en plantas de fresa infestadas con P. capsici.
Materiales y Métodos
Esta investigación se realizó en dos fases: La primera en laboratorio y la segunda en cámara de ambiente controlado (Sherer® Modelo CEL 37-14, Gillet Marshall Mich. USA).
Material biológico
Las plantas de fresa de la variedad Festival se adquirieron en la empresa Insumos Agrícolas para Invernadero INAPI, de Irapuato, Guanajuato.
Las cepas bacterianas (Pseudomonas tolassi, B. pumilus y Paenibacillus sp.) y el hongo micorrízico arbuscular (R. intraradices) fueron proporcionados por el área de Microbiología de Suelos, del Postgrado de Edafología del Colegio de Postgraduados, Campus Montecillo.
Phytophthora capsici cepa PcT17 empleada en este experimento fue proporcionada por la Universidad Michoacana de San Nicolás de Hidalgo.
Patogenicidad de Phytophthora capsici cepa PcT17en fresa
Ocho plantas de fresa de la variedad Festival con tres y cuatro hojas se inocularon (8 d después del trasplante) con 200 000 zoosporas por planta, para mostrar la patogenicidad del oomiceto en esta variedad de fresa bajo condiciones de invernadero.
Primera fase: Capacidad antagónica in vitro de tres cepas de rizobacterias hacia Phytophthora capsici
La primera fase fue una prueba de antagonismo mediante confrontación in vitro de las rizobacterias de P. tolassi, B. pumilus, y Paenibacillus sp. contra P. capsici. Las rizobacterias se cultivaron en agar nutritivo por 48 h a 27 °C y la cepa P. capsici se desarrolló en medio V8 (jugo de ocho verduras: carbonato de calcio: agar) a 27 °C durante 10 d.
Prueba in vitro
El crecimiento micelial de P. capsici in vitro se evaluó con la técnica de cultivos duales descrita por Landa et al. (1997). Discos de medio V8 de 5 mm, con crecimiento activo del oomiceto, se colocaron en el centro de una caja Petri con medio V8. Al mismo tiempo, las bacterias se sembraron de forma individual en línea recta, a una distancia de 3 cm del disco con contenido micelial. Los cultivos se incubaron 5 d a 28 °C. El testigo fue un disco de 5 mm de medio V8 con crecimiento micelial, pero sin inóculo bacteriano.
Tratamientos y diseño experimental
El experimento tuvo cuatro tratamientos, 1) P. toolassi confrontada con P. capsici, 2) B. pumilus confrontada con P. capsici, 3) Paenibacillus sp. confrontada con P. capsici y, 4) Testigo. El diseño experimental fue completamente al azar y cada tratamiento tuvo cuatro repeticiones. La unidad experimental fue una caja Petri.
El porcentaje de inhibición se calculó con la siguiente fórmula (Landa et al., 1997):
donde r es el radio de P. capsici y R es el radio máximo del oomiceto sin la bacteria.
Segunda fase: Prueba en ambiente controlado
Plantas de fresa de la variedad Festival de tamaño uniforme, se desinfectaron 3 min con hipoclorito de sodio al 1 % y se enjuagaron tres veces con agua destilada estéril. Cada planta se transfirió a un contenedor de 400 cm3 que fue la unidad experimental.
El sustrato fue una mezcla de peat moss, agrolita y vermicomposta (4:4:2 v/v/v), esterilizada dos veces en autoclave a 120 °C por 2 h. Las plantas se regaron con agua estéril según lo requirieron y cada semana se adicionó solución nutritiva Long Asthon modificada para aplicar 11 mg de P L-1 (Hewitt, 1966).
Las plantas de fresa se inocularon 8 d después del trasplante con 0.5 g de raíces de sorgo colonizadas en 80 a 85 % con R. intraradices, y 1 mL de la suspensión bacteriana compuesta por P. toolassi, B. pumilus y Paenibacillus sp. a una concentración de 108 UFC mL-1. Las plantas de fresa con y sin inóculo se colocaron en una cámara de ambiente controlado (Sherer Modelo CEL 37-14, Gillet Marshall Mich. USA), con una temperatura constante de 26 °C.
Multiplicación e inoculación de Phytophthora capsici
Cultivos de P. capsici con 10 d de crecimiento en medio V8 se adicionaron con 10 mL de solución de cloruro de sodio al 0.9 % (AbbottMR) por caja Petri durante 10 min. La solución isotónica se decantó, se dividió en cuatro partes y cada una se colocó en una caja Petri estéril. Después se agregó agua destilada estéril y se colocaron los cultivos de P. capsici bajo luz blanca fría a 26 °C por 48 h, y a 28 °C en oscuridad por 24 h.
Las cajas Petri con P. capsici se colocaron 30 min a 4 °C y después 30 min a 28 °C para favorecer la liberación de zoosporas. El contenido de cada caja Petri se vació en un recipiente y se contó el número de zoosporas con un citómetro (Marienfeld). La suspensión de zoosporas se ajustó a 200 000 zoosporas mL-1.
El oomiceto se inoculó en las plantas de fresa 45 d después de la inoculación de los microorganismos biocontroladores, añadiendo 1 mL de la suspensión por contenedor. Las plantas inoculadas se mantuvieron 5 d en suelo a saturación para favorecer el desplazamiento del oomiceto. Este experimento se repitió dos veces.
Incidencia y severidad de la enfermedad
La incidencia (número total de plantas marchitas por el fitopatógeno respecto al total expresada en porcentaje) y severidad de la enfermedad se registró a los 5, 10, 15 y 20 d con respecto a la inoculación del patógeno. La severidad se evaluó usando la escala modificada de Adorada et al., (2000), que asigna valores de 1 a 5 según el grado de marchitez de la planta: 1=0 % de hojas marchitas; 2=1-25 % de hojas marchitas; 3=26-50 % de hojas marchitas; 4=51-75 % de hojas marchitas; 5=76-100 % de hojas marchitas o muerte.
La severidad de la enfermedad (SE) se expresó como una proporción (porcentaje) de acuerdo con la fórmula de Adorada et al., (2000):
Área foliar, peso de la biomasa seca de la parte aérea, volumen radical y número de estolones
El área foliar se registró de manera directa con un medidor de área foliar (Area Meter, Modelo LI-3100; Nebraska, EE.UU.). El peso de la biomasa seca de la parte aérea se determinó secando las muestras en un horno (FELISA, Modelo 242-A) a 70 °C por 72 h y se pesaron en una balanza analítica (Acculab, Modelo ALC-104). El volumen radical se evaluó por desplazamiento de agua, al sumergir el sistema radical en una probeta graduada de 100 mL. El número de estolones se determinó en cada tratamiento. Todas las variables se evaluaron al finalizar el experimento.
Determinación de nitrógeno (N) y fósforo (P)
El N y P se determinaron en el laboratorio de Fertilidad de Suelos del Colegio de Postgraduados. El N por el método semimicro-kjeldahl (Bremner, 1975) y el P mediante fotocolorimetría por reducción con Molibdo-vanadato.
Determinación de colonización micorrízica
La colonización micorrízica se determinó con el método de clareo y tinción de raíces (Phillips y Hayman, 1970).
La frecuencia de la colonización micorrízica en raíces de fresa se determinó con el método de Biermann y Linderman (1981) y se expresó en porcentaje.
Diseño experimental y tratamientos
El diseño experimental fue completamente al azar, con ocho tratamientos y seis repeticiones cada uno. Los tratamientos fueron: 1) Testigo negativo (sin inocular), 2) Testigo positivo (inoculado solo con P. capsici), 3) Plantas inoculadas con PGPR’s (Pseudomonas tolassi, Bacillus pumilus, y Paenibacillus sp.), 4) Plantas inoculadas con PGPR’s+P. capsici, 5) Plantas inoculadas con R. intraradices, 6) Plantas inoculadas con R. intraradices+P. capsici, 7) Plantas inoculadas con PGPR’s+R. intraradices y, 8) Plantas inoculadas con PGPR’s+R. intraradices+P. capsici. La unidad experimental fue una maceta de 400 cm3 con una planta.
Con los datos se realizó un ANDEVA, las medias de los tratamientos se compararon con la prueba de Tukey (p>0.05), y se usó SAS Versión 9.0 (SAS Institute, 2002).
Resultados y Discusión
Primera fase: Capacidad antagónica in vitro de P. tolassi, B. pumillus y Paenibacillus sp. hacia Phytophthora capsici
Las tres cepas bacterianas tuvieron efecto antagónico contra P. capsici (Cuadro 1 y Figura 1). P. tolassi y B. pumillus inhibieron el crecimiento del oomiceto en 54 %, y Paenibacillus sp. en 43 %. Estos resultados sugieren que las rizobacterias probablemente producen metabolitos secundarios que se difunden a través del agar e inhiben el crecimiento del fitopatógeno. Landa et al. (1997) reportan que algunas cepas de Pseudomonas producen metabolitos secundarios que se difunden en el agar causando la inhibición de Fusarium spp. Además, algunas especies de Bacillus ejercen un efecto antagónico debido a la producción de enzimas líticas, antibióticos o metabolitos, o ambos, que originan cambios en la membrana citoplasmática (Sicuia et al., 2015; Ramyabharathi y Raguchander, 2014).
Cuadro 1 Inhibición del crecimiento micelial in vitro de Phytophthora capsici causada por tres cepas de rizobacterias, después de cinco días de cocultivo.
| Cepa rizobacteriana | Inhibición del oomiceto (%) |
| Pseudomonas tolassi | 54.93±0.09 a |
| Bacillus pumilus | 54.12±0.89 a |
| Paenibacillus sp. | 43.11±0.05 a |
| Testigo | 0 b |
a, b Medias con letras distintas en una columna son estadística mente diferentes (p≤0.05). ± desviación estándar; n: 4 repeticiones por tratamiento.
Segunda fase: Prueba en ambiente contralado
Incidencia y severidad de la enfermedad
A los 0 y 3 d no se observó incidencia de la enfermedad. Las plantas inoculadas sólo con el patógeno presentaron 83 % de incidencia de la enfermedad al final del experimento. Sin embargo, las plantas preinoculadas con PGPR’s o R. intraradices mostraron 50 y 33 % de incidencia, respectivamente. La manifestación de la enfermedad en las plantas inoculadas con PGPR’s+R. intraradices fue 33 % (Figura 2).
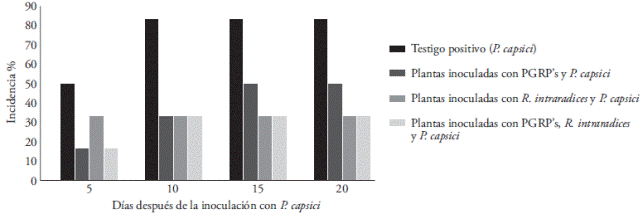
Figura 2 Incidencia de la enfermedad causada por Phytophthora capsici en plantas de fresa preinoculadas con Rhizophagus intraradices y PGPR’s. La incidencia se registró a los 5, 10, 15 y 20 d después de la inoculación con el oomiceto fitopatógeno. Cada punto corresponde al promedio de seis plantas.
La severidad de la enfermedad comenzó a manifestarse en las plantas no inoculadas con los microrganismos benéficos, cinco días después de la inoculación del patógeno. Al final del experimento la severidad de la enfermedad en las plantas testigo positivo fue 63 %, pero las plantas preinoculadas con PGPR’s mostraron 37 % de severidad (Figura 3), debido posiblemente a la inducción de resistencia sistémica (Nadeem et al., 2014), o al competir por nutrientes y nicho (Ochoa et al., 2010).
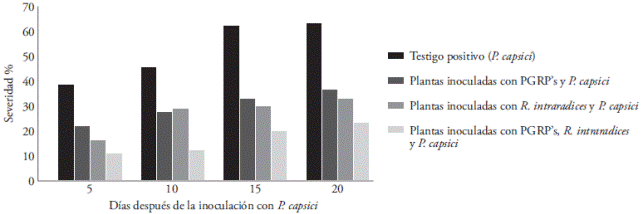
Figura 3 Severidad de la enfermedad causada por Phythophthora capsici en plantas de fresa preinoculadas con Rhizophagus intraradices y PGPR’s. La severidad se registró a los 5, 10, 15 y 20 d después de la inoculación con el oomiceto fitopatógeno. Cada punto corresponde al promedio de seis plantas.
Las plantas inoculadas con R. intraradices mostraron 33 % de severidad. Alarcón et al. (2000) indican que además del beneficio nutrimental de la simbiosis, los HMA también participan como agentes de control biológico de patógenos de hábito radical.
Las plantas inoculadas con PGPR’s+R. intraradices presentaron menor severidad (23 %) (Figura 3). Los HMA y las rizobacterias actúan sinérgicamente estimulando el crecimiento de las plantas y la inhibición del oomiceto fitopatógeno (Figura 4). Las PGPR’s estimulan el crecimiento de HMA (Linderman, 1993), el desarrollo radicular, una mayor susceptibilidad de la raíz a la colonización de hongos micorrízicos, y la mejora del proceso de reconocimiento entre la raíz y los hongos (Artursson et al., 2006; Bonfante y Anca, 2009).

Figura 4.Respuesta de plantas de fresa variedad comercial Festival, premicorrizadas con Rhizophagus intraradices e inoculadas con PGPR’s, al ataque de Phytophthora capsici. Plantas sin inocular (T1), plantas inoculadas con P. capsici (T2), plantas inoculadas solo con PGPR’s (T3), plantas inoculadas con PGPR’s+ P. capsici (T4), plantas inoculadas solo con R. intraradices (T5), plantas inoculadas con R. intraradices + P. capsici (T6), plantas inoculadas con R. intraradices + PGPR’s (T7) y plantas inoculadas con R. intraradices, PGPR’s+ P. capsici (T8).
Las PGPR’s suprimen enfermedades producidas por microorganismos fitopatógenos mediante la producción de sideróforos, síntesis de antibióticos, enzimas o compuestos fungicidas o ambos (Lugtenberg y Kamilova, 2009). Por ejemplo, Pseudomonas y Bacillus pueden controlar patógenos, sobre todo hongos, sintetizando moléculas antifúngicas (Whipps, 2001). Las bacterias del género Pseudomonas inducen resistencia en la planta al incrementar la velocidad y los niveles de síntesis de fitoalexinas, substancias implicadas directamente en la defensa de la planta (Lemanceau y Alabouvette, 1993).
Área foliar, peso de biomasa seca de la parte área, volumen radical y número de estolones
Las plantas inoculadas con PGPR’s+R. intraradices mostraron mayor área foliar (239.95 cm2), peso de biomasa seca (6.24 g) y volumen radical (2.1 mL) (Cuadro 2). Estos resultados coinciden con lo reportado por Vosatka et al. (2000) y Linderman (1993), quienes mencionan que el uso de simbiontes mutualistas en conjunto (fijadores de nitrógeno de vida libre como Pseudomonas y Bacillus) repercute en el aumento del crecimiento y producción de plantas. Además, la asociación simbiótico-mutualista en raíces de plantas frutícolas produce diversos cambios o modificaciones fisiológicos y sobresale el aumento en la actividad fotosintética debido a la mayor capacidad de fijación de CO2 (Alarcón y Ferrera-Cerrato, 2000); por lo tanto, aumentan las tasas de biomasa seca producida (Alarcón et al., 2000). Según Díaz et al. (2013), la simbiosis con HMA aporta beneficios en la planta hospedante, como aumento del crecimiento y mayor nutrición mineral.
Cuadro 2 Variables de crecimiento de plantas de fresa premicorrizadas e inoculadas con PGPR’s (Pseudomonas tolassi, Bacillus pumilus y Paenibacillus sp.) en respuesta al ataque de Phytophthora capsici.
| Tratamiento | Área foliar (cm2) | Materia seca (g) | Volumen radical (mL) |
| Testigo negativo (sin inocular) | 170.74±30.92 ab | 5.80±0.26 ab | 0.90±0.12 bc |
| Testigo positivo (inoculado con P. capsici) | 93.77±5.64 b | 5.24±0.28 b | 0.33±0.08 c |
| Plantas inoculadas con PGPR’s | 174.92±19.24 ab | 5.56±0.13 ab | 0.90±0.12 bc |
| Plantas inoculadas con PGPR’s y P. capsici | 189.28±27.26 ab | 5.97±0.17 ab | 0.90±0.15 bc |
| Plantas inoculadas con R. intraradices | 189.72±10.36 ab | 5.54±0.20 b | 1.36±0.17 b |
| Plantas inoculadas con R. intraradices y P. capsici | 128.36±17.97 b | 5.54±0.21 ab | 0.80±0.10 bc |
| Plantas inoculadas con PGPR’s y R. intraradices | 239.95±24.29 a | 6.24±0.19 a | 2.10±0.31 a |
| Plantas inoculadas con PGPR’s, R. intraradices y P. capsici | 167.43±27.85 ab | 5.60±0.22 ab | 0.80±0.10 bc |
Medias con letras diferentes en una columna son estadísticamente diferentes (p≤0.05). ± desviación estándar; n: 6 repeticiones por tratamiento.
El crecimiento y la nutrición de las plantas (Cuadro 2) fue mejorada por la producción rizobacteriana de reguladores del crecimiento, como lo reportan Molina-Romero et al. (2015). Las plantas inoculadas con PGPR’s+R. intraradices produjeron cinco estolones, las plantas inoculadas con R. intraradices tres, y las plantas inoculadas con PGPR’s, solo uno. Este resultado puede deberse a la síntesis de reguladores del crecimiento como giberelinas y citocininas (Alarcón et al., 2000). En los otros tratamientos no hubo producción de estolones.
Contenido de nitrógeno (N) y fósforo (P)
La concentración de N y P en el follaje no fue diferente (p>0.05) entre tratamientos (Cuadro 3), aunque las PGPR’s facilitan el crecimiento de las plantas proveyendo directamente N, P y minerales esenciales (Ahemad y Kibret, 2014). Las PGPR’s pueden fijar el N atmosférico debido a la presencia de la enzima nitrogenasa y así tornan accesible este N para las plantas con las cuales se asocian (Gupta et al., 2015). Las tres especies de PGPR’s usadas en nuestro estudio (B. pumilus, P. tolassi y Paenibacillus sp.) están reportadas como bacterias no simbióticas fijadoras de N (Hernández et al., 2009; Glick et al., 2007; Fernandes et al., 2014). No hubo diferencias significativas en la concentración de N en el follaje y el valor numéricamente más alto (1400 mg kg-1) se presentó en las plantas inoculadas solo con las PGPR’s. Las PGPR’s fijadoras de N no simbióticas suplen solo pequeñas cantidades del N fijado a la planta hospedera (Glick, 2012). Además, el bajo aporte de N vía bacteriana es afectado por las condiciones ambientales, como altas concentraciones de O2 en la atmosfera del suelo, las cuales inhiben a la nitrogenasa (Alquéres et al., 2010), o altas concentraciones de H2 y NO que compiten con el sustrato de la nitrogenasa (Hichri et al., 2015; Gabrielyan et al., 2015). La inoculación del HMA y las PGPR’s no aumentaron (p>0.05) el P en el follaje debido a su alta reactividad con Fe, Al y Ca y a su consecuente precipitación. Los rangos de precipitación pueden ser hasta 90 % (Adesemoye et al., 2008); además, el suelo y las condiciones ambientales impactan en la eficiencia de las PGPR’s y los HMAs (Adesemoye et al. (2008).
Cuadro 3 Concentración de N y P en plantas de fresa premicorrizadas e inoculadas con PGPR’s en respuesta al ataque de Phytophthora capsici.
| Tratamiento | Nitrgeno (N) mg kg-1 | Fósforo (P) mg kg-1 |
| Testigo negativo (sin inocular) | 1.18±0.09 | 0.73±0.10 |
| Testigo positivo (inoculado con P. capsici) | 0.97±0.11 | 0.62±0.18 |
| Plantas inoculadas con PGPR’s | 1.40±0.12 | 0.63±0.15 |
| Plantas inoculadas con PGPR’s y P. capsici | 0.83±0.15 | 0.43±0.06 |
| Plantas inoculadas con Rhizophagus intraradices | 0.93±0.11 | 0.68±0.05 |
| Plantas inoculadas con R. intraradices y P. capsici | 1.38±0.17 | 0.63±0.08 |
| Plantas inoculadas con PGPR’s y R. intraradices | 0.90±0.10 | 0.58±0.11 |
| Plantas inoculadas con PGPR’s, R. intraradices y P. capsici | 1.37±0.15 | 0.64±0.09 |
No hay diferencias estadísticas entre tratamientos (p>0.05). ± desviación estándar; n: 4 repeticiones por tratamiento.
En plantas inoculadas con HMA+PGPR’s se registró el mayor crecimiento. Los géneros Pseudomonas, Azotobacter y Bacillus liberan ácido indol-acético (AIA), giberelinas o citoquininas en la rizosfera de las plantas y ejercen un efecto estimulador del crecimiento, en especial si están en estado de plántula (Lugtenberg y Kamilova, 2009). Además, algunas PGPR’s producen enzimas que favorecen crecimiento y desarrollo de la planta, mediante la disminución de los niveles de etileno. Tales bacterias ocupan el etileno, precursor ACC, y lo convierten en 2 oxobutanoato y NH3 (Glick et al., 2007).
Colonización micorrízica
En la colonización micorrízica total no hubo diferencia estadística entre los tratamientos. El valor numérico más alto (70 %) se registró en el tratamiento de plantas premicorrizadas con R. intraradices e inoculadas con PGPR’s, y el más bajo (39.75 %) en las plantas inoculadas con R. intraradices+P. capsici (Cuadro 4). Frey-Klett et al. (2007) reportan el involucramiento de diferentes géneros de PGPR’s del suelo en el proceso de colonización micorrizica; a este grupo de PGPR’s se les denomina bacterias ayudadoras de la micorrización. Los porcentajes más altos de colonización total, vesículas e hifas en nuestro experimento se obtuvieron cuando se inocularon las PGPR’s (Cuadro 4). Probablemente, estas bacterias promovieron la colonización micorrizica, pero no la esporulación en las plantas de fresa.
Cuadro 4 Porcentaje de colonización micorrízica en plantas de fresa inoculadas con Rhizophagus intraradices, PGPR’s y Phytophthora capsici en cámara de ambiente controlado.
| Tratamiento | Colonizción micorrízica total (%) | Vesíclas (%) | Hifas (%) | Esporas (%) |
| Plantas inoculadas con R. intraradices | 59.00±2.50 | 20.00±2.82 | 19.00±2.00 | 20.00±3.96 |
| Plantas inoculadas con R. intraradices y P. capsici | 39.75±1.65 | 24.75±4.52 | 13.00±2.39 | 2.00±1.58 |
| Plantas inoculadas con PGPR’s y R. intraradices | 70.00±0.66 | 43.00±2.30 | 19.00±1.30 | 8.00±0.84 |
| Plantas inoculadas con PGPR’s, R. intraradices y P. capsici | 55.00±1.02 | 43.00±1.95 | 8.00±1.87 | 4.00±0.55 |
No hay diferencias estadísticas entre tratamientos (p>0.05). ± desviación estándar; n: 5 repeticiones por tratamiento.
Las vesículas fueron las estructuras predominantes y el número fue el mismo en las plantas inoculadas con R. intraradices y plantas inoculadas con PGPR’s+R. intraradices (Figura 5).
Conclusiones
Phytophthora capsici cepa PcT17 fue patogénica para las plantas de fresa de la variedad comercial Festival. Las PGPR’s (Pseudomonas tolassi, Bacillus pumilus y Paenibacillus sp.) inhibieron el crecimiento in vitro del oomiceto. Rhizophagus intraradices y las PGPR’s (Pseudomonas tolassi, Bacillus pumilus y Paenibacillus sp.) redujeron la incidencia y severidad de Phytophthora capsici bajo condiciones controladas.
En el tejido vegetal aéreo no aumentó la concentración de N y P, lo cual es contrario a lo reportado en otros estudios. El mayor crecimiento en las plantas inoculadas con HMA y PGPR’s probablemente se debe a la producción de reguladores del crecimiento vegetal, lo cual está documentado en los géneros Pseudomonas y Bacillus.











 texto en
texto en 




