Introducción
México es el mercado más grande de maíz (Zea mays L.) en el mundo y consume 11 % de la producción mundial. Del año 2014 al 2015, las importaciones de maíz en México fueron 10 millones Mg, y ocupa el segundo lugar como país importador en el mundo. La producción total de maíz fue 37.1 millones Mg, lo cual es aproximadamente 33 % del valor total de producción del sector agrícola (SIAP-SAGARPA, 2015)3.
En el cultivo de maíz, las arvenses compiten por agua, nutrientes del suelo y luz solar, principalmente en las fases iniciales del cultivo, cuando la plántula de maíz es más sensible a la competencia, debido a su sistema radicular reducido y área foliar escasa.
El vigor temprano de las plántulas de maíz conlleva al establecimiento más rápido del cultivo y posibilidades mejores frente al estrés provocado por la competencia con malezas (Costar et al., 2013).
El sistema radical del maíz se divide en raíces embrionarias (raíz primaria y raíces seminales) y raíces postembrionarias (raíces nodales y raíces de la corona). En las primeras dos semanas, la raíz principal y las raíces seminales constituyen la mayor parte del sistema radical. Las raíces nodales y de corona que forman la columna vertebral del sistema radical en maíz aparecen después de las raíces embrionarias. Durante la primera fase del desarrollo radical, las raíces laterales realizan el mayor transporte de agua y nutrimentos a las partes aéreas de la planta de maíz porque sus ramificaciones tienen la capacidad de conducción. La transición entre la primera y la segunda etapa del desarrollo radical de la planta de maíz (etapa temprana-tardía) empieza 3 a 4 semanas después de la germinación, junto con la formación de nudos de raíces de la corona (Hochholdinger et al., 2004).
La absorción nutrimentos del suelo por la planta depende de un espacio poroso adecuado (poros que puedan ser penetrados por las raíces) para almacenar el agua que forma la solución del suelo, cantidad suficiente de reservas de nutrimentos y un sistema radical sano en la planta. La eficiencia de absorción de nutrimentos, que es la proporción del total aplicado absorbido por la planta, depende de factores como el volumen del sistema radical, la forma física y química del fertilizante aplicado, y las reacciones en el suelo (Etchevers, 2008).
El proceso germinativo de la semilla tiene tres fases: hidratación, germinación y crecimiento, las cuales dependen del contenido de compuestos hidratables y la permeabilidad de la cubierta de la semilla al agua y oxígeno. La fase de crecimiento comprende la movilización de las reservas en la semilla y el desarrollo de la plántula (Koornneef et al., 2002). El crecimiento y desarrollo de la planta después del proceso germinativo está determinado por las reservas presentes en la semilla y en segunda instancia por las condiciones ambientales del entorno. Revilla et al. (1999) mencionan que tres semanas después de la emergencia, las reservas del endospermo son consumidas y la plántula depende de su capacidad para generar asimilados, producir área foliar y continuar su crecimiento. El éxito de la siembra es determinado en gran parte por las características fisiológicas y bioquímicas de la semilla, su reacción al ambiente y la rapidez con que utilice sus reservas para iniciar y sostener el crecimiento de la plántula en las primera etapas de desarrollo, antes de ser un organismo autotrófico (Soltani et al., 2006).
Las semillas recubiertas establecidas en diferentes condiciones ambientales logran porcentajes y tasa de emergencia cercanos al 100 %, un adecuado desarrollo inicial de plántula y altos rendimientos finales (Tillmann y Miranda, 2006). El recubrimiento de semillas se fundamenta en el proceso de encapsulación para elaborar pastillas y tiene como objetivo mejorar las características de crecimiento y desarrollo de la plántula y protegerla de agresiones bióticas exteriores nocivas (Lizárraga et al., 2011). Los polisacáridos de origen animal y vegetal usados con frecuencia en la microencapsulación son alginato, goma arábiga y quitosano (Lupo et al., 2012).
El quitosano es un polisacárido hidrofílico biodegradable derivado de la desacetilación de la quitina y se usa en el recubrimiento de semillas para conservarlas durante el almacenamiento, estimula el crecimiento de las plánulas y presenta un efecto bactericida (Kong et al., 2010), fungicida y antiviral (Niquette et al., 2004; Lárez, 2006; Lárez, 2008). El alginato es un polisacárido hidrofílico natural obtenido de algas pardas y se usa en la microencapsulación de semillas por ser biocompatible, no tóxico y degradable (Reddy y Reddy, 2010; Lupo et al., 2012).
El secado por aspersión (Parra, 2010) y la gelificación iónica son técnicas de recubrimiento de semillas adecuadas desde el punto de vista práctico y económico (Gouin, 2004; Lakkis, 2007; Guevara y Jiménez, 2008). La gelificación iónica consiste en la formación redes tridimensionales por uniones no completamente estables (hidrogeles físicos) y más débiles que las uniones covalentes (hidrogeles químicos) (Lupo et al., 2012).
El objetivo de este estudio fue evaluar el efecto del quitosano, alginato de sodio, ácido salicílico y nutrimentos en la emergencia, desarrollo radical, y absorción de agua y nutrimentos, en dos variedades de maíz con desarrollo radical contrastante. La hipótesis fue que el recubrimiento de semillas con uno o más de los materiales mencionados, favorece un estatus hídrico y nutrimental de la plántula, que estimula una eficiente emergencia, un incremento en la producción de biomasa radical y una mayor absorción de agua y nutrimentos.
Materiales y métodos
Este estudio se realizó en invernaderos del Colegio de Postgraduados, Montecillo, México. Antes de evaluar los recubrimientos en semillas de maíz se hicieron pruebas de: 1) cinética del consumo de reservas de semillas para determinar el tiempo en que las plántulas de maíz son autótrofas y ya no dependen de las reservas de la semilla en una variedad criolla; 2) selección de dos variedades de maíz con desarrollo radical contrastante; 3) comparación de técnicas para recubrir las semillas de maíz.
El tiempo requerido por la planta para independizarse de las reservas de las semillas se determinó con semillas de maíz blanco criollo. Todas las semillas usadas en este experimento se obtuvieron del Programa de Semillas del Colegio de Postgraduados. Las semillas fueron sembradas en macetas cónicas (25 cm de diámetro, 25 cm de altura) con tezontle rojo (diámetro<5 mm) en invernadero. Las macetas se regaron con 0.5 L d-1 de agua de pozo, en la cual se analizó su concentración nutrimental y se determinaron los micronutrimentos (mg L-1): NO30.003; NH4+ 0.001; P 0.025; K 9.334; Ca 29.210; Mg 9.334; Na 39.663; Fe 0.023; Cu 0.028; Zn 0.164; Mn 0.027.
Las semillas de maíz se pesaron y se sembraron el 27 de enero de 2014. Siete, 15, 22, 29 y 36 días después de la siembra (DDS) se evaluó la materia seca (MS) del remanente de la semilla, la parte aérea y la raíz, en seis plántulas. Las plántulas se extrajeron manualmente de la maceta para obtener toda la biomasa radical, se lavaron con agua corriente, se secaron 72 h en una estufa a 70 °C y se pesaron en una balanza analítica con aproximación de 1 x 10-4 g. Los datos se procesaron con Excel de Microsoft Office 2010 y se graficaron con CurveExpert Profesional versión 2.0.4.
En la selección de las dos variedades de maíz con producción contrastante de biomasa radical se utilizó grano de ocho líneas o variedades (cinco repeticiones en cada una): CMS939083, C13x11, CS14x15, CPV-20, HS-2, HT-PRECOZ, PROMESA y VS22. Las semillas se pesaron antes de la siembra y se seleccionaron aquellas con un peso de 0.21 a 0.3 g para obtener cantidades de reservas homogéneas. Las semillas se sembraron en macetas rellenas con tezontle rojo fino en invernadero el 25 de marzo de 2014 y se regaron con 0.3 L d-1 de agua.
Las plántulas se cosecharon 20 DDS y se secaron en una estufa a 70 °C por 72 h. El peso de la biomasa obtenida por planta se midió en una balanza analítica con aproximación de 1x10-4 g. Los datos se procesaron con Excel de Microsoft Office 2010.
La comparación de técnicas de recubrimiento comprendió la selección del solvente, concentración y metodología de recubrimiento para cada polímero, que produjera una capa sólida, uniforme y homogénea sobre la superficie de la semilla. Los materiales evaluados fueron: semillas de maíz, quitosano de bajo peso molecular (50-190 kDa) con un grado de desacetilación entre 75 y 85 %, alginato de sodio (Sigma Aldrich), ácido salicílico, ácido acético glacial concentrado, cloruro de calcio e hidróxido de sodio. Las suspensiones evaluadas tuvieron concentraciones de 1, 3 y 5 % de cada polímero y se agitaron 60 min a velocidad media en un agitador magnético.
La dosis de fertilización propuesta para el cultivo de maíz con un ciclo de 180 d y una densidad de población de 60,000 plantas ha-1 fue 120-40-60 de N-P2O5-K2O, de la cual se calculó la dosis 26.7-7.5-13.3 kg ha-1 para plántulas de maíz durante 15 d. Las cantidades de nutrimentos para cada plántula de maíz durante este periodo fueron: 0.44 g N, 0.05 g P y 0.18 g K por planta. Los fertilizantes usados para cubrir los requerimientos nutrimentales de las plantas de maíz fueron: nitrato de amonio, sulfato de potasio, fosfato de calcio monohidratado, nitrato de potasio y fosfato monobásico de potasio.
Las suspensiones se prepararon solubilizando primero los polímeros y luego los fertilizantes para evitar precipitados, los cuales fueron triturados en un mortero para facilitar su integración. En las suspensiones finales se agregó ácido salicílico porque favorece el crecimiento vegetal, al estar involucrado en procesos fisiológicos: termogénesis, resistencia a patógenos, inducción a la floración, crecimiento de raíces y absorción de nutrimentos (Larqué y Martín, 2007).
El quitosano es un policatión y forma complejos con moléculas de carga opuesta para obtener películas coloidales (Rodríguez et al., 2010). La técnica para gelificar el quitosano fue la propuesta por Trasviña y Louvier (2010)4, la cual se modificó para determinar la concentración adecuada de NaOH porque la alcalinidad de este reactivo puede dañar la superficie de la semilla. Las semillas de maíz se sumergieron en la suspensión de quitosano, luego en NaOH 0.5 y 1N por 5, 60 y 180 min. La gelificación de alginato de sodio se realizó con cloruro de calcio 0.05 M mediante la técnica de gelificación externa descrita por Lupo et al. (2012). Las semillas recubiertas se secaron a la sombra y al aire libre por 24 h.
El efecto de los recubrimientos propuestos se evaluó con la emergencia, biomasa producida y la concentración nutrimental en las plantas de maíz obtenidas. Las semillas de maíz de las variedades seleccionadas se pesaron en una balanza analítica y se seleccionaron aquellas con un peso de 0.21 a 0.30 g. La interacción entre las dos líneas de maíz y las seis suspensiones para recubrir las semillas originaron los 12 tratamientos evaluados (Cuadro 1), a los cuales se anexaron dos tratamientos testigos (semillas sin recubrimiento).
Cuadro 1 Suspensiones finales para la evaluación de recubrimientos.
| Suspensión† | Tratamiento | |
| Var. HS-2 | Var. CMS939083 | |
| Quitosano | 1 | 8 |
| Quitosano + Dosis de fertilizante 1 | 2 | 9 |
| Quitosano + Dosis de fertilizante 2 | 3 | 10 |
| Alginato de calcio | 4 | 11 |
| Alginato de calcio + Dosis de fertilizante 1 | 5 | 12 |
| Alginato de calcio + Dosis de fertilizante 2 | 6 | 13 |
| Testigo | 7 | 14 |
† Dosis de fertilizante 1=1.1 g N, 0.125 g P, 0.45 g K y 10 mL de ácido salicílico (1x10-3 M), Dosis de fertilizante 2=2.2 g N, 0.25 g P, 0.9 g K y 10 mL de ácido salicílico (1x10-3 M); ambas dosis se aforaron a 100 mL con su respectivo solvente: ácido acético al 2 % para quitosano y agua destilada para alginato de sodio.
Las semillas de las dos líneas de maíz se recubrieron con las suspensiones finales y se secaron a la sombra y al aire libre por 24 h (Figura 1). Para el recubrimiento de semillas se usó quitosano (30 gL-1), alginato de sodio (50 gL-1), ácido salicílico (1x10-3 M) y fertilizantes (N-P2O5-K2O: 26.7-7.5-13.3), como promotores del desarrollo radical.

Figura 1 Semillas recubiertas. A) Semillas de la variedad HS-2 sin recubrir, B) Semillas de la variedad HS-2 recubiertas con quitosano, C) Semillas de la variedad HS-2 recubiertas con alginato de sodio, D) Semillas de la variedad CMS939083 sin recubrir, E) Semillas de la variedad CMS939083 recubiertas con quitosano y, F) Semillas de la variedad CMS939083 recubiertas con alginato de sodio.
Las semillas recubiertas se sembraron en macetas rellenas con tezontle rojo fino (diámetro <5 mm) en invernadero, donde se regaron diariamente con 0.3 L de solución de Steiner modificada (sin macronutrimentos). El agua para riego se analizó para ajustar la concentración de macro y micronutrimentos en la solución nutritiva. La concentración nutrimental de la solución nutritiva según Steiner (1961) sin macronutrimentos fue: 2 ppm Fe, 0.7 ppm Mn, 0.5 ppm B, 0.04 ppm Mo, 0.16 ppm Zn y 0.02 ppm Cu; la cual se preparó con: 0.50 mg L-1 H3BO3, 1.98 mg L-1 quelato-Fe 13.2 %, 0.67 mg L-1 MnSO4*H2O y 0.04 mg L-1 Na2MoO4*2H2O.
La siembra se realizó el 21 de diciembre de 2014 y se efectuaron dos cosechas 30 y 50 DDS, en las cuales se extrajo la planta completa y separó la parte aérea de la raíz. Las variables medidas en plantas de 30 DDS fueron biomasa de la parte aérea y raíz, y la longitud radical; en plantas de 50 DDS se midió solo la biomasa de la parte aérea y raíz. El peso de la biomasa se midió con una balanza analítica con una aproximación de 1 x10-4 g. La longitud radical de las plántulas de 30 DDS se midió con el método de Newman modificado (Böhm, 1979). En ambas cosechas se realizaron análisis químicos del tejido vegetal con la metodología del manual de Walinga et al. (1995) y se determinó N, P y K totales de muestras compuestas, de la parte aérea y de la raíz.
El diseño experimental fue completamente al azar con un arreglo factorial 2x6 (2 líneas y 6 tratamientos) y dos tratamientos testigos (semillas sin recubrimiento) para la prueba de comparación de medias. Las unidades experimentales fueron macetas con tezontle rojo fino (diámetro <5 mm). Los tratamientos tuvieron 10 repeticiones, para un total de 140 unidades experimentales. En la primera cosecha (30 DDS) se recolectó la parte aérea y radical de cinco plantas por tratamiento. En la segunda cosecha las plantas por tratamiento fueron variables, donde el tratamiento 3 se perdió por completo. Para los resultados se hizo una prueba de normalidad (Shapiro-Wilks) y una prueba de homocedasticidad (Bartlett). El ANDEVA de los datos se realizó con el procedimiento GLM y la comparación de medias con la prueba LSD (p≤0.05). Todos los resultados se procesaron con SAS 9.0 y se graficaron con Excel de Microsoft Office 2010.
Resultados y discusión
Después del desarrollo de las raíces, hojas y tallo, las plántulas comienzan a fotosintétizar y producir su propio alimento u obtenerlo del suelo mediante su sistema radical, lo cual independiza a la planta de las reservas de la semilla. Durante esta etapa, la MS de la semilla disminuye debido al consumo de las reservas. Con un promedio entre 87 y 92 %, el consumo de las reservas de la semilla se estabilizó entre 15 y 22 DDS (Figura 2). Estos resultados mostraron que la plántula de maíz se independizó de las reservas de la semilla aproximadamente 20 DDS.
La evaluación de las líneas de maíz se realizó 20 DDS, cuando la planta ya es independiente de las reservas de la semilla. Las variedades de maíz con valores superiores en materia fresca y seca de raíz fueron HT-Precoz, PROMESA, HS-2 y CPV-20, comparadas con las líneas CMS939083, CS13x11 y CS14x15 (Cuadro 2). Las variedad HS-2 y la línea CMS939083 se eligieron para evaluar los recubrimientos en semillas debido a que presentaron desarrollo radical contrastante.
Cuadro 2 Biomasa producida por variedad en plantas de maíz en invernadero.
| Variedad | Materia fresca | Materia seca | ||
| Parte aérea | Raíz | Parte aérea | Raíz | |
| g planta-1 | ||||
| CMS939083 | 1.518 | 1.476 | 0.157 | 0.098 |
| CS13x11 | 1.510 | 1.519 | 0.168 | 0.103 |
| CS14x15 | 1.77 | 2.027 | 0.183 | 0.122 |
| CPV-20 | 2.056 | 2.734 | 0.208 | 0.144 |
| HS-2 | 1.975 | 2.839 | 0.244 | 0.169 |
| HT-PRECOZ | 2.646 | 3.327 | 0.279 | 0.169 |
| PROMESA | 1.872 | 2.568 | 0.207 | 0.174 |
| VS22 | 1.806 | 2.192 | 0.166 | 0.140 |
Las técnicas de recubrimiento de aspersión manual y gelificación iónica son comunes en el tratamiento de semillas debido a su facilidad metodológica y bajo costo. El ácido acético al 2 % se utilizó para solubilizar el quitosano, y agua destilada para el alginato de sodio. Las concentraciones que permitieron una adecuada adherencia a la semilla sin interferir en la emergencia fueron 30 g L-1 de quitosano y 50 g L-1 de alginato de sodio. El nitrato de amonio, nitrato de potasio y fosfato monobásico de potasio fueron los fertilizantes elegidos para las pruebas de recubrimiento de semillas, ya que no generaron precipitados en la suspensión. Las concentraciones de los fertilizantes fueron: 57 g de nitrato de amonio (NH4NO3), 15.5 g de nitrato de potasio (KNO3) y 11 g de fosfato monobásico de potasio (KH2PO4) por litro de suspensión. La suspensión final se preparó agregando 10 mL de ácido salicílico 1x10-3 M por cada 100 mL de suspensión, antes de la adición de los fertilizantes.
La retención de cualquier producto con las técnicas de tratamiento de semillas depende de la adherencia de los productos aplicados, la compatibilidad entre las diferentes formulaciones utilizadas y las características de la cubierta de la semilla (Avelar et al., 2012). La técnica de aspersión manual no logró un recubrimiento uniforme en ambas caras de la semilla. La gelificación iónica se eligió para recubrir las semillas de maíz porque permitió que los recubrimientos se aplicaran sin problemas de adherencia u homogeneidad en la superficie de la semilla. El quitosano se gelificó con soluciones de NaOH 0.5 y 1N, sin diferencias físicas notables del recubrimiento. Sin embargo, la superficie de la semilla se afectó cuando la concentración de NaOH aumentó a 1N, por lo cual se eligió la solución de NaOH 0.5 N. El tiempo mínimo para la obtención de recubrimientos estables y homogéneos de quitosano fue 5 min.
Emergencia
Bhaskara et al., 1999 reportaron que el quitosano tiene efectos positivos en el crecimiento de las plantas (raíces, retoños y hojas) y la germinación de semillas. Sin embargo, en nuestro estudio, el quitosano redujo la emergencia de las semillas de maíz, la cual se acentúa con la adición de fertilizantes y ácido salicílico. Estos resultados concuerdan con los de Arias et al. (1998), quienes recubrieron semillas de maíz con quitosano combinado con Captan para controlar el deterioro inducido por Pythium spp. y observaron que las plantas de maíz redujeron su emergencia significativamente.
Los recubrimientos mostraron un efecto adverso en la emergencia de las semillas, porque presentaron valores de 13 a 67 % menores al testigo para el quitosano, y 7 a 40 % menores al testigo en el alginato de sodio. Sin embargo, los tratamientos con alginato de sodio solo disminuyeron en promedio 10 % la emergencia de las semillas de la variedad HS2, comparada con la línea CMS939083 cuya emergencia se redujo 17 %, en promedio con respecto al testigo.
El efecto negativo del quitosano sobre la emergencia de las semillas puede explicarse por las altas concentraciones de polímero, ya que Guan et al. (2009) observaron un incremento en la emergencia de semillas de maíz recubiertas con quitosano cuando fueron sometidas a condiciones de estrés por temperatura. Lárez et al (2012) mostraron que el quitosano con alto peso molecular estimula un mayor potencial de emergencia en semillas de calabacín (Cucúrbita Pepo). Esto se repite en algodón americano (Gossypium Irsutum) y maíz (Zea Mays L.)(Tingda et al., 1994), trigo (Triticum Aestivum) (Bhaskara et al., 1999 y Reddy et al., 1999), pepino (Cucumis Sativus), pimiento (Capsicum Annuum), calabaza (Cucúrbita Sp.) (Chandrkrachang, 2002) y alcachofa (Cynara Scolymus L.) (Ziani et al., 2010).
Las concentraciones de quitosano evaluadas en estos estudios van de 0.5 a 2 % del polímero (p/v), y las semillas sólo se sumergieron en las suspensiones por cierto tiempo y se filtraron, dejando un delgado recubrimiento sobre la semilla. Estas condiciones de escaso recubrimiento permitieron que las semillas emergieran sin ninguna barrera física, pero en nuestro estudio fue lo contrario porque se generó una mayor cantidad de recubrimiento sobre la semilla, lo cual fue una cualidad requerida para el estudio. Un recubrimiento mayor sobre las semillas pudo reducir la velocidad de imbibición de la semilla debido a las propiedades poliiónicas del quitosano, las que le permiten formar complejos insolubles en agua (Argin et al., 2009), lo cual causó que las semillas tardaran más tiempo para emerger o no germinaran.
El alginato de sodio presenta alta permeabilidad, ya que no repele al agua y se hincha con la exposición prolongada al agua (McHugh, 1987), permitiendo una imbibición adecuada de la semilla, favoreciendo el proceso germinativo y generando porcentajes de emergencia similares al testigo (semilla sin recubrir). Sin embargo, la combinación de alginato de sodio con fertilizantes disminuyó la germinación en ambas variedades, con un efecto mayor en la línea CMS939083. Estos resultados son similares a los de Sarrocco et al. (2004), quienes recubrieron semillas de trigo con alginato de sodio y los porcentajes de emergencia fueron similares a las semillas no tratadas.
Desarrollo radical
En la plantas de maíz de 30 DDS hubo efecto (≤£0.05) de la dosis de fertilización en la mayoría de las variables (Cuadro 3). Las plantas de maíz de 50 DDS solo presentaron efectos significativos (p≤0.05) en la materia fresca de raíz, por lo cual se omitió la información del ANDEVA.
Cuadro 3 Diferencia estadística de factores e interacciones en la biomasa producida y longitud radical de plantas de maíz con 30 días de desarrollo † .
| Fuente de variación | MFPA | MFR | MSPA | MSR | LR |
| Variedad (V) | ns | ** | ns | ** | * |
| Polímero (P) | ns | ns | ns | ns | ns |
| Dosis de fertilización (F) | ** | ** | ** | * | ** |
| Interacción V*P | ns | ns | ns | ns | ns |
| Interacción V*F | ns | ns | ns | ns | ns |
| Interacción P*F | ns | ns | ns | ns | ns |
| Interacción V*P*F | ns | ** | ns | ns | * |
Ns: no significativa; * p≤0.05; ** p≤0.01. †MFPA: materia fresca de la parte aérea, MFR: materia fresca de raíz, MSPA: materia seca de la parte aérea, MSR: materia seca de raíz y, LR: longitud radical.
Brown y Scott (1984) mencionan que el suelo o sustrato donde se coloca la semilla, así como el clima y el propio cultivo, influyen en las cualidades físicas de las raíces desarrolladas en las plantas. La semilla de la variedad HS-2 evaluada 30 DDS mostró un vigor inicial mayor que la línea CMS939083, al producir mayor biomasa radical. Sin embargo, la longitud radical fue mayor en la línea CMS939083, lo cual puede explicarse por el uso de las reservas de la semilla para la elongación de la raíz en vez de la producción de materia seca (Figura 3).
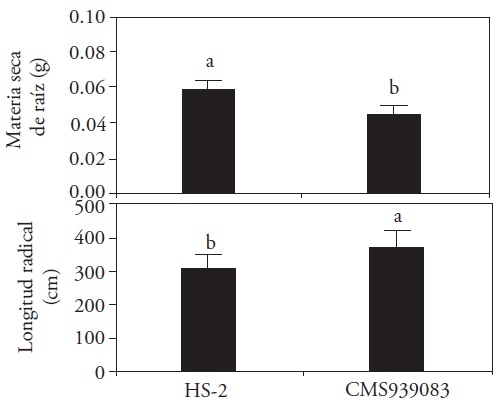
Figura 3 Efecto de la variedad sobre el desarrollo radical de plantas de maíz con 30 días de desarrollo (LSD, p≤0.05, materia seca de raíz; DMS=0.0057 y longitud radical; DMS=50.756).
Las variables medidas en plantas de 30 DDS fueron susceptibles a la dosis de fertilización y evidencia un marcado efecto negativo de los fertilizantes y ácido salicílico (Cuadro 4). Estos resultados son similares a los de Gawade y Somawanshi (1979), quienes mostraron que la aplicación de fertilizantes en formas insolubles no afecta la emergencia, por lo que son seguros utilizarlos en semillas para etapas iniciales del cultivo. Sin embargo, Scott et al. (1985) y Scott (1975) mencionan que los fertilizantes insolubles son ineficaces para promover el crecimiento inicial de la planta.
Cuadro 4 Comparación de medias de biomasa y longitud radical en plantas de maíz con 30 días de desarrollo en función de la dosis de fertilización.
| Materia fresca | Materia seca | Longitud radical | |||||
| Tratamiento† | P. aérea | Raíz | P. aérea | Raíz | |||
| g | cm | ||||||
| Testigo | 1.772 a | 1.051 a | 0.155 a | 0.057 a | 370.4 a | ||
| D1 | 1.571 ab | 0.833 b | 0.132 b | 0.047 b | 359.9 a | ||
| D2 | 1.380 b | 0.755 b | 0.122 b | 0.049 b | 269.2 b | ||
| DMS¶ | 0.228 | 0.160 | 0.019 | 0.007 | 63.3 | ||
Letras distintas indican diferencias significativas (LSD, p≤0.05). † Testigo=sin fertilizantes, D1=2.2 g N, 0.25 g P y 0.9 g K, D2=4.4 g N, 0.5 g P y 1.8 g K. ¶DMS=diferencia mínima significativa.
El efecto de los fertilizantes dependerá del tipo y cantidad de fertilizante adicionado, especie de cultivo, y la textura y humedad del sustrato. La mayor cantidad de fertilizante produjo los valores más bajos en biomasa aérea y radical, y longitud radical en plantas con 30 días de desarrollo. Sin embargo, las plantas de 50 DDS no presentaron diferencias significativas entre los tratamientos, debido a una probable disminución de los fertilizantes, lo que redujo su efecto en los tratamientos. Estos resultados se pueden explicar con lo reportado por Melaj y Daraio (2012), quienes muestran que el quitosano libera el fertilizante en tiempos cortos, ya que su capacidad de hinchamiento es alta, fase previa para la liberación del fertilizante. Por lo tanto, los fertilizantes probablemente generaron condiciones salinas que afectaron el crecimiento y desarrollo de la planta.
Concentración nutrimental
Cuando las necesidades de un cultivo (nutrimentales y otras) son satisfechas, la concentración de los nutrimentos en toda la planta alcanzan niveles que varían con la edad y tipo de planta (Etchevers, 2008). Esto explica las diferencias de concentración nutrimental entre las variedades o líneas y días de desarrollo de las plantas de maíz (Cuadro 5), porque en plantas de 30 DDS la concentración de N en hoja y P en raíz de la línea CMS939083 fue superior comparada con la de la variedad HS-2, y en plantas de 50 DDS la concentración de potasio en hoja en la variedad HS-2 fue superior comparada con la de la línea CMS939083 (p≤0.05).
Cuadro 5 Comparación de medias de la concentración nutrimental en la biomasa de plantas de maíz en función de la variedad.
| Tratamiento | 30 DDS | 50 DDS | ||
| N-hoja | P-raíz | K-hoja | ||
| % | ||||
| HS-2 | 2.64 b | 0.16 b | 5.29 a | |
| CMS939083 | 2.83 a | 0.19 a | 4.87 b | |
| DMS† | 0.17 | 0.02 | 0.41 | |
Letras distintas indican diferencias significativas (LSD, p≤0.05. DDS: Días después de la siembra, N: nitrógeno, P: fósforo, K: potasio.†DMS: diferencia mínima significativa.
El requerimiento interno de N, P, K en la biomasa aérea total de plantas de maíz que han alcanzado la máxima producción se ha estimado en 1.0, 0.17 y 1.0 % (Rodríguez, 1993), y la concentración de algunos nutrimentos disminuyen en el tejido (MS) a medida que la planta crece (N, P, K, Mg), mientras que otros aumentan (Ca, Mn) (Etchevers, 2008), esto puede explicar que la concentración nutrimental en plantas de 30 DDS solo mostró el efecto significativo (p≤0.05) de los polímeros en la acumulación de K en la hoja de las plantas de maíz, mientras que en plantas con 50 DDS, los polímeros produjeron diferencias significativas (p≤0.05) en la acumulación de N en la raíz (Cuadro 6). Además, el quitosano está compuesto por dos unidades estructurales: la Nacetil-D-glucosamina y la D-glucosamina (Peniche, 2006), que presentan nitrógeno y durante el proceso de degradación del quitosano probablemente fue aprovechado por la planta, lo cual explica la diferencia de concentración nutrimental en las plantas de 50 DDS.
Cuadro 6 Comparación de medias de la concentración nutrimental en la biomasa de plantas de maíz en función del polímero.
| Tratamiento | K-hoja (30 DDS) | N-raíz (50 DDS) |
| % | ||
| Testigo | 4.97 a | 1.11 b |
| Quitosano | 4.32 b | 1.25 a |
| Alginato de sodio | 4.81 ab | 1.13 b |
| DMS | 0.56 | 0.11 |
Letras distintas indican diferencias significativas (LSD, p≤0.05). DDS: Días después de la siembra, N: nitrógeno, P: fósforo, K: potasio. †DMS: diferencia mínima significativa.
Conclusiones
El quitosano presentó porcentajes de emergencia promedio inferiores al testigo en las líneas genéticas de maíz cuando se aplicó a la semilla sólo o combinado con fertilizantes. El alginato de sodio redujo los porcentajes de emergencia en menor grado que el quitosano, en la variedad HS-2 y en la línea CMS939083, aunque sin fertilizantes logró porcentajes de germinación similares al testigo. El desarrollo radical de las plantas no fue estable en ambas líneas genéticas. La variedad HS-2 produjo mayor cantidad de materia seca de raíz, pero la línea CMS939083 generó mayor longitud radical. La adición de fertilizantes y ácido salicílico a las semillas disminuyó la producción de biomasa y longitud radical de las plantas de maíz. La concentración de nitrógeno, fósforo y potasio en las plantas de maíz fue variable, por lo cual no hay un efecto concluyente de los recubrimientos sobre la acumulación de nutrimentos en la planta.











 texto en
texto en 



