Introducción
México es uno de los lugares más importantes como centro de origen y domesticación del nopal, Opuntia ficus-indica (L.) Miller (Caryophyllales: Cactaceae) (Casas y Barbera, 2002; Griffith, 2004). Ésta se explota en países de zonas áridas y semiáridas (Le Houérou et al., 1993; Griffith, 2004) y se usa como forraje y sus frutos para consumo humano. En México se consumen como hortaliza los cladodios inmaduros, denominados nopalitos, o nopal verdura (Flores, 2001), y hay alrededor de 11 000 ha para su cultivo (SIAP, 2013).
En Milpa Alta, al sur de la ciudad de México, se cultivan alrededor de 4000 ha de nopal verdura (SIAP, 2013). Las plantas presentan una sintomatología denominada cacarizo del nopal, que se manifiesta como pústulas color ocre en los cladodios maduros. El daño inicial aparece alrededor de 5 d después de que la chinche roja, Hesperolabops nigriceps Reuter (Hemiptera: Miridae) introduce su estilete en el cladodio para alimentarse. En ese sitio aparece una pequeña mancha con un halo clorótico que se transforma en una pústula sobre la epidermis del cladodio. Después las pústulas coalescen y adquieren tonalidades de amarillo a ocre, hasta que se revientan probablemente por la destrucción y deshidratación de secciones de tejido; del inicio de los síntomas a la manifestación final del daño transcurren unos 30 d (Palomares-Pérez et al., 2010).
Algunos productores y técnicos agrícolas relacionan al cacarizo del nopal con la aparente disminución en la tasa fotosintética de las plantas y de la producción, pero no hay evidencia científica que confirme dicha hipótesis. La información disponible relaciona esta sintomatología con la presencia y daño de la chinche roja, Hesperolabops spp. (Hemiptera: Miridae) (Melgarejo-Moreno, 2000; Méndez-Gallegos et al., 2008; Palomares-Pérez et al., 2010). En algunos manuales técnicos se sugiere que el cacarizo del nopal pudiera resultar de la interacción de la chinche roja y algún hongo fitopatógeno (Mena-Covarrubias y Rosas-Gallegos, 2004), pero en la literatura científica revisada no hay evidencia de que esta sintomatología pueda considerarse de origen patogénico.
A pesar de la importancia del cultivo de nopal verdura en la región sur de la ciudad de México, no se han desarrollado estudios para evaluar los daños ni distribución del cacarizo del nopal (Mann, 1969; Badii y Flores, 2001; Ayala-Escobar et al., 2006; Quezada-Salinas et al., 2006). Por esta razón, el objetivo de esta investigación fue determinar la incidencia, severidad y distribución del cacarizo del nopal en la región de Milpa Alta, y corroborar la relación cacarizo del nopal con la presencia de H. nigriceps.
Materiales y métodos
Área de estudio
La delegación de Milpa Alta, con una superficie de 28,375 ha (Diario Oficial de la Federación, 1997), está situada al sureste de la Ciudad de México entre 19° 04’ y 19° 12’ N y 98° 57’ y 99° 08’ O. Presenta una topografía montañosa y altitudes de 2,230 a 3,200 m (Rodríguez y López, 2006). El clima es templado subhúmedo con lluvias en verano [C(w2)(w)], temperatura media anual de 14.4 °C y precipitación anual de 878.9 mm (García, 1988). La precipitación es heterogénea en su distribución, desde 580.6 mm en las áreas de menor altitud a 1,200 mm en las de mayor altitud (IMTA, 1996).
Escala logarítmica diagramática
Para evaluar la incidencia y severidad del cacarizo del nopal se construyó una escala logarítmica diagramática, se utilizó la metodología propuesta por Mora-Aguilera et al. (2003) 3. Con una cámara digital de 5 mega pixeles se fotografiaron al azar 60 cladodios maduros de varios niveles de severidad del cacarizo del nopal. Después, con el editor de imágenes Adobe Photoshop (Adobe System Incorporated, 2010), se midió el área invadida por el cacarizo del nopal mediante el programa ImageTool® (Wilcox et al., 2002) y se determinaron los límites inferior y superior. Una vez definido el límite máximo de la escala, se puso ese valor en el programa 2LOG ver.1 (Osada-Velázquez y Mora-Aguilera, 1997 4) para definir el número de clases (Tovar-Soto et al., 2002; Mora-Aguilera et al., 20033; Gomesa et al., 2004).
Con el programa 2LOG ver.1 se obtuvo una escala logarítmica que se convirtió en diagramática mediante la asociación de una imagen fotográfica cuya severidad se aproximaba mejor a los puntos medios de cada clase. De esta manera, la escala diagramática quedó definida mediante cinco clases (0-4) (Figura 1).

Figura 1 Escala logarítmica diagramática de severidad del cacarizo del nopal. Los rangos representan el porcentaje de área promedio invadida en los cladodios.
La escala diagramática se validó antes de usarla, para lo cual se usaron los valores reales obtenidos con el programa PhotoShop e Image Tool, y los obtenidos por el evaluador. Con esos datos se realizó un análisis de regresión lineal simple con el programa Validar-PER ver. 1.1 (Mora-Aguilera, 20095) y los valores de r2 y b1 próximos a 1.0 indicaron máxima precisión y exactitud, respectivamente.
Muestreo
El muestreo fue simple estratificado con base en la altitud y puntos cardinales en Milpa Alta en primavera verano del 2010. Por la distribución del cultivo en la región de estudio, se definieron cinco zonas de muestreo por altitud (msnm): I) 3070 a 2920, II) 2919 a 2770; III) 2769 a 2620; IV) 2619 a 2470 y V) 2469 a 2320, y en cada zona se eligieron cuatro sitios de muestreo; 20 parcelas las cuales tenían de 5 a 10 años de edad y sus plantas no rebasaron 1.60 m de alto, donde el principal sistema de manejo de plagas y enfermedades mediante la fertilización con abono orgánico y control químico.
Incidencia
La incidencia se evaluó como presencia o ausencia del cacarizo del nopal sobre O. ficus-indica. En cada parcela se examinaron 10 plantas elegidas al azar. Las variables de respuesta fueron: número de pencas por planta, y número de pencas por planta con al menos una pústula de cacarizo del nopal. Cada punto de muestreo se georeferenció con el sistema de posicionamiento global (GPS 12 XL Garmin Olathe, KS, USA). La determinación de la incidencia se realizó de acuerdo con la proporción o porcentaje de plantas con síntomas empleando la fórmula siguiente (Tovar-Soto et al., 2002):
Severidad
Para evaluar la severidad (área del cladodio afectado por el cacarizo del nopal), se seleccionaron al azar 10 plantas de cada parcela con el tamaño que se indica anteriormente. En cada planta se estimó el grado de daño en tres estratos utilizando la escala logarítmica diagramática. El cladodio base y segundo cladodio se consideraron como estrato bajo, tercer cladodio como estrato medio y los cladodios que crecen sobre el tercer cladodio como estrato alto. El número total de cladodios por estrato se determinó y también el número de cladodios por nivel de daño por estrato. La severidad se estimó con la fórmula siguiente (Tovar-Soto et al., 2002):
Los datos obtenidos de la incidencia y severidad se capturaron en una hoja de cálculo del programa Excel y se importaron al programa SURFER 32 ver. 6.04 (Surface Mapping System, 1997) para determinar la distribución del cacarizo del nopal. Así mismo, estimar la dimensión gráficamente de ambas con los datos grabados previamente en la hoja de cálculo y luego como un gráfico. Después se ejecutaron las opciones “Classed post y Countour” para generar mapas bi y tridimensionales.
Identificación del insecto
Para corroborar la especie de chinche roja, se recolectaron cinco ejemplares en cada sitio de muestreo. y se llevaron al laboratorio de Entomología del Posgrado en Fitosanidad del Colegio de Postgraduados, montados en alfileres entomológicos. Después se identificaron los insectos con un microscopio de disección y con las claves para el género Hesperolabops, publicadas por Froeschner (1967). Además, la especie fue corroborada por el Dr. Harry U. Brailovsky del Instituto de Biología de la UNAM, especialista en la familia Miridae. Lo ejemplares se pusieron en resguardo en el laboratorio de taxonomía del Departamento de Parasitología Agrícola de la Universidad Autónoma Chapingo.
Análisis estadístico
Para la distribución del cacarizo del nopal en campo se usaron los cálculos de agregación y dispersión espacial, los cuales se determinaron mediante los índices de Morisita y Lloyd (Campbell y Madden, 1990) usando el programa MorLloyd versión 1.0 (Rivera-Valencia y Mora-Aguilera, 20106). El índice de agregación y dispersión espacial de H. nigriceps se estimó con el mismo programa.
El diseño experimental fue completamente aleatorio con cinco tratamientos, cada altitud se consideró un tratamiento y las cuatro parcelas dentro de cada altitud fueron las repeticiones. Como los datos no tuvieron distribución normal, aun cuando se intentaron transformaciones (Shapiro-Wilk) se procesaron mediante la prueba no paramétrica de Friedman. También se hicieron pruebas de correlación simple entre la presencia de H. nigriceps y la incidencia del cacarizo del nopal. Las variables fueron cladodio sano, cladodio con cacarizo del nopal y presencia de la chinche roja, y cladodio con la presencia de la chinche roja sin cacarizo del nopal.
Resultados y discusión
Incidencia y severidad del cacarizo del nopal
La validación de la escala logarítmica diagramática para determinar la severidad del cacarizo del nopal, estimada por análisis de regresión, presentó una precisión de r2=0.988 y una exactitud de b1=1.012, lo cual indicó que los valores de severidad fueron adecuados para esta evaluación. La incidencia y severidad del cacarizo del nopal en Milpa Alta fueron 56.4±18.5 % y 10.5±6.4 %, respectivamente. De acuerdo con los índices de agregación de Morisita (0.990), y de dispersión de Lloyd (0.980), la incidencia del cacarizo del nopal presentó una distribución de tipo uniforme en la región (Figura 2A), mientras que la severidad fue de tipo agregada Morisita (1.767) y Lloyd (2.535) (Figura 2B). Estos datos sugieren una posible transmisión vegetativa del agente causal influenciado por el manejo agronómico como sucede con otros problemas fitosanitarios como manchas cloróticas asociadas a O. ficus-indica (Alonso-Barrera et al., 2015).
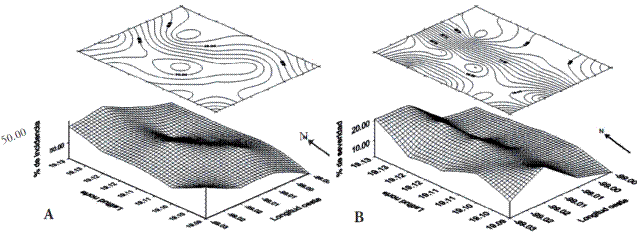
Figura 2 Distribución espacial de la incidencia (A: tipo uniforme) y severidad (B: tipo agregada) del cacarizo del nopal en Milpa Alta, Ciudad de México, 2010.
Aunque los mapas bidimensionales y los índices de Morisita y Lloyd revelaron cierta agregación de la severidad del cacarizo del nopal en la zona poniente de Milpa Alta, no se encontró diferencia estadística entre categorías altitudinales (F=0.57; p=0.943), ni tampoco entre los puntos cardinales (F=1.0; p=0.464).
De manera individual, en cada planta la mayor concentración del cacarizo del nopal se registró en el estrato bajo y medio, donde se ubican los cladodios madre, segundo y tercero (Cuadro 1) y que corresponden a los cladodios de mayor edad en una plantación y mayor concentración de chinche roja, observación que coincidió con lo registrado por PalomaresPérez et al. (2010).
Cuadro 1 Severidad del cacarizo del nopal por estratos en plantas de nopal verdura, O. ficus-indica, en Milpa Alta, Ciudad de México.
| Grado de severidad (escala diagramática) | Porcentaje de severidad por estrato† | ||
| Bajo (cladodios de 5 a 8 años) | Medio (cladodios de 6 meses a 5 años) | Alto (cladodios menores a 6 meses) | |
†Media ± desviación estándar.
Asociación cacarizo del nopal-Hesperolabops nigriceps
Todos los ejemplares de chinches recolectados en las parcelas correspondieron a H. nigriceps y hubo una correlación significativa entre la presencia de H. nigriceps y el cacarizo del nopal (r=0.765). Además, los índices de Morisita (1.003) y Lloyd (1.006) indicaron que la concentración de la chinche roja en Milpa Alta fue agregada y coincidió con las áreas (poniente) donde se concentró la mayor severidad el cacarizo del nopal (Figura 3). Es posible que la zona topográfica poniente presente las condiciones óptimas para el desarrollo de este problema o que el mal manejo fitosanitario principalmente en el corte y traslado de la penca a plantar, sean los factores que favorecen el desarrollo de este daño, como sucede con la diseminación de otros problemas del nopal como la mancha negra o manchas cloróticas (Quezada-Salinas et al., 2006; Alonso-Barrera et al., 2015).
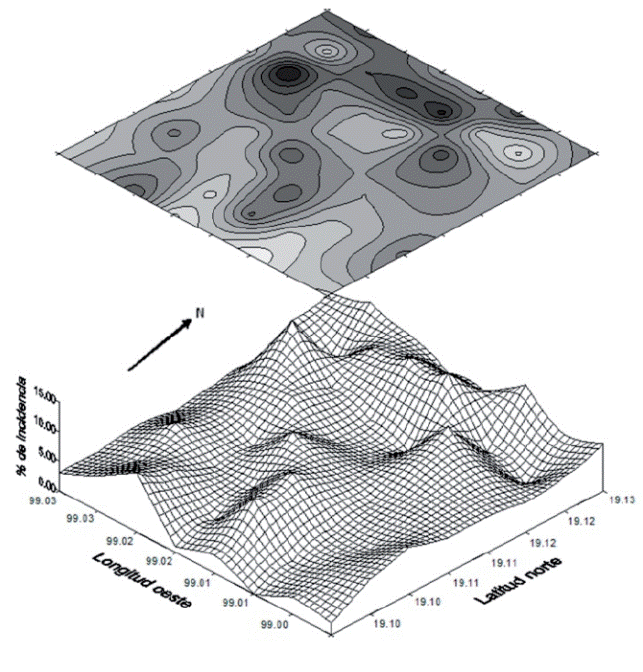
Figura 3 Distribución espacial de la chinche roja, Hesperolabops nigriceps, en la zona productora de nopal verdura en Milpa Alta, Ciudad de México.
El cacarizo del nopal es un problema fitosanitario de primer orden en Milpa Alta según algunos reportes técnicos. Con este estudio se puede considerar importante la sintomatología del cararizo del nopal y establecer que las estimaciones visuales realizadas en los estudios técnicos probablemente estén sobreestimadas, como sucede con otras sintomatologías que se manifiestan sobre hojas o tallos en las plantas de interés (Cadena-Hinojosa et al., 2003; Soltero-Díaz y Williams-Alanís, 2003).
Un factor fundamental en el nivel de daño o severidad fue la edad de los cladodios. Las pústulas resecas se limitaron prácticamente a los cladodios maduros de más de un año de edad, mientras que los nopalitos rara vez lo presentaron. Palomares-Pérez et al. (2010) mencionan que los cladodios jóvenes son cortados por los agricultores cuando tienen cualquier daño que afecte su presentación en el mercado, y probablemente este sea una de las causas de que el daño se observó sólo en cladodios maduros y se relaciona con los lugares donde la chinche roja prefiere alimentarse. Quizá la concentración de nutrientes en cladodios maduros e inmaduros, como está reportado en estudios de nutrición en nopal (Villareal et al., 1963; Saag et al., 1975; Bravo-Hollins, 1978; McGarvie y Parolis, 1979, 1981), sea importante para definir los lugares de alimentación de esta especie de insecto. En adición a la preferencia de los lugares de alimentación por H. nigriceps, la sintomatología es acumulativa, es decir, los cladodios maduros pueden tener síntomas ocasionados por la alimentación de chinches de años anteriores.
Aunque no se detectaron diferencias entre la incidencia y severidad del cacarizo del nopal a diferentes altitudes y puntos cardinales fue evidente que, mediante la interpretación espacial y los índices de Morisita y Lloyd, la sintomatología presentó cierta tendencia de agregación hacia la zona poniente, donde se concentraron las poblaciones de H. nigriceps. Esto corroboró la relación cacarizo del nopal-H. nigriceps y el hábito de agregación de esa especie, como se presenta con otras especies con hábitos gregarios de la misma familia como Lygus hesperus Knight y Sahlbergella singularis Haglung (Schotzko y O’Keeffe, 1989; Bisseleua et al., 2011).
La presencia de microclimas debido a cambios altitudinales es un factor que afecta la distribución de abejas y otros insectos polinizadores (Gonçalves y Stort, 1978; Salamanca-Grosso, 2009). En el caso de H. nigriceps la presencia de microclimas en la región de Milpa Alta, relacionados con la altitud (García, 1988; IMTA, 1996; Rodríguez y López, 2006), no parece afectar de manera importante la distribución del insecto y el cacarizo del nopal. Esto pudiera atribuirse, al menos en parte, a la capacidad adaptativa de esta especie de insecto para explotar el recurso nopal en el ambiente de Milpa Alta.
Un factor que puede influenciar la distribución del cacarizo del nopal es el manejo del cultivo. A pesar de ser el área con mayor superficie destinada a ese cultivo en México (SIAP, 2013), en Milpa Alta la agricultura es una actividad secundaria y los productores destinan relativamente menos tiempo a labores de manejo y control de plagas, incluida H. nigriceps, comparados con productores que tienen a la agricultura como actividad primaria (Vanegas-Rico et al., 2010). Además, aparentemente no se proporciona suficiente atención al origen de cladodios que se usarán para establecer nuevas plantaciones. El ciclo de H. nigriceps es de un año y no son evidentes los lugares de oviposición en el cladodio (Palomares-Pérez, datos sin publicar), por lo cual es probable que al establecer nuevas plantaciones lleven huevos del insecto (Badii y Flores, 2001) y eso favorezca la dispersión de la chinche roja y del cacarizo del nopal. A la fecha no existe información del efecto del cacarizo del nopal sobre O. ficus-indica. No obstante, debido a la distribución de esta sintomatología en Milpa Alta, y a la severidad que puede alcanzar en algunas parcelas, es conveniente estudiar este fenómeno y sus posibles consecuencias en la vida productiva de las plantas.
Conclusión
El cacarizo del nopal tiene distribución uniforme en 56 % del área de Milpa Alta, y severidad de 10 %. Hay correlación positiva entre el cacarizo del nopal y la presencia de Hesperolabops nigriceps. Además las labores de manejo del cultivo pueden favorecer la presencia y dispersión de la sintomatología.











 texto en
texto en 


