Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.50 n.7 Texcoco Oct./Nov. 2016
Fitociencia
Concentraciones de hierro en caña de azúcar (Saccharum officinarum L.) cultivada en solución nutritiva
1 UNESP São Paulo State University “Júlio de Mesquita Filho”, Department of Soils and Fertilizers, Via de Acesso Prof. Paulo Donato Castellane, s/n, Zip Code 14884-900, Jaboticabal, SP, Brazil. (valeriasantos_88@hotmail.com).
Hay dudas acerca de la concentración adecuada de hierro (Fe) en soluciones nutritivas para el crecimiento óptimo de las plantas, sobre todo en gramíneas como la caña de azúcar (Saccharum officinarum L.). Por lo tanto, el objetivo de este estudio fue evaluar los efectos de las concentraciones de Fe sobre el crecimiento, índice de color verde y la producción de materia seca (MS) en la caña de azúcar cultivada en una solución nutritiva. La hipótesis fue que la solución nutritiva debe tener una concentración más alta de Fe, el cual es usado por la planta para su desarrollo óptimo. El estudio se realizó en un invernadero con la variedad IAC SP 93 3046, cultivada en maceras (7.5 L) con una solución nutritiva aireada. El diseño experimental fue completamente al azar con cinco réplicas y cuatro tratamientos (0; 184; 368 y 551.4 μmol L-1 de Fe-EDDHA). Para el análisis de los datos se usó ANDEVA con una prueba F (p≤0.05). Las variables evaluadas fueron la altura de la planta, diámetro del tallo, área foliar, índice de color verde, producción de MS, acumulación total de Fe y también se realizó un diagnóstico visual. Tanto hojas como raíces presentaron mayor acumulación de Fe de 0.28 g y 2 g por maceta, respectivamente, en la concentración de Fe-EDDHA de 184 μmol L-1. El índice de color verde y la acumulación de nutrientes fueron mayores a mayores concentraciones de Fe-EDDHA. La concentración de 184 μmol L-1 cubrió las necesidades de la planta, al dar un diámetro de 12.2 mm, altura de 25 cm, 750 cm2 de área foliar y 4.10 g de MS por maceta, 2.18 g de raíces por maceta y 6.28 g de planta entera por maceta. El uso del quelato Fe-EDDHA aumentó la acumulación del elemento en las plantas y el índice de color verde; y 184 μmol L-1 Fe fue la concentración adecuada para satisfacer las necesidades de la planta, promoviendo la producción satisfactoria de MS.
Palabras clave: Fe-EDDHA; deficiencia férrica; materia seca; índice de color verde
Doubts remain about the adequate iron (Fe) concentration in nutrient solutions used for optimal plant growth, especially in gramineae like sugar cane (Saccharum officinarum L.). Therefore, the aim of this study was to evaluate the effect of Fe concentrations on growth, green color index and dry matter (DM) production in sugar cane cultivated in a nutrient solution. The hypothesis was that the nutrient solution must contain higher Fe concentration, which is used by the plant for optimum development. The study was conducted in a greenhouse with the variety IAC SP 93 3046, cultivated in pots (7.5 L) with aerated nutrient solution. The experimental design was completely randomized with five replicates and four treatments (0; 184; 368 and 551.4 μmol L-1 of Fe-EDDHA). For data analysis we used ANOVA with an F test (p≤0.05). Variables evaluated were plant height, stem diameter, leaf area, green color index, DM production, total Fe accumulation and we also performed visual diagnosis. Both leaves and roots had greater Fe accumulation of 0.28 g and 2 g per pot, respectively, on the Fe-EDDHA concentration of 184 μmol L-1. Green color index and nutrient accumulation were greater with increased FeEDDHA concentrations. The concentration of 184 μmol L-1 met the needs of the plant, providing a 12.2 mm diameter, 25 cm height, 750 cm2 leaf area and 4.10 g of DM per pot, 2.18 g of roots per pot and 6.28 g of whole plant per pot. The use of Fe-EDDHA chelate increased both the element’s buildup in plants and green color index; and 184 μmol L-1 Fe was the adequate concentration to supply the plant’s needs, promoting satisfying DM production.
Key words: Fe-EDDHA; ferric deficiency; dry matter; green color index
Introducción
Los pastos presentan altos requerimientos de hierro (Fe) comparado con otros cultivos, como la caña de azúcar (Saccharum officinarum L.), que acumula cerca de 9000 g ha-1 (Prado, 2008). El Fe es esencial para la formación de la clorofila, funge como catalizador en la respiración y la fotosíntesis, como un factor en algunos sistemas enzimáticos (Madhuri et al., 2013); además, aumenta la productividad y está relacionada con la calidad nutricional de los productos vegetales (Briat et al., 2007).
La absorción de Fe por la caña de azúcar se realiza por un mecanismo que libera fitosideróforos de las raíces, formando quelatos con el nutriente (estrategia II), lo que resulta en la absorción de Fe3+. Cuando hay deficiencia de Fe en el medio de cultivo, aumenta la descarga de fitosideróforos, promoviendo una autorregulación de las respuestas a este estrés en plantas de estrategia II, que son menos estudiadas que las plantas de estrategia I (Morrissey y Guerinot, 2009).
Los quelatos se usan para suministrar Fe, como Fe-EDDHA, usado por su elevada constante de estabilidad (Ks=35.4) comparado con otros quelatos comercializados como Fe-EDTA (Ks=26.5) y FeEDDS (Ks=20.1); además, es estable, incluso en un pH alto (Ylivainio et al., 2004). A pesar de su estabilidad alta, algunos cultivos pueden reducir la eficiencia de la absorción de Fe por la dificultad de absorber iones de Fe del compuesto.
Las concentraciones adecuadas de Fe en la solución de nutrientes relacionadas con la producción más alta de materia seca (MS) varían de acuerdo a la especie: en maíz BSC 6661 es 120 μM de Fe-EDDHA (Çelik et al., 2010); en soya 50 μM EDTA-Fe-3 (Li et al., 2011); y en trigo duro 80 μM EDTAFe-3 (Zuchi et al., 2012). Estas concentraciones de Fe difieren con la solución de nutrientes estándar (184 μmol de FeEDDHA) reportada por Hoagland y Arnon (1950) para el cultivo hidropónico de varias especies. Para la caña de azúcar hay un número limitado de estudios que usan soluciones de nutrientes; así, Vale et al. (2011) y Subasinghe (2006) utilizaron 184 μmol L-1 de FeEDDHA y 0.18 mM de Fe2+, respectivamente, pero sin sustento científico.
La hipótesis de este estudio es que la caña de azúcar es un cultivo demandante de Fe y requiere una concentración más alta de este micronutriente en la solución establecida para el desarrollo óptimo del cultivo, como lo señalan Hoagland y Arnon (1950). El objetivo fue evaluar el efecto de las concentraciones de Fe en la solución de nutrientes sobre el crecimiento, el índice de color verde y la producción de MS de la caña de azúcar.
Materiales y métodos
El experimento se realizó en un invernadero de la Universidad de Ciencias Agrícolas y Veterinarias, Jaboticabal - SP, con caña de azúcar (variedad IAC SP 93 3046), 21° 15’ 22’’ S y 48° 18’ 58’’ W. Durante los experimentos, las temperaturas promedio para el día y la noche fueron 28 °C±1.0 y 25 °C±1.0, respectivamente, y la humedad promedio fue 40 %.
El diseño experimental fue completamente al azar, con cuatro tratamientos (concentraciones) de Fe-EDDHA [quelatos etilendiamina-N,N’-bis (ácido 2-hidroxifenilacético)]: 0 (testigo), 184, 368 y 551.4 μmol L-1, que son 0, 1, 2 y 3 veces la concentración de referencia (184 μmol L-1; Hoagland y Arnon, 1950); y cinco réplicas por tratamiento.
Palanquillas de 5 cm se colocaron en recipientes de plástico de 500 mL con arena lavada. Quince días después del surgimiento de brotes, las plantas fueron transplantadas en macetas de polipropileno (7.5 L) con la solución de nutrientes diluida al 50 % y en reposo de 7 d (periodo de adaptación). Luego, la solución fue renovada cada semana y aireada de manera constante, con el pH ajustado (6.0±0.1), ya sea con soluciones de HCl 0.1 N o NaOH 1 N.
Los síntomas visuales de la deficiencia nutricional se observaron y describieron al final del experimento. Una evaluación de crecimiento se realizó para las variables: altura de plantas (desde la base hasta la primera vaina de hoja completamente extendida); diámetro del tallo medido con un calibrador digital (Starrett 727-2001®, Brasil); y área foliar, medida con un sistema de análisis de imagen (Delta T Image Analysis System, Canadá). El índice de color verde fue determinado en la parte media de la hoja +1 usando un medidor de clorofila CCM200 (OptiSciences, Canadá).
Treinta días después de iniciar el experimento, se cosecharon las plantas y las raíces se separaron de las partes aéreas y secaron en un horno de ventilación forzada a 65 °C hasta alcanzar un peso constante. Luego de secarse, la MS se pesó y se trituró en un molinillo tipo Willey para el análisis químico de contenido total de Fe en partes aéreas y raíces (Bataglia et al., 1983). Con los resultados se calculó la acumulación total de Fe.
Los resultados se analizaron con ANDEVA (p≤0.05) y se realizó una regresión polinomial con los valores mayores de R2.
Resultados y discusión
Las concentraciones de Fe en la solución de nutrientes causaron un aumento con ajustes cuadráticos y cúbicos sobre la acumulación de micronutrientes, en tallos y en raíces, respectivamente (Figuras 1A y 1B). La concentración de Fe-EDDHA causante de una mayor acumulación foliar del nutriente fue 250 μmol L-1 con una acumulación de 0.30 g de Fe por maceta. Sin embargo, con la concentración de 184 μmol L-1 Fe-EDDHA la acumulación foliar fue 0.28 g de Fe por maceta. En las raíces, la mayor acumulación de Fe fue de 2 g por maceta, observada con 184 μmol L-1 de Fe-EDDHA. Esta concentración proporciona una mayor acumulación de Fe en plantas, ya que concentraciones más altas proporcionan aumentos pequeños de acumulación de nutrientes en hojas y raíces.
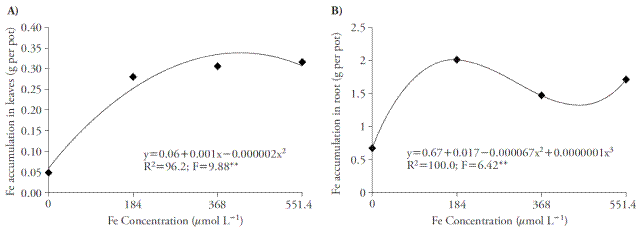
Figura 1 Efectos de concentración de Fe en hojas (A) y raíces (B) de caña de azúcar cultivada en cuatro concentraciones de solución de nutrientes. ** p≤0.01; prueba F.
Un contenido alto de Fe en raíces respecto a las hojas puede deberse al uso de fitosideróforos por los pastos (estrategia II). Estos compuestos son despedidos hacia la rizósfera desde la deficiencia férrica, facilitando la absorción de este nutriente (Nozoye et al., 2011). Por lo tanto, las plantas de la estrategia II plants poseen una mayor eficiencia de adquisición de hierro y resistencia a su deficiencia, en comparación con plantas de estrategia I (Zuo y Zhang, 2011). En el tratamiento testigo (0 μmol L-1), fue posible observar la acumulación de Fe, sobre todo en raíces, ya que la forma de diseminación ocurre por partes vegetativas; por lo tanto, se usó la palanquilla, que contenía concentraciones de Fe que influyeron el mantenimiento de la planta. Sin embargo, esta fuente se agotó en menos de 15 d, lo que permitió la verificación de síntomas de deficiencia.
Otra posible explicación para la acumulación alta de Fe en las raíces podría ser la posible adsorción en cargas negativas fijas en el apoplasto de la raíz o la precipitación en forma óxido-hidrato de Fe (III) en el rizoplano (Jin et al., 2007). Las plantas presentan la estrategia de acumular elementos metálicos para mitigar los posibles riesgos de toxicidad metálica, reduciendo su contenido en la parte aérea, lo cual podría afectar su desarrollo (Sarma, 2011).
El aumento de las concentraciones de Fe mejoró el índice de color verde y alcanzó el punto máximo en 551.4 μmol L-1 de Fe-EDDHA (Figura 2A). El aumento de este índice se debe al aumento en la acumulación de Fe en la planta, ya que hay una correlación entre ambas variables (Figura 2B).
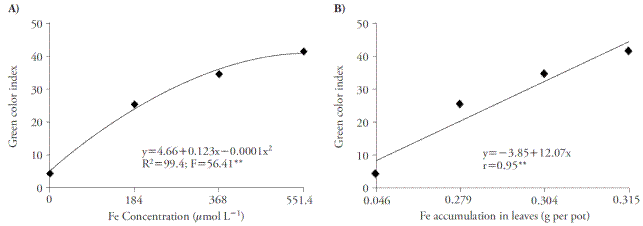
Figura 2 Efecto de concentraciones de Fe en el índice de color verde (A) y la correlación entre el índice de color verde y la acumulación en hojas (B) de caña de azúcar cultivada en cuatro concentraciones de nutrientes. **p≤0.01; prueba F.
Las plantas en el grupo testigo presentaron clorosis, en comparación con los otros tratamientos (Figura 3A). Los síntomas de deficiencia férrica inducen a la clorosis intervenal foliar, que se convirtió en manchas blancas (Figura 3B). En el tratamiento testigo las raíces mostraron menor densidad y color oscuro (Figura 3C), aunque con una mayor concentración de Fe se observó una mayor densidad de raíces y una coloración más clara (Figura 3D). Este diagnóstico visual probablemente refleje cambios fisiológicos en las raíces debido a una mayor acumulación de Fe, comparado con las partes aéreas (Figura 1).

Figura 3 (A) Todos los tratamientos; (B) Tratamiento testigo, indicando deficiencia férrica en hojas nuevas; (C) Tratamiento testigo, indicando deficiencia férrica en raíces; (D) Tratamiento de mayor concentración de Fe.
El elevado índice de color verde fue un efecto del Fe, según lo reportan por Huang et al. (2012), quienes usaron una solución de nutrientes con FeEDDHA. El contenido reducido de clorofila foliar en plantas con deficiencia férrica se podría recuperar usando una solución de nutrientes con mayores concentraciones de Fe (Pestana et al., 2012). Según Fernández et al. (2008) y Pestana et al. (2005), las concentraciones de clorofila y la acumulación de Fe se pueden usar para diagnosticar la deficiencia férrica en plantas.
La concentración de Fe que promovió un mayor diámetro (12.2 mm) y altura (25 cm) fue 184 μmol L-1 of Fe-EDDHA (Figuras 4A and 4B). Sin embargo, tomando en cuenta el área foliar, la concentración que promovió el mayor aumento fue 551.4 μmol L-1 de Fe-EDDHA para 906 cm2, mientras que 184 μmol L-1 promovió 750 cm2 (Figura 4C).

Figura 4 Efecto de concentraciones de Fe en el diámetro del tallo (A), altura de la planta (B) y área foliar (C) de la caña de azúcar en cuatro concentraciones de nutriente. **p≤0.01; prueba F.
El efecto benéfico del uso del Fe en el crecimiento, el índice de color verde y área foliar en los brotes cultivados en una solución nutritiva puede explicarse por la participación del micronutriente en varias etapas del metabolismo de biosíntesis de la clorofila y la ultraestructura de los cloroplastos (Jeong y Guerinot, 2009). Además, este nutriente forma parte del proteoma del cloroplasto, tiene una función importante en la reducción de la cantidad de proteínas involucradas en los complejos de transferencia de electrones, y eleva las proteínas involucradas en la fijación de carbono (Briat et al., 2007).
La concentración de Fe que promovió una mayor producción de MS en tallos y la planta entera fue 551.4 μmol L-1, y se obtuvo 5.20 g y 6.78 g MS por maceta, respectivamente (Figura 5). Sin embargo, no hubo un aumento considerable sobre la concentración de 184 μmol L-1, que dio 4.10 g MS para los tallos y 6.28 g para toda la planta. Al considerar las raíces, 184 μmol L-1 de Fe EDDHA promovió una mayor producción de MS (2.18 g por maceta).
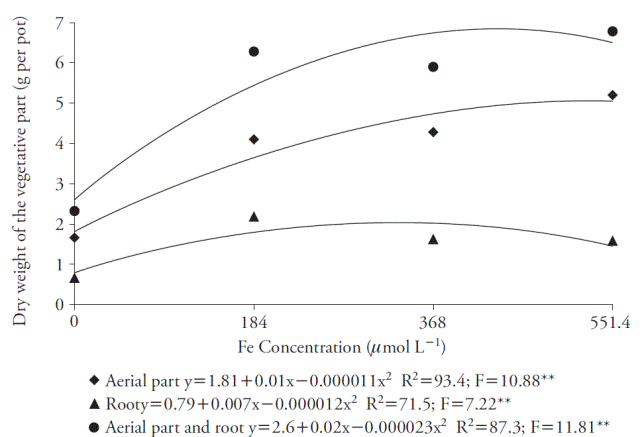
Figura 5 Efecto de concentraciones de Fe en la producción de materia seca en partes aéreas, raíces y la planta completa (parte aérea y raíces) de la caña de azúcar cultivada en cuatro concentraciones de nutriente. **p≤0.01; prueba F.
El efecto del Fe sobre la MS, usando Fe-EDDHA fue observado en otras especies por Moro et al. (2013), quienes señalan que dosis altas de Fe inducen el estrés oxidativo, elevan la producción de radicales libres y reducen la acumulación de MS de las plantas.
La concentración adecuada de hierro para las variables fue 184 μmol L-1 de Fe-EDDHA, y la ley de los incrementos decrecientes prevaleció, ya que otras concentraciones no mostraron incrementos mayores significativos. La concentración de Fe-EDDHA de 184 μmol L-1 promovió una mayor producción de MS en toda la planta para la plantación hidropónica en solución de nutrientes; por ello, sería la concentración adecuada, como lo señalan Hoagland y Arnon (1950). Además, estos resultados mostraron que el Fe-EDDHA se puede usar como fuente de hierro para la caña de azúcar.
Literature cited
Bataglia, O. C., A. M. C. Furlani, J. P. F. Teixeira, P. R. Furlani, and J. R. Gallo. 1983. Métodos de Análise Química de Plantas. Instituto Agronômico. Campinas. 48 p. [ Links ]
Briat, J.-F., C. Curie, and F. Gaymard. 2007. Iron utilization and metabolism in plants. Curr. Opin. Plant Biol. 10: 276-282. [ Links ]
Çelik, H., B. B. Aşik, S. Gürel, and A. V. Katkat. 2010. Effects of potassium and iron on macro element uptake of maize. Zemdirbyste-Agriculture 97: 11-22. [ Links ]
Fernández, V., V. Del Río, L. Pumariño, E. Igartua, J. Abadía, and A. Abadía. 2008. Foliar fertilization of peach [Prunus persica (L.) Batsch] with different iron formulations: effects on re-greening, iron concentration and mineral composition in treated and untreated leaf surfaces. Sci. Hort. 117: 241-248. [ Links ]
Jeong, J., and M. L. Guerinot. 2009. Homing in on iron homeostasis in plants. Trends Plant Sci. 14: 280-285. [ Links ]
Jin, C. W., G. Y. You, Y. F. He, C. Tang, P. Wu, and S. J. Zheng. 2007. Iron deficiency-induced secretion of phenolics facilitates the reutilization of root apoplastic iron in red clover. Plant Physiol. 144: 278-285. [ Links ]
Hoagland, D. R., and D. L. Arnon. 1950. The Water Culture Methods for Growing Plants Without Soil. California Agricultural Experimental Station. Berkeley. 347 p. [ Links ]
Huang, H., C. X. Hu, Q. Tana, X. Hu, X. Suna, and L. Bia. 2012. Effects of Fe-eddha application on iron chlorosis of citrus trees and comparison of evaluations on nutrient balance with three approaches. Sci. Hort. 146: 137-142. [ Links ]
Li, X. T., P. Cao, X. G. Wang, M. J. Cao, and H. Q. Yu. 2011. Comparison of gas exchange and chlorophyll fluorescence of low-potassium-tolerant and -sensitive soybean [Glycine max (L.) Merr.] cultivars under low-potassium condition. Photosynthetica 49: 633-636. [ Links ]
Madhuri, K. V. N., N. V. Sarala, M. H. Kumar, M. S. Rao, and V. Giridhar. 2013. Influence of micronutrients on yield and quality of sugarcane. Sugar Tech. 15: 187-191. [ Links ]
Morrissey, J., and M. L. Guerinot . 2009. Iron uptake and transport in plants: the good, the bad, and the ionome. Chem. Rev. 109: 4553-4567. [ Links ]
Moro, E., C. A. Costa, H. Cantarella, A. S. Nascente, A. L. Moro, and F. Broetto. 2013. Soil acidity as affecting micronutrients concentration, nitrato reductase enzyme activity and yield in upland rice plants. Semina 34: 3397-3410. [ Links ]
Nozoye, T., S. Nagasaka, T. Kobayashi, M. Takahashi, Y. Sato, Y. Sato, N. Uozumi, H. Nakanishi, and N. K. Nishizawa. 2011. Phytosiderophore efflux transporters are crucial for iron acquisition in graminaceous plants. J. Biol. Chem. 286: 5446-5454. [ Links ]
Pestana, M., A. Varennes, J. Abadıa, and E. A. Faria. 2005. Differential tolerance to iron deficiency of citrus rootstocks grown in nutrient solution. Sci. Hort. 104: 25-36. [ Links ]
Pestana, M., P. J. Correia, T. Saavedra, F. Gama, A. Abadía, and A. Varennes . 2012. Development and recovery of iron deficiency by iron resupply to roots or leaves of strawberry plants. Plant Physiol. Bioch. 53: 1-5. [ Links ]
Prado, R. M. 2008. Nutrição de Plantas. Universidade Estadual de São Paulo “Júlio de Mesquita Filho”. São Paulo. 407 p. [ Links ]
Sarma, H. 2011. Metal hyperaccumulation in plants: a review focusing on phytoremediation technology. J. Environ. Sci. Technol. 4: 118-138. [ Links ]
Subasinghe, R. 2006. Effect of nitrogen and potassium stress and cultivar differences on potassium ions and nitrate uptake in sugarcane. J. Plant Nutr. 29: 809-825. [ Links ]
Vale, D. W., R. M. Prado, C. C. Avalhães, and R. H. Hojo. 2011. Omissão de macronutrientes na nutrição e no crescimento da cana-de-açúcar cultivada em solução nutritiva. Rev. Bras. Ciên. Agrár. 6: 189-196. [ Links ]
Ylivainio, K., A. Jaakkola, and R. Aksela. 2004. Effects of Fe compounds on nutrient uptake by plants grown in sand media with different pH. J. Plant Nutr. Soil Sci. 167: 602-608. [ Links ]
Zuchi, S., S. Cesco, and S. Astolfi. 2012. High S supply improves Fe accumulation in durum wheat plants grown under Fe limitation. Environ. Exp. Bot. 77: 25-32. [ Links ]
Zuo, Y., and F. Zhang. 2011. Soil and crop management strategies to prevent iron deficiency in crops. Plant Soil 339: 83-95. [ Links ]
Recibido: Agosto de 2015; Aprobado: Abril de 2016











 text in
text in 


