Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agrociencia
versão On-line ISSN 2521-9766versão impressa ISSN 1405-3195
Agrociencia vol.50 no.7 Texcoco Out./Nov. 2016
Ciencia de los alimentos
Películas basadas en emulsiones de pectina de frutos de tejocote (Crataegus spp.) y cera de candelilla: caracterización y aplicación en Pleurotus ostreatus
1 Programa de Posgrado en Ciencia y Tecnología Agroalimentaria. Departamento de Ingeniería Agroindustrial. Universidad Autónoma Chapingo. 56230. México-Texcoco km 38.5, Texcoco de Mora, México.
2 Universidad Tecnológica de Huejotzingo. Camino Real San Mateo s/n. 74169. Santa Ana Xalmimilulco, Huejotzingo, Puebla, México. (svalleg@taurus.chapingo.mx).
El tejocote (Crataegus spp.) es una especie subutilizada en México, pero su fruto posee alto contenido de pectina, lo que se puede usar para dar valor agregado. Los objetivos del estudio fueron extraer pectina (HP) desde frutos de tejocote para utilizar junto con cera de candelilla (CW) en la preparación de emulsiones con 1-2 % HP y 0.5-1 % CW, y evaluar el potencial de uso de tales emulsiones como recubrimiento de productos hortofrutícolas para preservar sus atributos de calidad en postcosecha. La evaluación reológica mostró que las emulsiones se comportan como materiales estructurales típicos y las propiedades de flujo se describieron bien con el modelo de Carreau modificado. De las emulsiones se obtuvieron películas comestibles. El incremento en HP aumentó la resistencia a la tensión (0.16 a 0.22 MPa), pero redujo la capacidad de estiramiento hasta ruptura (57.2 a 4.4 %), indicando más fragilidad. La permeabilidad a vapor de agua varió entre 9.3x10-14 y 1.3x10-14 mol m s-1 m-2 Pa-1 para baja (1.0 y 0.5 %) y alta (2.0 and 1.0 %) concentración de HP y CW, respectivamente. Las emulsiones y películas hechas con pectina de tejocote fueron superiores o iguales que aquéllas hechas con pectina cítrica. Las emulsiones de HP y CW fueron aplicadas sobre Pleurotus ostreatus y aquéllas con 2 % HP y 1 % CW redujeron las pérdidas de peso, firmeza y luminosidad, respecto a rebanadas de hongo no tratadas durante un almacenamiento de 20 d a 4 °C, lo cual indica buen potencial para ser usadas en la conservación postcosecha de productos frescos.
Palabras clave: Películas comestibles; cera de candelilla; pectina de tejocote; postcosecha; vida de anaquel
Hawthorn or tejocote (Crataegus spp.) is an underutilized species in Mexico, but its fruit possesses a high pectin content, which may be utilized to give it added value. The objectives of this study were to extract pectin (HP) from hawthorn fruit to be used with candelilla wax (CW) in the preparation of emulsions with 1-2 % HP and 0.5-1 % CW, and to evaluate the potential use of such emulsions as coatings of fresh produce to preserve quality attributes in postharvest. Rheological measurements showed that emulsions behaved as typical structural materials and flow properties were well described by the modified Carreau model. Emulsions were cast to obtain edible films. Increments of HP increased tensile strength (0.16 to 0.22 MPa) but reduced its elongation at break (57.2 to 4.4 %), indicating more fragility. Water vapor permeability varied between 9.3x10-14 and 1.3x10-14 mol m s-1 m-2 Pa-1 for low (1.0 and 0.5 %) and high (2.0 and 1.0 %) concentrations of HP and CW, respectively. Emulsions and films made with HP were equal to or superior to those made with citrus pectin. Emulsions of HP and CW were applied on Pleurotus ostreatus slices, and those that received 2 % HP and 1 % CW had smaller losses of weight, firmness, and lightness, relative to untreated mushroom slices, during 20 d of storage at 4 °C, which indicates good potential for use in postharvest conservation of fresh produce.
Key words: Candelilla wax; edible films; hawthorn pectin; postharvest; shelf life
Introducción
El género Crataegus (Rosaceae: Maloideae; Hummer and Janick, 2009) incluye alrededor de 280 especies que crecen en distintas regiones templadas del Hemisferio Norte, como arbustos espinosos o pequeños árboles con hojas de color verde brillante y flores blancas (Chang et al., 2002). Los frutos son bayas que al madurar adquieren colores de amarillo a rojo y púrpura oscuro (Chang et al., 2002; Özcan et al., 2005). El fruto de tejocote (Crataegus spp.), como se le llama en México (Martínez, 1979), es una fuente de pectina de buena calidad (Wang et al., 2007), con aplicaciones potenciales en la industria alimentaria, farmacéutica y en varias industrias, derivado de su capacidad para formar geles (Thakur et al., 1997). El área de la conservación postcosecha de productos hortícolas requiere el uso de materiales como la pectina, para formular películas biopoliméricas que se usen como recubrimientos, para proporcionar protección contra daños mecánicos, químicos o microbiológicos y extender la vida útil (Falguera et al., 2011). Ahora hay mayor conciencia sobre la conservación del medio ambiente y, con base en ventajas como comestibilidad, biodegradabilidad, biocompatibilidad y el desarrollo de propiedades de barrera (Alparslan et al., 2014), las películas comestibles son una alternativa a los plásticos durante el desarrollo de atmósferas modificadas, donde un polímero como la pectina puede ser adecuado para actuar como un envase activo (Pérez-Espitia et al., 2014). De hecho, la pectina se aplica sobre productos procesados (Castro-Freitas et al., 2009), aunque se usa en mezcla con otras materias primas como almidón de maíz (Fishman et al., 2000), harina de soya (Mariniello et al., 2003) y harina de plátano (Sothornvit y Pitak, 2007).
La pectina para fines industriales se obtiene de pulpa de manzana y cáscara de cítricos (Galus y Lenart, 2013; Pérez-Espitia et al., 2014), pero también se exploran otras fuentes como la pulpa de frutos de mango (Azeredo et al., 2009). En este sentido, el fruto de tejocote podría ser una buena fuente de pectina para utilizar en formulaciones de películas biopoliméricas con potencial para ser incluidas en estrategias de conservación de productos hortofrutícolas en postcosecha, pero esa caracterización aún no se realiza. El tejocote es una especie subutilizada en México (Nieto-Ángel, 2007), pero con base a su composición y potencial antioxidante, el fruto podría ser mejor valorado (García-Mateos et al., 2012; 2013). Así, la extracción y uso de la pectina podría ser una estrategia alternativa para dar valor agregado a este recurso fitogenético.
La pectina es altamente hidrofílica porque se compone de al menos 17 tipos de monosacáridos, entre los cuales el ácido D-galacturónico es el más abundante, seguido por la D-galactosa o la L-arabinosa, unidos entre sí en forma covalente (Yapo, 2009). Debido a esto, la inclusión de un compuesto lipídico puede ser necesaria durante la formulación de recubrimientos poliméricos para regular el balance hidrofílico-lipofílico. Para nuestro estudio se seleccionó la cera de candelilla, un producto natural obtenido de la planta Euphorbia antisyphilitica, para usarse junto con la pectina y formular películas biopoliméricas, porque está reconocida como segura (GRAS) (FDA, 2003) y se ha mostrado que forma películas con buena barrera a vapor de agua (Chick and Hernandez, 2002). Por tanto, los objetivos de este estudio fueron: 1) formular y evaluar emulsiones de cera de candelilla en pectina de tejocote; 2) obtener películas comestibles a partir de las emulsiones y evaluar sus propiedades funcionales y; 3) evaluar el potencial de uso de las emulsiones de cera de candelilla en pectina de tejocote en la conservación postcosecha de productos hortofrutícolas frescos. Con el fin de atender el último objetivo, se seleccionó al hongo Pleurotus ostreatus como material experimental, porque tiene alta importancia económica (Gregori et al., 2007), pero su vida de anaquel es corta debido a velocidades altas de respiración y transpiración (Villaescusa y Gil, 2003).
Materiales y métodos
Materiales
Los frutos de tejocote provinieron de la accesión 55 del banco de germoplasma de la Universidad Autónoma Chapingo, México. La cera de candelilla (CW) fue provista por Cedrosa S. A. de C. V., México. Otros materiales usados fueron pectina cítrica (CP; 72.9 % de grado de metoxilación; Laitz® S. A. de C. V., México), carboximetilcelulosa (CMC; 700,000 g mol-1; Meyer® S. A. de C. V., México), monoestearato de sorbitan (S60; Laitz® S. A. de C. V., Mexico), glicerol (como plastificante) y etanol (96 %; Meyer® S. A. de C. V., Mexico).
Extracción de pectina
La pectina de tejocote (HP) fue extraída con el método de Yapo et al. (2007). La pulpa de los frutos fue mezclada con HCl 0.1 N (1000 mL por 100 g de pulpa), calentada a 85 °C por 45 min y filtrada a través de tela de muselina. El filtrado se mezcló (1:1) con etanol (96 % v/v), se dejó reposar a 4 °C por 24 h y se decantó el sobrenadante. Este procedimiento se repitió tres veces. Los precipitados se combinaron y se lavaron tres veces con una mezcla de etanol:agua (70:30, v/v). Después se aplicó centrifugación (equipo Sorvall RC-5B; Du Pont Instruments, MN, USA) y la pectina se purificó en agua destilada con membrana de diálisis (Spectra/Por 6 Dialysis Membrane, 12 kDa; Spectrum Laboratories Inc., CA, USA). Finalmente, el polisacárido se secó en un horno (Memmert, Wisconsin Oven Distributions, LLC, WI, USA) durante 24 h a 30x2 °C. El rendimiento de pectina fue calculado en base seca (Y p , %) con la ecuación (1), donde m p y m f son masas (g) de la pectina obtenida y la cantidad original de pulpa de tejocote usada, respectivamente:
El grado de esterificación (ED, %) fue evaluado con el método de Singthong et al. (2004), con 500 mg de pectina seca mezclada con 2 mL de etanol y 100 mL de agua destilada. Se aplicó titulación con NaOH 0.5 N (V A , mL). Después, 10 mL de NaOH 0.5 N fueron agregados con agitación y reposo por 15 min. La mezcla fue incorporada con 10 mL de HCl 0.5 N y se tituló de nuevo con NaOH 0.5 N (V B , mL). ED (%) se calculó con la ecuación (2):
Preparación de emulsiones
Cuatro emulsiones aceite en agua (O/W) se prepararon con diferente composición. Las fases dispersa y continua se prepararon por separado. La fase dispersa se hizo con CW (0.5 ó 1.0 g)+S60 (0.5 ó 1.0 g)+glicerol (1.26 g) por 100 g de emulsión. La fase continua se preparó con HP o CP (1.0 ó 2.0 g)+CMC (0.5 g)+la cantidad requerida de agua para obtener 100 g de emulsión. Ambas fases, dispersa y continua, fueron calentadas a 75±2 °C y mezcladas por separado con un homogeneizador Ultra Turrax T50 (IKA Labortechnik, Staufen, Germany). La fase dispersa se agregó gota a gota a la fase continua con agitación constante, usando el mismo homogeneizador a 10 000 rpm por 10 min, manteniendo la temperatura a 75 °C. Las emulsiones fueron codificadas como E0.5CW,1HP y E0.5CW,1CP, teniendo una fracción másica de fase dispersa (φ) de 0.0226, y como E1CW,2HP y E1CW,2CP, teniendo una φ de 0.0326.
Caracterización de emulsiones
El diámetro promedio volumen a superficie (d3,2) de las gotas de grasa en las emulsiones se midió con un analizador de tamaño de partícula (Malvern Instruments, Ltd., UK), usando muestras de 1 mL diluidas en agua destilada hasta obtener un índice de oscurecimiento de 16 % en el equipo. Además, se evaluaron las propiedades de flujo de las emulsiones con un reómetro Physica MCR 301 (Anton Paar®, Messtechnik, Germany), usando geometría cono-plato, donde el cono rotatorio tenía diámetro de 50 mm y ángulo de 1°. Pruebas de cizallamiento constante se realizaron a 20 °C aplicando tasas de corte de 0.001 a 1000 s-1 y se registró en cada nivel la viscosidad aparente.
Preparación de películas
Alícuotas de 6 mL de cada emulsión se vaciaron en cajas Petri de vidrio de 9 cm de diámetro y se secaron en un horno (Memmert, Wisconsin Oven Distributions, LLC, WI, USA) a 30±2 °C por 24 h. Así, se obtuvieron películas que fueron codificadas en función de las emulsiones como F0.5CW,1HP, F0.5CW,1CP , F1CW,2HP y F1CW,2CP.
Evaluación de películas
El espesor de las películas (δ, μm) se obtuvo como la media de cinco determinaciones con un micrómetro (Starret Company, USA) en diferentes puntos de cada película. La transparencia (T r ) se evaluó con la ecuación (3) y el método de Chana-Thaworn et al. (2011). Piezas rectangulares de 0.5 cmx4.0 cm fueron colocadas en celdas de un espectrofotómetro (CS-200PC®, Spectronics Instruments Inc., USA), perpendicular al paso de luz para evaluar transmitancia (T550) at 550 nm.
La permeabilidad a vapor de agua (WVP) se evaluó con el método de McHugh et al. (1993), con contenedores de vidrio de 125 mL, 4.5 cm en diámetro y 7.5 cm de profundidad. En cada recipiente se colocó un volumen de 35 mL de una solución acuosa de KNO3 (Meyer® S. A. de C. V., México) para generar una humedad relativa (Rh ) constante de 97 %. Cada recipiente fue cubierto con la película a ser evaluada y el conjunto se colocó en el espacio de cabeza de una cámara sellada que contenía una solución de K2CO3 anhidro (Meyer® S. A. de C. V., México) a 24±2 °C para desarrollar un ambiente interno con 54 % Rh. El flujo de vapor de agua (r
v
; mol s-1) a través de la película se calculó registrando la pérdida de peso de la solución de KNO3 en un periodo de 24 h. Las presiones parciales de vapor (Pa) fueron evaluadas dentro (
Además, las presiones parciales de vapor fueron corregidas considerando la difusión gaseosa a través de la capa de aire estática en ambos lados de la película (Gennadios et al., 1994). La WVP (mol m s-1 m-2 Pa-1) se calculó con la ecuación (5), donde A es área de transmisión de vapor de agua (m2).
La resistencia a la tensión (t) se evaluó en piezas rectangulares de 8 cmx3 cm con un analizador de textura (TA-TX2i, Stable Micro Systems, UK). Las muestras fueron estiradas hasta la ruptura a 2 mm s-1. La fuerza resultante fue dividida por la sección transversal de la película y t expresada en MPa. Además, la capacidad de estiramiento hasta ruptura (EB) se calculó, en porcentaje, con la ecuación (6), donde L i y L f fueron longitudes (mm) inicial y final de las películas (Navarro-Tarazaga et al., 2011).
Aplicación de películas
El hongo P. ostreatus fue usado para evaluar el potencial de uso de las películas comestibles de pectina de tejocote y cera de candelilla en la conservación de productos hortofrutícolas en postcosecha. El hongo fue cosechado en Nopaltepec, México (19° 44’ 43” N, 98° 38’ 26” O; 2450 msnm). Después de la cosecha, se aplicó enfriamiento rápidamente hasta 4 °C. El material se cortó en trozos de 3 cmx5 cm, se sumergió en una solución de 200 ppm de NaClO, seguido de inmersión en una solución de eritorbato de sodio (1.0 g 100 mL-1) y ácido cítrico (0.5 g 100 mL-1) por 3 min, para retardar oxidación (Ventura-Aguilar et al., 2011). Las emulsiones E0.5CW,1HP y E1CW,2HP fueron asperjadas sobre la superficie de rodajas de hongo para formar los tratamientos E1 and E2, respectivamente. Las rodajas de hongo recubiertas fueron expuestas a una corriente de aire durante 30 min y 150 g del producto de cada tratamiento fueron puestos en cada uno de 30 clamshell. Dos controles se establecieron: C2, el producto tratado sólo con NaClO y la solución antioxidante y; C1 se trató sólo con la solución de NaClO. Todos los lotes fueron colocados a 4 °C y 85 % Rh. Cada tercer día en tres clamshells de cada tratamiento se evaluaron pérdida de peso, firmeza y color. La pérdida de peso se evaluó con una balanza digital (Ohaus, USA) respecto al peso del inicio del almacenamiento. La firmeza se midió con un analizador de textura (TA-TX2i, Stable Micro Systems, UK) con una sonda esférica de 5.0 mm de diámetro, y una rutina donde el hongo fue deformado hasta 4 mm a velocidad de 4 mm s-1. El color se evaluó con un colorímetro Hunter Lab (Mini Scan XE Plus 45/0-L, USA) y se expresó como ángulo de matiz, cromaticidad y luminosidad.
Análisis de datos
La organización del estudio durante la fase de evaluación de emulsiones y películas fue con un diseño completamente al azar y la unidad experimental fue una emulsión o una película. Se esperaba que un aumento en la concentración de los constituyentes de las emulsiones afectara la reología y las propiedades mecánicas y se mejoraran las propiedades de barrera. La fase de aplicación de películas consideró un clamshell con 150 g de producto como unidad experimental y tuvo el tipo de tratamiento (C1, C2, E1 y E2) y el tiempo de almacenamiento como factores de variación. Se esperaba que al menos una de las emulsiones causara un efecto benéfico en el alargamiento de la vida de anaquel. Todas las mediciones se realizaron por triplicado y con los datos se realizó un ANDEVA y las medias se compararon con la prueba de Tukey (p≤0.05).
Resultados y discusión
Rendimiento de pectina de tejocote y grado de esterificación
El rendimiento de pectina de tejocote purificada (Y p ) fue 4.3 (±0.3) %. Los valores varían de 7 a 15 % en casos sin tratamiento de purificación (Methacanon et al., 2014; Wang et al., 2007). Esto confirma el reporte de Yapo (2009), quien afirma que la producción de pectina depende de la pureza deseada. El grado de esterificación fue 76.9±0.1 %, lo que correspondió a alto grado de metoxilación.
Propiedades de flujo de emulsiones
La viscosidad aparente (η) de las emulsiones como función de la velocidad de corte (
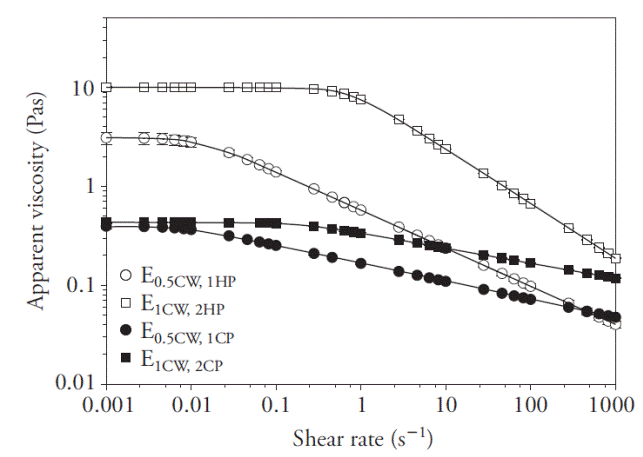
Figura 1 Cambio en viscosidad aparente (η) de las emulsiones (E) como función de la velocidad de corte (
Cuadro 1 Parámetros del modelo de Carreau modificado durante la caracterización reológica de emulsiones.
| Emulsion code† | Model parameter¶, § | R2 | ||
| η 0 (Pa s) | λ (s) | n (dimensionless) | ||
| E0.5CW,1HP | 3.09 (±0.7) b | 77.52 (±8.9) b | 0.61 (±0.01) b | 0.90 (±0.004) |
| E1CW,2HP | 9.99 (±0.3) a | 1.36 (±0.1) d | 0.45 (±0.01) c | 0.99 (±0.003) |
| E0.5CW,1CP | 0.39 (±0.1) c | 116.71 (±3.7) a | 0.82 (±0.01) a | 0.91 (±0.015) |
| E1CW,2CP | 0.43 (±0.1) c | 5.35 (±1.5) c | 0.85 (±0.02) a | 0.93 (±0.002) |
†CW: cera de candelilla; HP: pectina de tejocote, CP: pectina cítrica. Los números en los subíndices indican concentración de HP, CP o CW en porcentaje. ¶Parámetros del modelo; η 0: viscosidad límite a baja velocidad de corte; l: constante característica relacionada con el tiempo de relajación de los biopolímeros en la emulsión; n: índice de comportamiento de flujo que determina la pendiente en la región de adelgazamiento por cizalla; R2: coeficiente de determinación. §Los valores en paréntesis son errores estándar. Medias en una columna seguidas por letras distintas son estadísticamente diferentes (Tukey, p≤0.05).
Los parámetros de la ecuación (7) están en el Cuadro 1. Las emulsiones basadas en HP mostraron mayores valores en η 0 que las emulsiones basadas en CP (p≤0.05), independientemente de los valores de concentración de pectina y φ, lo que coincidió con el reporte de Wang et al. (2007), quienes encontraron que HP tiende a exhibir de cuatro a seis veces mayor viscosidad que las pectinas de cítricos o pulpa de manzana. Además, Pal (2011) indicó que la reología de emulsiones es sensible a la concentración de biopolímeros, dado que un incremento en sólidos en la fase continua puede causar aumento de la viscosidad, en tanto que McClements (2004) estableció que valores relativamente mayores en φ producen aumento en las interacciones partículapartícula, causando mayor deslizamiento entre ellas en un campo de flujo, lo que resulta también en mayor viscosidad. En nuestro estudio, E1CW,2HP exhibió mayor η 0 que E0.5CW,1HP (p≤0.05), lo cual era esperado; sin embargo, E1CW,2CP tuvo un valor de η 0 similar al de E0.5CW,1HP (p>0.05), lo cual no era esperado.
El comportamiento de las emulsiones con CP se puede explicar considerando dos efectos compensatorios. Por un lado, una mayor concentración de CP tendió a incrementar η 0, pero por otro, cuando φ aumentó, el tamaño de gota aumentó (ver subsección Tamaño de gota pequeña en emulsiones), con lo cual se redujo efectivamente el número de gotas por unidad de volumen, resultando en un decremento en η 0 y, por tanto, ambos efectos resultaron compensados.
El parámetro λ (Cuadro 1) está relacionado con el tiempo de relajación de una emulsión y su inverso (1/λ) es la velocidad de corte crítica (
Tamaño de gota pequeña de emulsiones
Las emulsiones tuvieron los siguientes valores de diámetro d3,2: 1.79 (±0.01) μm (E0.5CW,1HP)=1.75 (±0.01) μm (E1CW,2HP)=1.71 (±0.02) μm (E0.5CW,1CP)<1.99 (±0.02) μm (E1CW,2CP) (diferencia significativa honesta [HSD]=0.19 μm). De acuerdo con McClements (2004), durante la emulsificación, aun antes que el cizallamiento ha cesado, las gotas pequeñas pueden estar en movimiento continuo y frecuentemente colisionan entre sí por causa de la gravedad y de su movimiento Browniano. Se espera que el movimiento y la frecuencia de colisión sean moduladas por la viscosidad aparente de la fase continua y por la fracción másica de la fase dispersa. Por tanto, es posible que el tamaño de partícula en E0.5CW,1HP y E1CW,2HP no fue significativamente diferente porque el mayor φ fue balanceado con la mayor viscosidad aparente en la segunda emulsión. Además, el tamaño de partícula en E1CW,2CP fue significativamente mayor que en E0.5CW,1CP , debido probablemente a que la primera tuvo mayor φ que la segunda, pero su viscosidad aparente fue similar en todo el rango de velocidad de corte estudiado (ver subsección Propiedades de flujo de emulsiones).
Espesor de películas
Concentraciones mayores de pectina y φ produjeron películas significativamente más gruesas, pero el origen de la pectina (tejocote o cítricos) no tuvo efecto significativo en esta variable. El espesor de las películas varió de 47.3 a 94.3 μm (Cuadro 2). El espesor depende del método de preparación. A nivel industrial se pueden obtener valores entre 150 y 1040 μm a través de métodos de vaciado o extrusión (Pérez-Espitia et al., 2014). En nuestro estudio se usó un método de vaciado y se usaron volúmenes constantes para reducir la variabilidad. Galus y Lenart (2013) mostraron que un aumento en pectina puede causar un incremento en espesor, debido a las propiedades coloidales de este compuesto. Sin embargo, el aumento en espesor se ha asociado también con un incremento de lípidos en las películas (Ghasemlou et al., 2011; Ayala-Zavala et al., 2012).
Cuadro 2 Espesor, transparencia, resistencia a la tensión, capacidad de estiramiento hasta ruptura y permeabilidad a vapor de agua de películas comestibles.
| Parameter† | Film code¶, § | HSD | |||
| F0.5CW,1HP | F1CW,2HP | F0.5CW,1CP | F1CW,2CP | ||
| δ | 63.0 (±3.0) b | 94.3 (±5.1) a | 47.3 (±10.2) b | 102.0 (±8.5) a | 19.10 |
| T r | 1.98 (±0.04) a | 1.43 (±0.05) b | 2.03 (±0.06) a | 1.56 (±0.03) b | 0.26 |
| τ | 0.16 (±0.04) b | 0.22 (±0.01) a | 0.14 (±0.01) b | 0.06 (±0.03) c | 0.06 |
| EB | 57.2 (±2.1) a | 4.4 (±1.8) d | 23.9 (±2.8) b | 15.4 (±2.5) c | 5.46 |
| WVPx1014 | 9.3 (±0.7) a | 1.3 (±0.3 b | 9.2 (±2.0) a | 1.2 (±0.3) b | 6.01 |
†Parámetros de películas; δ: espesor (μm); T r : transparencia (%); τ: resistencia a la tensión (MPa); EB: capacidad de estiramiento hasta ruptura (%); WVP: permeabilidad a vapor de agua (mol m s-1 m-2 Pa-1). ¶CW: cera de candelilla, HP: pectina de tejocote, CP: pectina cítrica. Los números en los sub-índices indican concentración de HP, CP, or CW en porcentaje. §Los valores en paréntesis son errores estándar. Medias en un renglón seguidas por letras distintas son significativamente diferentes. HSD: diferencia significativa honesta (Tukey, p≤0.05).
Transparencia de películas
Todas las películas fueron opacas aun cuando las formulaciones fueron incorporadas con CMC. De acuerdo con Aulin et al. (2013), la CMC tiene la habilidad de formar películas transparentes. Es posible que las gotas de cera se dispersan en la emulsión y reflejan la luz en la misma forma como un rayo de luz atraviesa el medio (efecto Tyndall). Este efecto es más pronunciado a medida que la concentración de la fase dispersa es mayor. En nuestro estudio, el aumento en φ causó reducción en transparencia, independientemente del origen de la pectina (Cuadro 2). La transparencia varió como sigue: F0.5CW,1CP (2.03)=F0.5CW,1HP (1.98)>F1CW,2CP (1.56)=F1CW,2HP (1.43). Además, la apariencia opaca puede aumentar en las películas comestibles si el componente lipídico está presente en mayor concentración (Fabra et al.,2009;Rodrigues et al., 2014).
Propiedades mecánicas de películas
Las propiedades mecánicas de películas basadas en polisacáridos están a menudo reportadas en términos de resistencia la tensión (τ) y capacidad de estiramiento hasta ruptura (EB ). La τ hace referencia a la resistencia mecánica de la película debido a fuerzas de cohesión entre cadenas, en tanto que EB mide la plasticidad o capacidad para extenderse antes de la ruptura (Galus y Lenart, 2013). Un valor alto en τ es generalmente necesario en películas comestibles con el propósito de soportar la tensión normal encontrada durante su aplicación en un alimento, el envasado de éste y su posterior manipulación. Sin embargo, debido a su estructura, las películas con alto τ muestran bajo EB (Galus y Lenart, 2013). En nuestro estudio, τ aumentó de 0.155 a 0.219 MPa al incrementar la concentración de HP, pero disminuyó de 0.136 a 0.063 MPa a medida que aumentó la concentración de CP en las películas. De acuerdo con Silva-Weiss et al. (2013), τ puede aumentar o disminuir en función de la interacción entre ingredientes. Por tanto, con base en propiedades reológicas, las películas con CP provinieron de emulsiones con estructura más débil que aquéllas con HP y esto se reflejó en una menor τ de las primeras. Sin embargo, los valores encontrados fueron pequeños. Maftoonazad et al. (2007) reportaron τ de 2.0-7.5 MPa en películas de pectina-cera de abeja, para concentraciones del polisacárido entre 2.0 y 9.0 %. Además, Farris et al. (2011) encontraron 11.09 MPa en películas de gelatina-pectina e indicaron que las interacciones iónicas entre la gelatina cargada positivamente y la pectina cargada negativamente produjeron hidrogeles con arreglos moleculares homogéneos que mejoraron la resistencia a la tensión. La inclusión de una fase dispersa lipídica puede reducir τ, debido a una relajación de la matriz polimérica (Fabra et al., 2009; Navarro-Tarazaga et al., 2011). En el caso particular de películas con CP, la reducción de τ a medida que φ aumentó puede posiblemente ser atribuida a la interrupción de la agregación de cadenas de CP en la red por las gotas relativamente grandes de la fase dispersa, la cual pudo favorecer el deslizamiento de cadenas durante el estiramiento, mostrando más bien un comportamiento plástico (no elástico) (Bonilla et al., 2012). En contraste, en el caso de películas con HP, a medida que la concentración de pectina aumentó surgió una matriz del polisacárido más coherente y con mayor entre cruzamiento, disminuyendo el efecto de CW en la relajación de la estructura, como fue evidenciado por un incremento en τ. El aumento en concentración de pectina y CW, sin embargo, causó reducción significativa en la capacidad de estiramiento de las películas antes de la ruptura (EB ), con valores de 57.2 a 4.4 % en películas con HP y de 23.9 a 15.4 % en películas con CP (Cuadro 2), lo que sugiere un incremento en rigidez de la estructura. Nuestros resultados indican que HP forma películas auto-soportadas con buenas propiedades mecánicas, pero con gran fragilidad. Para aumentar la capacidad de estiramiento de las películas, se debería agregar plastificantes como sorbitol y glicerol, que actúan químicamente entre las cadenas poliméricas moleculares, reduciendo las fuerzas de cohesión y permitiendo el estiramiento de la estructura. Maftoonazad et al. (2007) reportaron un incremento en EB cuando agregaron sorbitol a películas basadas en pectina y atribuyeron tal comportamiento a la sustitución de puentes de hidrógeno pectina-pectina con puentes de hidrógeno pectinasorbitol, lo que redujo la interacción directa entre cadenas poliméricas y aumentó de la movilidad segmental de cadenas, lo cual mejoró la extensibilidad de las películas. En nuestro estudio, la plastificación se consiguió con cantidades constantes de glicerol en las películas, independientemente de la concentración de pectina, pero quizá el reemplazo de puentes de hidrógeno pectina-pectina con puentes de hidrógeno pectina-glicerol no fue suficiente para producir un aumento en EB.
Permeabilidad a vapor de agua
El aumento en concentración de pectina y CW causó reducción significativa en la permeabilidad a vapor de agua (WVP), de 9.26x10-14 a 1.25x10-14 mol m s-1 m-2 Pa-1 (valores promedio), independientemente del origen de la pectina usada (Cuadro 2). Este comportamiento era esperado, pues la incorporación de un compuesto lipídico en una película polimérica causa reducción en WVP (Bahram et al., 2014; Baldwin y Hagenmaier, 2012). Bosquez-Molina et al. (2003) reportaron que en películas basadas en goma de mezquite se tuvo un decremento de 29.1 % en WPV cuando la cera de candelilla fue agregada (1.75 % p/p) a la matriz polimérica, en tanto que Ruíz-Ramos et al. (2006) reportaron un decremento de 34.6 % en WVP cuando se agregó CW en proporción de 2 % (p/p) a películas de goma de mezquite-quitosano. Similarmente, Chick y Hernandez (2002) reportaron una reducción de 27.3 % en WVP de películas basadas en caseína cuando se agregó 5 % de CW. Los valores de WVP de las películas de nuestro estudio fueron menores que los valores típicos reportados en la literatura para otras películas basadas en pectina, lo cual es una característica positiva. En particular, los valores encontrados fueron menores que los de películas de carragenina-pectina (9.5x10-11 mol m s-1 m-2 Pa-1; Alves et al., 2010) o películas basadas en pectina como único ingrediente (9.6x10-12 mol m s-1 m-2 Pa-1; Galus y Lenart, 2013), sin la adición de lípidos. WVP es una variable importante cuando una película biopolimérica se usará en la conservación de productos hortofrutícolas en postcosecha, dado que éstos pueden experimentar velocidades de transpiración altas y pérdida de calidad cuando se les expone a ambientes de baja humedad relativa (Morillon et al., 2002). Por tanto, es muy importante usar películas con baja WVP y esto enfatiza el efecto causado por CW en nuestro estudio, dado que su incorporación puede mejorar el potencial de las películas de pectina para proteger los productos de la deshidratación.
Aplicación de películas
La aplicación de recubrimientos comestibles sobre productos hortofrutícolas tiene varios propósitos: reducir la pérdida de agua y solutos, limitar el intercambio gaseoso con el ambiente y actuar como vehículo para la incorporación de aditivos (Martín-Belloso et al., 2005). Dado que la pectina es un polímero con alta hidrofilicidad, es necesario verificar que los recubrimientos basados en pectina-cera de candelilla sean útiles para reducir la transpiración cuando sean aplicados sobre productos hortofrutícolas. El hongo comestible P. ostreatus tiene corta vida de anaquel y uno de los principales factores de su deterioro está dado por altas tasas de transpiración que causan altas pérdidas de peso. En adición, el hongo experimenta rápido deterioro en postcosecha, lo cual es acompañado por velocidades de respiración altas (Villaescusa y Gil, 2003) y sugiere actividad metabólica alta. Las emulsiones basadas en HP-CW fueron aplicadas sobre rodajas de P. ostreatus con el propósito de verificar, primero, que desarrollan propiedades de barrera a vapor de agua que son suficientemente altas para reducir la velocidad de transpiración y, segundo, que los cambios en atributos de calidad son reducidos suficientemente para conseguir alargar la vida de anaquel. Un buen comportamiento de los recubrimientos en este tipo de materiales puede ser evidencia de su potencial para aplicarlos en otros productos hortrofrutícolas.
El material del tratamiento sin antioxidante y sin recubrimiento (C1) mostró rápido deterioro, el cual se caracterizó por la presencia de manchas oscuras, dando evidencia de decaimiento al día 10 e indicando el término de la vida útil del material. Esta situación fue acompañada por alta velocidad de pérdida de peso, aunque no hubo diferencia significativa con el hongo tratado con una solución antioxidante (C2) y tampoco con el material cubierto con la emulsión E0.5CW,1HP (E1). En contraste, la aplicación de la emulsión E1CW,2HP (E2) redujo significativamente la pérdida de peso del hongo en relación a los tratamientos control (Figura 2A). Dado que la práctica de adicionar un compuesto lipídico ha probado que causa reducción en la pérdida de peso (Bibi and Baloch, 2014), el efecto benéfico de E2 fue atribuido a la mayor presencia de cera de candelilla, lo cual fue coherente con la menor permeabilidad a vapor de agua (WVP) que fue encontrada en las películas correspondientes.

Figura 2 Comportamiento fisiológico de Pleurotus ostreatus durante un almacenamiento de 20 días expresado como pérdida acumulativa de peso (A), ángulo de matiz y cromaticidad (B), firmeza (C) y luminosidad (D). C1: tratamiento testigo sin tratamiento antioxidante y sin ningún recubrimiento; C2: tratamiento testigo con solución antioxidante pero sin ningún recubrimiento adicional; E1: material tratado con solución antioxidante y recubierto con emulsión con 0.5 % CW y 1 % HP (E0.5CW,1HP); E2: material tratado con solución antioxidante y recubierto con emulsión con 1 % CW y 2 % HP (E1CW,2HP), donde CW es cera de candelilla y HP es pectina de tejocote. Letras diferentes indican diferencia significativa. HSD: diferencia significativa honesta (Tukey, p≤0.05). Las barras de error corresponden a error estándar.
La firmeza del material de ambos tratamientos control y aquella del tratamiento E1 experimentó reducción continua durante el almacenamiento, mientras el hongo del tratamiento E2 mantuvo firmeza significativamente mayor que el resto durante los primeros 10 días de almacenamiento, aunque posteriormente experimentó una reducción gradual en esta propiedad mecánica (Figura 2C). El material de todos los tratamientos mostró tonalidad amarillenta y, aunque el ángulo de matiz tuvo el menor valor en el tratamiento C1 y el mayor en el tratamiento E2, las diferencias no tuvieron importancia práctica. En el caso de la cromaticidad no hubo diferencias significativas (Figura 2B), pero la luminosidad fue significativamente mayor en el material recubierto con una emulsión de HP-CW que en ambos tratamientos control (Figura 2D), lo que indicó que el recubrimiento mejoró la apariencia del hongo. Falguera et al. (2011) reportaron que la aplicación de recubrimientos biopoliméricos sobre la superficie de productos hortofrutícolas puede inducir un efecto de atmósfera modificada, que puede afectar el color, la firmeza, la calidad sensorial, el crecimiento microbiano, la producción de etileno, y resulta en alargamiento de la vida de anaquel. En nuestro estudio, los efectos benéficos obtenidos con emulsiones con HP y CW con 2 y 1 % en concentración, respectivamente, sugirieron que los recubrimientos correspondientes exhibieron propiedades de barrera a O2 y CO2 que fueron suficientemente altas para causar reducción de la actividad metabólica. Sin embargo, la permeabilidad de los recubrimientos a estos gases deberá ser evaluada en trabajos futuros, con el propósito de disponer de mayor información que permita explicar los beneficios encontrados. No obstante, los recubrimientos de HP y CW con 2 y 1 %, respectivamente, se podrían usar como parte de una estrategia de conservación de productos hortofrutícolas, en virtud de que exhiben buen potencial para reducir el efecto de los factores de deterioro en el hongo P. ostreatus. En adición, el uso de pectina extraída de frutos de tejocote en formulaciones de recubrimientos puede constituir una estrategia factible para agregar valor a esta especie.
Conclusiones
Las emulsiones basadas en pectina de tejocote y cera de candelilla exhibieron un comportamiento reológico que correspondió a un fluido pseudoplástico, lo que fue coherente con el modelo de Carreau modificado. El incremento en la concentración de pectina permitió una región Newtoniana más amplia, con un tamaño de partícula estable en la fase dispersa.
Las películas poliméricas mostraron resistencia a la tensión que incrementó con el incremento en la concentración de pectina, causando, al mismo tiempo, reducción en la capacidad de estiramiento hasta ruptura, con incremento de opacidad. La permeabilidad a vapor de agua fue baja y, por tanto, estas películas pueden ser buenas barreras al intercambio a vapor de agua. Las películas basadas en pectina de tejocote y cera de candelilla exhibieron buen potencial para ser usadas en la conservación postcosecha del hongo Pleurotus ostreatus.
Literature cited
Advani, S. G., and E. M. Sozer. 2010. Process Modeling in Composites Manufacturing. CRC Press, Boca Raton, FL, USA. 630 p. [ Links ]
Alparslan, Y., T. Baygar, T. Baygar, H. Hasanhocaoglu, and C. Metin. 2014. Effects of gelatin-based edible films enriched with laurel essential oil on the quality of rainbow trout (Oncorhynchus mykiss) fillets during refrigerated storage. Food Technol. Biotech. 52: 325-333. [ Links ]
Alves, V. D., N. Costa, and I. M. Coelhoso. 2010. Barrier properties of biodegradable composite films based on kappacarrageenan/pectin blends and mica flakes. Carbohyd. Polym. 79: 269-276. [ Links ]
Aulin, C., E. Karabulut, A. Tran, L. Wågberg, and T. Lindström. 2013. Transparent nanocellulosic multilayer thin films on polylactic acid with tunable gas barrier properties. ACS Appl. Mater. Inter. 5: 7352-7359. [ Links ]
Ayala-Zavala, J. F., B. A. Silva-Espinoza, M. R. Cruz-Valenzuela, J. M. Leyva, L. A. Ortega-Ramírez, D. K. Carrazco-Lugo, J. J. Pérez-Carlón, B. G. Melgarejo-Flores, G. A. González Aguilar, and M. R. A. Miranda. 2012. Pectin-cinnamon leaf oil coatings add antioxidant and antibacterial properties to fresh-cut peach. Flavour Frag. J. 28: 39-45. [ Links ]
Azeredo, H. M. C., L. H. C. Mattoso, D. Wood, T. G. Williams, R. J. Avena-Bustillos, and T. H. McHugh. 2009. Nanocomposite edible films from mango puree reinforced with cellulose nanofibers. J. Food Sci. 74: N31-N35. [ Links ]
Bahram, S., M. Rezaei, M. Soltani, A. Kamali, S. M. Ojagh, and M. Abdollahi. 2014. Whey protein concentrate edible film activated with cinnamon essential oil. J. Food Process. Pres. 38: 1251-1258. [ Links ]
Baldwin, E. A., and R. D. Hagenmaier. 2012. Introduction. In: Baldwin, E. A., R. Hagenmaier, and J. Bai (eds). Edible Coatings and Films to Improve Food Quality. CRC Press, Boca Raton, FL. pp. 1-12. [ Links ]
Bibi, F., and M. K. Baloch. 2014. Postharvest quality and shelf life of mango (Mangifera indica L.) fruit as affected by various coatings. J. Food Process. Pres. 38: 499-507. [ Links ]
Bonilla, J., L. Atarés, M. Vargas, and A. Chiralt. 2012. Effect of essential oils and homogenization conditions on properties of chitosan-based films. Food Hydrocolloid. 26: 9-16. [ Links ]
Bosquez-Molina, E., I. Guerrero-Legarreta, and E. J. Vernon-Carter. 2003. Moisture barrier properties and morphology of mesquite gum-candelilla wax based edible emulsion coatings. Food Res. Int. 36: 885-893. [ Links ]
Bosquez-Molina, E., S. A. Tomás, and M. E. Rodríguez-Huezo. 2010. Influence of CaCl2 on the water vapor permeability and the surface morphology of mesquite gum based edible films. LWT-Food Sci. Technol. 43: 1419-1425. [ Links ]
Castro-Freitas, D. G., S. A. Garcia-Berbari, P. Prati, F. M. Fakhouri, F. P. Collares-Queiroz, and E. Vicente. 2009. Reducing fat uptake in cassava product during deep-fat frying. Food Eng. 94: 390-394. [ Links ]
Chana-Thaworn, J., S. Chanthachum, and T. Wittaya. 2011. Properties and antimicrobial activity of edible films incorporated with kiam wood (Cotyleobium lanceotatum) extract. LWT-Food Sci. Technol. 44: 284-292. [ Links ]
Chang, Q., Z. Zuo, F. Harrison, and M. S. S. Chow. 2002. Hawthorn. J. Clin. Pharmacol. 42: 605-612. [ Links ]
Chick, J., and R. J. Hernandez. 2002. Physical, thermal, and barrier characterization of casein-wax-based edible films. J. Food Sci. 67: 1073-1079. [ Links ]
Fabra, M. J., P. Talens, andA. Chiralt. 2009. Microstructure and optical properties of sodium caseinate films containing oleic acid-beeswax mixtures. Food Hydrocolloid. 23: 676-683. [ Links ]
Falguera, V., J. P. Quintero, A. Jiménez, J. A. Muñoz, and A. Ibarz. 2011. Edible films and coatings, structures, active functions and trends in their use. Trends Food Sci. Tech. 22: 292-303. [ Links ]
Farris, S., K. M. Schaich, L. Liu, P. H. Cooke, L. Piergiovanni, and K. L. Yam. 2011. Gelatin-pectin composite films from polyion-complex hydrogels. Food Hydrocolloid. 25: 61-70. [ Links ]
FDA (Food and Drug Administration). 2003. Code of federal regulations title 21, food and drugs, CFR184. Department of Health and Human Services, Washington DC, USA. pp: 559. [ Links ]
Fishman, M. L., D. R. Coffin, R. P. Konstance, and C. I. Onwulata. 2000. Extrusion of pectin/starch blends plasticized with glycerol. Carbohyd. Polym. 41: 317-325. [ Links ]
Galus, S., and A. Lenart. 2013. Development and characterization of composite edible films based on sodium alginate and pectin. J. Food Eng. 115: 459-465. [ Links ]
García-Mateos, R., E. Ibarra-Estrada, and R. Nieto-Angel. 2013. Antioxidant compounds in hawthorn fruits (Crataegus spp.) of Mexico. Rev. Mex. Biodiv. 84: 1298-1304. [ Links ]
García-Mateos, R., L. Aguilar-Santelises, M. Soto-Hernández, R. Nieto-Angel, and G. Kite. 2012. Total phenolic compounds, flavonoids and antioxidant activity in the flowers of Crataegus spp. from México. Agrociencia 46: 651-662. [ Links ]
Gennadios, A., C. L. Weller, and C. H. Gooding. 1994. Measurement errors in water vapor permeability of highly permeable, hydrophilic edible films. J. Food Eng. 21: 395-409. [ Links ]
Ghasemlou, M., F. Khodaiyan, A. Oromiehie, and M. S. Yarmand. 2011. Characterization of edible emulsified films with low affinity to water based on kefiran and oleic acid. Int. J. Biol. Macromol. 49: 378-384. [ Links ]
Gregori, A., M. Švagelj, and J. Pohleven. 2007. Cultivation techniques and medicinal properties of Pleurotus spp. Food Technol. Biotech. 45: 238-249. [ Links ]
Hummer, K. E., and J. Janick. 2009. Rosaceae: taxonomy, economic importance, genomics. In: Folta, K. M., and S. E. Gardiner (eds). Genetics and Genomics of Rosaceae, Plant Genetics and Genomics: Crops and Models 6. Springer, New York, USA. pp. 1-18. [ Links ]
Maftoonazad, N., H. S. Ramaswamy, and M. Marcotte. 2007. Evaluation of factors affecting barrier, mechanical and optical properties of pectin-based films using response surface methodology. J. Food Process Eng. 3: 539-563. [ Links ]
Mariniello, L., P. Di Pierro, C. Esposito, A. Sorrentino, P. Masi, and R. Porta. 2003. Preparation and mechanical properties of edible pectin-soy flour films obtained in the absence or presence of transglutaminase. J. Biotechnol. 102: 191-198. [ Links ]
Martín-Belloso, O., R. C. Soliva-Fortuny, and E. A. Baldwin. 2005. Conservación mediante recubrimientos comestibles. In: González-Aguilar, G. A., A. A. Gardea, and F. Cuamea-Narrarro (eds). Nuevas Tecnologías de Conservación de Productos Vegetales Frescos Cortados. Logiprint Digital S.A. de C.V., México. pp: 341-356. [ Links ]
Martínez, M. 1979. Catálogo de Nombres Vulgares y Científicos de Plantas Mexicanas. Fondo de Cultura Económica. México. 1247 p. [ Links ]
McClements, D. J. 2004. Food emulsions: principles, practice and techniques. CRC Press, Boca Raton, FL, USA. 614 p. [ Links ]
McHugh, T. H., R. Avena-Bustillos, and J. M. Krochta. 1993. Hydrophilic edible films: modified procedure for water vapor permeability and explanation of thickness effects. J. Food Sci. 58: 899-903. [ Links ]
Methacanon, P., J. Krongsin, and C. Gamonpilas. 2014. Pomelo (Citrus maxima) pectin: effects of extraction parameters and its properties. Food Hydrocolloid. 35: 383-391. [ Links ]
Morillon, V., F. Debeaufort, G. Blond, M. Capelle, and A. Voilley. 2002. Factors affecting the moisture permeability of lipidbased edible films: a review. Crit. Rev. Food Sci. 42: 67-89. [ Links ]
Navarro-Tarazaga, M. L., A. Massa, and M. B. Pérez-Gago. 2011. Effect of beeswax content on hydroxypropyl methylcellulosebased edible film properties and postharvest quality of coated plums (Cv. Angeleno). LWT-Food Sci. Technol. 44: 2328-2334. [ Links ]
Nieto-Ángel, R. 2007. Colección, conservación y caracterización del tejocote (Crataegus spp.). In: Nieto-Ángel, R. (ed). Frutales Nativos, Un Recurso Fitogenético de México. Universidad Autónoma Chapingo, Estado de México, México. pp: 25-107. [ Links ]
Özcan, M., H. Haciseferoğullari, T. Marakoğlu, and D. Arslan. 2005. Hawthorn (Crataegus spp.) fruit: some physical and chemical properties. J. Food Eng. 69: 409-413. [ Links ]
Pal, R. 2011. Rheology of simple and multiple emulsions. COCIS 16:41-60. [ Links ]
Pérez-Espitia, P., W. X. Du, R. J. Avena-Bustillos, N. F. Ferreira-Soares, andT. H. McHugh. 2014. Edible films from pectin: physical-mechanical and antimicrobial properties a review. Food Hydrocolloid. 35: 287-296. [ Links ]
Rodrigues, D. C., C. A. Caceres, H. L. Ribeiro, R. F. A. Abreu, A. P. Cunha, and H. M. C. Azeredo. 2014. Influence of cassava starch and carnauba wax on physical properties of cashew tree gum-based films. Food Hydrocolloid. 38: 147-151. [ Links ]
Ruíz-Ramos, J. O., J. P. Pérez-Orozco, J. G. Báez-González, E. Bósquez-Molina, C. Pérez-Alonso, andE. J. Vernon-Carter. 2006. Interrelationship between the viscoelastic properties and effective moisture diffusivity of emulsions with the water vapor permeability of edible films stabilized by mesquite gum-chitosan complexes. Carbohyd. Polym. 64: 355-363. [ Links ]
Silva-Weiss, A., M. Ihl, P. J. A. Sobral, M. C. Gómez-Guillén, and V. Bifani. 2013. Natural additives in bioactive edible films and coatings: functionality and applications in foods. Food Eng. Rev. 5: 200-216. [ Links ]
Singthong, J., W. C. Steve, S. Ningsanond, and G. H. Douglas. 2004. Structural characterization, degree of esterification and some gelling properties of Krueo Ma Noy (Cissampelos pareira) pectin. Carbohyd. Polym. 58: 391-400. [ Links ]
Sothornvit, R., and N. Pitak. 2007. Oxygen permeability and mechanical properties of banana films. Food Res. Int. 40: 365-370. [ Links ]
Thakur, B. R., R. K. Singh, A. K. Handa, and M. A. Rao. 1997. Chemistry and uses of pectin a review. Crit. Rev. Food Sci. 37: 47-73. [ Links ]
Ventura-Aguilar, R., M. T. Colinas-León, M. T. Martínez-Damián, and S. Valle-Guadarrama. 2011. Atmósferas modificadas, frigoconservación e inhibidores de oscurecimiento en poscosecha de Pleurotus ostreatus. Rev. Mex. Cie. Agríc. 2: 197-206. [ Links ]
Villaescusa, R., and M. I. Gil. 2003. Quality improvement of Pleurotus mushrooms by modified atmosphere packaging and moisture absorbers. Postharvest Biol. Tec. 28: 169-179. [ Links ]
Wang, N., C. Zhang, Y. Qi, and T. Li. 2007. Extraction and food chemical characterizations of haw pectins. Sci. Technol. Food Ind. 11: 87-92. [ Links ]
Yapo, B. M. 2009. Pectin quantity, composition and physicochemical behaviour as influenced by the purification process. Food Res. Int. 42: 1197-1202. [ Links ]
Yapo, B. M., C. Robert, I. Etienne, B. Wathelet, and M. Paquot. 2007. Effect of extraction conditions on the yield, purity and surface properties of sugar beet pectin extracts. Food Chem. 100: 1356-1364. [ Links ]
Recibido: Octubre de 2015; Aprobado: Mayo de 2016











 texto em
texto em 


