Introducción
El inicio de la pubertad en las hembras ovinas se caracteriza por la activación del eje hipotalámico-adenohipofisario-gonadal que precede al establecimiento de la actividad ovárica cíclica (Amstalden et al., 2011), la cual se modifica por el suministro de hormonas exógenas para inducir el pico preovulatorio de la hormona luteinizante (LH), la ovulación y la ocurrencia del estro (Letelier et al., 2011) o para acelerar su inicio, sincronizarlo y mejorar la eficiencia reproductiva en ovejas prepúberes (Abecia et al., 2012).
Los eventos reproductivos responden a los factores ambientales que incluyen el fotoperiodo, la nutrición, el estrés y la bioestimulación. Así, el control de algunos o todos estos factores, permite que la reproducción en las ovejas ocurra sin aplicar hormonas exógenas (Scaramuzzi y Martin, 2008). Estos factores pueden basarse en el conocimiento de los efectos socio-sexuales y nutricionales (Scaramuzzi et al., 2014). Los primeros se describen como una secuencia de eventos fisiológicos y endócrinos de ovejas en anestro, en respuesta a las feromonas de un carnero sexualmente activo (efecto macho) que culmina en la ovulación y en la formación de un cuerpo lúteo (Hawken y Martin, 2012). Los efectos nutricionales pueden observarse al complementar la dieta con aminoácidos neuroestimuladores (Wu, 2010), energía (Schneider et al., 2012) u ofrecer una dieta integral (Kara et al., 2010).
Los mecanismos nutricionales que regulan el inicio de la pubertad implican la integración de sensores y efectores metabólicos, en la función de las neuronas que sintetizan la hormona liberadora de gonadotropinas (GnRH) en el hipotálamo (Amstalden et al., 2011). Esta comunicación neuronal se favorece por la acción de neurotransmisores y aumenta con el suministro de aminoácidos neuroestimulantes (Brann y Mahesh, 1995): la arginina estimula la secreción de LH en ovejas prepúberes, por ser un constituyente para activar el eje hipotalámico-adenohipofisiari gonadal durante el desarrollo puberal (Recabarren et al., 1996); el aspartato aumenta la secreción de LH y testosterona en los machos (Estienne et al., 2000); el glutamato induce al pico preovulatorio de LH, acelera el inicio de la pubertad y el comportamiento reproductivo (Mahesh y Brann, 2005). La glutamina, la prolina, y la glicina participan en la regulación de la salud, la supervivencia, el crecimiento, el desarrollo, la lactancia y la reproducción (Wu, 2010); o en la expresión génica, la fertilidad, la neurotransmisión y la inmunidad en los animales (Wu, 2014).
Por lo anterior, el objetivo del presente estudio fue evaluar la respuesta del efecto macho y la acción de un reconstituyente energético comercial para inducir la primera ovulación y caracterizar el pico preovulatorio de LH en ovejas Pelibuey prepúberes.
Materiales y métodos
Localización del área de estudio
El estudio se realizó de octubre a diciembre de 2011 en el Laboratorio de Reproducción de Ovinos y Caprinos (LaROCa) del Colegio de Postgraduados, Campus Montecillo, Texcoco, Estado de México (19° 29’ N, 98° 53’ O, 2250 m de altitud y clima Cb (wo) (w) (i’) g, que corresponde a templado subhúmedo con lluvias en verano, precipitación y temperatura promedio anual de 636.5 mm y 15.2 °C; García, 2004).
Animales experimentales y manejo
En el estudio se usaron 46 ovejas Pelibuey prepúberes de 215±8.3 d de edad y 24.40±3.54 kg de peso. Cada oveja consumió 2.0 kg d-1 de una dieta elaborada con heno molido de avena (70 %) mezclado con un concentrado comercial (30 %) con 15 % proteína cruda y 2.9 Mcal EM kg-1, sales minerales y agua a libre acceso. El peso se registró cada semana para determinar los cambios durante el estudio y registrar el peso en la primera ovulación.
Protocolo experimental y tratamientos
El diseño experimental fue con un arreglo de dos factores, cada uno a dos niveles (2 ́2): Factor A, con (c) y sin (s) el reconstituyente energético comercial (REC, Metabolase®); y factor B, con (c) y sin (s) efecto macho. Esto generó cuatro tratamientos (T): T1 (n=12) ovejas testigo sin el REC y sin el efecto macho (sRECsEM); T2 (n=12) ovejas con 100 mL del REC cada tercer día durante 15 d y sin el efecto macho (cRECsEM); T3 (n=10) ovejas sin el suministro REC y con el efecto macho durante 54 h (sRECcEM); y T4 (n=12) ovejas con 100 mL del REC cada tercer día durante 15 d y con el efecto macho durante 54 h (Figura 1).

Figura 1 Protocolo de inducción a la ovulación en ovejas Pelibuey prepúberes en respuesta a la acción del reconstituyente energético comercial (cRECsEM), al estímulo con efecto macho (sRECcEM), a la interacción de factores (cRECcEM) y al tratamiento testigo (sRECsEM).
El REC (Metabolase®; Schütze-Segen, Italia) contenía en cada 100 mL: L-carnitina (613.3 mg), ácido tióctico (20 mg), piridoxina (15 mg), cianocobalamina (3 mg), acetilmetionina (2000 mg), L-arginina (240 mg), L-ornitina (153.2 mg), L-citrulina (120 mg), L-lisina (62.5 mg), glicina (150 mg), ácido aspártico (150 mg), ácido glutámico (150 mg), fructosa (5000 mg) y sorbitol (8000 mg).
Durante siete semanas previas al efecto macho (EM), todas las ovejas se mantuvieron a una distancia mínima de 100 m del corral de los carneros, para evitar el contacto visual, auditivo y olfativo entre ellos; y así aumentar el estímulo al momento del contacto. Después, las ovejas expuestas al macho se condujeron a un corral con una estructura metálica interna, que permitió tener contacto visual, olfativo y auditivo, pero no contacto físico con el carnero; lo cual facilitó el manejo durante la recolección de sangre. Durante el EM el carnero se sustituyó por uno diferente cada 4 h hasta las 56 h.
Evaluación de la actividad ovárica
Todas las ovejas se exploraron por laparoscopía (Mellisho et al., 2006); la primera vez para diagnosticar la presencia de cuerpo lúteo (CL) y se realizó 2 d antes de introducir al carnero, y se repitió 9 d después para evaluar la respuesta de los tratamientos (Figura 1). Los folículos ováricos se clasificaron de acuerdo con su diámetro aproximado (2 a 3 mm, 4 a 5 mm, y mayores de 6 mm; Bartlewski et al., 2011). La tasa ovulatoria (TO) fue el número total de CL presentes en respuesta a los tratamientos. El porcentaje de ovejas que ovularon se determinó por laparoscopía y con la presentación del pico preovulatorio de LH.
Determinación del pico preovulatorio de la hormona luteinizante (LH)
En las ovejas estimuladas con EM se recolectaron 5 mL de sangre vía punción de la vena yugular cada 2 h, desde 6 h antes de introducir el carnero, hasta 56 h después de su presencia (Figura 1), para observar el pico preovulatorio de LH inducido por el EM y determinar la proporción de ovejas que presentaron el pico: 1) el inicio del pico es el tiempo transcurrido desde la introducción del carnero hasta que la concentración promedio basal de LH por oveja excedió como mínimo dos desviaciones estándar y se mantuvo 4 h (Van Cleeff et al., 1998); 2) la duración del pico es el tiempo desde su inicio o se mantuvo 4 h y terminó cuando volvió a concentraciones basales (Van Cleeff et al., 1998); 3) la amplitud del pico fue la diferencia entre la máxima concentración de LH (ng mL-1) menos la concentración basal (CB) por oveja. La CB fue el promedio entre dos muestras antes y después del pico preovulatorio (Mattioli et al., 1986). Las muestras de sangre se recolectaron en tubos de vidrio de 5 mL y se centrifugaron a 600 g por 15 min. En seguida se separó el plasma por decantación y se vertió en tubos de plástico de 5 mL que se almacenaron a -20 °C hasta cuantificar la concentración de LH. El análisis se realizó por radioinmunoanálisis, con la técnica de doble anticuerpo (Perera-Marín et al., 2005), la cual detectó como mínimo 0.03 ng mL-1 de LH y 5 y 8 % de coeficientes de variación para el intra e inter ensayo.
Análisis estadístico
Los datos se analizaron con SAS® (SAS Institute Inc, 2012). La cantidad de folículos ováricos observados por laparoscopía se comparó con el procedimiento NPAR1WAY y la prueba de Kruskal-Wallis. La tasa ovulatoria se analizó con el procedimiento TTEST y la prueba de t pareada. La duración y la amplitud del pico preovulatorio sólo se determinó en las ovejas con EM, con un análisis estadístico de mediciones repetidas para un diseño completo con tratamientos aleatorizados mediante el procedimiento MIXTO (Littell et al., 1998); el tiempo de muestreo fue la variable fija y la concentración de LH la variable aleatoria.
Los datos de ovejas que presentaron el pico preovulatorio de LH se analizaron con una regresión logística con PROC LOGISTIC mediante la prueba de Wald. Con los datos de cambio de peso se realizó ANDEVA con el procedimiento MIXTO (Littell et al., 1998), se utilizó LSMEANS para calcular las medias de los mínimos cuadrados de los efectos fijos, y ADJUST para ajustar las pruebas de comparación múltiple de medias en pares (Tukey, p≤0.05), con un modelo mixto en un arreglo factorial 2 ́2, modificado para observar los efectos principales e interacciones en el periodo de evaluación (semanal):
Yijkl=μ+Ai+Bj+(A*B)ij+dij+Pk+(A*P)ik+(B*P)jk +(A*B*P)ijk+Eijkl
donde Yijkl: variable respuesta, i: 1,2; j: 1,2; k: 1,2...11; l: 1,2.; m: media general; Ai: efecto del factor A, reconstituyente energético comercial en i; Bj: efecto del factor B, efecto macho en j; Pk= efecto del periodo P en k; dji: error aleatorio dentro de efectos principales (tratamientos); (AB)ij, (AP)ik, (BP)jk, (ABP) ijk, (AB)ij: efecto de las interacciones; Eijkl: error aleatorio.
El peso de las ovejas con EM en la primera ovulación se determinó con análisis por contrastes ortogonales con el procedimiento GLM.
Resultados y discusión
Folículos ováricos y tasa ovulatoria
La acción del cRECsEM, el efecto macho (sRECcEM), así como su interacción (cRECcEM), no aumentaron (p>0.05) la cantidad de folículos ováricos de 2 a 3 mm, de 4 a 5 mm, ni los mayores a 6 mm de diámetro. Hubo una cantidad mayor (p≤0.05) de folículos de 4 a 5 mm de diámetro sólo en las ovejas testigo (sRECsEM; Figura 2).

Figura 2 Folículos ováricos en ovejas Pelibuey prepúberes en respuesta a la acción del reconstituyente energético comercial (cRECsEM), al efecto macho (sRECcEM), a la interacción de factores (cRECcEM) y al tratamiento testigo (sRECsEM). ** p≤0.01.
Zavala-Elizarrarás et al. (2008) indican que la raza de las ovejas influye en la cantidad de folículos ováricos, pero no en el diámetro folicular ni en la tasa ovulatoria y reportan 9.3 folículos de 1.5 mm de diámetro y una tasa ovulatoria de 1.4 como promedio para ovejas Pelibuey. Estos valores coinciden con lo reportado por Pellicer-Rubio et al. (2013), pero difieren de los obtenidos en las ovejas Pelibuey prepúberes, en nuestro estudio. Quizás la respuesta de los tratamientos para aumentar la cantidad de los folículos ováricos se relacione con el desarrollo folicular ovárico que presentaron las ovejas al iniciar los tratamientos. Debido a que la diferenciación folicular se observa en el reclutamiento, donde los folículos sensibles a las gonadotropinas son 32 mm de diámetro, y en la selección, los folículos ováricos de 4 mm de diámetro son los dominantes, y los demás sufren atresia (Bartlewski et al., 2011).
La primer laparoscopía diagnosticó que ninguna oveja presentó CL y la segunda mostró que la cantidad de CL no aumentó (p>0.05) por acción del cRECsEM, pero sí aumentó (p≤0.05) en las ovejas Pelibuey prepúberes estimuladas con efecto macho (sRECcEM) y con la interacción con el cRECcEM. Esas ovejas presentaron sólo un CL cada una, por lo cual la tasa ovulatoria fue similar (p>0.05), pero superior (p≤0.05) al de las ovejas testigo (sRECsEM) y al de aquellas tratadas con el cRECsEM (Cuadro 1).
Cuadro 1 Cantidad de cuerpos lúteos en ovejas Pelibuey prepúberes en respuesta a dos niveles del reconstituyente energético comercial y el efecto macho.
| Tratamientos | n | Ovejas que ovularon (n) | Cuerpos lúteos (n) | Tasa ovulatoria |
| Ovejas testigo | 12 | 0 | 0 | 0.00 a |
| Ovejas con reconstituyente energético y sin “efecto macho” | 12 | 2 | 2 | 0.17 a |
| Ovejas sin reconstituyente energético y con “efecto macho” | 10 | 7 | 7 | 0.70 b |
| Ovejas con reconstituyente energético y con “efecto macho” | 12 | 9 | 9 | 0.75 b |
a, b: Valores con distinta letra en una columna son estadísticamente diferentes (p≤0.05).
Alcaraz-Romero et al. (2012) reportan 61.5% de ovejas Pelibuey prepúberes que ovularon con efecto macho y presentaron tasa ovulatoria de 1.4±0.2. Esto difiere del 70 % de ovejas que ovularon con efecto macho (sRECcEM) y presentaron tasa ovulatoria de 0.7 en nuestro estudio. Cuando la ovulación se induce con la presencia del carnero, también se estimula el inicio de la función luteal (Bartlewski et al., 2002). Por tanto, en nuestro estudio, las ovejas Pelibuey prepúberes estimuladas con efecto macho ovularon por la presencia continua del carnero, la cual estimuló la producción de GnRH y la secreción de LH (Abecia et al., 2012). Pero la similitud en la tasa ovulatoria de las ovejas testigo (sRECsEM), con respecto a las suministradas con el REC sin efecto macho (cRECsEM), responde a una falla en la inducción a la ovulación y se atribuye a que la acción del REC quizás no fue suficiente para estimular la actividad ovárica. Esto coincide con el efecto similar en la foliculogénesis y en las concentraciones hormonales de ovejas testigo comparadas con las alimentadas con ración extra de 500 g d-1 de granos de Lupinus luteus (Somchit et al., 2007). Pero nuestro resultado contrasta con la diferencia en el inicio de la pubertad en ovejas alimentadas con un complemento de L-arginina (Hamra et al., 2003), o en la eficiencia reproductiva en ovejas que recibieron más vitaminas, minerales, aminoácidos neuroestimuladores y sorbitol en la dieta (Kara et al., 2010).
Pellicer-Rubio et al. (2013) no encontraron relación entre el efecto macho y el estado folicular de las ovejas en anestro con la capacidad de ovular por la exposición del macho. Por tanto, quizás la acción neuroestimuladora del glutamato, el aspartato y la arginina contenidos en el REC mejoró la respuesta al efecto macho, y esta interacción se reflejó en la tasa ovulatoria, en la inducción del pico preovulatorio de LH y la ovulación (Estienne et al., 2000; Mahesh y Brann, 2005; Wu, 2010). Estudios posteriores evaluarán la dosis y el suministro para cada aminoácido en el REC, el aprovechamiento y función individual para estimular la actividad ovárica en ovejas prepúberes (Wu, 2014).
Caracterización del pico preovulatorio de la hormona luteinizante (LH)
El efecto macho (sRECcEM) y su interacción con el REC (cRECcEM) no afectaron (p>0.05) las características del pico preovulatorio de LH (Cuadro 2), el porcentaje de respuesta o la concentración (Figura 3) del pico preovulatorio de LH en las ovejas Pelibuey prepúberes.
Cuadro 2 Características del pico preovulatorio de LH en ovejas Pelibuey prepúberes en respuesta al suministro del reconstituyente energético comercial y el efecto macho.
| Tratamiento | n | Pico (%) | Inicio† (h) | Ocurrencia† (h) | Duración† (h) | Amplitud† (ng mL-1) |
| Ovejas sin reconstituyente energético y con “efecto macho” | 10 | 70.0 | 12.0±4.4 | 21.1±3.3 | 11.5±1.0 | 17.6±0.8 |
| Ovejas con reconstituyente energético y con “efecto macho” | 12 | 91.7 | 15.8±2.8 | 23.2±2.6 | 11.2±1.8 | 17.5±0.8 |
No hubo diferencias entre tratamientos (p>0.05). †Media ± error estándar.

Figura 3 Cantidades plasmáticas de LH en ovejas Pelibuey prepúberes en respuesta al efecto del reconstituyente energético comercial (cRECcEM) y la interacción con el efecto macho (sRECcEM).
La introducción repentina de carneros en ovejas anovulatorias modifica la frecuencia pulsátil de GnRH y LH, la descarga preovulatoria de LH ocurre de 3 a 30 h después de la introducción del macho y la ovulación se presenta de 24 a 60 h (Hawken y Martin, 2012). Knights et al. (2002) reportaron respuesta total al pico preovulatorio de LH en ovejas expuestas al carnero. Este valor es similar a los resultados obtenidos en nuestro estudio, y la similitud entre tratamientos coincide con la caracterización del pico preovulatorio de LH obtenida por Camacho-Ronquillo et al. (2008); pero difiere de los valores reportados por Knights et al. (2002). Las diferencias se atribuyen a que las ovejas en anestro ovulan en respuesta a la introducción del carnero, aunque el efecto macho no estimule la secreción de LH, cuando la retroacción del estrógeno es demasiado fuerte (Martin y Cognie, 1984), o que la caracterización del pico preovulatorio de LH se determinó en época diferente del año, porque en época reproductiva se espera una respuesta favorable al efecto macho (Chanvallon et al., 2011). Quizás la presencia continua del macho es el elemento principal que desencadena la presentación del pico preovulatorio de LH, debido a que si el carnero se retira antes de que la oveja ovule, la frecuencia de la secreción pulsátil de LH se reduce a concentraciones basales.
Cambio de peso corporal
Durante el periodo experimental el efecto macho no afectó (p>0.05) el peso de las ovejas pero la acción del REC y su interacción con el efecto macho (cRECcEM) influyó (p≤0.05) en el cambio de peso de las ovejas (Cuadro 3).
Cuadro 3 Prueba para efectos fijos y la interacción por periodo semanal, para el cambio de peso en ovejas Pelibuey prepúberes, en respuesta al reconstituyente energético comercial y al efecto macho.
| Efecto | Periodo experimental (d) | p≤ | |||||||||||
| 0 | 7 | 14 | 21 | 28 | 35 | 42 | 49 | 56 | 63 | 70 | 77 | ||
| Reconstituyente energético*tiempo | NS | * | * | * | * | * | * | NS | * | ** | NS | ** | 0.0011 |
| “efecto macho” x tiempo | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | NS | 0.1237 |
| Interacción x tiempo | NS | NS | * | * | * | ** | * | NS | NS | ** | NS | * | 0.0041 |
NS: No significativo (p>0.05); *p≤0.05; **p≤0.01.
Las ovejas tratadas con el REC y con efecto macho presentaron peso mayor que las del grupo testigo (p≤0.05; cRECcEM 25.0±0.68 kg; sRECsEM: 22.2±0.68 kg). El peso de las ovejas con efecto macho en la primera ovulación y con la interacción con el REC se registró a los 63 d del periodo experimental y fue similar entre tratamientos (p>0.05; sRECcEM: 29.3 kg; cRECcEM: 29.8 kg; Figura 4).
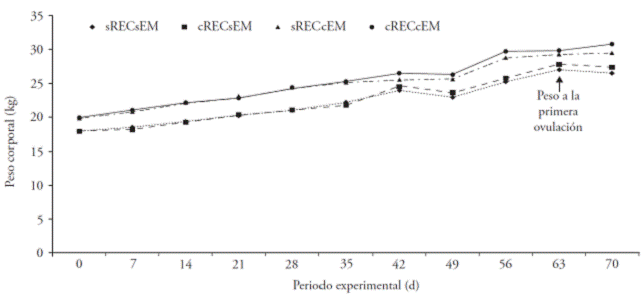
Figura 4 Peso corporal en ovejas Pelibuey prepúberes en respuesta al reconstituyente energético comercial (cRECsEM), al efecto macho (sRECcEM), a la interacción de factores (cRECcEM) y tratamiento testigo (sRECsEM).
En nuestro estudio, el peso a la primera ovulación se asemeja a los 27.6±0.2 kg de peso al primer CL (Zavala-Elizarrarás et al., 2008), pero difirió con los 39 kg de peso a la primera ovulación en ovejas inducidas al pico preovulatorio de LH con efecto macho en época reproductiva (Al-Mauly et al., 1991). También fue similar a los 31.2±0.7 kg de peso a la pubertad en ovejas que recibieron L-arginina (Hamra et al., 2003) y a los 32.5±1.4 kg de peso en ovejas con efecto macho (Álvarez y Andradre, 2008). Estas diferencias se relacionan con la nutrición y la actividad reproductiva en rumiantes, debido a que las evidencias son variables e inconsistentes (Zavala-Elizarrarás et al., 2008).
Las ovejas recibieron la misma dieta durante el experimento; aunque se sometieron a técnicas como la laparoscopía o recolección de sangre frecuente no presentaron cambios de peso corporal. Es posible que las condiciones de manejo en los animales, se consideren como factor estresante para los eventos reproductivos, en los que la disminución en peso y la condición corporal baja sean una consecuencia (Dobson et al., 2012). Por tanto, el peso a la pubertad se considera como variable indicativa que se relaciona con los factores ambientales, como las condiciones climáticas, el estado nutricional, la condición corporal y el nivel de estrés (Zavala-Elizarrarás et al., 2008).
Las diferencias encontradas en la tasa ovulatoria y ausentes en la actividad ovárica de las ovejas Pelibuey prepúberes en nuestro estudio, es posible que se asocien a una atresia folicular mayor en ovejas con el REC y sometidas al efecto macho, por lo cual se observaron pocos folículos reclutados y seleccionados para el crecimiento, maduración y ovulación. No obstante, esta hipótesis debe probarse en futuros estudios. Pero la respuesta de las ovejas sin el REC y sin efecto macho, sirvió para comparar los efectos de los tratamientos mencionados. El pico preovulatorio de LH se presentó en las ovejas expuestas a la presencia del carnero, con o sin el suministro del REC. El manejo de las ovejas por laparoscopía o durante la recolecta de sangre, no afectaron el peso a la primera ovulación de las ovejas Pelibuey prepúberes con REC.
Conclusiones
La acción del reconstituyente energético, el efecto macho, y su interacción, no aumentan la cantidad de folículos ováricos de diámetro diferente. Pero, el efecto macho y la interacción con el reconstituyente energético mejoran la tasa ovulatoria, influyen en la respuesta a la presentación del pico preovulatorio de LH y en el porcentaje de ovulación.
El peso de las ovejas no cambia por el efecto macho, pero sí con el suministro del reconstituyente energético y la interacción con el efecto macho durante el periodo de evaluación, aunque no hay cambios en el peso a la primera ovulación.





![Ocurrencia de micotoxinas en alfalfa (Medicago sativa L.), sorgo [Sorghum bicolor (L.) Moench] y zacate (Cenchrus ciliaris L.) en venta al menudeo en el estado de Nuevo León, México](/img/es/next.gif)





 texto en
texto en 


