Introducción
En décadas recientes se ha investigado fuentes energéticas alternativas que sustituyan paulatinamente a los combustibles fósiles. Ahora, el interés por los biocombustibles, en especial para el sector transporte, se debe a cuatro factores: 1) seguridad en el suministro de energía, 2) disminución de las reservas de hidrocarburos, 3) volatilidad del precio del petróleo, y 4) mitigación de los efectos del cambio climático.
Los biocombustibles de primera generación producidos desde maíz y caña de azúcar impulsaron el aumento de los precios de los alimentos en 2007 y 2008. Esto causó inestabilidad económica y cuestionar la función de los biocombustibles en la crisis alimentaria. Así, los biocombustibles a partir de biomasa lignocelulósica surgieron como alternativa, pues usan como materias primas residuos forestales y agrícolas, como bagazo de caña de azúcar, olote y rastrojo de maíz, paja de trigo y arroz; industriales como pulpa y desechos del procesamiento del papel; residuos sólidos urbanos; y además cultivos de pastos y árboles de crecimiento rápido.
La biomasa lignocelulósica es una matriz densa constituida principalmente de celulosa, hemicelulosas y lignina (Demirbas, 2004). La celulosa es una cadena lineal de unidades de glucosa unidas por enlaces β(1"4). Las hemicelulosas son principalmente cinco azúcares: glucosa, galactosa, manosa, xilosa, y arabinosa. La lignina está integrada por compuestos fenólicos que actúan como inhibidores de la fermentación de los azúcares (Robinson et al., 2002).
En México existe potencial para la producción de bioetanol a partir de material lignocelulósico. Pero, aún existen limitantes técnicas y económicas que impiden la bioconversión eficiente de la biomasa en bioetanol. Los rendimientos de etanol desde biomasa lignocelulósica pueden ser 0.11 a 0.27 m3 Mg-MS-1 (ORNL, 2006).
El etanol se usa como materia prima química o como promotor de octano de gasolinas. Mezclas de etanol:gasolina (v:v) se produjeron en proporciones 8:92 % (Hernández-Salas et al., 2009). El bioetanol se combina con 10 % de gasolina sin plomo (E10) y se usa en motores de combustión interna sin modificar. Con la mezcla E10 se define la cantidad máxima de etanol permitida para motores no modificados, por las garantías de fabricantes de automóviles (Yacobucci, 2010). En México, la ley de bioenergéticos se aprobó en 2008, y fomenta el uso de bioetanol en la gasolina nacional para reducir el uso de agentes oxigenantes, como éter metil tert-butílico que es dañino por ser un compuesto estable, soluble y contaminante de aguas subterráneas (Nava et al., 2007). Ahora, los biocombustibles se consideran fuente de energía complementaria para suministrar la demanda energética del sector transporte y electricidad.
Algunas gramíneas de crecimiento rápido se han evaluado como materia prima para la producción de bioetanol de segunda generación. Las tres especies principales son: Panicum virgatum (Sarath et al., 2008; Schmer et al., 2008), Pennisetum purpureum (Anderson et al., 2008) y Miscanthus giganteus (Murnen et al., 2007).
En México las evaluaciones de pastos de rápido crecimiento, se están iniciando para determinar su potencial como fuente de materia prima para la producción de bioetanol. El objetivo de este estudio fue evaluar el potencial de Urochloa brizantha (Sin. Brachiaria brizantha) cv. Toledo, en seis frecuencias de corte, para producir bioetanol en áreas tropicales.
Materiales y métodos
Área de estudio
El rendimiento de biomasa se evaluó en el Sitio Experimental Papaloapan de INIFAP (18° 06’ N, 95° 31’ O y 65 msnm), en Cd. Isla, Veracruz, México, con clima AwO y temperatura media de 25.7 °C (García, 1988); suelo acrisol órtico, francoarenoso, pH de 4 a 4.7, pobre en materia orgánica, nitrógeno, calcio, potasio y contenidos medios a altos de fósforo y magnesio (Enríquez y Romero, 1999). Las determinaciones físicoquímicas de materia seca (MS) del forraje se realizaron en el Laboratorio para Materiales Lignocelulósicos de INIFAP, San Martinito, Puebla, México, con excepción del contenido de N, que se realizó en el laboratorio de fertilidad de suelos y química ambiental del Colegio de Postgraduados, Campus Montecillo. Las variables evaluadas fueron rendimiento de biomasa, extractivos, holocelulosa, celulosa, lignina, N, poder calorífico, y se realizó el análisis inmediato para humedad, carbono fijo, material volátil, cenizas.
Establecimiento de parcelas
La siembra se realizó el 22 de julio de 2011, en surcos con separación de 0.50 m, en parcelas experimentales de 5 m de ancho por 16 m de longitud, con tres repeticiones. Dos fertilizaciones se aplicaron 43 y 112 d después de la siembra, con la fórmula 12080-00 kg ha-1 de N y P2O5.
Rendimiento de biomasa (MS ha -1 )
La acumulación de biomasa se determinó por unidad de superficie para cada frecuencia de corte, 30, 60, 90, 120, 150 y 180 d después del corte de homogeneización (ddch), en muestreos destructivos por un año. En cada parcela se lanzó al azar, en cinco ocasiones, un marco cuadrado de metal de (7 m2) y se cortó el forraje total (planta entera), el remanente se dejó a 20 cm de altura para la recuperación de la planta. La biomasa cosechada se pesó en balanza de precisión (Ohaus, Mod. GT-4000; 6.200 kg ±0.1 g). Después, el peso fresco de una submuestra se registró, se deshidrató en una estufa de aire forzado (Felisa, Mod. FE-243A), a 55 °C hasta peso constante y se calculó la MS.
Preparación de las muestras para análisis
Las muestras secadas en la estufa se pulverizaron en un molino (Wiley; PA, USA) y se tamizaron con mallas No. 40 (0.42-1.00 mm) y No. 60 (0.25-0.42 mm). Luego se realizaron las determinaciones químicas, el análisis inmediato y el poder calorífico.
Composición química
La norma TAPPI T-204 (TAPPI, 2007) se usó para la liberación de extractivos. El contenido de holocelulosa se determinó por el método de cloración ácida (Rowell et al., 2005) y la celulosa con el procedimiento de la norma ASTM D1103 (ASTM, 1977). Las hemicelulosas se obtuvieron después de extraer la celulosa de la holocelulosa. La lignina se determinó de acuerdo con la norma TAPPI T-222 os-74 (TAPPI, 2007) y el contenido de nitrógeno por el método semi-micro Kjeldahl (AOAC-984.13; 1990). Seis determinaciones se realizaron por cada frecuencia de corte en dos repeticiones por muestra.
Análisis inmediato
Para determinar la humedad se utilizó el método de la norma ASTM E871, material volátil según ASTM E872, cenizas según ASTM D 1102-84 (ASTM, 2012) y el carbono fijo se calculó con la fórmula: CF100 (humedad cenizas material volátil). Tres repeticiones se evaluaron por muestra y nueve por frecuencia de corte.
Poder calorífico
El poder calórico se determinó en un calorímetro de bomba adiabática (Isoperibol, Parr 1266), de acuerdo con la norma ASTM (E711), a 300.5 °C, con pastillas comprimidas de 1 g máximo. El contenido de humedad se determinó en una balanza térmica Ohaus MB45. Cinco determinaciones por muestra se analizaron y 15 repeticiones por frecuencia de corte.
Rendimiento teórico de bioetanol
El rendimiento teórico de bioetanol se determinó con base a las reacciones de hidrolisis y de transformación de azúcares a etanol, con sus ecuaciones químicas respectivas y estequiometria de reacción de celulosa y hemicelulosas, y las formulas siguientes (Badger, 2002; Dien, 2010):
Para celulosa
Para hemicelulosas
Total
donde RET: L Mg-1 MS, C: kg celulosa Mg-1 biomasa, H: kg hemicelulosas Mg-1 biomasa, C g/c : concentración de glucosa (1.111kg glucosa kg-1 celulosa), H x/h : concentración de xilosa (1.136 kg xilosa kg-1 hemicelulosas), Ecc: eficiencia de conversión de la celulosa (0.76), Ech: eficiencia de conversión de las hemicelulosas (0.90), Ret: rendimiento estequiométrico de etanol (0.511 kg etanol/kg glucosa; 0.511 kg etanol kg-1 xilosa), Efg: eficiencia de fermentación glucosa (0.75), Efx: eficiencia de fermentación xilosa (0.50), Det: densidad de etanol (0.78 Mg m3).
Además, la cantidad teórica anual de bioetanol (L) que produce 1 ha de Toledo se calculó para cada frecuencia de corte. El procedimiento consistió en multiplicar el rendimiento teórico de bioetanol por unidad de biomasa, por el rendimiento anual de biomasa.
Análisis estadístico
El diseño experimental fue de bloques al azar con arreglo de parcelas divididas: la parcela grande fue el genotipo, y la parcela chica fue la frecuencia de corte (30, 60, 90, 120, 150 y 180 d) con tres repeticiones. El ANDEVA se realizó con el procedimiento GLM y las medias se compararon con la prueba de Tukey (p≤0.05). Los datos se analizaron para estimar el efecto de frecuencia de corte, y se usó SAS para Windows versión 9 (SAS Institute, 2002).
Resultados y discusión
Rendimiento de biomasa
En el rendimiento de biomasa anual y la frecuencia de corte se observaron diferencias (p≤0.05). La producción de biomasa aumentó con la frecuencia de corte. La excepción fue el corte cada 150 d, en el cual la cantidad de biomasa disminuyó 21.9 %, con respecto a la frecuencia de corte de 120 d. La producción mayor de biomasa fue 28 Mg ha-1 año-1 con la frecuencia de corte de 180 d (Cuadro 1). Con cortes cada 30 d la producción de biomasa fue menor (11.12 Mg ha-1 año-1 ). Cab et al. (2007) obtuvieron 16.8 Mg ha-1 con pasto Toledo cortado cada 32 d. Switchgrass (Panicum virgatum) se estudia con fines energéticos y es materia prima adecuada por los rendimientos altos de biomasa, de 17.3 Mg ha-1 (Parrish and Fike, 2005) a 37.6 Mg ha-1 (Thomason et al., 2004). Los híbridos de Miscanthus sinensis también se consideran adecuados para fines energéticos; en las regiones del norte de Europa su rendimientos es 25 Mg ha-1, y en el centro y sur puede ser 38 Mg ha-1 (Lewandowski et al., 2003). El incremento de la proporción de pared celular con la edad del pasto puede ser la causa principal del incremento de MS, y es afectado por factores como disponibilidad de agua, fertilización, desarrollo radical, época del año, plagas y enfermedades.
Cuadro 1 Rendimiento de biomasa y producción teórica de bioetanol del pasto Urochloa brizantha cv. Toledo en seis frecuencias de cosecha.
| Frecuencias de cosecha (días) | Rendimiento (Mg ha -1 año -1 ) | Poder calorífico (MJ kg -1 ) | Producción de energía (GJ ha -1 año -1 ) | Humedad (%) |
|---|---|---|---|---|
| 30 | 11.1f | 16.37a | 182.2f | 8.40c |
| 60 | 13.7e | 16.33a | 224.2e | 7.40c |
| 90 | 18.4c | 16.64a | 307.2c | 8.20a |
| 120 | 20.7b | 16.37a | 340.1b | 7.90c |
| 150 | 16.2d* | 16.72a | 271.5d | 6.80bc |
| 180 | 28.0a | 16.69a | 466.6a | 7.70ab |
| Media | 18.40 | 16.52 | 298.7 | 7.79 |
| EE | 2.40 | 0.07 | 40.70 | 0.19 |
EE: Error estándar. Letras diferentes muestran diferencias entre cortes (Tukey, p≤0.05).
El rendimiento de biomasa de la variedad Toledo es inferior a los de Miscanthus y Switchgrass, pero las condiciones de producción y sitio de crecimiento influyen en el rendimiento de biomasa. Por esto, la información de diferentes estudios es útil, aunque se modifique por el ambiente.
Poder calorífico y contenido de humedad
La humedad alta reduce la eficiencia de la combustión porque gran parte del calor liberado se usa para evaporar el agua en lugar de la reducción química del material (Hakkila, 1989). El contenido de humedad fue diferente (p≤0.05) entre las frecuencias de corte (Cuadro 1).
El poder calorífico por unidad de masa es la variable que determina la energía disponible en la biomasa (Godin et al., 2013) y no mostró diferencias entre las frecuencias de corte (p>0.05) (Cuadro 1); su intervalo fue de 16.3 MJ kg-1 a 16.7 MJ kg-1. En nuestro estudio, el poder calorífico no mostró relación directa con la frecuencia de corte, opuesto a lo observado en especies leñosas. La leña es la más usada para generar energía y su poder calorífico aproximado es 20 MJ kg-1. Los valores de Switchgrass son 18.1 MJ kg-1 (Jenkins et al., 1998) y 17.4 MJ kg-1 (McKendry, 2002). El valor de maderas de coníferas es 20.5 MJ kg-1 y el de maderas de latifoliadas es 20.2 MJ kg-1 (CEN, 2005). El poder calorífico promedio de Toledo es de 16.52 MJ kg-1, lo que es inferior al de maderas y otros pastos.
La producción anual mayor de energía (466.56 Gigajulios; GJ) por hectárea con pasto Toledo se logra con la cosecha cada 180 d (dos cortes anuales) (Cuadro 1). Los rendimientos anuales con eucalipto (Eucalyptus spp.) en Brasil (24 Mg ha-1) y la energía anual por hectárea (448.52 GJ) (Roger et al., 2011) fueron menores a los obtenidos con pasto Toledo.
Composición química
Total de extractivos
La composición química permite definir la metodología para pretratamiento, hidrólisis y fermentación. Los extractivos funcionan como intermediarios metabólicos, reserva de energía o forman parte de mecanismos de protección, son responsables del color, olor y resistencia al marchitamiento de las plantas (Olanders y Steenari, 1995). En las frecuencias de estos componentes se observaron diferencias (p≤0.05) (7.7 a 11.8 % en 90 y 180 d). La frecuencia en los pastos Maralfalfa (Pennisetum glaucum Pennisetum purpureum), Bermuda (Cynodon dactylon) y King (Pennisetum híbrido) fue 10.7, 5.5 y 16.9 % (Lee et al., 2009; Mateus et al., 2012; Cardona, 2013; Cuadro 2). Rowell et al. (2005) reportan 8 y 9 % en madera de coníferas y latifoliadas. La cantidad de extractivos depende de la fisiología y la morfología de la planta y las condiciones ambientales. Los extractivos no pueden ser transformados a etanol, por lo que la biomasa lignocelulósica con cantidad mayor de extractivos causará rendimiento menor de etanol.
Cuadro 2 Composición química del pasto Urochloa brizantha cv. Toledo en seis frecuencias de cosecha.
| Frecuencia de cosecha (días) | Componente (%) | |||||
|---|---|---|---|---|---|---|
| Holocelulosa† | Celulosa† | Hemicelulosas† | Lignina† | Extractivos | Proteína | |
| 30 | 69.5cd | 39.4d | 30.1a | 16.8c | 10.1bc | 8.2a |
| 60 | 71.3cd | 41.3c | 30.0a | 16.2c | 10.8abc | 4.8b |
| 90 | 68.5d | 41.7c | 26.7c | 19.5a | 7.7d | 4.3bc |
| 120 | 71.5b | 42.6bc | 28.9ab | 16.8c | 9.4c | 4.3bc |
| 150 | 72.7ab | 44.1a | 28.5b | 17.1bc | 11.5ab | 2.4c |
| 180 | 73.6a | 43.7ab | 29.9ab | 18.3ab | 11.8a | 2.8c |
| Media | 71.1 | 42.1 | 29.0 | 17.4 | 10.2 | 4.5 |
| EE | 0.78 | 0.70 | 0.53 | 0.49 | 0.61 | 0.83 |
EE: Error estándar. Letras diferentes muestran diferencias entre cortes (Tukey, p≤0.05). † Valores con base al peso libre de humedad y de extractivos
Holocelulosa
La combinación de celulosa y hemicelulosas constituye la holocelulosa y 60 a 80 % de la biomasa lignocelulósica en una célula podría ser fuente de energía. En teoría, un contenido elevado de carbohidratos corresponderá con cantidades mayores de bioetanol. La cantidad de holocelulosa mostró diferencias (p≤0.05) entre las frecuencias de corte (Cuadro 2) y el intervalo de valores fue 68.5 a 73.6 % (90 y 180 ddch). Las cantidades menores se obtuvieron con las frecuencias de 30, 60 y 90 d. La cantidad de holocelulosa aumentó con la frecuencia de corte hasta un máximo de 73.6 % a 180 d, en el que se detectó cantidad mayor de azúcares para obtener bioetanol.
Los valores de holocelulosa en otras especies de pasto C4, son: 56.3 % en Maralfalfa, 53.5 y 76.4 % en Switchgrass, 59.7 % en Bermuda y 76.5 % en Miscanthus spp. (Sun y Cheng, 2002; Lee et al., 2009; Xu et al., 2010; Brosse et al., 2012; Mateus et al., 2012). La cantidad mayor de holocelulosa en pasto Toledo fue 73.6 % e inferior al de Miscanthus, similar a de Switchgrass y superior a de Maralfalfa y Bermuda. La composición y porcentaje de los polímeros varía entre especies, etapa de crecimiento y edad de la planta.
Celulosa
La hidrólisis de celulosa por enzimas celulolíticas o química con ácido sulfúrico u otros ácidos produce glucosa (Sues et al., 2005), que es la fuente principal para la fermentación. El contenido de celulosa fue diferente (p≤0.05) entre frecuencias de corte. El porcentaje menor y mayor correspondió a 30 (39.4%) y 150 d (44.1 %) (Cuadro 2). El aumento de celulosa con la edad del pasto se debe al engrosamiento de la pared secundaria. El contenido de celulosa de Switchgrass es 31 a 45 % (Sun y Cheng, 2002; Carroll y Somerville, 2009). Los pastos contienen 25 a 40 % de celulosa (Sun y Cheng, 2002), las maderas de las latifoliadas 40 a 55 % y de las coníferas 45 a 50 % (Betts et al., 1991). El contenido de celulosa en pasto Toledo fue menor que el de las maderas y superiores al de los pastos Switchgrass, Miscanthus y Maralfalfa.
Hemicelulosas
Las hemicelulosas también son fuente de carbohidratos en la biomasa lignocelulósica, están constituidas por cadenas ramificadas de pentosas y hexosas, con potencial para ser hidrolizadas a azúcares, como xilosa, arabinosa, galactosa, glucosa y manosa. El contenido de las hemicelulosas fue diferente (p≤0.05) entre las frecuencias de corte. Los contenidos menores (26.7 y 28.5 %) se obtuvieron con las frecuencias de corte de 90 y 150 d (Cuadro 2); la proporción mayor (30 %) fue con las frecuencias de 30 y 60 d.
El promedio de las hemicelulosas de las frecuencias fue 29 %. Sun y Cheng (2002) reportan 31.4 % de hemicelulosas en Switchgrass y 35.7 % en Bermuda; Brosse (2012) obtuvo 30.3 % en Miscanthus spp. y en Maralfalfa 22.54 % (Mateus et al., 2012). El contenido del pasto Toledo fue similar al de Switchgrass y Miscanthus, inferior al de Bermuda y superior a Maralfalfa. Los contenidos de hemicelulosas son homogéneos entre pastos. No obstante, la caracterización de los azúcares en cada especie es necesaria para identificar las enzimas adecuadas que aumenten la eficiencia del proceso de fermentación y el rendimiento de bioetanol.
Lignina
Las diferencias en el contenido de lignina entre las frecuencias de corte fueron significativas (p≤0.05) (Cuadro 3). Los valores entre 16.2 a 18.3 % presentaron sólo 2.1 % de variabilidad. Esto indica que la lignificación es notablemente homogénea entre edades de cosecha. El contenido de lignina en Switchgrass, Bermuda y Miscanthus es 15 y 28 % (Lee et al., 2009; Hodgson et al., 2010; Zhang et al., 2012), en Maralfalfa (Pennisetum glaucum Pennisetum purpureum) es 22.54 %. En madera de coníferas es 27 a 30 % y en madera de latifoliadas 20 a 25 % (McKendry, 2002). La cantidad de lignina en pasto Toledo es menor a la presente en Switchgrass, Bermuda, Maralfalfa y maderas, y similar a Miscanthus. La lignina no es fermentada a etanol y su presencia es negativa para la fermentación. Por lo tanto, en el proceso viable para obtener etanol, a partir de lignocelulosa, debe extraerse y puede aprovecharse para obtener otros productos.
Cuadro 3 Análisis inmediato del pasto Urochloa brizantha cv. Toledo en seis frecuencias de cosecha.
| Frecuencia de cosechas) | Componente (%) | |||
|---|---|---|---|---|
| Humedad | Cenizas | Carbono fijo | Materia volátil | |
| 30 | 8.4a | 9.0a | 17.2ab | 73.6d |
| 60 | 7.9a | 8.1b | 16.6ab | 75.1c |
| 90 | 8.1a | 8.1b | 17.8a | 73.9cd |
| 120 | 8.1a | 6.4c | 16.8ab | 76.7b |
| 150 | 7.1b | 5.2d | 16.3b | 78.4a |
| 180 | 7.8a | 5.3d | 16.3b | 78.2a |
| Media | 7.9 | 7.0 | 16.8 | 75.9 |
| EE | 0.18 | 0.65 | 0.23 | 0.85 |
EE: Error estándar. Letras diferentes muestran diferencias entre cortes (Tukey, p≤0.05)
Proteína
La cantidad de proteína fue diferente (p≤0.05) entre las frecuencias de corte y al madurar la planta el contenido fue menor. La cantidad mayor (8.2 %) correspondió al corte de 30 d (Cuadro 2). Rincón et al. (2008) reportan 11.2 % de proteína cruda en el pasto Toledo 28 d después del rebrote; ese valor fue mayor al de nuestro estudio. Chacón-Hernández y Vargas-Rodríguez (2009) indican 9.5, 8.7 y 8.4 % de proteína cruda de en pasto King (Pennisetum purpureum) cortado a 60, 75 y 90 d, valores superiores a los del pasto Toledo de nuestro estudio. A mayor cantidad de proteína en la biomasa menor será la bioconversión de azúcares totales a bioetanol porque las proteínas de la pared celular forman puentes con el ácido ferúlico y aumentan la resistencia e insolubilidad de toda la estructura (Bidlack et al., 1992).
Análisis inmediato
El análisis inmediato indica la energía química almacenada en la biomasa en forma de materia volátil y carbono fijo. El análisis consiste en la separación de compuestos del combustible dependiente de su volatilidad, al calentarlo gradualmente, y proporciona los contenidos de humedad, cenizas, materia volátil y carbono fijo.
Humedad
La mayoría de los procesos de conversión energética requiere que la biomasa tenga humedad inferior a 30 % (Valverde et al., 2007). En pasto Toledo la humedad fue 7.1 y 8.4 % (Cuadro 3). El valor a los 150 d (7.1 %) mostró diferencia (p≤0.05) entre las frecuencias de corte. Humedad de 11.5, 13 y 15, 20 y 6 % se ha documentado en Miscanthus, Switchgrass, madera y paja (McKendry, 2002). La humedad facilita la formación de hidrógeno, pero reduce la eficiencia térmica.
Cenizas
El contenido de cenizas disminuyó con la madurez del pasto y cambió (p≤0.05) entre frecuencias de corte (Cuadro 3). El contenido máximo (9 %) correspondió a la frecuencia de 30 d y los mínimos (5.2 y 5.3 %) a 150 y 180 d. Los valores determinados en otros pastos son similares a los de nuestro estudio: 3.8 % en Switchgrass, 4.8 % en Bermuda y 2.5 % en Maralfalfa (Lee et al., 2009; Xu et al., 2010; Mateus et al., 2012). Estos valores contrastan con los obtenidos por Chacón-Hernández y Vargas-Rodríguez (2009) en pasto King (Pennisetum purpureum) a los 60, 75 y 90 d de rebrote (14.5, 13.8 y 13.6 %).
El contenido de cenizas difiere entre especies, no tiene valor energético y es mayor en residuos agrícolas. Las plantas herbáceas contienen más cenizas y sílice que las maderas. En el proceso de combustión, el conocimiento de la concentración de las cenizas es necesario para mejorar la eficiencia de la operación y reducir los costos asociados con la producción de escoria en las calderas o calentadores. Como alternativa, las cenizas se pueden usar para remediar suelos ácidos porque son completamente inocuas.
Materia volátil
Al inicio de la combustión se desprenden CO, CO2, H2 y otros gases derivados de los compuestos volátiles mediante un proceso exotérmico que ayuda a la combustión (Lewandowski y Kicherer, 1997). La cantidad de materia volátil mostró diferencia (p≤0.05) entre las frecuencias de corte; los porcentajes mayores (78.4 y 78.2 %) fueron para los 150 d 180 d, y los menores (73.6 %) a los 30 d (Cuadro 3). La cantidad de material volátil en Miscanthus fue 66.8 %, en paja de cereales 79 %, en residuos forestales 79.8 %, en Switchgrass 76.6 % y en bagazo de caña 83.6 % (McKendry, 2002; Vamvuka et al., 2003; Yin, 2011). El contenido de materia volátil en pasto Toledo fue similar al reportado en Switchgrass, paja de cereales y residuos forestales; fue mayor que en Miscanthus y menor que en bagazo de caña. El contenido de compuestos volátiles indica reactividad, facilidad de ignición y velocidad de combustión de la biomasa.
Carbono fijo
El carbono fijo es la masa residual de la liberación de compuestos volátiles, excluyendo ceniza y humedad y es indicativo del material combustible parcialmente quemado en las cenizas. La cantidad de carbono fijo entre las frecuencias de corte mostró diferencia (p≤0.05) (Cuadro 3). El carbono fijo comprendió de 16.3 a 17.8 % y los cortes a 150 y 180 d tuvieron cantidad menor (16.3 %). McKendry (2002) reportó 15.9 y 21 % de carbono fijo en Miscanthus y paja de trigo, y Vamvuka et al. (2003) 20 % en residuos forestales. El porcentaje de carbono fijo en el pasto Toledo fue inferior al de paja de trigo y de residuos forestales y similar al de Miscanthus. El carbono fijo tiene relación directa con la masa de lignina por su notable resistencia a la descomposición térmica. Cantidades mayores de carbono fijo causan rendimientos menores de bioetanol.
Rendimiento teórico a bioetanol
De acuerdo con las reacciones químicas, el rendimiento máximo teórico de bioetanol es 0.51 kg y 0.49 kg de dióxido de carbono por kg de glucosa o xilosa (Balat et al., 2008). Con base en cálculos estequiométricos, la hidrólisis de la celulosa y las hemicelulosas a azúcares fermentables es 76 y 90 % y la eficiencia de conversión de glucosa a etanol es 75 % y de xilosa a etanol es 50 % (Badger, 2002).
Los contenidos de celulosa y hemicelulosas determinan el rendimiento teórico de bioetanol por unidad de biomasa. Los rendimientos mayores de bioetanol por unidad de biomasa fueron 281.3 y 278.6 L Mg MS-1, a los 150 y 180 d. El intervalo estimado fue de 262.6 a 281.3 L Mg MS-1 (Cuadro 4). El rendimiento anual de bioetanol se relaciona directamente con la producción de biomasa cosechada. El rendimiento máximo anual de bioetanol (7865.1 L Mg-1 año-1) fue a los 180 d y diferente (p≤0.05) a los demás cortes. El corte a los 30 d generó la producción menor (2935.6 L Mg-1 año-1).
Cuadro 4 Rendimiento teórico de bioetanol del pasto Urochloa brizantha cv. Toledo en seis frecuencias de cosecha.
| Frecuencia de cosecha (Días) | Producción de bioetanol | |
|---|---|---|
| L Mg-MS -1 | L ha -1 año -1 | |
| 30 | 264.3cd | 2935.6e |
| 60 | 271.6bc | 3720.0de |
| 90 | 262.6d | 4858.3bc |
| 120 | 273.1b | 5677.0b |
| 150 | 278.6ab | 4517.8cd |
| 180 | 281.3a | 7865.1a |
| Media | 271.9 | 4928.9 |
| EE | 3.04 | 702.1 |
EE: Error estándar. Letras diferentes muestran diferencias entre cortes (Tukey, p≤0.05)
El rendimiento de bioetanol entre las frecuencias de corte mostró la inconveniencia de los cortes en etapas tempranas del cultivo porque el rendimiento anual de biomasa y de bioetanol es bajo. Además, el costo de cosecha aumenta al realizar número mayor de cortes por año.
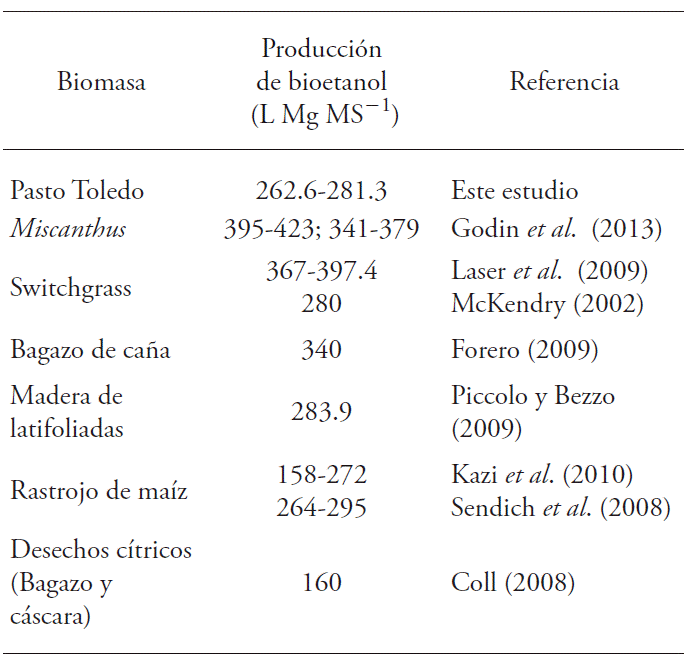
McKendry (2002) indica que mediante hidrólisis enzimática se obtienen hasta 280 L Mg-MS-1 de etanol desde Switchgrass y 205 L Mg-MS-1 desde madera. El rendimiento de bioetanol de pasto Toledo (Cuadro 5) está entre estos valores y el obtenido con rastrojo de maíz (Sendich et al., 2008). En contraste, hay rendimientos mayores a 340 L Mg MS-1 para Miscanthus (Godin et al., 2013) y Switchgrass (Laser et al., 2009). La diferencia en el rendimiento teórico de bioetanol se debe principalmente a los valores de eficiencia usados para los cálculos, principalmente en la hidrolisis y en la fermentación (Spatari et al., 2010), y los rendimientos de biomasa seca y contenidos de celulosa y hemicelulosas (Godin et al., 2013).
Conclusiones
El rendimiento de U. brizantha cv. Toledo aumenta con el intervalo entre cortes. La composición química también se modifica, pues carbohidratos totales (holocelulosa) y lignina aumentan con los días a la cosecha y, en consecuencia, el rendimiento teórico de bioetanol aumenta con el período de cosecha. Los valores máximos de materia seca, carbohidratos totales y bioetanol se obtienen con la cosecha en intervalos de 180 días.
Los resultados del rendimiento de materia seca y las características químicas de la biomasa indican que U. brizantha cv. Toledo es una opción para la producción de bioetanol.











 texto en
texto en