Introducción
El tamaño de un material nanoestructurado es intermedio entre las estructuras moleculares y micrométricas y su magnitud se mide en escala nanométrica. Las nanopartículas (NPs) tienen características fisicoquímicas y ópticas únicas, debido a su alta razón superficie/volumen. En esta condición hay un gran número de átomos en la superficie que modifican las propiedades físicas, magnéticas, fotoeléctricas y térmicas (Hernando-Grande, 2007). La nanotecnología ha llevado al desarrollo de nanomateriales usados en la industria automotriz, en pinturas, electrónica, construcción, aeronáutica, cosméticos y farmacéutica. En el 2012 habían 1300 productos donde al menos uno de sus componentes fue NPs (Love et al., 2012).
Las partículas de óxido metálico más comunes son las NPs de óxido de titanio (TiO2) y de óxido de zinc (ZnO) y son las más usadas en la industria farmacéutica (Huang et al., 2013). Para evaluar el impacto de la exposición a estas NPs en la salud humana es necesario detectar y monitorear nanomateriales en el aire, agua y suelo, lo cual requiere de varios tipos de sensores (Maynard et al., 2006; Handy et al., 2008).
El mecanismo por el cual un nanomaterial puede ser tóxico y alterar los sistemas biológicos, depende de su tamaño, composición, forma, y propiedades superficiales (Dhawan et al., 2009, Hossain et al., 2015). La evaluación de la toxicidad de las NPs que contienen un metal pesado dependerá del tamaño, forma y de la toxicidad del ion metálico, el cual puede liberarse de éstas (Perreault et al., 2010). La toxicidad de un metal a organismos vivos está influenciada por su solubilidad en agua, la unión específica a un sitio biológico y su morfología. Los efectos tóxicos de un metal pesado están definidos por cambios en la funcionalidad o cambios morfológicos en el cuerpo humano, a consecuencia de la ingesta, inhalación y absorción o introducción a través de un agente biológico (Panyala et al., 2008, Hossain, 2015).
Los metales pesados se encuentran en la naturaleza pero también pueden ser antropogénicos. En Europa las concentraciones de NPs de ZnO fueron 0.01 g L-1 en agua superficial y 0.432 g L-1 en las aguas residuales y en el Reino Unido hubo menos de 100 ug L-1 (Boxall et al., 2007, Gottschalk et al., 2009).
Las plantas no están libres de la exposición a NPs y su efecto se conoce poco. El mecanismo de absorción, translocación y acumulación de las NPs en plantas depende de la especie vegetal, así como del tamaño, tipo, composición química, funcionalización y estabilidad de las NPs (Rico et al., 2011). Por ejemplo, la exposición de Passiflora juliflora-velutina a NPs de ZnO aumentó la actividad antioxidante, de la catalasa (CAT) y de la ascorbato peroxidasa (APOX), principalmente en la raíz donde se observó la mayor absorción de NPs. No obstante, las plantas no presentaron clorosis, necrosis, ni marchitez, denotando cierta tolerancia hacia estas NPs (Hernández et al., 2011). En contraste, el efecto de NPs de ZnO (17.4±4.9 nm) en maíz (Zea mays L.) y col (Brassica oleraceae var. capitata L.) fue negativo. En maíz las células meristemáticas de las raíces presentaron daño estructural sin afectar la germinación, pero en col la elongación de raíz no cambió (Pokhrel et al., 2013). El efecto toxico de NPs de ZnO y Zn+ se evaluó en Brassica napus, Raphanus sativus, Lolium perenne, Lactuca sativa, Z. mays y Cucumis sativus; una concentración de 2000 mg L-1 redujo la tasa de germinación y crecimiento de la planta L. perenne y Z. mays (Lin et al., 2007). López-Moreno et al. (2010) encontraron efectos genotóxicos de NPs de ZnO (8 nm) y de CeO2 (7 nm) en Glycine max; una acumulación de 4000 mg L-1 de NPs de ZnO en los tejidos, alteró la estabilidad del ADN y el sistema antioxidante.
La toxicidad de NPs ZnO en plantas acuáticas es poco conocida. Hay estudios de la toxicidad de NPs de ZnO, Ag, CuO, y TiO en Lemmna minor (Perreault et al., 2010), Spirodela polyrhiza (Jiang et al., 2012), Landoltia punctata (Shi et al., 2011) y Salvinia natans (Hu et al., 2013), pero no se encontró información en otras plantas acuáticas. Hossain et al., (2015) al revisar literatura en proteómica vegetal para entender la respuesta al estrés producida por NPs con metales, señalan el predominio de estudios realizados en Arabidopsis thaliana y la escases de información en otras especies.
Azolla filiculoides es un helecho acuático usado para limpiar aguas superficiales contaminadas por compuestos orgánicos e inorgánicos; y destaca su tolerancia a varios metales (Cu y As); además crece rápido con una tasa alta de duplicación, por lo cual es un buen candidato para uso en fitorremediación (Sánchez-Viveros et al., 2010, 2011). Pero, no hay reportes sobre el efecto de NPs en este helecho acuático. Por lo tanto, el objetivo de la presente investigación fue evaluar la toxicidad de micropartículas y nanopartículas de ZnO en el helecho flotante A. filiculoides, mediante la evaluación del efecto en el crecimiento, pigmentos fotosintéticos, florescencia de clorofila, actividad antioxidante total, y actividad nitrogenasa, así como en la acumulación de Zn en las frondas de A. filiculoides.
Materiales y métodos
Caracterización de las partículas de ZnO
En este estudio se usaron NPs de ZnO grado analítico suspendidas en butilglicol 40 % (Sigma-Aldrich®, USA) y partículas de grado farmacéutico (SMPs), en polvo (Farmacia Paris, México). El butilglicol se eliminó, centrifugando 1 mL de la suspensión a 18 000 g por 20 min, y lavando tres veces la NPs, con agua desionizada. Las NPs y SMPs secas, se diluyeron 1:100 (v:v) en agua desionizada y se sonicaron (Ultrasonicador, Branson 1800®, Connecticut, USA) a 70W y 70 Hz por 10 min. La morfología, índice de redondez (diámetro mayor/diámetro menor) y tamaño promedio, de ambos tipos de partículas, se examinó con un Microscopio Electrónico de Transmisión (MET) (Tecnai 2 Spirit, Fei Company, USA) operado a 120 Kv, y con el procesador de imágenes TIA (Tecnai, Imagining & Analysis, New York USA) version 4.7 SP3 (1994-2014). El diámetro promedio de las MPs fue 238±30.7 nm y de las NPs 26.7±1 nm.
Material biológico y establecimiento del experimento
Las plantas de A. filiculoides se obtuvieron del solario del área de Microbiología del Postgrado de Edafología, Colegio de Postgraduados, campus Montecillo (19.52° N, 98.88° O a 2250 msnm). Un gramo de helecho fresco se colocó en charolas de plástico (12´6.5´4 cm) conteniendo 200 mL con solución nutritiva pH 5.5 (Yoshida et al., 1971), en invernadero con temperatura promedio diurna de 26 °C y nocturna de 19 °C.
Los tratamientos fueron la exposición del helecho a dos tamaños de partícula (NPs y SMPs), y tres concentraciones de partículas de ZnO (100, 200, y 400 mg L-1) y un testigo sin partículas. La solución nutritiva con las NPs se sonicó 10 min, para dispersar las partículas, antes de colocar el helecho. Las variables se midieron a los 6 d de exposición a los tratamientos.
Tasa relativa de crecimiento y cuantificación de pigmentos fotosintéticos
La tasa relativa de crecimiento (TRC; g g·d-1) se calculó con la ecuación:
donde Ln pi : Logaritmo natural del peso inicial (g); Ln pf : Logaritmo natural del peso final (g); t: tiempo de incubación (d).
Los pigmentos fotosintéticos se extrajeron en acetona al 80 % y el contenido de clorofila a (Chla), clorofila b (Chlb) y xantofilas+carotenoides (x+c) se midieron con espectroscopía UV/vis según la formula de Lichtenthaler y Wellburn (1983).
Actividad antioxidante total y compuestos fenólicos solubles totales
La actividad de los antioxidantes totales se determinó por la prueba de decoloración del radical 1,1-difenil-2picryldrazyl (DPPH) (Matthäus, 2002). La extracción se obtuvo de 150-200 mg de peso fresco de A. filiculoides con 1 mL de metanol 80 % a 4 °C, y los extractos se centrifugaron 15 min a 17 000 g. A 30 mL del extracto se añadieron 235 mL de solución de DPPH en microplacas. Las lecturas de absorbancias iniciales y las lecturas finales (15 min después) se tomaron a una longitud de onda de 515 nm con un espectrofotómetro (Synergy 2, Biotek Instruments®, USA). La actividad antioxidante se calculó con la aplicación de alícuotas de Trolox y concentraciones conocidas de solución 1,1-difenil-2-picril-hidrazilo (DPPH). Los resultados se expresaron en micromoles equivalentes de Trolox por gramo de tejido fresco (mM Trolox g-1 PF).
El contenido de compuestos fenólicos solubles totales se evaluó por el ensayo de reactivo Folin-Ciocalteu usando ácido clorogénico como estándar. Una muestra de 150-200 mg de fronda fresca se maceró con 1 mL de metanol (80 %) a 4 °C y se centrifugó 15 min a 17 000 g. La mezcla de 30 mL de extracto+90 mL de Na2CO3 y 150 m del reactivo de Folin-Ciocalteau se colocó en microplacas y 30 min después se midió la absorbancia a 725 nm con un espectrofotómetro UV/ vis (Synergy 2, Biotek Instruments®, USA). Los resultados se expresaron en microgramos equivalentes de ácido clorogénico por gramo de tejido fresco (mg g-1 PF).
Actividad nitrogenasa y fluorescencia de clorofila
La actividad nitrogenasa se evaluó indirectamente, mediante la determinación de la concentración de etileno producido por 1 g de A. filiculoides fresco, flotando en 200 mL de solución nutritiva (de los cuatro tratamientos de NPs y SMPs), en un frasco de 1 L sellado herméticamente con cinta teflón. Del frasco se extrajo 10 % del aire y se sustituyó con un volumen equivalente de gas acetileno. Después de 2 h, se extrajeron 5 mL de gas y se colocaron en tubos vacutainer para análisis con cromatografía de gases (HP 5890 Series II PLUS GC con FID and TCD, Agilent Technologies) usando un estándar de etileno de 20 ppm balance N2 (INFRA de México, S. A de C. V.). Con base en el área bajo la curva se ajustaron las concentraciones de las muestras problema. Los resultados se expresaron en micromoles de etileno por gramo de tejido fresco (mmol etileno g-1 PF).
La fluorescencia de la clorofila a se evaluó con un fluorómetro portátil (OS-30p, Chlorophyll Fluorometer, USA). Las frondas se acondicionaron en oscuridad por 5 min, antes de medir la eficiencia máxima fotoquímica potencial del fotosistema PSII (Fv/Fm) con el procedimiento de Küpper et al. (2002).
Microanálisis de Zn mediante EDS-MEB
La espectroscopía de energía dispersiva de rayos X (EDS en inglés) acoplado a Microscopía Electrónica de Barrido (MEB), permite identificar y cuantificar la composición elemental de áreas específicas en una muestra. A los 6 d de tratamiento, frondas de A. filiculoides sin lavar, se secaron a 60 °C hasta peso constante. Las frondas secas se montaron en porta muestras de Cu, con cinta doble adhesiva de cobre y se recubrieron con oro/paladio 80/20 con una evaporadora de metales (Fine Coat, Jeol, Japón). La superficie abaxial y adaxial de la fronda se analizaron con EDS (INCA x-ACT, Oxford Instruments, UK) acoplado a un MEB (Jeol JSM-6390) operando a 20 Kv. La concentración relativa del elemento Zn se expresó en porcentaje de peso y masa.
Diseño experimental y análisis estadístico
El diseño esperimental fue completamente al azar, los tratamientos fueron dos tamaños de partícula, chica (NPs 26.7± 1 nm) y grande (SMPs de 238±30.7 nm), tres concentraciones de partículas de ZnO (100, 200, y 400 mg L-1) y un testigo sin partículas, con tres repeticiones cada uno y el experimento se repitió tres veces (n=9). Los datos se analizaron con un ANDEVA y las medias de los tratamientos se compararon con la prueba de Tukey (p≤0.05) usando SAS (Statistic Analysis System, Institute Inc., Cary, NC, USA 2002). Los valores de cada variable se expresaron como promedios ± error estándar de la media (EEM).
Resultados y discusión
Caracterización de las partículas de ZnO
Las NPs grado analítico observadas con MET, presentaron tamaño promedio de 26.7±1.0 nm, índice de redondez de 1.09±0.058, forma isodiamétrica, y textura lisa; el diámetro de las NPs más abundante fue 21 a 30 nm (Figura 1 A y C). Las SMPs de grado farmacéutico tuvieron un diámetro promedio de 238±30.7 nm e índice de redondez de 3.2±0.54; el tamaño submicrométrico más abundante fue 201-300 nm (Figura 1 B y D). Las SMPs fueron nueve veces más grandes y tres veces más alargadas que las NPs.
Efecto de NPs y SMPs ZnO en el crecimiento
La tasa relativa de crecimiento de A. filiculoides, no se afectó por la presencia de las partículas independiente del tamaño y concentración (Figura 2). Esto contrasta con lo observado en Arabidopsis thaliana, cuyo crecimiento se redujo con 100 mg L-1 NPs de ZnO (Landa et al., 2012).
Pigmentos fotosintéticos
Las NPs redujeron significativamente los niveles de la Chla, Chlb y Chl total en 33.3 %, 71.8 % y 49.1 %, con respecto a las SMPs (Cuadro 1); la aplicación de 400 mg de NPs redujo estos tres pigmentos en 47.3 %, 10.4 % y 20.8 % respecto al testigo (Cuadro 1). Estos resultados son similares a los observados en Salvinia natans en presencia de 1, 10, 20,50mgL-1 NPs de ZnO de 25nm (Hu et al., 2013). Las NPs pueden producir peroxidación de la membrana del cloroplastos, alterando la acumulación de pigmentos y la fotosíntesis (Ma et al., 2013; Hu et al., 2013). Las NPs de ZnO redujeron en 29.1 % la concentración total de carotenoides y xantofilas (c+x) en las frondas del helecho; la aplicación de 400 mg de NPs redujo en 24.3 % el contenido de c+x con respecto al testigo (Cuadro 1). Los c+x son importantes moléculas que participan en la detoxificación de varias formas de oxígeno activado producidos en los complejos fotosintéticos; así el b-caroteno amortigua el estado de excitación de la clorofila triplete, lo cual reduce la formación de oxígeno singlete (Foyer y Shigeok, 2011). En este sentido, las partículas pequeñas (NPs ZnO) al reducir los niveles de x+c en A. filiculoides, son más toxicas que las SMPs. Esta respuesta es similar a la observada al exponer Oryza sativa L. a NPs de Ag de 25 nm, las cuales redujeron los niveles de pigmentos fotosintéticos y causaron mayor toxicidad que partículas más grandes (Prakash et al., 2014; Yin et al., 2013). La toxicidad de NPs pequeñas se observó en cultivos in vitro de bacterias, levaduras, algas, crustáceos y células de mamíferos (Ivask et al., 2014). La toxicidad de NPs está asociada con una alta razón superficie/volumen, facilidad de entrar a las células y al cloroplasto, desestabilizando la fotosíntesis y el sistema antioxidante. El efecto de la concentración, en ambos tamaños de partículas, fue significativo en 400 mg L-1, la cual redujo el nivel de todos los pigmentos fotosintéticos estudiados (Cuadro 1).
Cuadro 1 Efecto de la concentración y del tamaño de partículas de ZnO en pigmentos fotosintéticos de Azolla filiculoides a los 6 d de exposición.
| Concentración (mg partículas -1 ) | Chla (mg g -1 PF) | Chlb (mg g -1 PF) | C+x (mg g -1 PF) | Chl total (mg g -1 PF) |
|---|---|---|---|---|
| 0 | 0.2056 ± 0.0062 a | 0.0774 ± 0.0074 ab | 0.0745 ± 0.0024 a | 0.2831 ± 0.0092 a |
| 100 | 0.1958 ± 0.0133 a | 0.0788 ± 0.0118 ab | 0.0709 ± .0044 a | 0.2756 ± 0.0252 a |
| 200 | 0.1953 ± 0.019 a | 0.0851 ± 0.0134 a | 0.069 ± 0.0056 a | 0.279 ± 0.0319 a |
| 400 | 0.1086 ± 0.0017 b | 0.0688 ± 0.0103 b | 0.0564 ± 0.0038 b | 0.2243 ± 0.0236 b |
| Tamaño de partícula (nm) | ||||
| NPs (26.7 ± 1 ) | 0.1451 ± 0.0078 b | 0.0341 ± 0.0020 b | 0.0561 ± 0.0026 b | 0.1792 ±0.0095 b |
| SMPs (238 ± 30.7) | 0.2067 ± 0.0108 a | 0.1209 ± 0.0027 a | 0.0793 ±0.0023 a | 0.3518 ±0.0087 a |
Los datos son la media ± error estándar; n=9. Letras distintas en una columna indican diferencias significativas (Tukey, p≤0.001)
Actividad antioxidante total, compuestos fenólicos totales, actividad nitrogenasa y fluorescencia de clorofila
La actividad antioxidante total y contenido de compuestos fenólicos solubles totales en A. filiculoides disminuyó significativamente ante NPs, pero aumentó en presencia de SMPs (Figura 3). La mayor toxicidad de las partículas pequeñas (NPs ZnO) puede explicarse porque su tamaño favorece su rápida absorción, solubilidad y liberación del ion Zn+ (Reed et al., 2012). El estrés por metales pesados eleva la cantidad de especies reactivas de oxígeno (EROS), y como respuesta, la planta produce más compuestos antioxidantes para inhibir la degradación oxidativa de moléculas biológicas (Foyer and Noctor, 2005b; Sheng et al., 2008; Hernández et al., 2012). El aumento de los antioxidante catalasa (CAT) y glutatión (GSH) se observó en Fagopyrum esculentum ante NPs de ZnO (Lee et al., 2013). Nuestro estudio es el primero en su tipo referente al efecto de dos tamaños de partículas de ZnO en variables fisiológicas de plantas acuáticas, en particular A. filliculoides, y su relación con la tolerancia y atenuación del estrés oxidativo. Algunos compuestos fenólicos pueden secuestrar radicales libres (Gulcin et al., 2003) y actuar como donadores de electrones como mecanismo de destoxificación (Sánchez et al., 2010; Forni et al., 2012). La disminución de la actividad antioxidante y el contenido de compuestos fenólicos totales en presencia de NPs (Figura 3), fue similar al efecto que produjo la presencia de cadmio y uranio en Azolla y Lemna minor (Sela et al., 1988; Forni et al., 2012). El efecto de la exposición de 100 mg L-1 de NPs de ZnO en la expresión de genes de Arabidopsis thaliana se estudió con micro arreglos; después de 7 d los genes inducidos fueron los asociados al estrés oxidativo, respuesta a heridas y transporte de electrones (Landa et al., 2012). Azolla filiculoides forma simbiosis con la cianobacteria Anabaena azollae la cual fija nitrógeno atmosférico a través de la actividad de la enzima nitrogenasa, lo que facilita la asimilación de N y el crecimiento del helecho (Reddy, 1987; Vessey, 1994).
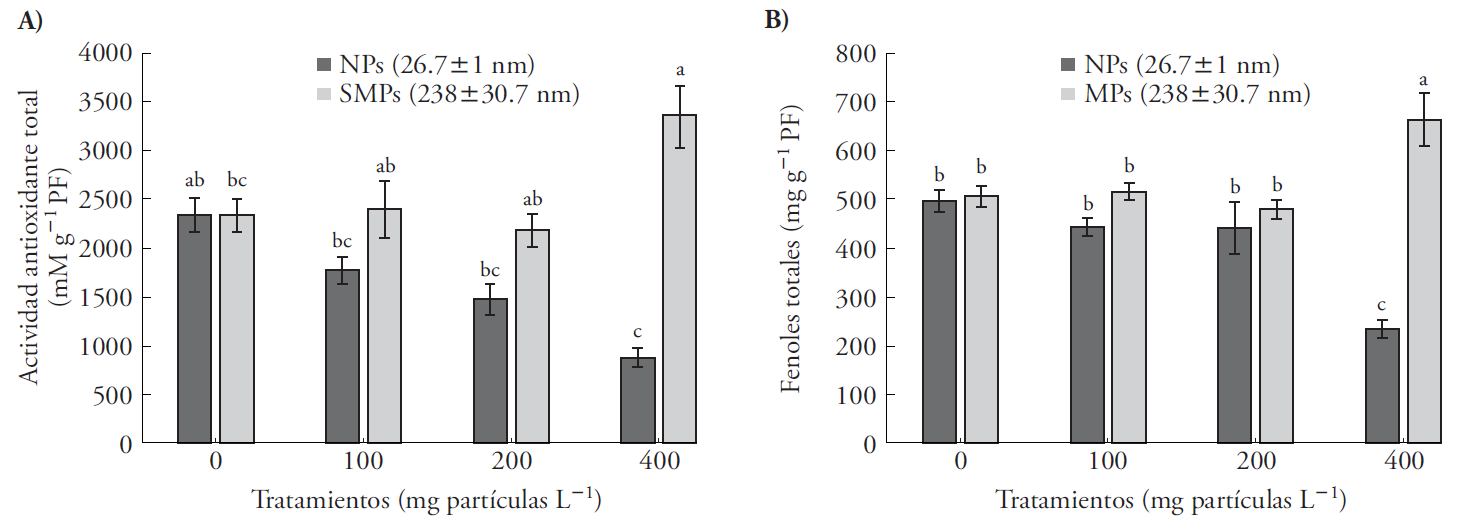
Figura 3 Actividad antioxidante total y fenoles totales en Azolla filiculoides expuesta a NPs (26.6±1 nm) y SMPs (268±30 nm) a tres concentraciones (100, 200 y 400 mg partículas L-1) durante 6 d. Media ± error estándar; n=9. Letras distintas indican diferencias significativas entre tratamientos (Tukey, p≤0.05); PF: peso fresco.
Nuestros resultados son el primer reporte del efecto de NPs de ZnO en la actividad nitrogenasa del simbio-sistema Azolla-Anabaena y estos muestran la respuesta del simbionte a las partículas. La actividad nitrogenasa en el simbio-sistema A. filiculoides-Anabaena disminuyó significativamente (82 %) desde la concentración más baja (100 mg L-1) (Figura 4). Las NPs redujeron en 23.5 % esta actividad enzimática con respecto a las SMPs (Cuadro 2); la reducción fue 79 % y 83 % en concentraciones de 100400 mg L-1 con respecto al testigo (Figura 4). Estos resultados indican una clara alteración en el metabolismo de N de la cianobacteria y, en consecuencia, reducción en el N asimilable para la planta. Sood et al. (2012) comparan el potencial fitoremediador de las macrofitas acuáticas (Elodea, Eichhornia, Lemna, Pistia, Salvinia, Ceratophyllum y Azolla) y enfatizan la capacidad fitorremediadora de Azolla por crecer rápidamente, fijar nitrógeno, e hiperacumular metales.
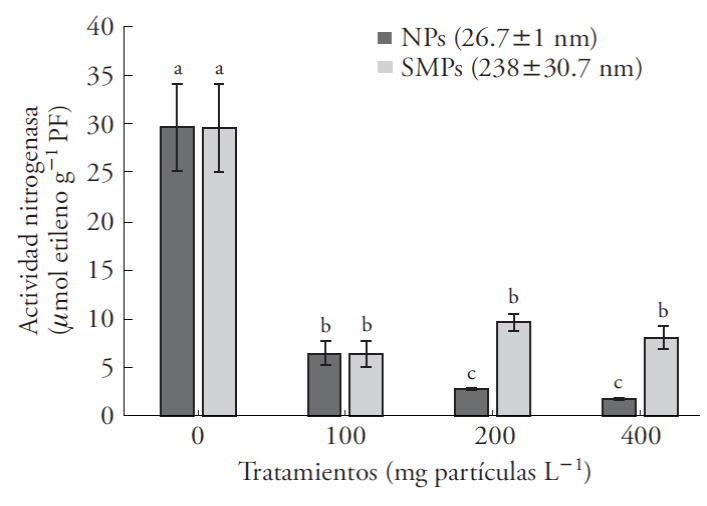
Figura 4 Actividad nitrogenasa en Azolla filiculoides expuesta a nanopartículas (NPs) y partículas submicrométricas (SMPs) de ZnO durante 6 d. Media ± error estándar; (n=6). Letras distintas indican diferencias significativas entre tratamientos de un mismo tamaño de partícula (Tukey, p≤0.05); PF: peso fresco.
Cuadro 2 Microanálisis de Zn mediante EDS-MEB, en Azolla filiculoides, expuesta a tres concentraciones de nanopartículas (NPs) y partículas submicrométricas (SMPs) de ZnO durante 6 d.
| Tamaño de las partículas (nm) | Tratamiento (mg partícula L -1 ) | Elemento Zn (% peso) |
|---|---|---|
| testigo | 0 | |
| NPs (26.7 ± 1) | 100 | 19.9 ± 1.8 d |
| 200 | 41.3 ± 4.1 bc | |
| 400 | 72.3 ± 6.6 a | |
| SMPs (238 ± 30.7) | 100 | 65.3 ± 6 ab |
| 200 | 48.3 ± 3.3 bc | |
| 400 | 20.3 ± 4.6 d |
Letras distintas indican diferencias significativas entre concentraciones (Tukey, p≤0.05), (n=3)
Las partículas no afectaron el crecimiento del helecho durante 6 d, lo que podría sugerir un potencial remediador, pero la toxicidad observada para el simbionte, cuestiona el crecimiento a mediano plazo.
La fluorescencia de clorofila, se redujo ante la exposición a los dos tamaños de partículas de ZnO y en todas las concentraciones probadas (Figura 5). Esta reducción fue 15.3 % en promedio, con respecto al control (Cuadro 2). La fluorescencia de la clorofila se usó para evaluar la toxicidad de NPs de CuO en Lemna gibba (Perrault et al., 2010). Además, los metales pesados tienen un efecto tóxico en la mayoría de las plantas (Viehweger, 2014). Así, la exposición de A. filiculoides y A. caroliniana al ion cobre (2mM Cu) deprime significativamente los niveles de Fv/Fm a las 35 h de exposición (Sánchez et al., 2010). En nuestro estudio, la exposición de A. filiculoides a 100 mg NPs L-1 redujo en 22% el Fv/Fm, en comparación con las SMPs (238± 30.7 nm), las cuales disminuyeron la fluorescencia solo en 15 % (Figura 5). El rendimiento del PSII (Fv/Fm) mide el potencial fotoquímico y la eficiencia del transporte de electrones del PSII al PSI. Esta variable se usa como indicador de estrés en plantas, y permite caracterizar los efectos y mecanismos de acción de diferentes tipos de estrés ambiental por metales pesados, herbicidas y detergentes en los sistemas acuáticos (Ralph et al., 2007).
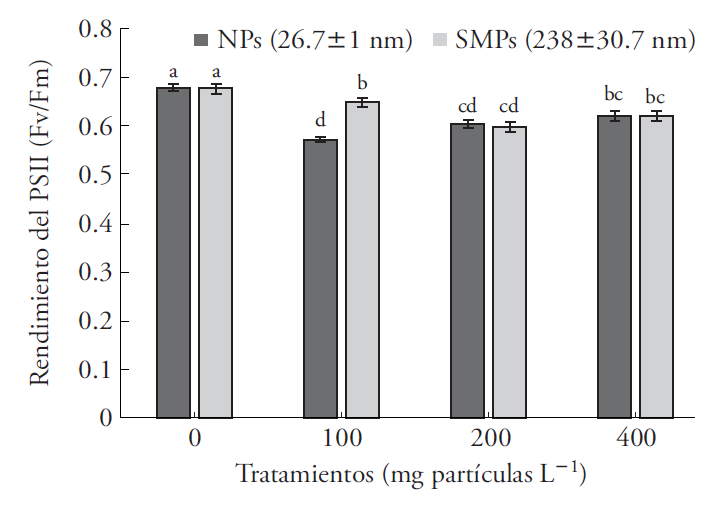
Figura 5 Fluorescencia de clorofila, rendimiento del PSII de Azolla filiculoides expuesta a nanopartículas (NPs) y partículas submicrométricas (SMPs) de ZnO durante 6 d. Media ± error estándar; n=9. Letras distintas indican diferencias significativas entre tratamientos de un mismo tamaño de partícula (Tukey, p≤0.05).
Los valores máximos de Fv/Fm medidos en plantas sanas, son usualmente mayores a 0.7 (Butler y Kitajima, 1975; Sánchez-Viveros et al., 2010). Sin embargo, no hay reportes del efecto de NPs de ZnO en la eficiencia fotoquímica del PSII, pero la inhibición de esta variable en diversas plantas y en especies de Azolla se asocia con la presencia de metales pesados, por ejemplo la aplicación de 2 mM Cu2+ (Michalak, 2006; Sánchez-Viveros et al., 2010; Viehweger, 2014). En nuestro estudio, las NPs a 100 mg L-1, redujeron en 22 % el Fv/Fm respecto al testigo, en comparación con las SMPs (15 %) (Figura 5).
La reducción de la fluorescencia de clorofila indica menor rendimiento de los centros de reacción de la plastocianina, para catalizar la transferencia eficiente de los electrones entre el PS II (citocromo b6f ) y el PS I (Küpper et al., 2002; Letelier et al., 2010). La reducción de Fv/Fm causada por la NPs ZnO se puede explicar en parte por el efecto tóxico del ion Zn2+ en la reacción fotoquímica del PSII, bloqueando así el transporte de electrones (Padua et al., 2010). En A. thaliana la exposición a 100 mg L-1 de NPs de ZnO deprimió la expresión de genes asociados al transporte de electrones (Landa et al., 2012). Según Ivask et al. (2014) hay un efecto del tamaño de las NPs de Ag en la toxicidad de bacterias, algas, crustáceos y células de mamíferos. Nuestro estudio aporta información nueva sobre la respuesta de los centros de reacción fotosintética a dos tamaños de partícula de ZnO, nanometríca y submicrometrica, en A. filiculoides.
Microanálisis de Zn mediante EDS-MEB
La señal de rayos X del elemento Zn se produjo de aglomerados y cristales adheridos a la epidermis abaxial de la fronda. En los tratamientos con NPs la acumulación de Zn aumentó proporcionalmente a la concentración. Estas observaciones fueron similares a las de un estudio en Fagopyrum sculentum, donde las NPs ZnO se acumularon principalmente en la superficie de la raíz, y la acumulación de Zn aumentó en función de la concentración de NPs (Lee et al., 2013). En contraste, en los tratamientos con SMPs, a mayor concentración de SMPs en la solución, menor acumulación de Zn sobre la fronda. La aparición de precipitados en la solución nutritiva a 200 y 400 mg L-1, sugiere que debido al tamaño, estas partículas precipitaron y el Zn no se acumuló en la hoja. Para entender mejor la toxicidad de Zn se requieren más estudios acerca de la movilidad de este elemento en la planta.
Conclusiones
Las NPs de ZnO, no afectaron el crecimiento del helecho A. filiculoides durante 6 d pero la reducción en pigmentos fotosintéticos, antioxidantes, actividad nitrogenasa y fluorescencia de clorofila indican toxicidad para el simbio-sistema Azolla-Anabaena. Las SMPs de ZnO no afectaron el crecimiento y contenido de pigmentos fotosintéticos, pero sí redujeron la florescencia de clorofila, y actividad nitrogenasa lo que indica estrés en la planta. Azolla filiculoides pudo liderar mejor con las SMPs, las cuales promovieron el aumento de los antioxidantes y fenoles solubles totales para compensar los radicales libres producidos por estrés.
En resumen, las partículas pequeñas (NPs) fueron más tóxicas que las partículas grandes (SMPs), lo cual indica que el tamaño de la partícula de ZnO es más determinante que la concentración en la toxicidad del helecho A. filliculoides.











 texto em
texto em 




