Introducción
La planta de uchuva (Physalis peruviana L.) es silvestre, su origen y diversificación son americanos, principalmente en los valles andinos de Perú, Colombia y Ecuador; después se introdujo en África e India y hay más de 80 variedades en el mundo (Medina, 1991). Desde la época de los incas se conoce su fruto, quienes lo utilizaban para autoconsumo; la planta se consideraba como maleza, pues se desconocía su valor alimentico y comercial (Fischer et al., 2014).
El consumo y valor económico del fruto ha aumentado porque es una fruta exótica debido a su aroma, sabor dulce, y bondades nutraceúticas. La principal forma de consumir el fruto es en fresco o procesado, en jugos, mermeladas, conservas en almíbar, vinos y salsas. Entre sus propiedades nutraceúticas contiene vitamina A (3000 UI de caroteno), vitamina C (43 mg), hierro (1.70 mg) y fósforo (38 mg) (Fischer, 2000), se usa como antioxidante y antinflamatorio (Wu et al., 2006) y tiene actividad hipoglucémica (Mushagalusa-Kasali et al., 2013).
El N es el nutriente que más influye en el crecimiento y la fructificación de la planta de uchuva, al promover el crecimiento de tallos, ramas, hojas y frutos (Samra y Arora, 1997; Navarro y Navarro, 2000), lo que determina el crecimiento reproductivo de la planta; se absorbe durante la etapa vegetativa y se almacena en los tejidos meristemáticos para su traslocación (Navarro y Navarro, 2000). Según Fischer y Angulo (1999), N es el nutriente con mayor influencia sobre el rendimiento de las plantas de uchuva; su deficiencia se manifiesta en una reducción en número y longitud de ramas, provocando la disminución del tamaño y la calidad de los frutos.
Un suministro adecuado de N en la planta acelera las tasas de división y diferenciación celular, así como la actividad fotosintética, lo cual aumenta la biomasa vegetativa o reproductiva por la mayor eficiencia en la intercepción y conversión de la radiación (Uhart y Andrade, 1995). El contenido de N en la biomasa de la planta varía de 1 a 5 % (Hammad et al., 2007; Marschner, 2012). La planta absorbe N en forma de NO3 - y, en menor medida, como NH4 +. El NO3 - en la planta se convierte en NH4 + y se usa para la síntesis de proteínas (Adams et al., 1984). El NO3 - se absorbe más porque el NH4 + se oxida a NO3 -, por acción de las bacterias nitrificantes (Taiz, y Zeiger, 2010). Sin embargo, el NH4 + sería la fuente preferida de N dado su bajo costo energético para la síntesis de proteínas, comparado con el NO3 - aunque en altas concentraciones es tóxico para la planta. Entonces, las plantas que usan NH4 + como fuente de nitrógeno presentan mayores niveles de carbohidratos y proteínas, respecto a las plantas que usan NO3 -. Pero no todas las especies se comportan de la misma forma cuando estas dos fuentes de nitrógeno se encuentran en el medio de cultivo (Echeverría y Sainz, 2005).
Un suministro combinado y en proporción adecuadas de NH4 + y NO3 - favorece a la mayoría de las especies, al propiciar un balance en el metabolismo y una eficiente absorción de N (Hageman, 1992; Villalobos, 2001). Según Britto y Kronzucker (2002), la absorción de NH4 + está influenciada por la presencia de NO3 - y K+ (Szczerba et al., 2006) en la solución, los cuales pueden reducir la toxicidad del NH4 +. La absorción de NO3 - aumenta la concentración de algunas hormonas del crecimiento en el xilema (Rahayu et al., 2005), regulando la división y la expansión celular (Francis y Sorell, 2001), y el NH4 + absorbido por la raíz se incorpora a los aminoácidos u otros compuestos con N reducido (Resh, 2001), por lo que la demanda de energía es menor (5 moles de ATP) comparado con el nitrato (12 moles de ATP). Pero altas proporciones de NH4 + causan desórdenes fisiológicos como una menor concentración de Ca+2, K+ y Zn+2 en hojas (Fleming et al., 1987).
Con base en lo anterior, esta investigación tuvo como objetivo evaluar la floración y fructificación de P. peruviana L., con la aplicación conjunta de NH4 + y NO3 - y edad de la planta (brotes con alto, medio y bajo vigor contra plantas nuevas derivadas de semilla). La hipótesis fue que la presencia de NH4 + y NO3 - en la solución nutritiva y los brotes vigorosos mejoran la morfología de la planta.
Materiales y Métodos
El estudio se realizó de agosto a diciembre de 2013, en un invernadero tipo túnel, con cubierta de polietileno UVII-720, y estructura de acero galvanizado, con ventilación lateral. La temperatura máxima fue 38 °C y 9 °C la mínima, con una intensidad luminosa de 653.43 mmol m-2 s-1, en el Campus Montecillo del Colegio de Postgraduados, Estado de México. Las plantas de uchuva tenían dos edades: una fue el brote de plantas establecidas, con dos años de edad; otra fueron plantas nuevas obtenidas de semilla. El material vegetal utilizado fue proporcionado por el Área de Nutrición Vegetal. Los tratamientos del primer experimento resultaron de la combinación de la relación NH4 +:NO3 - (0:100, 25:75 y 50:50) y el vigor del brote (bajo, medio y alto; 10, 15, 20 cm de altura, respectivamente). En el segundo experimento se usaron plantas nuevas derivadas de semilla y con las mismas relaciones NH4 +:NO3 - del primer experimento. El diseño experimental en ambos experimentos fue completamente al azar, con cinco repeticiones en plantas de brote y cuatro repeticiones en plantas provenientes de semilla. La unidad experimental fue una planta colocada en una bolsa negra de polietileno con capacidad de 19 L, con tezontle como sustrato, con granulometría de 1 a 10 mm, densidad aparente promedio de 0.82 g cm-3, 50 % de porosidad total, 45 % de porosidad de aireación, 5.42 % de agua disponible, sin capacidad de intercambio de cationes y conductividad eléctrica cercana a cero (Gutiérrez et al., 2011). Las plantas se mantuvieron en posición vertical mediante tutoreo utilizando rafia colocada a lo largo de las hileras y sujeta a postes de madera en los extremos de las mismas. Las soluciones nutritivas se elaboraron con base en la solución universal Steiner (1984) la cual se modificó, de acuerdo con los tratamientos, al utilizar N en forma de NH4 +, ya que originalmente se utiliza NO3 - y también con base en el mejor tratamiento encontrado por Gastelum et al. (2013), que fue la solución Steiner con 50 % de su fuerza iónica original; el pH de las soluciones se ajustó a 6.0.
Las variables evaluadas fueron el número de botones florales, flores y frutos verdes por planta, respectivamente, y lecturas SPAD, para lo cual se hicieron mediciones cada 15 d. En plantas de brote, el número de botones florales, flores y frutos verdes se contó desde los 41 d después de la poda (ddp), mientras que la medición de lecturas SPAD inició 15 ddp. En plantas derivadas de semilla, el conteo del número de botones florales, flores y frutos verdes dio inició 41 d después del transplante (ddt) y las lecturas SPAD comenzaron 60 ddt. Para las lecturas SPAD se usó el medidor del grado de verdor SPAD 502 (Minolta SPAD, Osaka, Japón) del laboratorio de Nutrición Vegetal del Postgrado de Edafología. Las mediciones se realizaron en cinco hojas recientemente maduras ubicadas en la parte alta en cada planta y se obtuvo un promedio. Para número de botones florales, flores y frutos verdes se contó el número total en la planta, en cada muestreo.
El análisis de varianza se realizó para comprobar el efecto de la relación amonio:nitrato y el vigor del brote; las medias de los tratamientos se compararon con la prueba de Tukey (p≤0.05). En el segundo experimento se evaluó el efecto de la relación amonio:nitrato. Los análisis se efectuaron con SAS (SAS, 2002) versión 9.1.
Resultados y Discusión
Plantas originadas de brote
El número de botones florales por planta cambió a los 71 ddp por el suministro conjunto de NH4 + y NO3 -; el máximo valor fue en plantas tratadas con NH4 + en la solución nutritiva. El vigor de la planta solo presentó efecto positivo en el último muestreo, a los 116 ddp; el mayor número de botones florales se encontró en plantas con vigor alto y medio (Cuadro 1).
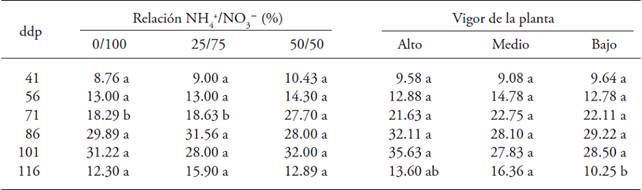
Letras distintas en un renglón y factor indican diferencias significativas (p≤0.05). ddp = días después de la poda.
Cuadro 1: Número de botones flores en plantas de uchuva (Physalis peruviana L.) con origen de brote en respuesta a los efectos de la relación NH4 +/NO3 - y el vigor de la planta.
Morgan (2001) evaluó el efecto de proporciones de NH4 + (0, 10, 20 y 30 %) en plantas de espinaca (Spinacia oleracea L.) cultivadas en sistema NFT y baja luminosidad, y encontró que al aumentar el porcentaje de NH4 + en la solución nutritiva se acelera la floración; los valores más altos se presentaron con 30 % NH4 +, y los más bajos con 0 y 10 % NH4 +.
Un suministro excesivo de NH4 + aumenta la concentración de N reducido en la planta, lo cual causa una mayor producción de poliaminas asociadas con el aumento en la síntesis de giberelina, ADN, ARN y proteínas (Amberger, 1984). Al respecto, Marschner (2012) indica que la aplicación foliar de urea aumenta el vigor de la planta, al ser una fuente de N que participa en la síntesis de aminoácidos, y es el responsable de causar cambios hormonales en la planta, al aumentar la concentración de citocininas.
El vigor de la planta se correlaciona de manera directa con la capacidad de la raíz para almacenar una fuente de reserva de energía, que continúa durante toda su etapa de crecimiento. Después el almacenaje de las reservas (fotoasimilados) declina porque se usa por la planta para iniciar a la floración, debido a que la mayor parte del N presente en la reserva de energía se dirige hacia la formación de flores y la maduración de los frutos o, en otro caso, para seguir con el crecimiento vegetativo (Taiz y Zeiger, 2010).
La relación amonio:nitrato afectó el número de flores por planta a los 116 ddp (Cuadro 2); el mayor número de flores se presentó en plantas tratadas con la relación 50:50 (9 flores). El vigor de la planta influyó a los 86 y 116 ddp; las plantas con alto (15 flores) y medio vigor (10 flores) presentaron el mayor número de flores por planta en cada muestreo, respectivamente (Cuadro 2).
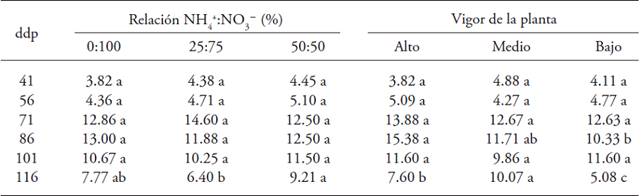
Letras distintas en un renglón y factor indican diferencias significativas (p≤0.05). ddp = días después de la poda
Cuadro 2: Número de flores en plantas de uchuva (Physalis peruviana L.) con origen de brote en respuesta a los efectos de la relación NH4 +:NO3- y el vigor de la planta.
Cantidades altas de N inhiben la floración y promueven el crecimiento vegetativo (Lovatt, 1990). Por lo tanto, concentraciones menores de 30 % NH4 + del N total, favorecen de 3 a 7 d la precocidad de la floración, y tienen un efecto positivo sobre el número de inflorescencias/tallo, longitud de tallo y color verde de las hojas (Kasten y Sommer, 1990; Stensvand y Gisrelod, 1992). En cítricos (Citrus spp.) existe una relación entre la intensidad de la floración y el contenido de N reducido y poliaminas en la planta que pueden incrementar con aplicaciones foliares de urea (Lovatt, 1990).
El tamaño de la planta sirve como un indicador del rendimiento, por lo cual un crecimiento vigoroso y una adecuada diferenciación del meristemo apical de la planta permitirá una mayor productividad al determinar en gran medida el número de flores formadas, resultado de la dinámica del proceso y expansión celular que ocurre en la interfase, la cual depende de la tasa de fotosíntesis y de la distribución de asimilados. Además, el número de flores variará según el genotipo, condición ambiental, fitosanidad y manejo (Taiz y Zeiger, 2010; Jemmali y Boxus, 1993; Stapleton et al., 2001).
La aplicación de NH4 +:NO3 - a los 41 ddp afectó el número de frutos verdes por planta (Cuadro 3); plantas tratadas con mayor proporción de NH4 + en la solución nutritiva tuvieron un mayor número, pero desde los 56 hasta los 116 ddp no se encontró efecto de la relación NH4 +:NO3 -. El vigor de la planta influyó a los 41, 101 y 116 ddp a el valor máximo se tuvo en plantas con alto vigor (Cuadro 3).
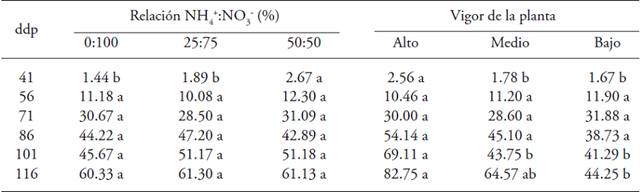
Letras distintas en un renglón y factor indican diferencias significativas (p≤0.05). ddp = días después de la poda
Cuadro 3: Número de frutos verdes en plantas de uchuva (Physalis peruviana L.) con origen de brote en respuesta a los efectos de la relación NH4 +:NO3 - y el vigor de la planta.
La combinación de NO3 - con cantidades bajas de NH4 + produce un mayor crecimiento; sin embargo, la proporción óptima difiere entre las especies y podría cambiar con la edad de la planta (Haynes, 1986). Concentraciones altas de NH4 + se acumulan en los tejidos jóvenes, en este caso los brotes, y causan una disminución en la fotosíntesis, crecimiento y producción del cultivo (Marques et al., 1983).
El crecimiento y la productividad de cada planta están determinados por su genética, condición ambiental, disponibilidad de agua y nutrición, pero, variaciones en estos aspectos se relacionan con el vigor y la cantidad de asimilados en la planta, como fuente de reserva para zonas de alta demanda. En plantas como el tomate (Solanum lycopersicum L.), el vigor influye muy fuerte sobre la distribución de los asimilados a largo plazo y afecta el número de frutos en la planta (Papadopoulos y Ormrod, 1990). Por lo tanto, un incremento en el vigor aumenta el número de frutos, en simultáneo crecimiento, e indirectamente participa en la generación de biomasa (Heuvelink, 1995).
La relación NH4 +/NO3 - y el vigor de la planta afectaron las lecturas SPAD (Cuadro 4) al inicio del ciclo. La relación NH4 +/NO3 - solo afectó las lecturas SPAD a los 30 ddp, y el valor máximo fue en plantas tratadas con la relación 50/50 (47.50). El vigor de la planta influyó en las lecturas SPAD a los 15 ddp, y la mayor lectura fue en plantas con vigor alto (39.30), mientras que de 45 hasta 105 ddp no hubo efecto de la relación NH4 +/NO3 - ni del vigor de la planta.
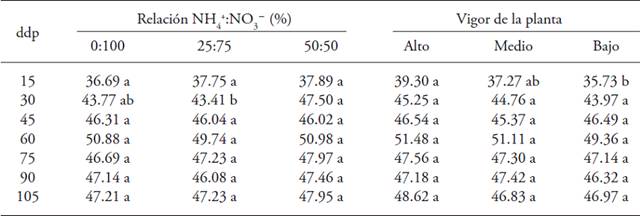
Letras distintas en un renglón y factor indican diferencias significativas (p≤0.05). ddp = días después de la poda
Cuadro 4: Lecturas SPAD en plantas de uchuva (Physalis peruviana L.) con origen de brote en respuesta a la relación NH4 +:NO3 - y el vigor de la planta.
El contenido de clorofila y la absorción de N se correlacionaron con las lecturas SPAD en diversas condiciones ambientales, como intensidad luminosa, temperatura, humedad relativa, plagas, densidad de población, fuente de nitrógeno (Sandoval-Villa et al., 1999; Dong et al., 2004). Al respecto, Sandoval-Villa et al. (1999) encontraron que las lecturas SPAD en plantas de tomate aumentan al elevar en 25 % la concentración de NH4 + en la solución nutritiva; en contraste, concentraciones altas de NH4 + reducen el valor de las lecturas SPAD.
Para un crecimiento vigoroso, la planta debe tener una reserva de energía. Los carbohidratos que conforman esta reserva se utilizan para iniciar el nuevo crecimiento después de cada poda, y sobrevivir a condiciones de estrés (Ho et al., 1983; Hellman et al., 2000; Stapleton et al., 2001). La planta no usa energía para sintetizar sus aminoácidos porque los absorbe directamente de la solución del suelo. Sus modos de acción son: 1) como suplemento de aminoácidos de alto consumo, que incluye a la glicina, necesaria para la síntesis de porfirinas constituyentes estructurales de la clorofila y los citocromos; y 2) la formación de sustancias biológicamente activas, que proporcionan vigor y estimulan a la planta en periodos críticos, y en producciones altamente intensivas (Fischer et al., 1998; Lalonde et al., 2004).
Plantas con origen de semilla
El suministro de NH4 + y NO3 - influyó de manera positiva sobre el número botones florales, flores y frutos verdes por planta; la mayor cantidad ocurrió en plantas tratadas con NH4 + en la solución nutritiva (Cuadro 5). El número de botones florales y flores por planta varió constantemente y disminuyó con el tiempo. En el número de frutos verdes por planta, la relación NH4 +:NO3 - afectó de manera constante en todo el ciclo, y el mayor número de frutos fue en plantas tratadas con la relación 25:75, excepto al final del ciclo, a los 116 ddt, cuando no hubo efecto de la relación NH4 +:NO3 - (Cuadro 5). Esta respuesta se atribuye al envejecimiento de la planta o al efecto de la forma del N en el medio, debido a que participa de manera importante en la síntesis de proteínas y formación de la clorofila, el crecimiento vegetativo y la determinación del número de flores y frutos. No obstante, esta disminución se puede atribuir a una deficiencia en fósforo, lo que atrasa el desarrollo de la planta, retarda la diferenciación de las yemas florales, y reduce el número de frutos por planta (Rodríguez et al., 1989; Menezes dos Santos, 1992).
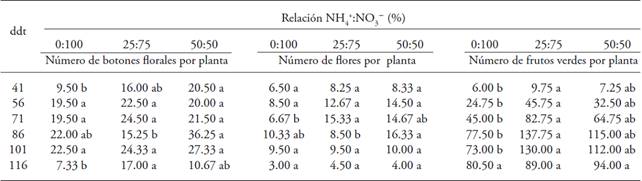
Letras distintas en un renglón indican diferencias significativas (p≤0.05). ddt = días después del transplante
Cuadro 5: Número de botones florales, flores y frutos verdes en plantas de uchuva (Physalis peruviana L.) con origen de semilla en respuesta a la relación NH4 +:NO3 -.
Resultados similares obtuvieron Bugarín et al. (1988), quienes evaluaron la respuesta a diferentes concentraciones de NH4 +: cationes en la solución nutritiva en el crecimiento y la floración de tres variedades de crisantemo [Dendranthema x glandiflorum (Ramat) Kitam.]: Puma, Funflower e Improved Funshine, y encontraron un efecto positivo del NH4 + sobre el número de inflorescencias en la cosecha. Los valores máximos se obtuvieron con las concentraciones de 4.5 y 3.0 meq L-1 de NH4 +. Sandoval et al. (1992) indican que en trigo (Triticum aestivum L.) se puede obtener una mayor producción de grano y materia seca al usar NH4 + en porcentajes menores o iguales a 50 % de la cantidad de N aplicado, respecto a la aplicación exclusiva de NO3 - a la planta. Además, Osorio et al. (2003) y Chen et al. (1998) observaron una producción de biomasa mayor en plantas tratadas con mezclas de NH4 +:NO3 -, respecto al uso independiente de NH4 + o NO3-.
La relación NH4 +:NO3 - no causó diferencias significativas en las lecturas SPAD en todo el ciclo del cultivo (Cuadro 6). Los valores máximos de lecturas SPAD se alcanzaron en plantas tratadas exclusivamente con nitrato (0/100), en comparación con aquellas tratadas con NH4 + en la solución nutritiva.
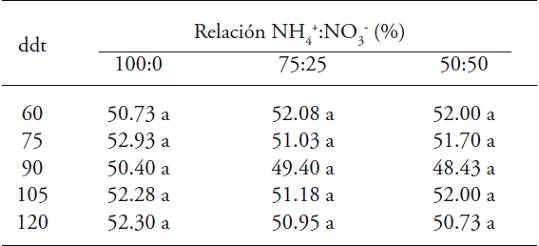
Letras distintas en un renglón indican diferencias significativas (p≤0.05). ddt = días después de la poda
Cuadro 6: Lecturas SPAD en plantas de uchuva (Physalis peruviana L.) con origen de semilla en respuesta a la relación NH4 +:NO3 -.
Después de 90 ddt hubo lecturas SPAD inferiores a los registrados en los otros muestreos, lo cual se relaciona con la etapa de floración-fructificación de la planta, por lo cual la demanda de N es mayor hacia el desarrollo de frutos (Sandoval-Villa et al., 2001). Al respecto, Rodríguez et al. (1998) encontraron una correlación alta entre las lecturas SPAD, la concentración de clorofila extractable en la quinta hoja y el porcentaje de N en plantas de tomate cultivar Rio Grande. Asimismo, existe una relación directa entre las lecturas SPAD y la concentración de N en la planta, donde las plantas fertilizadas adecuadamente con NO3-, como fuente principal de N, presentan un color verde en sus hojas (Villar y Ortega, 2003). Lo contrario reportan González et al. (2009), quienes evaluaron diferentes relaciones NH4 +/NO3 - en la producción de hierbas aromáticas en hidroponía y no encontraron diferencias estadísticas entre las lecturas SPAD en cebollín (Allium schoenoprasum Regel & Tiling), albahaca (Ocimum basilicum L.) y eneldo (Anethum graveolens L.). Los máximos valores se presentaron en plantas tratadas con NH4+ en la solución nutritiva, y la mejor relación fue la 20:80. Además, Kond y Higuchi (2012) indican que la aplicación de N en forma de amonio provoca bajos valores SPAD en Passiflora edulis.
La prueba de contrastes ortogonales, para comparar el efecto del origen de la planta (semilla y brote), mostró diferencias significativas (p≤0.05) en las lecturas SPAD y el número de frutos verdes totales por planta. Las mayores lecturas SPAD y el mayor rendimiento de frutos verdes por planta se encontraron en plantas nuevas obtenidas por semilla (Cuadro 7). Estas diferencias se deben a que la uchuva se propaga, principalmente y sin problemas, mediante semilla; lo cual puede originar variabilidad genética. Sandhu et al. (1989) mencionan que la uchuva propagada por semilla varía en crecimiento, vigor, rendimiento y calidad del fruto. Al respecto, Angarita y Santana (1997) señalan que la uchuva presenta gran variabilidad fenotípica, al ser una planta alógama y de propagación sexual; por lo cual, en las plantas obtenidas de semilla, el crecimiento, el rendimiento y la calidad de frutos son variables.
Conclusiones
En plantas de brote, la aplicación conjunta de amonio y nitrato, y el vigor de la planta no afectaron el número de botones florales, flores y frutos verdes por planta, ni el valor de lecturas SPAD, y solo se observó efecto del vigor del brote sobre el número de frutes verdes por planta.
En plantas de semilla, la presencia de amonio en la solución nutritiva incrementó el número de botones florales, flores y frutos verdes por planta; en contraste, el valor de lecturas SPAD no fue afectado.











 texto en
texto en 



