Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.50 no.5 Texcoco jul./ago. 2016
Fitociencia
Relaciones genéticas entre variedades de Stenocereus pruinosus (Cactaceae) en los estados de Puebla y Oaxaca, México, con marcadores AFLP
1División de Ciencias Biológicas y de la Salud, Universidad Autónoma Metropolitana, Iztapalapa, México, D.F., México. Avenida San Rafael Atlixco 186, Colonia Vicentina, Iztapalapa, 09340. (lyanez@xanum.uam.mx).
La pitaya de mayo, Stenocereus pruinosus (Otto) Buxbaum (Cactaceae) es un producto hortofrutícola con gran importancia en la región de la Mixteca (sudoeste de Puebla y noreste de Oaxaca, México) y ha ganado atención internacional por su sabor dulce y fresco. En consecuencia, numerosos cultivares o variedades se desarrollaron. En este estudio se usaron marcadores moleculares AFLP con el objetivo de analizar las relaciones genéticas entre seis variedades. Stenocereus stellatus (Pfeiffer) variedad Riccobono se consideró como grupo externo. El híbrido putativo de estas dos especies San Gabriel, se cultivó en 12 parcelas, con plantas clonales, en la región de Tehuacán-Cuicatlán, México. Los resultados mostraron muchos polimorfismos. Los índices de similitud fluctuaron entre 0.24 y 0.60. Las muestras se agrupan de acuerdo con su lugar de recolección e independiente de la variedad estudiada, lo cual podría explicarse por el manejo tradicional dado por los productores a esta especie en la región.
Palabras clave: Cactus columnar; variabilidad intraespecífica; pitaya; Stenocereus stellatus; manejo tradicional
Pitaya de mayo, Stenocereus pruinosus (Otto) Buxbaum (Cactaceae), is a horticultural produce with great importance in the Mixteca region (Sowthwestern Puebla and Northeastern Oaxaca, México) and is gaining international attention for its sweet and fresh flavor; accordingly, many different cultivars or varieties were developed. In this study we used AFLP molecular markers with the objective of analyzing the genetic relationships between six varieties. Stenocereus stellatus (Pfeiffer) Ricobono variety was considered as outgroup, and the putative hybrid from these two species, San Gabriel, was grown in 12 plots of clonal reproduced plants at Tehuacán-Cuicatlán Region in Mexico. Results showed many polymorphisms, and similarity indexes fluctuated between 0.24 and 0.60. Samples were grouped according to the collecting site and independent from the studied variety, which might be explained by the traditional handling that growers give to this species in the region.
Key words: Columnar cactus; intraspecific variability; pitaya; Stenocereus stellatus; traditional handling
Introducción
Stenocereus pruinosus (Otto) Buxbaum es un cactus columnar conocido como pitaya de mayo, y distribuido principalmente en la región semiárida del valle de Tehuacán, en el Centro de México (Bravo-Hollis, 1978; Parra et al., 2012). Esta especie ha pasado por un proceso de domesticación desde hace unos 8000 años (Smith, 1967; Luna-Morales y Aguirre, 2001), con base principal en la selección de frutos grandes dulces, con epidermis delgada, pocas espinas y pulpas de color diferente (Luna-Morales y Aguirre, 2001;. Rosales-Bustamante et al., 2009; Parra et al., 2012). Este proceso ha generado más de 30 variedades con diferentes características comerciales atractivas (Luna-Morales, 2007; Rosales-Bustamante et al., 2009).
Stenocereus pruinosus se encuentra en poblaciones silvestres, sistemas agroforestales y huertos (Parra et al., 2010; 2012). Dentro de los huertos el patrón más común para reproducir y aumentar la producción es mediante el método de corte, que produce plantas clones con características deseables; por lo tanto, plantas procedentes de un tallo común se pueden considerar réplicas genéticas (Rosales-Bustamante et al., 2009; Carrillo-Ángeles y Mandujano, 2011). Según Rozenfeld et al. (2007), este método no produce casi ninguna variación genética y cada individuo se convierte en un clon del original, lo cual es común en las poblaciones naturales de cactus (Clark-Tapia et al., 2005a; 2005b).
Según Luna-Morales (2004), una evidencia de la domesticación de especie es un híbridos interespecífico, entre S. pruinosus y S. stellatus (Pfeiffer) Riccobono, llamado San Gabriel por los cultivadores de la región Mixteca Baja (Noroeste de Oaxaca y sureste de Puebla). Este se obtuvo por los mixtecos mediante la manipulación y selección de las poblaciones crecidas in situ y más adelante ex situ, en huertos cercanos a esta región. Este híbrido presenta dos estaciones de fructificación marcadas en el año y cada una coincide con la fructificación de las especies parentales.
La variabilidad morfológica y genética altas en las poblaciones silvestres y cultivadas se debe a la selección artificial de las especies producidas (Parra et al., 2008; 2010; 2012). Sin embargo, las relaciones genéticas entre diferentes huertos clonales dentro de la producción agrícola no se han estudiado. Por lo anterior, el objetivo de este experimento fue analizar la diversidad genética y relaciones genéticas de S. pruinosus y los huertos clonales de Puebla y Oaxaca, mediante AFLP; además, se incluyó S. stellatus como grupo externo de una especie con relación estrecha, y su híbrido putativo San Gabriel. La hipótesis fue que las recolectas de S. pruinosus de la misma variedad son genéticamente similares e independiente de su región de procedencia.
Materiales y Métodos
Este estudio se realizó con 12 recolectas de S. pruinosus, y se usaron tallos individuales de las variedades Ceniza (C), Roja (R), Amarilla (A), Burra (B), Espina Negra (ES) y Jarro (J); además se incluyó el híbrido San Gabriel (SG) y S. stellatus (X), como grupo externo, y se recolectaron en huertos clónales de Oaxaca y Puebla (Cuadro 1). La extracción de ADN se hizo de 20 mg de parénquima clorofílico del tallo (la cantidad de ADN usada evita la saturación de la membrana del kit con el mucílago del cactus), y se usó el Kit DNeasy® Plant Mini (Qiagen). La técnica de AFLP (Vos et al., 1995) se realizó con un AFLP® Plant Mapping Kit (Applied Biosystems), de acuerdo con su protocolo y 32 combinaciones de iniciadores. Los fragmentos de ADN se detectaron por medio de un secuenciador automático ABI PRISM® 3130×l Genetic Analyzer.
Los electroferogramas se analizaron con el programa Gen Marker® V.2 (The Biological Friendly Software SoftGenetics). Los coeficientes de similitud se estimaron desde una matriz binaria por medio del índice de Nei y Li (1979) con el programa Free Tree v 0.9.1.50 (Pavlíček et al., 1999). Un remuestreo (Bootstrap) de 1000 repeticiones se realizó y se obtuvo un árbol consenso (Hampl et al., 2001). Además, los datos se agruparon con el método de agrupamiento de pares no ponderado con media aritmética (UPGMA) y un dendrograma se construyó con el programa Tree View v.1.6.6 (Page, 1996).
Resultados y Discusión
Ocho combinaciones se escogieron de los 32 iniciadores de AFLP probados, que amplificaron el número mayor de fragmentos. Un total de 538 bandas se obtuvo con esos marcadores (Cuadro 2). El número de polimorfismos de cada una de las combinaciones de iniciadores fue muy alto en relación con las cifras reportadas para otras cactáceas, como Opuntia pilifera y Cereus spp. (Nilsen et al., 2005; Faria-Tavares et al., 2013), y otras especies, como Passiflora edulis (Ponciano-Samayoa y Lacan-de León, 2012).
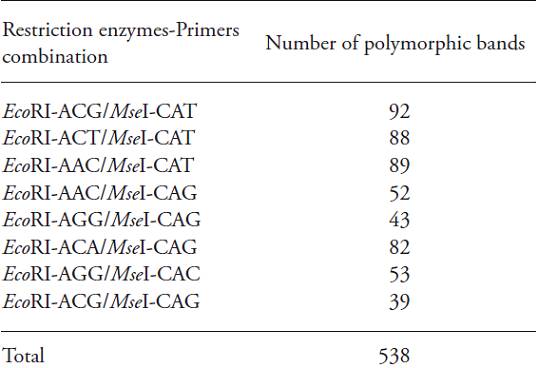
Cuadro 2: Combinaciones de iniciadores probadas con EcoR1 y Mse1, y número de bandas polimórficas obtenidas para cada combinación.
Todas las variedades de S. pruinosus se agruparon con un índice de similitud de 0.24 a 0.60 en el dendrograma UPGMA (Figura 1). Las recolectas de S. pruinosus se separaron en dos subgrupos: el primero, pertenece a las muestras de Oaxaca y el segundo a las muestras de Puebla. Además, en el caso de S. stellatus pocas bandas amplificron de las ocho combinaciones de AFLP usadas. Esto originó un índice de similitud de 0.01 respecto a las recolectas de S. pruinosus, aunque son especies de relación estrecha. El hibrido San Gabriel mostró un índice de similitud de 0.11 respecto del grupo de las pitayas (Figura 1).

Figura 1: Dendrograma UPGMA que representa las relaciones entre las 12 recolectas de S. pruinosus, S. stellatus y el híbrido San Gabriel. La similitud genética entre individuos está definida por la longitud horizontal de las ramas. Los números en los puntos de bifurcación indican la similitud entre las recolectas, basados en el coeficiente de similitud de Nei-Li, calculado de los perfiles de AFLP derivados de ocho combinaciones de iniciadores.
Los valores de similitud muestran que todas las recolectas estudiadas son genéticamente diferentes, incluyendo las de la misma variedad, como la pitaya Roja y Jarro. Esto sugiere que todos los huertos clonales analizados (independiente de la variedad) tienen orígenes diversos. Este resultado coincide con el de Parra et al. (2010), quienes observaron que existe variabilidad genética alta en las poblaciones de S. pruinosus, en particular en las manejadas por selección artificial (Casas y Parra, 2007; Parra et al., 2008 y 2012). Sin embargo, nuestro resultado se opone a otros reportados en especies del mismo género, como S. stellatus (Casas et al., 2006), S. gummosus, S. eruca y S. thurberi (Hamrick et al., 2002; Clark-Tapia y Molina-Freaner, 2003; Clark-Tapia et al., 2005a; Lozano et al., 2015).
Los huertos en Puebla y Oaxaca, donde se recolectaron los individuos, presentaron diferentes factores bióticos y abióticos, lo cual sugiere que la variabilidad genética resulta de la adaptación a las diferencias ambientales en los sitios de recolección (Morales-Nieto et al., 2006) y al manejo vegetativo de los productores, para determinar el origen de los brotes, lo cual contribuye a mantener o aumentar la diversidad en los huertos (Casas et al., 1999; Casas y Parra, 2007; Parra et al., 2012). En contraste, Clark-Tapia et al. (2005a; 2005b) indicaron que no hay variación dentro de las poblaciones en la especie estrechamente relacionada Stenocereus eruca.
Los valores grandes de la distancia genética obtenidos entre las recolectas de pitaya de los huertos clonales es probable que se deban al manejo tradicional realizado a través del tiempo y a las características ambientales de los alrededores. Por último, las combinaciones exitosas de los iniciadores usadas en este estudio, y la técnica AFLP por sí, podrían ayudar a realizar estudios de diversidad genética en S. pruinosus y especies estrecha con relación.
Conclusiones
Una gran diversidad genética se encontró entre cultivares de S. pruinosus. Al contrario de lo esperado, las recolectas de S. pruinosus de la misma variedad mostraron gran distancia genética, a pesar de su propagación vegetativa. Ellas se agruparon de acuerdo a su región de procedencia, independiente de la variedad a la cual pertenecen.
Literature Cited
Bravo-Hollis, H. 1978. Las Cactáceas de México. Vol. I. 2a. ed. Universidad Nacional Autónoma de México. México, D. F. 743 p. [ Links ]
Carrillo-Ángeles, I. G., y M. del C. Mandujano. 2011. Patrones de distribución espacial en plantas clonales. Bol. Soc. Bot. México 89: 1-18. [ Links ]
Casas, A., J. Caballero, A. Valiente-Banuet, J. A. Soriano, and P. Dávila. 1999. Morphological variation and the process of domestication of Stenocereus stellatus (Cactaceae) in Central Mexico. Am. J. Bot. 86: 522-533. [ Links ]
Casas, A. J. Cruse, E. Morales, A. Otero-Arnaiz, and A. Valiente-Banuet. 2006. Maintenance of phenotypic and genotypic diversity of Stenocereus stellatus (Cactaceae) by indigenous peoples in Central Mexico. Biodivers. Conserv. 15: 879-898. [ Links ]
Casas, A., y F. Parra. 2007. Agrobiodiversidad, parientes silvestres y cultura. LEISA Rev. Agroecología 23: 5-8. [ Links ]
Clark-Tapia R. and F. Molina-Freaner. 2003. The genetic structure of a columnar cactus with a disjunct distribution: Stenocereus gummosus in the Sonoran desert. Heredity 90: 443-450. [ Links ]
Clark-Tapia, R., C. Alfonso-Corrado, L. E. Eguiarte, and F. Molina-Freaner. 2005a. Clonal diversity and distribution in Stenocereus eruca (Cactaceae), a narrow endemic cactus of the Sonoran Desert. Am. J. Bot. 92: 272-278. [ Links ]
Clark-Tapia, R., M. C. Mandujano, T. Valverde, A. Mendoza, and F. Molina-Freaner. 2005b. How important is clonal recruitment for population maintenance in rare plant species? The case of the narrow endemic cactus, Stenocereus eruca, in Baja California, Mexico. Biological Conservation 124: 123-132. [ Links ]
Faria-Tavares, J. S., P. Garcia M., C. A. Mangolin, S. A. de Oliveira-Collet, and M. F. P. S. Machado. 2013. Genetic relationships among accessions of mandacaru (Cereus spp.: Cactaceae) using amplified fragment length polymorphism (AFLP). Biochem. Syst. Ecol. 48: 12-19. [ Links ]
Hampl, V., A. Pavlíček, and J. Flegr. 2001. Construction and bootstrap analysis of DNA fingerprinting-based phylogenetic trees with the freeware program Free Tree: application to trichomonad parasites. Int. J. Syst. Evol. Micr. 5: 731-735. [ Links ]
Hamrick, J. L., J. D. Nason, T. H. Fleming and J. M. Nassar. 2002. Genetic diversity in columnar cacti. In: Fleming, T. H. and A. Valiente-Banuet (eds). Columnar Cacti and their Mutualists. Evolution, Ecology and Conservation, The University of Arizona Press, Tucson, AZ, USA. pp: 122-133. [ Links ]
Lozano G., O. A., J. L. León L., S. Favela L., and F. J. García L. 2015. New interpretations about clonal architecture for the sour pitaya (Stenocereus gummosus, Cactaceae), arising from microsatellite markers of de novo isolation and characterization. Open J. Gen. 5: 1-11. [ Links ]
Luna-Morales, C. C. 2004. Recolección, cultivo y domesticación de cactáceas columnares en la Mixteca Baja, México. Rev. Chapingo, Ser. Hort. 10: 95-102. [ Links ]
Luna-Morales, C. 2007. Ordenación y clasificación morfológica del fruto de cultivares mixtecos de pitaya (Stenocereus pruinosus) en México. Agrociencia XI: 10-16. [ Links ]
Luna-Morales, C. C. y J. R. Aguirre R. 2001. Variación morfológica del fruto y domesticación de Stenocereus pruinosus (Otto) Buxb. y S. stellatus (Pfeiff.) Riccob. (Cactaceae) en la Mixteca Baja, México. Rev. Fitotec. Mex. 24: 213-221. [ Links ]
Morales-Nieto, C., A. Quero-Carrillo, O. Le-Blanc, A. Hernández-Garay, J. Pérez-Pérez, y S. González-Muñoz. 2006. Caracterización de la diversidad del pasto nativo Bouteloua curtipendula Michx. Torr. mediante marcadores de AFLP. Agrociencia 40: 711-720. [ Links ]
Nei, M., and W.-H. Li. 1979. Mathematical model for studying genetic variation in terms of restriction endonucleases. Proc. Natl. Acad. Sci. USA 76: 5269-5273. [ Links ]
Nilsen, L. B., S. S. Dhillion, S. L. Camargo-Ricalde, B. Rendón-Aguilar, and M. Heum. 2005. Traditional knowlwdge and genetic diversity of Opuntia pilifera (Cactaceae) in the Tehuacán-Cuicatlán Valley, México. Econ. Bot. 59: 366-376. [ Links ]
Page, R. D. M. 1996. TREEVIEW: an application to display phylogenetic trees on personal computers. Comput. Appl. Biosci. 12: 357-358. [ Links ]
Parra, F., N. Pérez-Nasser, R. Lira, D. Pérez-Salicrup, and A. Casas. 2008. Population genetics and process of domestication of Stenocereus pruinosus (Cactaceae) in the Tehuacan Valley, México. J. Arid Envir. 72: 1997-2010. [ Links ]
Parra, F., A. Casas, J. M. Peñaloza-Ramírez, A. C. Cortés-Palomec, V. Rocha-Ramírez, and A. González-Rodríguez. 2010. Evolution under domestication: ongoing artificial selection and divergence of wild and managed Stenocereus pruinosus (Cactaceae) populations in the Tehuacán Valley, Mexico. Ann. Bot. 106: 483-496. [ Links ]
Parra, F., J. J. Blancas, and A. Casas. 2012. Landscape management and domestication of Stenocereus pruinosus (Cactaceae) in the Tehuacán Valley: human guided selection and gene flow. J. Ethnobiol. Ethnomedicine 8: 32. [ Links ]
Pavlíček, A., Š. Hrdá, and J. Flegr. 1999. Free Tree - Freeware program for construction of phylogenetic trees on the basis of distance data and bootstrap/jackknife analysis of the tree robustness. Application in the RAPD analysis of the genus Frenkelia. Folia Biologica (Praha) 45: 97-99. [ Links ]
Ponciano-Samayoa, K. M., y J. P. Lacan-de León. 2012. Diversidad genética de maracuyá en Guatemala revelada por marcadores AFLP. Agron. Mesoam. 23: 73-80. [ Links ]
Rosales-Bustamante, E. P., C. C. Luna-Morales, y A. Cruz-León. 2009. Clasificación y selección tradicional de pitaya (Stenocereus pruinosus (Otto) Buxb.) en Tianguistengo, Oaxaca y variación morfológica de cultivares. Rev. Chapingo Ser. Hortic. 15: 75-82. [ Links ]
Rozenfeld, A. F., S. Arnaud-Haond, E. Hernández-García, V. M. Eguiluz, M. A. Matías, E. Serrão, and C. M. Duarte. 2007. Spectrum of genetic diversity and networks of clonal organisms. J. Roy. Soc. Interface 4: 1093-1102. [ Links ]
Smith, C. E. Jr. 1967. Plant remains. In: Byers, D. S. (ed). The Prehistory of the Tehuacan Valley. Vol. 1. Environment and Subsistence. University of Texas Press, Austin, Tx. pp: 220-225. [ Links ]
Vos, P., R. Hogers, M. Bleeker, M. Reijans, T. van de Lee, M. Hornes, A. Frijters, J. Pot, J. Peleman, M. Kuiper, and M. Zabeau. 1995. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Res. 23: 4407-4414. [ Links ]
Recibido: Mayo de 2015; Aprobado: Enero de 2016











 texto en
texto en 



