Introducción
El éxito de la conservación de microorganismos se logra al evitar contaminaciones en el proceso, y al optimizar la sobrevivencia alta y la estabilidad genética. Los métodos de conservación varían y debe elegirse un método para los microorganismos que se conservarán (García y Uruburu, 2000; Morales-García et al., 2010). Un preservador único no existe para la conservación de cualquier tipo de bacterias y deberá identificarse el mejor para cada una (Morales-García et al., 2010).
Un método es la liofilización, en el cual el agua en el material a conservar se congela y se elimina por sublimación, mediante diferencia de presión (Kumar et al., 2013). La liofilización es el proceso más usado para conservar productos biológicos porque deshidrata al eliminar el agua congelada. La naturaleza, tiempo y gasto del proceso dependen de la naturaleza química y física de los microorganismos que serán liofilizados (Ramírez, 2006). El proceso de liofilización es efectivo para la conservación de células, en un estado viable y de latencia de eucariontes y bacterias. Para aumentar la supervivencia de las células sometidas a liofilización se usan sustancias que actúan como protectoras.
La conservación de bacterias relevantes en nutrición animal, mediante liofilización, se ha documentado como parte del proceso de investigación (Safronova y Novikova, 1996; Jung et al., 2004; Cobos et al., 2007; Cobos et al., 2011), pero no hay información del proceso de conservación de los microorganismos. Según Morgan et al. (2006), la conservación de microorganismos por liofilización es un método empírico sin incluir teorías comprobadas. En la literatura especializada no se encontró información sobre el uso de preservadores en bacterias celulolíticas anaerobias de origen ruminal. El objetivo de este estudio fue evaluar la efectividad del carbón activado como preservador de un cultivo de bacterias celulolíticas mediante su capacidad de degradación de sustratos celulolíticos después de liofilizarlas.
Materiales y Métodos
El estudio se realizó en el Laboratorio de Microbiología Ruminal y Genética Microbiana, del Colegio de Postgraduados, Campus Montecillo. Además, se desarrolló en una campana (Labconco®) de bioseguridad, con purificador de clase II, y con rayos ultravioleta.
Medio de cultivo fluido ruminal (FR)
El medio de cultivo (esterilizado 15 min en una autoclave (Tuttnauver® 2540F, Israel) a 121 °C y 15 psi) estuvo formado por 30 mL de fluido ruminal (FR) clarificado con 5 mL de solución mineral I [6 g K2HPO4, (Sigma) en 1000 mL de H2O destilada], 5 mL de solución mineral II [6 g KH2PO4 (Sigma), 6 g (NH4)2SO4 (Merck), 12 g NaCl (Sigma-Aldrich), 2.45 g MgSO4 (Sigma) y 1.6 g CaCl-2H2O (Sigma) en 1000 mL de H2O destilada], 0.1 mL de resarzurina a 0.1 % (Sigma-Aldrich), 0.2 g de peptona de soya (Merck), 0.1 g de extracto de levadura (Sigma), 2 mL de solución sulfido-cisteína [2.5 g L-cisteína (Sigma) en 15 mL de 2N NaOH (Meyer), 2.5 g de Na2S-9H2O (Meyer) aforados a 100 mL de H2O destilada], 5 mL de solución al 8 % de Na2CO3 (Baker) y 52.6 mL de H2O destilada.
Cultivo de bacterias celulolíticas
El fluido ruminal se obtuvo de una vaca Jersey con cánula ruminal. El fluido se centrifugó 3 min a 1157 g en una centrífuga (Eppendorf® 5804, Alemania) a 25 °C. El sobrenadante se recuperó y se usó como inóculo. Nueve mL de medio FR estéril se agregaron a tubos (18×150 mm) con una tira de papel Whatman (3×30 mm) y 0.05 g de celulosa cristalina (Sigma) estériles, bajo flujo de CO2, en una incubadora (Riossa® EO-71, México) y se mantuvieron 24 h a 29 °C para detectar esterilidad. Un tubo estéril se inoculó con 1 mL de inóculo y se mantuvo a 39 °C, hasta degradar el papel Whatman. A otro tubo estéril se transfirió 1 mL de medio inoculado y se incubó a 39 °C hasta degradar el papel Whatman. Cuatro transferencias se realizaron para obtener un cultivo de bacterias celulolíticas (CBC) con capacidad para degradar papel Whatman. En viales serológicos (50 mL), con una tira de papel Whatman (3×30 mm) y 0.1 g de celulosa cristalina estériles, se depositaron 27 mL de medio FR estéril bajo flujo constante de CO2, y se mantuvieron 72 h a 39 °C, para detectar esterilidad. Los viales se inocularon con 3 mL del producto obtenido de la cuarta transferencia y se incubaron a 39 °C hasta degradar el papel Whatman (10 d).
Tratamientos
Los tratamientos fueron: 1) CA, carbón activado como preservador, un vial con 0.1 g de carbón activado (Hycel) se incubó a 39 °C por 2 h y; 2) SL, sin preservador, un vial como tratamiento testigo. Los viales se congelaron en un congelador de rodillo (Labconco® Shell Freezer, EE.UU.) hasta alcanzar ‒38 °C, luego en una liofilizadora (Labconco® Freezone 6 L, EE.UU.) se liofilizaron 24 h (‒50 °C y 13.5 Pa).
Reactivación de los tratamientos
Tubos (18×150 mm) con una tira de papel Whatman (3×30 mm) y 0.05 g de celulosa cristalina, se esterilizaron (15 min a 121 °C y 15 psi). Luego se adicionaron 9 mL de medio FR estéril, bajo flujo de CO2 y se incubaron 72 h a 39 °C para detectar esterilidad. Seis tubos se inocularon con 0.05 g de liofilizado CA y seis con 0.05 g de SL, bajo CO2. Los tubos se incubaron 10 d a 39 °C. Después de 7 y 10 d se cuantificó la degradación del papel. Al terminar la incubación se midió: 1) pH con potenciómetro (Orion 250A, Brasil; calibración: pH 7 y 4); 2) potencial de óxido-reducción con un potenciómetro (Orión 710A, Brasil; calibración: solución +220 de óxido-reducción); y 3) concentración de bacterias totales mediante recuento directo en cámara Petroff-Hauser (Hausser #39000, Electron Microscopy Sciences, EE.UU.) y la fórmula: concentración de bacterias = (promedio) (factor de dilución) (2×107).
Degradación in vitro de materia seca
Tubos (18×150 mm) con 0.01 g de papel Whatman y 0.05 g de celulosa cristalina se esterilizaron 15 min a 121 °C y 15 psi. Luego se adicionaron 9 mL de medio FR estéril bajo flujo de CO2 y se incubaron a 39 °C por 72 h para detectar esterilidad. Los tubos (12 repeticiones independientes) se inocularon con 1 mL de CA o SL reactivado. Los tubos se incubaron a 39 °C por 10 d. Después de 7 y 10 d de incubación se cuantificó la degradación del papel. La capacidad de degradación in vitro %DEGMS se calculó a los 10 d con la formula %DEGMS=(muestra inicial ‒ muestra no degradada / muestra inicial)×100.
Concentración de ácidos grasos volátiles (AGV)
Un mL de medio de cultivo, con 10 d de incubación, se mezcló con ácido metafosfórico al 25 % y se centrifugaron a 18 800 g, por 10 min; el sobrenadante se colocó en viales para cromatografía (1.5 mL, Perkin Elmer®, USA). La concentración de AGV se determinó en un cromatógrafo de gases (Perkin Elmer®, modelo Claurus 500, EE.UU.) equipado con detector de ionización de flama y columna capilar (Elite FFAP, Perkin-Elmer®) de 15 m×0.32 mm; el gas acarreador fue nitrógeno (flujo de 4mL min-1) e H2 yO2 (flujo de 45 y 450 mL min-1) para generar la flama. Las temperaturas del horno, inyector y columna fueron 120, 250 y 250 °C y se inyectó 1𝛍L de muestra. Tres picos se obtuvieron en tiempo de retención de 2.16, 2.59 y 3.11 para los ácidos acético, propiónico y butírico.
Diseño y análisis estadístico
El diseño experimental fue completamente al azar. El experimento se repitió una vez y los datos de %DEGMS, AGV, pH, óxido-reducción y concentración de bacterias totales se analizaron como medidas repetidas con el procedimiento MIXTO de SAS (SAS® Institute Inc., 2011). Los promedios se ajustaron por mínimos cuadrados para compararlos con la prueba de Tukey (p≤0.05). Las variables ácido propiónico y AGV se transformaron a log10 y se calculó la raíz cuadrada de %DEGMS para cumplir con el supuesto de homocedasticidad de los datos. El modelo estadístico fue:
donde Y ijk es la variable de respuesta en observación k, repetición j, tratamiento i; 𝛍 es la media general; τ i , es el efecto del i-ésimo tratamiento; δ j(i) es el error aleatorio asociado con la j-ésima repetición dentro del i-ésimo tratamiento; P k es el efecto del késimo tiempo; (τP) ik es el efecto de la interacción tratamiento tiempo; ε ijk es el error aleatorio asociado con k-ésima medida repetida dentro de j-ésima repetición.
Resultados y Discusión
Ochenta y tres por ciento de las repeticiones de la reactivación de las bacterias liofilizadas con CA degradaron el papel a los 7 y 10 d de incubación; en contraste las repeticiones de SL no degradaron el papel en los mismos días. El tratamiento SL tuvo 88.79 % menos capacidad de degradación in vitro de sustratos celulolíticos, respecto a CA (Cuadro 1). El tratamiento CA mostró %DEGMS mayor de celulosa cristalina y papel que el tratamiento SL (p≤0.05; Cuadro 1). Esto se debe a que las bacterias celulolíticas son anaerobias y el carbón activado reduce la presencia de oxigeno antes de la liofilización (Malik, 1990) y los preservadores aumentan la supervivencia de bacterias liofilizadas (Muñoz-Rojas et al., 2006; Morales-García et al., 2010). El carbón funciona como preservador en procesos de liofilización por sus características de adsorción física reversible, adsorción en fase líquida sin eliminación por desorción simple y porosidad (Littrell et al., 2002; Roussak y Gesser, 2013). El carbón activado se usa como soporte para crecimiento microbiano en biorremediación (Gabr et al., 2009; Mercier et al., 2013) y adsorción de bacterias para su aislamiento (Yuan et al., 2012).
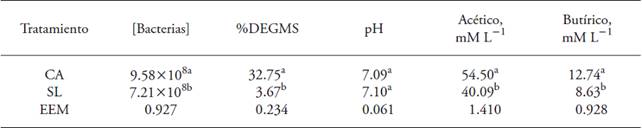
† Las variables no presentaron interacción significativa tratamiento tiempo (p>0.05); a, b: valores promedio con distinta letra en una misma columna son diferentes estadísticamente (p≤0.05); EEM: error estándar del valor promedio; CA: Carbón activado como preservador; SL: sin preservador
Cuadro 1: Concentración de bacterias [Bacterias], porcentaje de degradación in vitro de la materia seca (%DEGMS), pH y concentración de ácido acético y butírico después de 10 d de incubación con bacterias celulolíticas liofilizadas con y sin carbón activado como preservador†.
La concentración de bacterias totales en el tratamiento CA fue 2.37×108 bacterias mL-1 más que con SL (p≤0.05). El carbón en su proceso de activación aumenta el área de superficie (Elder, 2010; Villareal et al., 2015), que le permite absorber bacterias dentro de su estructura porosa y liberarlas después (Roussak y Gesser, 2013; Villareal et al., 2015). Las diferencias de la concentración de bacterias entre tratamientos y %DEGMS (Cuadro 1) se reflejaron en la producción de AGV (Cuadro 2). Las bacterias celulolíticas producen más ácido acético durante la fermentación de carbohidratos (Zavaleta, 1976). El tratamiento CA produjo 14.41 y 4.11 mM L-1 más ácido acético y propiónico que el tratamiento SL (p≤0.05).
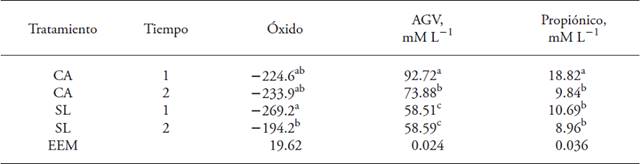
† Las variables presentaron interacción tratamiento tiempo (p≤0.05); a, b, c: valores promedio con distinta letra en una misma columna son diferentes estadísticamente (p≤0.05); EEM: error estándar del promedio; CA: carbón activado como preservador; SL: sin preservador, testigo
Cuadro 2: Potencial de óxido reducción (Óxido) y concentración de ácidos grasos volátiles (AGV) y ácido propiónico† en medios inoculados con bacterias celulolíticas liofilizadas y conservadas con carbón activado.
El pH tuvo valores neutros y sin diferencias entre tratamientos (p>0.05; Cuadro 1) lo cual facilitó el crecimiento de bacterias celulolíticas, ya que una disminución en el pH interfiere con la adherencia de las bacterias celulolíticas al material celulósico (Nag-Jin et al., 2005). Barboza et al. (2009) señalaron que las bacterias celulolíticas requieren pH neutro (Cuadro 1) para su actividad adecuada. El potencial de óxido-reducción negativo de los medios de cultivo indica que es altamente reductor. En nuestro estudio los medios de cultivo no presentaron diferencias (p>0.05) entre tratamientos, debido a que el carbón activado es un compuesto apolar (Mendonça et al., 2015) y no afecta el crecimiento. Pero la interacción del tratamiento CA en ambos tiempos de medición fue significativa (Cuadro 2).











 text in
text in 



