Introducción
Los carbohidratos vegetales son fuente de energía para rumiantes y se dividen en polisacáridos estructurales y polisacáridos no estructurales. Los estructurales están en la pared celular, es la fibra detergente neutro (FDN), se componen de celulosa, hemicelulosa y lignina (Barboza et al., 2009) y la proporción depende de la especie, tipo de célula y etapa de desarrollo (Vermerris, 2008). El ambiente anaerobio y los microorganismos del rumen degradan de manera eficiente los polisacáridos de origen vegetal, Ruminococcus flavefaciens, Ruminococcus albus y Fibrobacter succinogenes producen endoglucanasas, exoglucanasas y β-glucosidasas que actúan sinérgicamente en la degradación de celulosa en el rumen (Cai et al., 2010).
Los estudios de fermentación ruminal usan la evaluación in vitro de sustratos celulósicos para medir la degradación de un sustrato en un tiempo determinado, así como los ácidos grasos volátiles (AGV) obtenidos en la fermentación. Los microorganismos ruminales se usan como inóculo para simular las condiciones del rumen (Dhanoa et al., 2004; Váradyová et al., 2005). Los métodos in vitro son adecuados para comparar la degradación de sustratos celulósicos y la formación de productos derivados de la fermentación. Los AGV producto de fermentaciones in vitro difieren según las condiciones experimentales (Weimer et al., 2011).
La digestibilidad de materia seca (MS) de forrajes y residuos agrícolas se reduce con la madurez fisiológica por el incremento de polisacáridos estructurales (Barboza et al., 2009). Las bacterias celulolíticas pueden degradar polisacáridos estructurales de la pared celular; sin embargo, una sola especie bacteriana no produce las enzimas necesarias para digerirla, por lo cual deben asociarse fisiológicamente para combinar la acción de las enzimas (Miron et al., 2001). Además requieren interactuar con otros microorganismos mediante interdependencia alimentaria o alimentación cruzada (Cobos, 2007). El producto principal de esta degradación es acetato y CO2 (Lynd et al., 2002).
En la literatura revisada no hay publicaciones sobre la adición de bacterias celulolíticas a una población de microorganismos ruminales para observar los efectos en las variables de fermentación. La degradación in vitro de MS por bacterias celulolíticas como cultivos puros o cocultivos entre ellas la estudiaron Min et al. (2006) y Grilli et al. (2011), pero no se ha evaluado en cocultivo con bacterias ruminales. Por tanto, los objetivos de este estudio fueron comparar la producción de AGV de un cultivo de bacterias celulolíticas reactivadas (CBC) con bacterias ruminales totales (BRT) en cuatro sustratos celulósicos, así como establecer la relación entre AGV y la degradación in vitro de sustratos celulósicos.
Materiales y Métodos
El estudio se realizó en el Laboratorio de Microbiología Ruminal y Genética Microbiana, del Colegio de Postgraduados, Campus Montecillo, ubicado en el Km 36.5, carretera MéxicoTexcoco, Montecillo, Texcoco, Estado de México.
Medio de cultivo para bacterias celulolíticas
El medio de cultivo para bacterias celulolíticas contenía: 30 mL de fluido ruminal clarificado (líquido ruminal fresco centrifugado a 12 857 g por 10 min y esterilizado 15 min a 121 °C y 15 psi), 5 mL de solución mineral I [6 g K2HPO4 (Sigma) en 1000 mL de H2O destilada], 5 mL de solución mineral II [6 g KH2PO4 (Sigma) + 6 g (NH4)2SO4 (Merck) + 12 g NaCl (Sigma-Aldrich) + 2.45 g MgSO4 (Sigma) + 1.6 g CaCl-2H2O (Sigma) en 1000 mL de H2O destilada], 0.1 mL de resarzurina a 0.1 % (Sigma-Aldrich), 0.2 g de peptona de soya (Merck), 0.1 g de extracto de levadura (Sigma), 2 mL de solución sulfido-cisteína [2.5 g L-cisteína (Sigma) en 15 mL de 2 N NaOH (Meyer) + 2.5 g de Na2S-9H2O (Meyer) aforado en 100 mL de H2O destilada], 5 mL de solución al 8 % de Na2CO3 (Baker) y 52.6 mL de H2O destilada. El medio de cultivo se esterilizó 15 min en autoclave (Tuttnauver® 2540F, Israel) a 121 °C y 15 psi (Cobos y Yokoyama, 1995).
Cultivo de bacterias celulolíticas
El fluido ruminal se obtuvo de una vaca Jersey con cánula ruminal, la cual pastó en praderas de alfalfa (Medicago sativa) antes de tomar la muestra de fluido ruminal que se centrifugó 3 min a 1157 g en una centrífuga (Eppendorf® 5804, Alemania) a 25 °C. En una campana Labconco® (USA) de bioseguridad con purificador de Clase II provista de rayos ultravioleta, se recuperó el sobrenadante y se utilizó como inóculo. En tres tubos de 18×150 mm con una tira de papel Whatman® (3×30 mm) y 0.05 g de celulosa cristalina (Sigma) estériles, bajo flujo de CO2, se adicionaron 9 mL de medio de cultivo estéril y en una incubadora (Riossa® EO-71, México) se incubaron 24 h a 39 °C para verificar esterilidad. Los tres tubos se inocularon con 1 mL de inóculo; el medio se incubó 7 d a 39 °C hasta la degradación del papel Whatman®. Para obtener sólo bacterias con capacidad de degradar material celulósico, en otro tubo estéril se transfirió 1 mL de medio inoculado y se incubó a 39 °C hasta la degradación del papel Whatman (7 d). Cuatro transferencias se realizaron para obtener un cultivo de bacterias celulolíticas con capacidad para degradar la celulosa constituyente del papel Whatman®.
En viales serológicos de vidrío (50 mL) con una tira de papel Whatman (3×30 mm) y 0.1 g de celulosa cristalina (Sigma) estériles se depositaron 27 mL de medio de cultivo estéril, bajo flujo constante de CO2, y se incubaron 72 h a 39 °C para verificar esterilidad. El medio de cultivo en los viales se inoculó con 3 mL del producto obtenido de la cuarta transferencia del cultivo de bacterias celulolíticas y se incubaron a 39 °C hasta la degradación del papel Whatman (10 d). Las bacterias celulolíticas requieren un preservador para la liofilización y el carbón activado cumple esta función; por tanto, en cada vial se adicionó 0.1 g de carbón activado (Hycel) y se incubó a 39 °C por 2 h. Los viales se congelaron en un congelador de rodillo (Labconco® Shell Freezer, USA) hasta alcanzar -38 °C; después en una liofilizadora (Labconco® Freezone 6 L, USA) se liofilizaron 24 h en modo automático (-50 °C y 13.5 Pa de presión).
Inóculos y sustratos
Los inóculos fueron: 1) BRT=bacterias ruminales totales obtenidas del fluido ruminal de una vaca Jersey con cánula ruminal; la vaca pastó en praderas de alfalfa antes de tomar la muestra de fluido ruminal, el cual se centrifugó 3 min a 1157 g y 25 °C para precipitar protozoarios y partículas de fibra. 2) CBC=cultivo de bacterias celulolíticas reactivadas. En viales serológicos de vidrío (50 mL) con una tira de papel Whatman (3×30 mm) y 0.02 g de celulosa cristalina (Sigma) estériles se depositaron 30 mL de medio de cultivo estéril, bajo flujo constante de CO2. El medio de cultivo en el vial se inoculó con 0.05 g de liofilizado de CBC, bajo flujo constante de CO2 y se incubaron 10 d a 39 °C hasta degradar el papel Whatman. 3) Cocultivo=BRT y CBC (50:50); en ambos inóculos se determinó concentración de bacterias totales usando conteo directo en la cámara Petroff-Hauser (Hausser #39000, Electron Microscopy Sciences, USA) y la fórmula: concentración de bacterias=(promedio conteo directo) (factor de dilución) (2×107) para igualar la concentración de BRT y CBC (Ley de-Coss et al., 2013).
Los sustratos fueron rastrojo de maíz (Zea mays), alfalfa con 35 d de crecimiento, pasto bermuda (Cynodon dactylon) con 45 d de crecimiento y celulosa cristalina (Sigma). El rastrojo, la alfalfa y el pasto bermuda se molieron y pasaron por una criba de 1 mm, se lavaron con agua corriente para eliminar micropartículas (<25 𝛍m) y se llevaron a peso constante.
Degradación in vitro de materia seca
Los tubos de 18×150 mm con 0.05 g de un sustrato se esterilizaron 15 min a 121 °C y 15 psi. Luego se adicionaron 9 mL de medio de cultivo estéril bajo flujo de CO2 y se incubaron a 39 °C por 72 h para verificar esterilidad. Los tubos se inocularon con 1 mL de BRT, CBC o cocultivo; los medios se incubaron a 39 °C por 72 h. Al término de la incubación se midió pH con un potenciómetro (Orión modelo 250A, Brasil; calibración: pH 7 y 4). La capacidad de degradación in vitro de la MS (%DEGMS) se calculó como la diferencia entre la materia inicial y la residual después de la fermentación (Getachew et al., 2004).
Concentración de ácidos grasos volátiles (AGV)
Del medio de cultivo con 72 h d de incubación, se mezcló 1 mL y ácido metafosfórico al 25 % (razón 4:1) en un tubo para microcentrífuga (Hettich® EBA 21, Alemania). Los tubos se centrifugaron 18 800 g por 10 min; el sobrenadante se colocó en viales para cromatografía (1.5 mL, Perkin Elmer, USA). La concentración de AGV se determinó en un cromatógrafo de gases (Perkin Elmer, modelo Claurus 500, USA) equipado con detector de ionización de flama, columna capilar (Elite FFAP, Perkin-Elmer) de 15 m × 0.32 mm, usando nitrógeno como gas acarreador con flujo de 4 mL min-1 e H2 y O2 para generar una flama con flujo de 45 y 450 mL min-1. Las temperaturas del horno, inyector y columna fueron 120, 250 y 250 °C y se inyectó 1𝛍L de muestra. Así se obtuvieron tres picos en un tiempo de retención de 2.16, 2.59 y 3.11 para acetato, propionato y butirato (Cobos et al., 2007).
Diseño y análisis estadístico
El diseño experimental fue completamente al azar con un arreglo factorial 3×4 (cinco muestras independientes). Los factores fueron inóculos (BRT, CBC y cocultivo) y sustratos (rastrojo, pasto bermuda, alfalfa y celulosa cristalina). Los datos de %DEGMS, AGV y pH se analizaron usando el procedimiento GLM (SAS Institute Inc., 2011). Los promedios se ajustaron por mínimos cuadrados para compararlos con la prueba de Tukey (p≤0.05). Las variables se relacionaron usando la correlación de Pearson (p≤0.05) (SAS Institute Inc., 2011).
Resultados y Discusión
El cultivo de bacterias celulolíticas reactivadas (CBC), bacterias ruminales totales (BRT) y el cocultivo produjeron acetato, propionato y butirato por la fermentación de los carbohidratos presentes en sustratos celulósicos por actividad heterofermentativa (Cuadro 1). Esta actividad heterofermentativa se presentó debido a las interacciones entre microorganismos ruminales para degradar biomasa celulósica (Zhang et al., 2015) por interdependencia alimentaria y alimentación cruzada (Cobos, 2007). Estos resultados concuerdan con los publicados por Mateo-Sánchez et al. (2002), acerca de diferencias heterofermentativas usando aserrín como sustrato con Bacteroides stercorys en cultivo mixto con un cocobacilo.
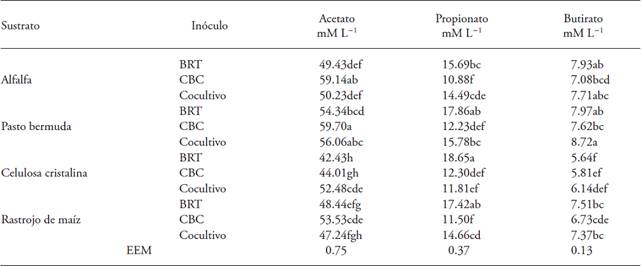
Valores promedio con distinta letra en una columna son diferentes estadísticamente (p≤0.05); EEM: error estándar del valor promedio. BRT: bacterias ruminales totales, concentración 5×109 bacterias mL-1 (se igualó la concentración con CBC); CBC: consorcio de bacterias celulolíticas, concentración 8.7×108 bacterias mL-1; Cocultivo: BRT y CBC (50:50).
Cuadro 1: Producción de ácidos grasos volátiles (mM L-1) de un cultivo de bacterias celulolíticas reactivadas (CBC), de bacterias ruminales totales (BRT) y un cocultivo CBC-BRT (50:50) en diferentes sustratos celulósicos.
El CBC al fermentar alfalfa y pasto bermuda produjo más acetato (p≤0.05) que las BRT (Cuadro 1) por la acción de las bacterias celulolíticas que fermentan acetato (Zhang et al., 2015). Sin embargo, CBC y BRT en celulosa cristalina y rastrojo de maíz no fueron diferentes (p>0.05) porque, los productos de fermentación in vitro dependen del tipo de inóculo y tipo de sustrato (Weimer et al., 2011).
Los tres inóculos no presentaron diferencias (p>0.05) en la producción de AGV en los sustratos alfalfa, pasto bermuda y rastrojo de maíz (Cuadro 2) porque las bacterias celulolíticas sólo afectan la proporción de acetato en la fermentación de sustratos celulósicos (Zhang et al., 2015). Las bacterias celulolíticas requieren pH neutro para su correcto funcionamiento (Barboza et al., 2009; Anrique, 2010) y son sensibles al pH. En pH inferiores a 6.0 se inhiben las bacterias celulolíticas (Chen et al., 2011). En nuestro estudio cuantificó el pH varió de 6.86 a 7.14 (Cuadro 2) por lo cual no influyó en el comportamiento de los inóculos sobre los sustratos evaluados.
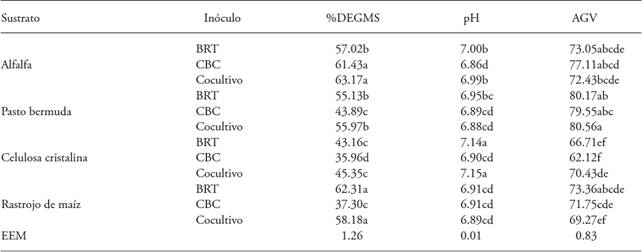
Valores promedio con distinta letra en una columna son diferentes estadísticamente (p≤0.05); EEM: error estándar del valor promedio. BRT: bacterias ruminales totales, concentración 5×109 bacterias mL-1(se igualó la concentración con CBC); CBC: consorcio de bacterias celulolíticas, concentración 8.7×108 bacterias mL-1; Cocultivo: BRT y CBC (50:50); %DEGMS, porcentaje de degradación in vitro de la materia seca a 72 h; pH, pH medido a 72 h de incubación; AGV, ácidos grasos volátiles (mM L-1) a las 72 h de incubación.
Cuadro 2: Comportamiento en la degradación in vitro de sustratos celulósicos inoculados con un cultivo de bacterias celulolíticas reactivadas (CBC), bacterias ruminales totales (BRT) y cocultivo CBC-BRT (50:50).
Las BRT en los sustratos evaluados presentaron mayor fermentación de propionato (p≤0.05) que CBC (Cuadro 1) por la presencia de bacterias amilolíticas que fermentan propionato (Anrique, 2010). La producción de butirato de los inóculos en los cuatro sustratos fue menor a 4 mM L-1 (Cuadro 1) porque se requiere sustratos como la fructosa o galactosa para aumentar su producción (Oba, 2011) y en nuestro estudio se fermentaron carbohidratos estructurales.
El CBC presentó los menores valores in vitro de la MS %DEGMS en pasto bermuda, rastrojo de maíz y celulosa cristalina; en contraste, el CBC y el cocultivo en alfalfa fueron mayores (p≤0.05) que BRT. En celulosa cristalina, rastrojo de maíz y pasto bermuda, el cocultivo no presentó diferencias (p>0.05) en la degradación in vitro con BRT (Cuadro 2). Estos resultados son mayores a los publicados por Juárez et al. (2009) y Grilli et al (2011), quienes reportaron menor degradación in vitro en pasto pangola inoculada con bacterias ruminales (Juárez et al., 2009) y alfalfa inoculada con F. succinogenes (Grilli et al., 2011). Ello se debe a que el tipo de inóculo, conformación de la población microbiana y especie donadora del inóculo (Mould et al., 2005) son determinantes en la degradación in vitro de los sustratos celulósicos.
El pH tuvo una correlación negativa con AGV totales y acetato (Cuadro 3). Al aumentar la producción de AGV el pH se acidificó, lo cual concuerda con lo publicado por Relling y Mattioli (2003) de que por su carácter ácido cuanto mayor es la producción de AGV disminuye el pH ruminal. La producción de AGV totales se correlaciona positivamente con %DEGMS, así al aumentar la producción de AGV totales se incrementó el %DEGMS. Estos resultados concuerdan con Getachew et al (2004), quienes señalan que la correlación entre degradación in vitro y la producción de AGV es positiva. La producción de acetato aumenta cuando disminuye la producción de propionato, con base en la correlación negativa de estas variables (Cuadro 3). Esto se debe al tipo de microorganismos presentes durante la fermentación de los sustratos celulósicos (Anrique, 2010).
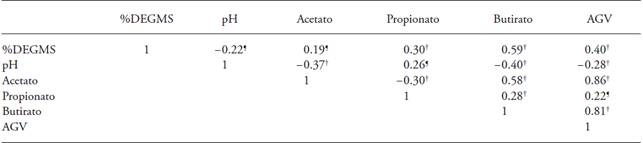
† Coeficiente significativo (p≤0.05); ❡ Coeficiente no significativo (p>0.05); %DEGMS: porcentaje de degradación in vitro de la materia seca a 72 h; pH, medido a 72 h de incubación; AGV: ácidos grasos volátiles (mM L-1) a las 72 h de incubación.
Cuadro 3: Coeficientes de correlación entre las variables de la prueba de degradación in vitro de sustratos celulósicos inoculados con un cultivo de bacterias celulolíticas reactivadas (CBC), bacterias ruminales totales (BRT) y un cocultivo entre CBC-BRT (50:50).
Conclusiones
El cultivo de bacterias celulolíticas reactivadas durante la fermentación de sustratos celulósicos presentó actividad heterofermentativa, y el acetato fue el principal producto de fermentación comparado con bacterias ruminales totales. La adición de un cultivo de bacterias celulolíticas reactivadas en bacterias ruminales no produjo sinergismo en la degradación in vitro de la materia seca de sustratos celulósicos, pero si mejoró la producción de acetato.











 texto en
texto en 


