Introducción
El uso de fabáceas forrajeras en asociación con gramíneas es relevante en la nutrición y sus-tentabilidad del sistema de producción pecuario (Martens et al., 2012). En gramíneas forrajeras tropicales, el contenido de proteína varía de 6 a 14 % y en algunos casos es menor a 6 %, según la época del año, edad de rebrote, y especie (Juárez-Hernández et al., 2004). En las fabáceas forrajeras la proteína puede alcanzar hasta 25 % (Heinritz et al., 2012); además, éstas fijan N al suelo, lo que puede beneficiar a las gramíneas asociadas (Onyeonagu y Eze, 2013). Las fabáceas contienen metabolitos secundarios, como compuestos fenólicos, que benefician o afectan negativamente al animal que las consume (Jezierny et al., 2010). Los compuestos fenólicos están relacionados con el sabor, olor y color del alimento, y pueden modificar la fermentación ruminal y reducir la emisión de gas metano (Evans y Martin, 2000; Rochfort et al., 2008). Entre los compuestos fenólicos están los taninos, que en concentraciones altas en las plantas las hacen menos aceptadas por el animal, y su efecto depende de la cantidad ingerida y del tipo de tanino (Mole et al., 1993; Patra et al., 2006).
Entre los taninos están los de tipo condensado o proantocianidinas y los hidrolizables (Hagerman y Butler, 1991). Los taninos condensados intervienen en la protección de la planta contra hongos y bacterias (Scalbert, 1991), actúan contra parásitos gastrointestinales (Aerts et al., 1999), son antioxidantes y pueden mejorar la resistencia al estrés por calor (Liu et al. , 2011). En contraste, concentraciones altas deprimen el consumo de alimento por el animal (Miller y Ehlke, 1994). Concentraciones bajas a moderadas, entre 5 y 55 g kg-1 MS, contribuyen a la protección de las proteínas en el rumen, permitiendo su paso hasta el intestino delgado, donde son degradadas y absorbidas (Gebrehiwot et al., 2002; Berard et al., 2011; Patra y Saxena, 2011).
En la región tropical de México, la mayoría de los estudios realizados con fabáceas forrajeras, se basan en su valor nutritivo sin incluir estudios de compuestos fenólicos, los que podrían afectar positiva o negativamente el valor nutritivo de la pradera, cuando está asociada, o se proporciona en banco de proteína o como forraje de corte. Además, la concentración de compuestos fenólicos, particularmente taninos, puede variar en función de la temperatura a la cual la fabácea crece, la fertilidad del suelo, del estado de madurez de la planta y de la especie (Berard et al., 2011). Por lo tanto, la determinación de la concentración de taninos en fabáceas forrajeras durante el desarrollo de las plantas ayudará a desarrollar estrategias de manejo y utilización en alimentación animal, sin producir efectos adversos. El objetivo del presente estudio fue determinar la concentración de compuestos fenólicos en cuatro fabáceas forrajeras tropicales con diferentes edades del rebrote.
Materiales y Métodos
La fase de campo se realizó en el Jardín de Recursos Genéticos Forrajeros del Campo Experimental Huimanguillo (17° 50' N, 93° 23' O) del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP) en Tabasco, México, de febrero a agosto de 2013. Este periodo abarcó los meses secos del año (de marzo a mayo) y los meses de lluvia (de junio a agosto) (Figura 1). La textura del suelo fue franca, con 41.1 % de arena, 24.5 % de arcilla y 34.4 % de limo, pH 7.0 y 21.5 meq 100 g-1 de CIC. No se aplicó fertilización y no se irrigó en el período seco del año.

Figura 1 Precipitación pluvial acumulada y temperatura promedio por mes durante el estudio en 2013. Huimanguillo, Tabasco, México. Las flechas indican el mes en el que se realizó el corte de uniformidad, previo a los meses sin y con lluvias.
En el estudio se evaluaron 16 tratamientos en un diseño de parcelas divididas completamente al azar, con tres repeticiones. La parcela mayor fue la especie de fabácea: Cacahuatillo (Arachis pintoi Krapovickas & Gregory), Stylo (Stylosanthes guianensis (Aubl.) Sw.), Clitoria, Conchita o Tehuana (Clitoria ternatea L.) y Kudzú (Pueraria phaseoloides Roxburgh Bentham). La parcela menor fue la edad del rebrote: 21, 42, 63 y 84 d. La unidad experimental fue una parcela de 2 X 1 m.
La siembra se realizó el 8 de agosto de 2012 en parcelas de 2x4 m, densidad de 5 kg de semilla ha-1 en hileras a 50 cm de separación, excepto Cacahuatillo, que fue establecido por material vegetativo (tallos con raíces), espaciado a 25 cm dentro de cada hilera.
Para determinar la edad del rebrote, en cada unidad experimental se asignó, en forma aleatoria, una de las cuatro edades del rebrote: 21, 42, 63 y 84 d. Los días de las edades del rebrote se contaron a partir del corte de uniformidad. El corte de uniformidad se aplicó a todas las parcelas el 26 de febrero para los meses secos, y el 20 de mayo para los meses con lluvias de 2013.
Las muestras de biomasa aérea recolectadas por especie y edad de rebrote se secaron a 50 °C, se trituraron, pasaron a través de una malla de 1 mm, en molino Wiley, y se conservaron en oscuridad a 4 °C hasta el análisis.
Las variables evaluadas fueron las concentraciones de polifenoles totales, fenoles no taninos, taninos condensados, hidrolizable y totales.
Polifenoles totales (PFT)
Las muestras se desengrasaron con éter de petróleo (Muzquiz et al., 1993). Los polifenoles se determinaron con el método de Folin-Ciocalteu, y ácido gálico como estándar en muestras libres de grasa. La absorbancia se midió a 765 nm en un espectrómetro (Thermoelectron, Genesys 10 UV) (Makkar et al., 1993).
Fenoles no taninos
A muestras libres de grasa se adicionó polivinilpirrolidona para separar fenoles taninos de los fenoles no taninos, después de agitarlas en vortex se incubaron por 15 min en oscuridad a 4 °C y se centrifugaron (10 000 rpm) a 25 °C por 10 min (Makkar et al., 1993). En el sobrenadante se cuantificó la concentración de fenoles no taninos con el reactivo de Folin-Ciocalteu a 725 nm. Los estándares se prepararon a partir de una solución estándar de 0.5 mg mL-1 de ácido gálico.
Taninos condensados (proantocianidinas)
Para cuantificar los taninos condensados, muestras libres de grasa se extrajeron con metanol al 80 %; a 250 /µL de ese extracto se le agregaron 1500 /µL de butanol:HCl (95:5, v/v) y 50 /µL de reactivo férrico (sulfato de amonio férrico al 2 % en HCl 2 N), se cubrieron y mantuvieron en baño María a ebullición por 60 min y se dejó enfriar a temperatura ambiente. Un blanco preparado con butanol:HCl y sin calentar se incluyó (Porter et al., 1986). La absorbancia se midió a 550 nm. La concentración de taninos condensados se calculó como equivalente leucocianidina con la fórmula: TC (g kg- 1MS) = (A550nm x 78.26 x Factor de dilución) / RMSP (g kg-1MS), donde 78.26 es un factor de corrección. El coeficiente de extinción molar (E 1 %, 1 cm, 550nm) de leucocianidinas es 460.
Taninos totales e hidrolizables
Los taninos totales (TT) se calcularon con la diferencia de fenoles no taninos de polifenoles totales. Los taninos hidrolizables (TH) fueron estimados como la diferencia de taninos totales y taninos condensados (Singh et al., 2005; Rana et al., 2006).
Análisis estadístico
Con los datos de concentración de cada compuesto fenólico por tratamiento se realizaron análisis de varianza y pruebas de comparación de medias por el método de Tukey (p≤ 0.05). Todas las determinaciones se realizaron por triplicado. Los análisis se hicieron con SAS, versión 9.3.
Resultados y Discusión
Condiciones Ambientales
Las temperaturas medias mensuales y las precipitaciones acumuladas por mes fueron mayores y menores en los meses secos en comparación con los de lluvias (Figura 1). Entre los meses secos, marzo tuvo la temperatura menor, 3.7 °C menos con respecto al promedio de abril y mayo. La diferencia en precipitación pluvial acumulada entre los meses secos y de lluvias promedió 190 mm más de lluvia en estos últimos. Mayo tuvo 98 mm más de lluvia que el promedio en marzo y abril.
La precipitación baja o alta y duración del periodo son condiciones ambientales a las cuales las fabáceas forrajeras tropicales están expuestas durante su crecimiento. Esto puede limitar la acumulación de biomasa y modificar la concentración de metabolitos secundarios (García et al., 2005; Jayanegara et al., 2011).
Polifenoles totales
En los meses secos las fabáceas, edad del rebrote y su interacción tuvieron efecto significativo (p≤0.05) en la concentración de polifenoles totales (PFT) (Cuadro 1). Las cuatro especies de fabáceas mostraron incremento inicial entre los 21 y 42 d de rebrote; pero esta tendencia de incremento no se mantuvo (Cuadro 2). Cacahuatillo, Stylo, Clitoria y Kudzú incrementaron su concentración en 27.02, 31.01, 74.62 y 46.38 g kg-1 MS en ese periodo. A los 42 d, Clitoria acumuló la cantidad mayor de PFT de las especies evaluadas (155.5 g kg-1 MS) y Cacahuatillo, Stylo y Kudzú no presentaron diferencias significativas (promedio 79 g kg- 1 MS).
Cuadro 1 Efecto de especie de fabácea, edad del rebrote y su interacción en la concentración de compuestos fenólicos en los meses secos y de lluvia del 2013, en Huimanguillo, Tabasco, México.
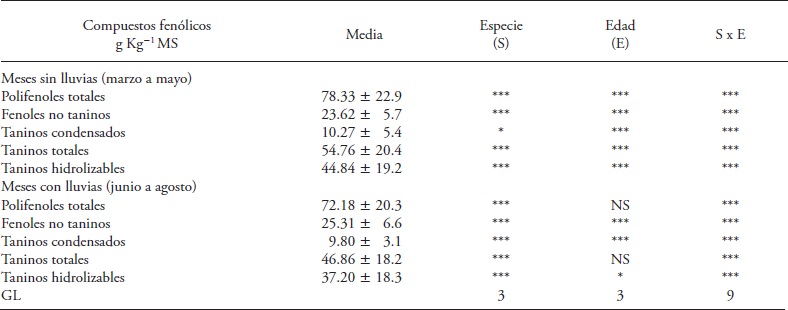
*, ** y *** Significancia p≤0.05, 0.01 y 0.001. NS: no significativo. GL: grados de libertad
Cuadro 2 Fenoles y sus fracciones (g kg-1 de MS) en rebrotes de fabáceas forrajeras tropicales entre marzo y mayo (meses secos) del 2013. Huimanguillo, Tabasco, México.
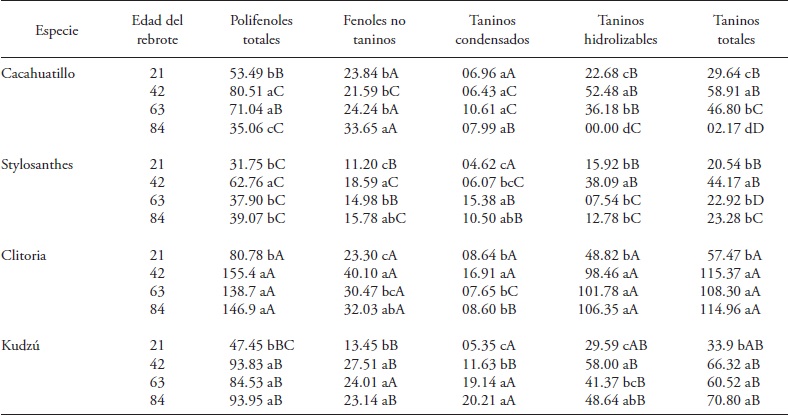
Medias con letras minúsculas distintas en una columna y dentro de cada especie son significativamente diferentes (Tukey, p≤0.05). Medias con letras mayúsculas distintas en una columna indican diferencia significativa (Tukey, p≤0.05) entre especies para una misma edad del rebrote
Clitoria y Kudzú mantuvieron la concentración de PFT sin cambio entre 42 y 84 d del rebrote, y Cacahuatillo y Stylo disminuyeron su concentración (Cuadro 2). En los meses con lluvias PFT aumentó a los 21 d con respecto a los meses secos, y la concentración con la edad del rebrote, excepto en Kudzú (Cuadro 3). La interacción especie x edad del rebrote afectó a Kudzú, ya que aumentó su concentración de PFT con la edad del rebrote, y cambió de una concentración baja, a los 21 d junto con Stylo, a la concentración mayor a los 84 d de edad. Simultáneamente Stylo mantuvo concentración baja durante su crecimiento. Cacahuatillo y Clitoria disminuyeron el contenido de PFT entre 21 a 84 d del rebrote.
Cuadro 3 Fenoles y sus fracciones (g kg-1 de MS) en especies de fabáceas forrajeras tropicales en edades diferentes del rebrote durante junio a agosto (meses con lluvias) del 2013. Huimanguillo, Tabasco, México.
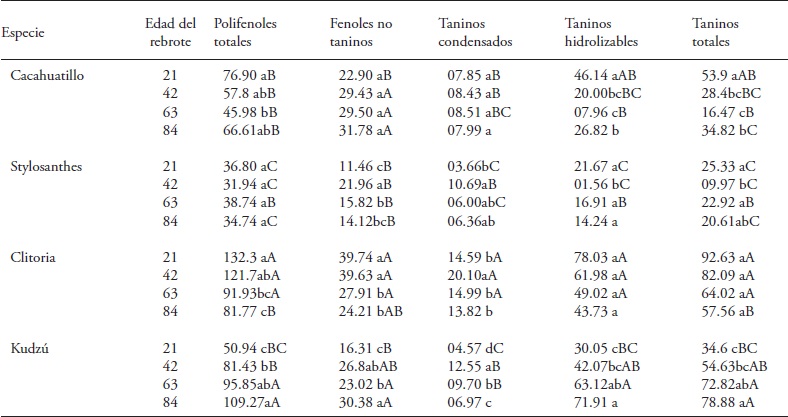
Medias con letras minúsculas distintas en una columna y dentro de cada especie son significativamente diferentes (Tukey, p≤0.05). Medias con letras mayúsculas distintas en una columna indican diferencia significativa (Tukey, p≤0.05) entre especies para una misma edad del rebrote
Durante el crecimiento, Clitoria y Stylo mostraron las concentraciones mayor y menor de PFT, excepto Clitoria a los 84 d en los meses de lluvias.
Variaciones del contenido de PFT durante el crecimiento de especies forrajeras tropicales se han documentado (Rana et al., 2006; Jayanegara et al., 2011). El efecto significativo de la época de lluvias en la concentración de PFT en Morus alba (García et al., 2005) se debe probablemente al aumento del área foliar (Frutos et al., 2004). Al respecto, en nuestro estudio el incremento de área foliar pudo haber aumentado los PFT en los meses con lluvias.
El contenido de PFT de Clitoria durante el crecimiento fue significativo, por lo que esta planta podría contribuir a disminuir las emisiones de gas metano por los rumiantes, ya que la concentración de PFT en plantas tiene correlación negativa con la producción de metano (Jayanegara et al., 2009; Jayanegara et al., 2011).
Fenoles no taninos (FNT)
Los fenoles simples no taninos mostraron un patrón similar al de los PFT con la edad del rebrote, y una interacción significativa especie x edad del rebrote (Cuadro 1). Stylo presentó la concentración menor de FNT entre las especies evaluadas (Cuadro 2 y 3). Los FNT variaron en los meses de lluvias y en los no lluviosos. A los 42 d Stylo, Clitoria y Kudzú incrementaron los FNT, excepto Cacahuatillo en los meses secos. Concentraciones superiores, de 14 a 56 g kg- 1 MS de FNT, se observaron en hojas de fabáceas arbustivas (Jayanegara et al., 2011). Estos compuestos son de interés porque algunos de ellos tienen propiedades antioxidantes (Makkar et al., 2007) y podrían tener una acción inhibitoria directa sobre la actividad de metanógenos (Jayanegara et al., 2011).
Taninos totales (TT)
La concentración de TT aumentó en las cuatro especies de fabáceas en los meses secos, y solo en Kudzú en los de lluvias (Cuadro 2 y 3). La interacción especie x edad del rebrote fue significativa solo en los meses secos (Cuadro 1). Los TT variaron de 2.17 (Cacahuatillo) a 115.37 (Clitoria) g kg- 1 MS en los meses secos y de 9.97 (Stylo) a 92.63 (Clitoria) g kg-1 MS en los de lluvias. Otros estudios mostraron que los taninos pueden actuar favorablemente en la fermentación ruminal, ya que forman complejos tanino-proteína que evitan la degradación de ésta en el rumen, inhiben la metanogénesis y mejoran la eficiencia reproductiva, aunque los efectos benéficos no son los mismos en todos los casos (Patra y Saxena, 2011). El efecto benéfico en la eficiencia reproductiva del ganado depende de la estructura química de los taninos presentes, su concentración y tipo de dieta (Makkar et al., 2007). El efecto en la reducción de la metanogenésis con los TT no se observa en todos los casos (Jayanegara et al., 2011). Solo Stylo y Cacahuatillo mostraron valores promedio inferiores a 60 g kg- 1 MS de TT en todas las edades del rebrote (Cuadro 2 y 3). Clitoria y Stylo mostraron la concentración mayor y menor durante su crecimiento en el año. Algo similar se observó en Clitoria y Kudzú en los últimos 21 d en la época con lluvia y en Stylo y Cacahuatillo en los meses secos a los 84 d de rebrote.
Taninos condensados (TC)
Información de la variación en taninos condensados es abundante en especies de fabáceas forrajeras y su efecto benéfico en producción pecuaria cuando las concentraciones no exceden 60 g kg- 1 MS (Makkar et al., 2003; Rochfort et al., 2008). Los TC de las especies en estudio variaron, en promedio, en cantidades similares en los meses secos y de lluvias (Cuadro 2 y 3). Solo en Clitoria aumentó TC en los meses con lluvia en todas las edades del rebrote (Cuadro 3). Kudzú, Stylo y Cacahuatillo mostraron concentraciones mayores desde 63 d del rebrote y en Clitoria desde los 42 d en los meses secos (Cuadro 2). Clitoria disminuyó su concentración casi 10 veces a los 63 d con respecto a los 42 d, y en los meses con lluvias, esta especie también aumentó la concentración de TC con la edad del rebrote (Cuadro 3). Berard et al. (2011) reportaron el contenido de TC en hojas de fabáceas tropicales, Acacia angustissima y Calliandra calothyrsus (33 y 196 g kg- 1 MS), y en fabáceas herbáceas, Medicago sativa y Astragalus cicer (0.0 g kg-1 MS) y Dalea purpurea (68.7 g kg-1 MS). Ellos también observaron aumento en TC con la madurez de la planta. Las especies presentaron concentraciones que podrían ser benéficas en alimentación de rumiantes (Patra y Saxena, 2011), aunque su actividad biológica depende de su estructura química y peso molecular. La unión de los taninos con proteínas depende del número de grupos fenólicos en la molécula y los de peso molecular alto no se absorben (Frutos et al., 2004).
Las concentraciones bajas de TC en las especies de nuestro estudio, comparando con otras fabáceas forrajeras, puede ser efecto de la especie y tejido vegetal analizado. Al respecto, Häring et al. (2007) indicaron que la distribución de taninos en los tejidos de las plantas es heterogénea, y concentraciones mayores se detectan en hojas y menores en tallos. Debido a esto se observa un efecto de dilución en la concentración de TC cuando la muestra incluye la biomasa aérea total.
Taninos hidrolizables (TH)
Todas las especies alcanzaron concentración mayor de TH a los 42 d de edad del rebrote. Desde esa edad, Clitoria mantuvo la concentración de 102.2 g kg-1 MS. En las otras especies la concentración fluctuó. Al contrario, en los meses de lluvias las especies no mostraron tendencias similares. Clitoria mantuvo una concentración promedio de 58.19 g kg-1 MS durante el crecimiento. Kudzú incrementó continuamente su concentración con la edad del rebrote. Clitoria y Kudzú tuvieron concentración mayor entre 42 y 84 d. Stylo mostró las concentraciones menores, junto con Kudzú a los 21 d y con Cacahuatillo a los 63 y 84 d de edad del rebrote (Cuadro 3).
Concentraciones de TH superiores a 200 g kg-1 MS pueden producir toxicidad al ganado (Mole et al., 1993; Rana et al., 2006). Las especies evaluadas no superaron los niveles tóxicos en los meses sin o con lluvias. La toxicidad causada por TH puede deberse a la degradación de los TH, con lo que su peso molecular disminuye y la absorción de los productos en el rumen puede producir una carga metabólica mayor con fenoles, los que pueden exceder la capacidad de desintoxicación del hígado (Jayanegara et al., 2011).
Los resultados de nuestro estudio mostraron el efecto de edad de la planta en la concentración de compuestos fenólicos durante su crecimiento. Pero, la interacción especie x edad del rebrote fue significativa para los grupos de compuestos evaluados. Las plantas tuvieron las concentraciones mayores de compuestos fenólicos a los 42 d de edad del rebrote. Las concentraciones mayores de compuestos fenólicos se observaron en Clitoria y las menores en Stylo; esas concentraciones fueron menores a las identificadas como tóxicas por algunos autores. Los niveles mayores de taninos condensados (16.91 y 20.1 g kg-1 MS) en Clitoria, a la edad de 42 d en los meses sin y con lluvias, son menores que la considerada (60 g kg-1 MS) mínima para que la fermentación en rumen sea afectada (Makkar, 2003).
Conclusiones
La especie de fabácea y la edad de rebrote son fuente de variación en la concentración de polifenoles totales durante el crecimiento; la edad de rebrote (madurez de la planta) es el factor que afecta más esas concentraciones. Las concentraciones máximas de compuestos fenólicos se observaron a los 42 d, y no alcanzaron los niveles tóxicos para los animales. Clitoria y Stylo presentaron la concentración de compuestos fenólicos mayor y menor entre las especies.











 texto en
texto en 


