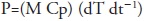Introducción
La chía (Salvia hispanica L.) es una planta herbácea originaria del sur de México y el norte de Guatemala, que pertenece a la familia Lamiaceae (Marineli et al., 2014). Las semillas de chía son buena fuente de fibra, aceite rico en ácidos grasos poliinsaturados y antioxidantes naturales, incluyendo tocoferoles, fitosteroles, carotenoides y compuestos fenólicos, como ácido clorogénico, ácido caféico, miricetina, quercetina y kaempferol (Capitani et al., 2012). Junto con el maíz (Zea mays L.), frijol (Phaseolus vulgaris L.) y amaranto (Amaranthus cau-datus), la chía era un componente básico en la dieta de muchas civilizaciones precolombinas de América, incluso la maya y azteca; sus semillas fueron valoradas como fuente de aceites para uso medicinal (Cahill, 2003). En México, las semillas de chía se utilizan por sus propiedades nutritivas y medicinales, i.e., para los atletas de resistencia, supresores del apetito, agentes de pérdida de peso, control de la glucosa en sangre, y regulación intestinal. El uso potencial de las semillas de chía como fuente adecuada de proteínas con estabilidad térmica notable está documentado (Sandoval-Oliveros y Paredes-López, 2013).
Los compuestos fenólicos se clasifican en varias clases, de ellos los ácidos fenólicos, flavonoides y taninos son los principales compuestos fenólicos de los alimentos (Balasundram et al., 2006). Las propiedades antioxidantes de los compuestos fenólicos se atribuyen a su capacidad para eliminar los radicales libres y para quelar iones de metales que intervienen en su producción. Así, la actividad antioxidante de los ácidos fenólicos se debe a su capacidad para donar un anión de hidrógeno, i.e., un electrón no apareado, y reubicarlo dentro de la estructura aromática (Fernández-Panchón et al., 2008; Cabrera-Soto et al., 2009; Ignat et al., 2011). Los antioxidantes son compuestos que retardan el proceso de oxidación mediante la inhibición de la iniciación o propagación de reacciones de oxidación en cadena, así se evita oxidaciones mayores, que son condiciones relacionadas con el estrés, enfermedades cardiovasculares, diabetes (Vuksan et al., 2010) aterosclerosis, accidentes cerebrovasculares, cáncer y enfermedades neurodegenerativas. Para aislar estos componentes bioactivos se usan técnicas de extracción convencionales y basadas en disolventes. Sin embargo, estos métodos tienen limitaciones como el consumo elevado de disolvente y tiempos largos de extracción. Entonces, se necesitan formas alternativas para mejorar el proceso de extracción, aumentando, el rendimiento y la calidad de los extractos (Rodríguez-Bernaldo et al., 2010). Los métodos propuestos son el uso de fluidos supercríticos (Zulkafli et al., 2014), microondas (Setyaningsih et al., 2015) y ultrasonido de alta potencia (Hussam et al., 2013). Hay una búsqueda continua de la definición de las variables adecuadas del proceso de estas tecnologías emergentes para alcanzar los objetivos definidos.
La extracción asistida por ultrasonido (EAU) se usa para aislar compuestos (Hussam et al., 2013). Ciertos beneficios en términos de penetración del disolvente surgen del uso en EAU de componentes de los alimentos, incluyendo la intensificación de transferencia de masa y efectos capilares. La extracción también podría mejorarse debido al colapso de las burbujas formadoras de cavitación, cerca de las paredes celulares (Toma et al., 2001). La tasa de extracción y el rendimiento pueden mejorarse mediante la combinación óptima de variables de ultrasonidos, como la intensidad y el tiempo (Rodríguez-Bernaldo et al., 2010). La extracción de compuestos fenólicos de semillas de chía fue documentado por Reyes-Caudillo et al. (2008) y ellos compararon el efecto del prensado y el disolvente. La aplicación de EAU no se ha explorado aún. Además, disolventes diferentes para la extracción podrían dar composiciones distintas de compuestos en los extractos, ya que la solubilidad de cada compuesto fenólico en un disolvente dado es diferente. Esto implica que los compuestos fenólicos con características más hidrofóbicas se pueden producir en cantidades menores que aquellos con características hidrofílicas. En consecuencia, la bioactividad de un extracto también se podría afectar (Lou et al., 2014). El objetivo de este estudio fue cuantificar EAU en la capacidad antioxidante y el contenido de fenoles totales de semillas de chía usando un disolvente polar (metanol) y uno no polar (hexano).
Materiales y Métodos
Materias primas, reactivos y estándares
Semillas frescas de chía se adquirieron en un mercado local de la ciudad de Zacatecas, México. Las semillas se limpiaron, molieron y tamizaron hasta tener partículas de 500 μm, se envasaron en bolsas herméticas de plástico y se almacenaron en la oscuridad a temperatura ambiente (25 ºC). Los reactivos Folin-Ciocalteu (2 N), 2,2'-azino-bis (3-etilbenzotiazolina de 6-sulfónico) (ABTS), ácido 6-hidroxi-2,5,7,8 tetrametilcroman-2 carboxílico (Trolox), ácido gálico, persulfato de potasio y carbonato de sodio fueron de grado analítico (Sigma Chemical Co.; St. Louis, MO, EE.UU.); n-hexano y metanol fueron grado HPLC (JT Baker).
Extracción convencional
Harina de semillas de chía (5 g) y 50 mL de n-hexano o metanol (1:10 p/v) se mezclaron completamente por 5, 10 o 15 min, con un homogeneizador Ultraturrax (T-25, IKA, Staufen, Alemania) y luego se centrifugó (2701 x g, 4 ºC) por 10 min. Los sobrenadantes se almacenaron a 4 ºC hasta su análisis (24 h).
Puesta en marcha del dispositivo ultrasónico
Un dispositivo de ultrasonidos de sonda (UP400S, Hiels-cher, Teltow, Alemania) que trabaja en condiciones de temperatura controlada (25 ºC) se utilizó, a 24 kHz, con potencia máxima de 400 W y un emisor de superficie de 3.8 cm2 (Figura 1). La sonda ultrasónica se sumergió 1.5 cm en la solución y el recipiente se mantuvo en oscuridad, para evitar posibles daños, inducidos por la luz en el extracto.
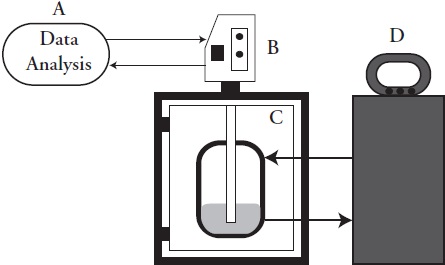
Figura 1 Equipo experimental para la extracción asistida por ultrasonido de compuestos fenólicos de semillas de chía (Salvia hispanica L.). A: computadora portátil; B: sistema de sonda de ultrasonido; C: recipiente de extracción con camisa; D: enfriador.
La potencia ultrasónica eficaz transferida se determinó en el medio (P) con un procedimiento colorimétrico (Hussam et al., 2013) (Ecuación 1) y registro del aumento de la temperatura cada segundo, durante los primeros 3 min de la aplicación de ultrasonido. P se calculó como sigue:
donde M (kg) es la masa de disolvente, Cp (J kg-1 ºC) es la capacidad calórica del disolvente y dT dt-1 es la pendiente de la curva temperatura-tiempo registrados. Las determinaciones se realizaron por triplicado.
Extracción por ultrasonidos
Los experimentos se realizaron con la misma harina de semillas de chía (relación de disolventes como se indicó antes). El extracto se colocó en un recipiente de extracción con camisa y se sometió a tratamiento de ultrasonido por 5, 10, y 15 min a amplitudes que corresponde a 50, 75 y 100 % de potencia de salida (400 W). Después de la extracción, se centrifugó la mezcla (2701 x g; 4ºC) por 10 min. El sobrenadante obtenido se almacenó (24 h) en viales opacos a 4 ºC hasta su análisis.
Determinación de compuestos fenólicos totales (TPC)
El contenido de fenoles totales (TPC) se determinó con el método Folin-Ciocalteu descrito por Hussam et al. (2013) con algunas modificaciones. En breve, 250 μL de extracto se mezclaron con 15 mL de agua desionizada y 1.25 mL de reactivo Folin-Ciocalteu para fenoles. Después de 5 min, 3.75 mL de Na2CO3 (7.5 %) y se aforó a 25 mL con agua desionizada. La absorbancia se midió a 765 nm en un espectrofotómetro UV-Vis (Thermo Scientific 10S, Thermo Fisher Scientific Inc, EE.UU.). El valor TPC de los extractos se expresó como equivalentes de ácido gálico en mg (GAE) por muestra (100 g), para lo que se utilizó una ecuación de regresión y una curva de calibración de ácido gálico. Al menos tres réplicas se hicieron de cada extracto.
Capacidad antioxidante (AC) y capacidad secuestradora ABTS+ ⋅
La capacidad de eliminación de ABTS se determinó como lo describió Fu et al. (2011). Un radical cationico ABTS (ABTS+⋅) se generó mediante la reacción de una solución acuosa de ABTS (7 mmol L-1) con K2S2O8 (concentración final 2.45 mmol L-1,) en oscuridad por 16 h, su absorbancia se ajustó a 734 nm a 0.700± 0.1 con etanol. Después de la adición de 900 mL de solución diluida ABTS+⋅ a 100 mL de extracto, la absorbancia se leyó exactamente 1 min después de la mezcla inicial. El porcentaje de inhibición de la absorbancia a 734 nm se calculó y se representó como una función de la concentración de antioxidantes y de Trolox por los datos de referencia estándar. La capacidad antioxidante Trolox equivalente (TEAC) se calculó posteriormente. Los resultados se expresaron como mg Trolox 100 g-1. Los experimentos se realizaron por triplicado.
Diseño experimental y análisis estadístico
El diseño experimental fue factorial (3x3x2) y tres replicas. Todos los valores se expresaron como medias ± desviación estándar. Con los datos se realizaron un análisis multifactorial de una sola vía y ANDEVA, y la significancia de la diferencia entre las medias se determinó con la prueba de Tukey (p≤ 0.05) con Statgraphics® Centurion XV (Statpoint Technologies Inc., Warrenton, VA, EE.UU.). La prueba de correlación de Pearson se realizó para determinar las correlaciones lineales entre TPC y AC con el mismo software.
Resultados y Discusión
Extracción convencional
Una diferencia significativa (p≤0.05) se observó entre TPC de los extractos metanólicos respecto a los obtenidos con hexano en todos los tiempos de extracción, con incremento promedio de 64.56 %. Así, los compuestos fenólicos en chía serían de naturaleza polar (Figura 2A). Estos resultados coincidieron con los de González-Jiménez et al. (2010). Reyes-Caudillo et al. (2008) obtuvieron en muestras de chía extraídas con etanol valores TPC de 88.00 mg por 100 g de muestra, y Martinelli et al. (2014) documentaron TPC de 94 mg 100 g-1. Una diferencia significativa (p≤ 0.05) se observó en AC de muestras extraídas con metanol y hexano (Figura 2B).
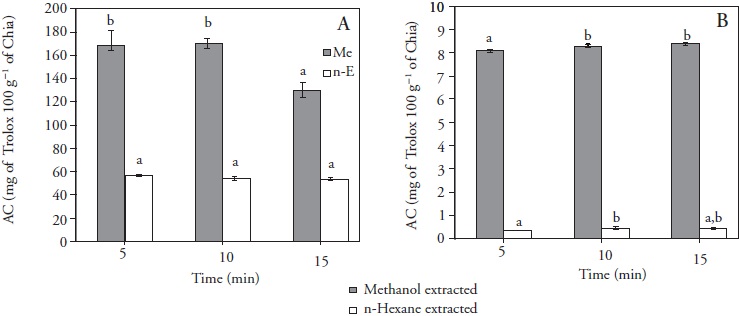
Figure 2 Efecto del tipo de disolvente (n-hexano o metanol) en tres tiempos convencionales de extracciones promedio (A) TPC y (B) AC de muestras de semillas de chía. Promedio ± HSD (p≤ 0.05).
Para comparar el efecto del disolvente, valores promedio de fenoles totales y actividad antioxidante se obtuvieron de todos los valores de la extracción convencional. Extractos metanólicos mostraron AC promedio de 8.27± 0.15 mg Trolox 100 g- 1 de chía, y los extractos de hexano tuvieron AC promedio de 0.44± 0.05 mg Trolox 100 g- 1 de chía, que es consistente con los resultados TPC. Los extractos de hexano son ricos en ácidos grasos poliinsaturados altamente inestables (PUFA) (González-Jiménez et al., 2010). La propensión de PUFAs a oxidación sería responsable de los valores bajos de AC. Estos resultados concuerdan con los obtenidos por González-Jiménez et al. (2010), quienes informaron que las fracciones de aceite de semillas de chía mostraron AC menor, relacionada con TPC baja obtenida con hexano y contenido PUFA alto. Los resultados mostraron (Figura 2A) diferencia significativa (p≤0.05) entre las extracciones de metanol por 5 min y 10 respecto a la extracción por 15 min. En las muestras con hexano hubo aumento significativo (p≤0.05) de TPC en las muestras extraídas con 5 min, mientras que AC (Figura 2B) no mostró influencia significativa (p>0.05) del tiempo de extracción con ambos disolventes.
Hay una influencia de la polaridad del disolvente en el proceso de extracción. Así, los TPC y AC mayores se obtuvieron en muestras con metanol, mientras que en el tiempo de extracción convencional TPC fue disminuyendo en muestras de metanol e incrementando en las muestras de hexano, y AC se mantuvo constante en ambas muestras.
Extracción asistida por ultrasonido
La potencia ultrasónica efectiva estuvo en el intervalo de 29.002 a 37.534 W. Como se esperaba, el ultrasonido aplicado al medio aumentó casi linealmente (R2metanol = 0.8833; R2n-hexano = 0.9972) con el suministro de energía eléctrica al transductor (Cuadro 1).
Cuadro 1 Potencia de ultrasonidos (W) aplicada al medio como función del porcentaje de la potencia total eléctrica (400 W) y tiempo (3 min) de aplicación de ultrasonido.
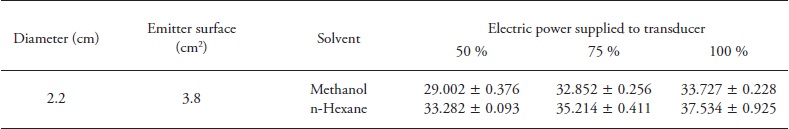
Los datos son medias ± desviación estándar (n=3).
Similar a la extracción convencional, para comparar el efecto del disolvente, valores promedio de fenoles totales y actividad antioxidante se obtuvieron de todos los valores por EAU. La potencia ultrasónica neta aplicada fue siempre mayor para hexano que para metanol; esto se atribuyó a diferencias en la capacidad calórica. Los resultados de los EAU (Cuadro 2) mostraron diferencia significativa (p≤0.05) en TPC y AC entre los extractos metanólicos (en promedio 149.95±20.39 mg de GAE 100 g-1 y 9.90±0.05 mg de Trolox 100 g- 1 de chía) y hexano (en promedio 60.31±5.99 mg de GAE 100 g-1 y 1.11±0.38 mg de Trolox 100 g-1 de chía). De acuerdo con otros estudios (Cárcel et al., 2007; Hussam et al., 2013), la potencia ultrasónica aplicada se consideró un factor clave que afectan a la eficiencia de extracción de los compuestos fenólicos. Una potencia ultrasónica superior genera cavitación mayor, que facilita la penetración del disolvente en la matriz y aumenta la eficiencia de la extracción (Priego y Luque, 2004).
Cuadro 2 Influencia de los parámetros del proceso de extracción asistida por ultrasonidos en el TPC y AC de semillas de chía con diferentes disolventes (metanol y hexano).
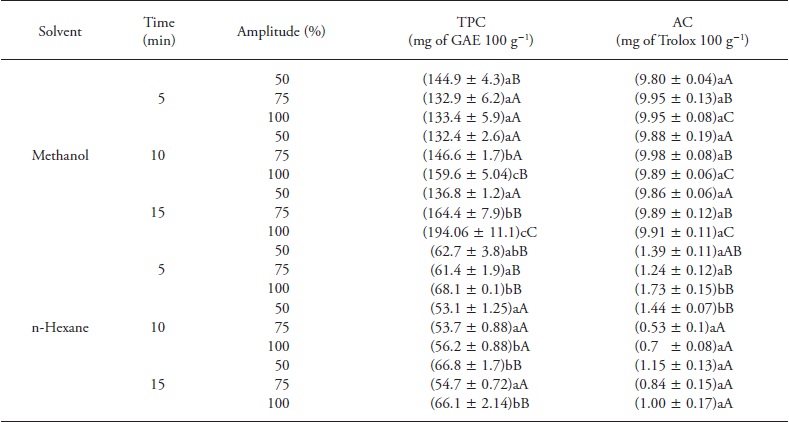
Los datos son medias ± desviación estándar (n=3). Las letras minúsculas diferentes en la misma celda y la misma columna indican diferencias significativas entre las amplitudes en el tiempo de extracción (p≤ 0.05); las letras mayúsculas en una celda diferente dentro de una única columna indican diferencias estadísticamente significativas entre los tiempos de la misma amplitud (p≤0.05).
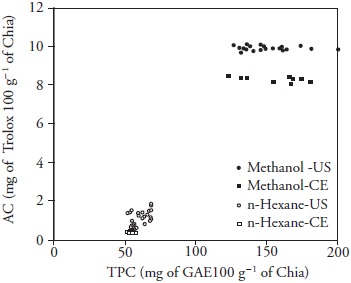
Los parámetros mejores de extracción de TPC se obtuvieron con 100 % de energía ultrasónica por 15 min y metanol (194.06 ±11.11 mg de GAE 100 g-1 de chía), pero no hubo efecto (p>0.05) con el ultrasonido aplicado por 5 y 15 min en la extracción con hexano (68.14±0.14 y 66.13±2.14 mg de GAE 100 g- 1 de chía). Una vez más, esto se atribuyó a la falta de afinidad de la polaridad del hexano hacia compuestos hidrófilos de chía, así como con la potencia de irradiación, lo que podría reducir la eficiencia de la energía ultrasónica transmitida al medio por aumento en el número de burbujas en el disolvente durante la cavitación (Filgueiras et al., 2000; Zhao et al., 2007). Como se esperaba, los extractos metanó-licos exhibieron el AC mayor (9.90± 0.05 mg Trolox 100 g-1 de chía) (Cuadro 2), pero no hubo diferencias significativas en la energía ultrasónica aplicada (p>0.05). Además, hubo correlación entre TPC y AC de semillas chía para los disolventes (R=0.9391; n=66; p=0.000) (Figura 3).
Conclusiones
La extracción con metanol asistida por ultrasonido se podría utilizar como una alternativa eficiente para obtener compuestos fenólicos, con capacidad antioxidante alta, de semillas de chía. El efecto del ultrasonido depende de la potencia ultrasónica que se aplique al medio y el tiempo de extracción.
Las mejores condiciones de extracción del contenido de fenoles totales fueron 100 % de la potencia eléctrica total durante 15 min. La extracción asistida por ultrasonido todavía presenta algunos retos para su escala industrial. Por lo tanto, los procesos asistidos por ultrasonido se deben evaluar para aumentar la probabilidad de aplicación en el procesamiento de alimentos.











 texto en
texto en