Introducción
El uso de rizobacterias promotoras del crecimiento vegetal (RPCV) es una aplicación tecnológica racional en los procesos de producción agrícola (Lugtenberg y Kamilova, 2009). Las RPCV pueden aumentar la disponibilidad de nutrimentos en la rizósfera y estimular el crecimiento vegetal a través de la fijación de nitrógeno, solubilización de nutrimentos y producción de sideróforos (Loredo et al., 2004) y ácido indolacético (AIA), hormona vegetal que promueve el desarrollo radical, vegetativo y producción de frutos (Martínez et al., 2013). Varias especies de RPCV tienen un impacto en la producción agrícola al usarse como biofertilizantes (Lugtenberg y Kamilova, 2009; Das et al., 2013).
La RPCV Brevibacillus brevis pertenece a la Clase Bacilli y se ha estudiado poco. Jha y Saraf (2011) reportaron que B. brevis MS1 aplicado a Jatropha curcas causó un incremento significativo en longitud (7 %) y biomasa (103 %) de la raíz, después de 60 d de la inoculación. Vivas et al. (2003) y Vivas et al. (2005) observaron que la inoculación con B. brevis en Trifolium sp. aumentó el crecimiento aéreo, biomasa de raíz y tolerancia a metales pesados. Estudios en C. annuum con RPCV del género Bacillus, perteneciente a la Clase Bacilli, mostraron resultados positivos en el crecimiento vegetal: aumento en altura de las plantas (21 a 65 %) e incremento en biomasa de raíz (35 a 75 %) y aérea (15 a 37 %) (Lamsal et al., 2012; Castillo et al., 2013; Martínez et al., 2013). Además, el contenido de algunos elementos minerales en el follaje, en particular el N, incrementa en respuesta a las inoculaciones con estas rizobacterias (Christinal y Tholkkappian, 2013; Rezvani et al., 2013). En varias especies vegetales el contenido de N foliar puede tener impactos directos en la susceptibilidad de las plantas huéspedes a insectos fitófagos (Lu et al., 2007; Chen et al., 2008).
Las RPCV de la Clase Bacilli pueden modular el efecto de fitófagos en el follaje (Pineda et al., 2010). Los efectos positivos de la inoculación de RPCV están documentados contra insectos fitófagos, como la mosca blanca (B. tabaci) en tomate (Solanum lycopersicum), donde se redujo 43 % la densidad de ninfas de B. tabaci por la inoculación a la semilla de varias especies de Bacillus (Murphy et al., 2000). Soto et al. (2010) también reportaron reducción significativa (36 %) en la población de ninfas de B. tabaci en plantas de S. lycopersicum inoculadas con B. subtilis.
El objetivo de este estudio fue evaluar el efecto de la rizobacteria B. brevis CBTC1 en el crecimiento y contenido de nitrógeno foliar de tres genotipos criollos y uno comercial de C. annuum, también se evaluó la respuesta de resistencia a B. tabaci de los genotipos inoculados.
Materiales y métodos
Sitio experimental
Muestras de suelo se recolectaron en la península de Yucatán para el aislamiento de la rizobacteria. Las muestras se tomaron a una profundidad aproxima de 10 cm, cerca de la rizósfera de plantas en zonas cultivadas y no cultivadas. Las muestras se depositaron en bolsas plásticas y se trasladaron al laboratorio donde se realizó el aislamiento e identificación de la cepa.
El efecto de la inoculación de la rizobacteria en genotipos de C. annuum se evaluó en un invernadero rústico en Conkal, Yucatán, México, en los genotipos criollos Simojovel, Amaxito y X-kat ik de chile del sureste de México y el comercial Jalapeño. Estas muestras se recolectaron en un estudio de potenciación de germoplasma (Hernández et al., 2012).
Aislamiento de la cepa bacteriana
Muestras de suelo de 2 g y se mezclaron con 10 mL de agua destilada estéril en tubos Falcon de 15 mL, se agitaron enérgicamente 30 a 40 s, se calentaron en baño maría a 80 °C por 15 min, e inmediatamente después se sumergieron en hielo 15 min. Un mL de la solución y se mezcló con 1 mL de agua destilada estéril en un microtubo de 2 mL y se repitió el calentamiento y enfriamiento anterior. Una alícuota de 50 mL se sembró en cajas Petri de 100 mm de diámetro con agar nutritivo (AN). Las cajas Petri se incubaron a 28 °C por 24 h (Travers et al., 1987).
Selección de la cepa bacteriana
Las colonias bacterianas cuya morfología, tinción de Gram y formación de esporas fueran las características de bacterias pertenecientes a la Clase Bacilli, se seleccionaron y cultivaron en cajas Petri, de 100 mm de diámetro, en AN. Después de 24 h de crecimiento se realizaron pruebas de tinción de Gram y de catalasa. La detección de esporas mediante frotis se hizo en colonias de 5 d de crecimiento. Así se aislaron 36 cepas con características morfológicas similares a la Clase Bacilli, en las cuales se determinó producción de ácido indolacético (AIA), por el método colorimétrico con el reactivo de Salkowski (Patten y Glick, 2002). La rizobacteria cepa CBTC1 se seleccionó para estudiar la promoción de crecimiento porque produjo más AIA (26.80 mg mL-1 de cultivo).
Identificación de la cepa bacteriana
La extracción de ADN se realizó con el paquete comercial DNA Wizard® Genomic DNA Purification Kit (Promega).
El gen 16s ARN se amplificó con los iniciadores Eubac27F y Eubac149R según Singh (2010). La integridad de los fragmentos amplificados se visualizó en geles de agarosa al 1 %. Los productos de amplificación los secuenciaron en Macrogen, EE.UU. Las secuencias se analizaron en el programa Blast del NCBI.
Obtención e inoculación de las plantas de C. annuum
Las semillas se sembraron en charolas de unicel, con 200 cavidades, y un sustrato comercial (cosmopeat®); las charolas con 50 % de las semillas germinadas se trasladaron a un invernadero. El trasplante se realizó 35 d después de la siembra (dds) en vasos de unicel de 1 L con una mezcla de suelo, sustrato comercial (cosmopeat®) y gravilla 50:30:20 (vol:vol:vol); la mezcla se desinfectó con formol al 2 %, 15 d antes del trasplante.
Dos inoculaciones con la rizobacteria se realizaron a las plantas de chile, la primera 15 dds y la segunda al trasplante (35 dds). Cada planta se inóculo con 3 mL de una suspensión de bacterias con 1x108 esporas mL-1. La suspensión bacteriana se obtuvo de las colonias establecidas en AN de 8 d de cultivo.
Evaluación de las variables indicadoras de promoción del crecimiento
Para evaluar el efecto de la rizobacteria en la promoción de crecimiento de C. annuum, 10 d después del trasplante (45 dds) se registró: altura de planta (cm), diámetro de tallo (mm) y número de hojas. La altura se midió con un flexómetro y el diámetro de tallo con un vernier digital. La producción de biomasa (g) y el contenido foliar de N se evaluó 15 d después del trasplante (50 dds). Para esto, la raíz y el vástago separados en bolsas de papel se secaron hasta peso constante en estufa con aire forzado a 65 °C. La cuantificación de N foliar se realizó por el método Kjeldhal.
Atracción y oviposición de B. tabaci en plantas de chile
Adultos de B. tabaci se obtuvieron de una colonia stablecida en plantas de chile y que ha permanecido en confinamiento varios años (Ballina-Gómez et al., 2013). Para los bioensayos, los genotipos de chile se inocularon con la rizobacteria en la misma forma como se describió para evaluar la promoción de crecimiento.
Para evaluar la atracción de adultos y preferencia de oviposición se usaron plantas de 10 d de trasplante (45 dds). Las plantas se confinaron en jaulas entomológicas y se liberaron en promedio 30 adultos de B. tabaci por planta. A las 48 h se contabilizó el número de adultos posados en dos hojas totalmente extendidas del tercio apical, esta medición se realizó a las 06:00 h para evitar alta actividad de vuelo de los adultos de B. tabaci. A las 72 h se evaluó la cantidad de huevos ovipositados en dos hojas, del tercio apical completamente extendidas, se midió su área foliar para obtener la relación del número de huevos por cm2 (Ballina Gómez et al., 2013).
La mortalidad de ninfas se evaluó con el método de “no elección” (Nombela et al., 2001). Treinta adultos de B. tabaci se confinaron en jaulas clip colocadas en hojas totalmente expandidas del tercio apical de plantas de 10 d de trasplante (45 dds). Los adultos se eliminaron 24 h después de haberse confinado. Los huevos ovipositados eclosionaron y las ninfas permanecieron en las secciones de las hojas que contenían las jaulas clip. Después de 15 d de la oviposición la mortalidad de ninfas se evaluó con un microscopio estereoscópico. Las ninfas parecían deshidratadas y su cuerpo era color café oscuro a negro.
Diseño experimental
El diseño experimental fue completamente al azar. Los efectos de la inoculación de la rizobacteria en las variables de crecimiento de la planta y en la respuesta a B. tabaci se analizaron separados en las plantas inoculadas con la rizobacteria y sin inocular (testigo). Los tratamientos se establecieron en 15 repeticiones para evaluar el crecimiento, cuatro para el análisis de N foliar, y 20 para la respuesta de las plantas a B. tabaci. El análisis estadístico (t de Student; p≤0.05) se realizó con Statgraphics Centurion (versión 15.2.06).
Resultados y discusión
Identificación molecular de la cepa bacteriana
Las secuencias directa e inversa se obtuvieron, se ensamblaron con el programa CAP3, y se secuenciaron en duplicado de dos extracciones de ADN de la misma cepa y cultivos diferentes. Una secuencia de 1423 bases se obtuvo y de acuerdo con el análisis del gen 16s ARN, la cepa CTB1 tiene un 99 % de identidad con el género Brevibacillus (Cuadro 1) y con la especie B. brevis. La cepa seleccionada se denominó B. brevis CTB1C1.
Crecimiento de diámetro de tallo y altura de plantas
Las plantas de todos los genotipos aumentaron significativamente su altura y diámetro de tallo por efecto de la inoculación con B. brevis CBTC1 (Cuadro 2). Los incrementos más sobresalientes del diámetro de tallo (11.3 %) y altura de planta (41 %) se observaron en Amaxito. En contraste, el incremento menor de diámetro del tallo (7.4 %) se registró en X-kat ik, en tanto que el incremento menor en altura de planta se registró en Jalapeño (15.8 %).
Cuadro 2 Efecto de la inoculación con B. brevis CBTC1 en el crecimiento en diámetro de tallo y altura de plantas en Capsicum annuum.
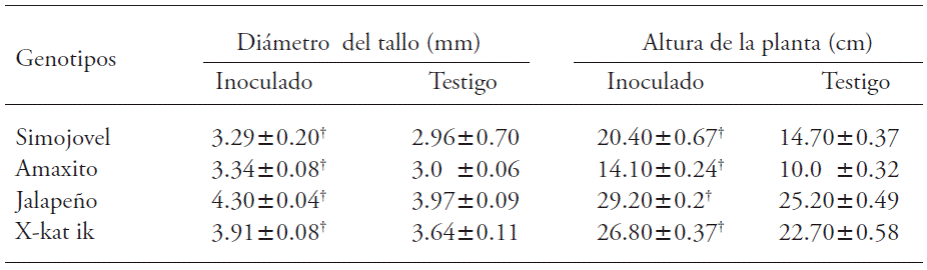
†Indica diferencia estadística con respecto al testigo (τ-Student; p≤0.05, n=15). Medias±error estándar de la media
La promoción de crecimiento vegetal por la inoculación de especies de rizobacteria de la Clase Bacilli en C. annuum ya se ha evaluado. Kokalis et al. (2002) observaron incremento de 50 % en diámetro de tallo en plantas inoculadas con una mezcla de B. subtilis y B. cereus. Akgül y Mirik (2008) inocularon plantas con B. megaterium y obtuvieron aumento de 23 % en diámetro del tallo. Guillen et al. (2006) reportaron que la inoculación de Bacillus spp. incrementó 20 % la altura de plantas además, la inoculación con B. cereus incrementó 76 % la altura de plantas (Damayanti et al. 2007). El aumento de 11 % en diámetro de tallo en nuestro estudio fue menor que lo observado en los estudios previos, pero la altura de planta no (41 %).
Formación de hojas y acumulación de biomasa
La inoculación con B. brevis CBTC1 incrementó la formación de hojas principales y axilares en todos los genotipos, excepto X-kat ik (Cuadro 3). En Simojovel, Amaxito y Jalapeño se observó aumento significativo en el número de hojas principales hasta 25 %.
Cuadro 3 Efecto de la inoculación con B. brevis CBTC1 en la formación de hojas principales y hojas axilares en plantas de Capsicum annuum.
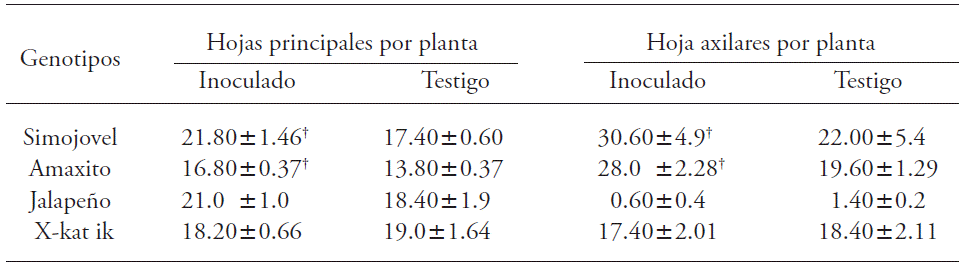
†Indica diferencia estadística con respecto al testigo (τ -Student; p≤0.05, n=15). Medias ± error estándar de la media
La inoculación con B. brevis CBTC1 incrementó la biomasa aérea en todos los genotipos, y la de raíz de Simojovel y Amaxito (Cuadro 4). El incremento mayor en biomasa aérea (45.2 %) y de raíz (44.4 %) se observó en Amaxito.
Cuadro 4 Efecto de la inoculación con B. brevis CBTC1 en la acumulación de biomasa en Capsicum annuum.

†Indica diferencia estadística con respecto al testigo (τ-Student; p≤0.05, n=15). Medias ± error estándar de la media
El efecto de la inoculación de rizobacteria de la Clase Bacili en la biomasa aérea en C. annum ya se ha evaluado, y aumenta el número y tamaño de las hojas. Según Damayanti et al. (2007), hay incremento significativo en tamaño de hojas al inocular plantas con una cepa de B. cereus. En nuestro estudio, las plantas de Simojovel y Amaxito inoculadas tuvieron hasta 42 % más hojas axilares. Esto puede mejorar la productividad biológica de las plantas y, de acuerdo con Ashrafuzzaman et al. (2011), mayor número de hojas en las plantas proporciona mayor intercepción de luz, fotosíntesis y acumulación de fotoasimilados, lo cual resulta en aprovechamiento mayor de los recursos hídricos y nutrimentales, y el aumento en rendimiento de frutos.
El incremento de biomasa en nuestro estudio (44 y 45 %) fue cercano al intervalo observado en otros estudios. Akgül y Mirik (2008) registraron aumento de 52 % en la biomasa foliar y 48 % en biomasa de raíz en C. annuum inoculado con B. megaterium. Similarmente, Nautiyal et al. (2013) obtuvieron incrementos de hasta 43 % en la biomasa de raíz en plantas inoculadas con B. amyloliquefaciens.
En nuestro estudio la biomasa aérea mayor en plantas inoculadas resultó del incremento en longitud y diámetro de tallos y en número de hojas. Ese aumento confirmó que la inoculación promovió el desarrollo de la raíz, lo que probablemente favoreció la asimilación de agua y nutrientes, y en consecuencia la producción de biomasa.
Análisis químico foliar de nitrógeno
En el contenido de nitrógeno de las hojas de plantas inoculadas y sus testigos no se observó diferencia significativa. Pero, sí hubo un efecto significativo para gramos de N foliar en plantas de Amaxito (33 %) y X-kat ik (17 %) (Cuadro 5).
Cuadro 5 Efecto de la inoculación con B. brevis CBTC1 en la concentración de nitrógeno foliar en plantas de Capsicum annuum.

†Indica diferencia estadística con respecto al testigo (τ -Student; p≤0.05, n=4). Medias ± error estándar de la media
Jones et al. (1991) clasificaron el contenido de nitrógeno en tres grupos: 1) valores altos, mayores a 4.5 %; 2) valores óptimos o suficientes, 3.5 a 4.5 %; y 3) valores bajos, 3 a 3.49 %. De acuerdo con esta clasificación, los porcentajes de nitrógeno en plantas inoculadas y testigo en el presente estudio se ubicaron entre los valores óptimos o suficientes. Es probable que los genotipos evaluados sin inocular asimilen nitrógeno suficiente, por lo que la inoculación con B. brevis CBTC1 no coadyuvó al aumento del contenido de N en el follaje.
Christinal y Tholkkappian (2013) encontraron contenido mayor de N foliar en plantas de C. annuum inoculadas con B. megaterium. Según Rezvani et al. (2013), plantas de C. annuum inoculadas con Bacillus spp. presentaron contenido mayor de N foliar en comparación con el testigo. En nuestro estudio hubo diferencia en la cantidad (g) de N foliar por planta en X-kat ik y Amaxito. Las diferencias están relacionadas con la acumulación de biomasa aérea.
Atracción de adultos, preferencia de oviposición y mortalidad de B. tabaci en genotipos de C. annuum
No hubo efecto significativo de la inoculación con B. brevis CBTC1 en la atracción de adultos de B. tabaci (Cuadro 6) entre los genotipos estudiados. Sólo en Simojovel hubo disminución (60.5 %) significativa (p≤0.05) en la oviposición. (Cuadro 6).
Cuadro 6 Efecto de la inoculación de B. brevis CBTC1 en la atracción de adultos y oviposición de Bemisia tabaci en follaje de Capsicum annuum.

†Indica diferencia estadística con respecto al testigo (τ-Student; p≤0.05, n=20). Medias ± error estándar de la media
Jalapeño fue el único que mostró efecto significativo (p≤0.05) en mortalidad (38.6 %) de ninfas de B. tabaci por la inoculación con B. brevis CBTC1, respecto al testigo (Figura 1).
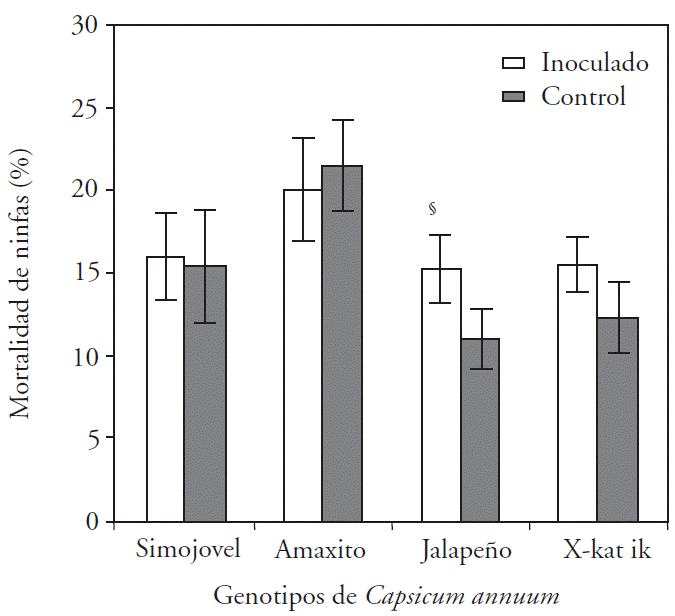
§Indica diferencia estadística con respecto al testigo (τ -Student; p<0.05, n=20).
Figura 1 Mortalidad de ninfas de Bemisia tabaci en genotipos de Capsicum annuum inoculados y no inoculados con CBTC1.
La inoculación de las plantas con rizobacterias induce cierto grado de resistencia a varias especies de insectos fitófagos. Este fue el caso de la disminución (44 %) en la alimentación del escarabajo (Diabrotica undecimpunctata howardi Barber) en plantas de pepino inoculadas con Bacillus pumilis (Zehnder et al., 1997). También hubo disminución significativa en la población de pulgón verde (Myzus persicae Zulcer) en plantas de C. annuum tratadas con B. subtilis y B. amyloliquefaciens (Herman et al., 2008). El retardo en el crecimiento y tamaño de la población de áfidos del algodón (Aphis gossypii) se observó en plantas de pepino tratadas con una cepa de Bacillus sp. (Stout et al., 2002).
La inducción de resistencia a B. tabaci por la inoculación con especies de Bacilli ha sido poco estudiada. Murphy et al. (2000) observaron que plantas de tomate de semillas inoculadas con Bacillus spp. tuvieron disminución significativa (40 a 43 %) en la población de ninfas de B. tabaci. Soto et al. (2010) reportaron que la inoculación de B. subtilis en plantas de tomate (Solanum lycopersicum) disminuyó significativamente el desarrollo de ninfas de B. tabaci de cuarto instar a adultos. Este efecto se atribuyó a la inducción de factores involucrados en la resistencia sistémica inducida (RSI) (Rojas-Solís et al 2013). Los resultados de nuestro estudio indicaron que el efecto de las rizobacterias varian entre genotipos de la misma especie, ya que la respuesta en la oviposición y mortalidad de B. tabaci en plantas inoculadas con B. brevis CBTC1 se detectó únicamente en los genotipos Simojovel y Jalapeño. Esta respuesta de resistencia vegetal producida por la inoculación de RPCV y atribuida en parte a RSI, varía entre especies o genotipos probablemente por la capacidad diferente de sus raíces para percibir los estímulos provocados por las rizobacterias (De Vleesschauwer et al., 2008).
En nuestro estudio la inoculación de los genotipos de C. annuum con B. brevis CBTC1 promovió crecimiento diferente de las plantas, pues permitió incremento de biomasa aérea, pero no modificó el grado de atracción de adultos de B. tabaci. Sin embargo, la inoculación indujo cierto grado de resistencia a oviposición de B. tabaci en el genotipo Simojovel y mayor mortalidad de ninfas en el genotipo Jalapeño. Esta respuesta de las plantas inoculadas a B. tabaci podría estar relacionada con factores de calidad nutricional del follaje, pero no al contenido de N foliar.
Conclusiones
La bacteria aislada (CBTC1) presentó 99 % de homología con Brevibacillus brevis. La inoculación de B. brevis CBTC1 en C. annuum incrementó el diámetro de tallo y altura de planta. En los genotipos Simojovel y Amaxito también aumentó el número de hojas y biomasa de raíz.
La inoculación de los genotipos de C. annuum con B. brevis CBTC1 no tuvo efecto en la atracción de adultos de B. tabaci. Pero, la inoculación en Simojovel y Jalapeño permitió cierto grado de resistencia debido a menor oviposición o mayor mortalidad de ninfas.











 texto en
texto en 



