Introducción
El arroz es el alimento básico de más de la mitad de la población mundial, con una influencia significativa sobre el desarrollo socioeconómico. Brasil está entre los primeros diez productores en el mundo, con unos 12 millones de Mg de arroz en 2012/2013, esto es 2.2 % más que en la temporada previa. Los estados de Rio Grande do Sul y Santa Catarina producen casi 75 % del arroz de Brasil (Conab, 2013).
La salinidad del suelo afecta alrededor de 2 % del área arrocera de Brasil (Menezes-Benavente et al., 2004) y compromte el potencial de rendimiento. Para el arroz bajo riego, uno de los principales factores que determina la calidad del riego es la salinidad del agua, que se debe a concentraciones excesivas de sales solubles (Gomes et al. 2004) que afectan el crecimiento de la planta. Las condiciones de alta salinidad pueden ser causadas por prácticas inadecuadas de riego e inundaciones del suelo con agua marina en regiones costeras (Tester y Davenport, 2003). En Rio Grande do Sul, el estándar para el riego de arroz es inundar los arrozales, lo cual podría causar la salinización del suelo, en especial en áreas de cultivo que usan agua de ríos costeros como los ríos Tramandaí y Mampituba rivers, y lagunas Patos, Mirim y Mangueira, sujetas a la salinización por la entrada de agua marina cuando el nivel de estos manantiales se reduce.
La intensidad del estrés por salinidad sobre el cultivo de arroz está determinada por la composición de sales en el suelo, la intensidad y duración del estrés, condiciones climáticas y del suelo, cultivar de la especie y la etapa fenológica del cultivo (Maas y Hoffman, 1977). Respecto a este último, las semillas de arroz son relativamente tolerantes durante la germinación, aunque muy sensibles en la etapa de plántula. Después de establecida, la tolerancia de la planta aumenta de manera progresiva hasta la diferenciación de panículas, y se reduce de nuevo hasta la etapa de floración (Yoshida, 1981).
La nutrición adecuada de la planta es un factor clave para la producción satisfactoria del cultivo. El silicio (Si) es benéfico para varios cultivos (Korndorfer et al., 2002); es necesario para el desarrollo de la planta (Epstein, 1994), en especial en pastos, contribuyendo a su adaptación, tanto al estrés biótico como abiótico. El Si es importante para el cultivo de arroz (Pereira et al., 2004) ya que aumenta las tasas de crecimiento y rendimiento, interactúa de forma positiva con fertilizantes nitrogenados, de fosfato y potasio, y da resistencia al estrés biótico (plagas y enfermedades) y abióticos (sequía, salinidad, enca mado) y promueve la productividad en suelos con niveles altos de Al, Fe y Mn (Savant et al., 1997). Además, el Si puede estar involucrado en actividades metabólicas o fisiológicas en el estrés por sal o agua o ambos (Gunes et al., 2008).
En Brasil hay varios productos comerciales que contienen Si, como cáscara gris carbonizada de arroz, con una concentración de 92 % Si (Foletto, 2005) y se puede usar como una fuente efectiva de Si debido a su concentración alta. Rio Grande do Sul es el mayor productor de arroz de Brasil (Conab, 2013) y generan cáscara de arroz como un subproducto de la molienda de arroz, por lo cual está disponible, sobre todo en el sur del estado. Según Chungsangunsit et al. (2004), la cáscara del arroz representa 20 % del peso total del arroz. Después de la combustión completa de la cáscara para generar energía, cerca de 20 % es convertido en ceniza (Pouey, 2006).
Por lo tanto, el objetivo de este estudio fue evaluar los efectos de la ceniza de cáscara del arroz aplicada al suelo sobre el rendimiento y la calidad fisiológica de las semillas de arroz producidas bajo estrés salino.
Materiales y Métodos
Este experimento se realizó en un invernadero y en el Laboratorio de Análisis de Semillas (LAS) Flavio Farias Rocha, Departamento de Fitotecnia, Facultad de Agronomía Eliseu Maciel (FAEM), Universidad Federal de Pelotas (UFPel).
El diseño experimental fue bloques al azar con un arreglo factorial de: 1) Cenizas de cáscara de arroz 0.0, 500, 1000, 1500, y 2000 kg ha-1; 2) NaCl 0.0, 4.0 y 8.0 mM; con cuatro repeticiones. La ceniza de cáscara de arroz carbonizada, molidas para lograr un tamaño de partículas uniforme, se usó como fuente de Si y el material de prueba fue cultivar de arroz IRGA 424.
Antes de la siembra, las semillas se trataron con el fungicida MAXIM XL® (Fludioxonil + Metalaxyl-M), insecticida CRUISER 350 FS® (Thiamethoxam) y el polímero Color Seed®, a concentraciones de 150, 150 y 300 mL 100 kg semilla-1, respectivamente, con un volumen de aspersión de 1200 mL 100 kg semilla-1, que se completó con agua. Las semillas fueron recubiertas manualmente, según la metodología descrita por Nunes (2005).
Después, las semillas cubiertas fueron plantadas en macetas con tierra recolectada del horizon A1 de un Planosol Solodicin Háplico Eutrófico (Streck et al., 2008), perteneciente a la unidad de mapeo Pelotas; el suelo fue tamizado para obtener una uniformidad de partículas. La fertilización se ajustó según los resultados del análisis de suelo y recomendaciones del Comité de Química y Fertilidad de Suelos - RS / SC (2004). Un encalado se realizó 30 d antes de plantar y las cenizas de cáscaras de arroz se aplicaron al momento de plantar, e incorporadas al suelo a una profundidad de 0.1 m. Los tratamientos fueron 0.0, 500, 1000, 1500 y 2000 kg ha-1 SiO2, ajustando las concentraciones al volumen del suelo de las unidades experimentales (macetas). Debido a que la ceniza de cáscara de arroz carbonizada contiene alrededor de 92 % Si (fluctúa de 88 a 96 %), se usó el equivalente a 0.0, 1.90, 3.80, 5.71, 7.61 g maceta de ceniza de cáscara de arroz carbonizada, respectivamente, para los niveles en aumento de Si.
En cada unidad experimental se plantaron 10 semillas, lo cual se rebajó a dos plántulas por maceta después de emergencia. Las macetas se regaron cada día por la mañana, con las respecti vas concentraciones de NaCl según el tratamiento. La tierra en cada maceta se mantuvo a capacidad de campo hasta establecer la lámina de agua, 30 d después de emergencia. El experimento se realizó hasta alcanzar la fase de madurez de campo.
En las inflorescencias y semillas se evaluaron características agronómicas y calidad fisiológica, para lo cual se trillaron panículas individuales, registrando: 1) Número de panículas por planta (NPANPL): conteo de todas las panículas de cada planta; 2) número de semillas por planta (NSPL): conteo manual de semillas por planta; 3) peso de semillas por planta (SWPL): calculado por el peso de todas las semillas de plantas individuales, corregido a contenido de humedad de 13 % y expresado en g planta-1; 4) número de glumas estériles por planta (NSGPL): cuantificados por el conteo manual de todas las semillas de cada unidad experimental y expresado como número de semillas vacías planta-1; 5) peso de mil semillas (1000W): calculado con ocho muestras de 100 semillas, pesadas en una báscula analítica; los datos para lo anterior se presentan como promedio, desviación estándar y coeficiente de varianza; 6) peso de 1000 semillas, calculado multiplicando el valor promedio por el factor de 10 (Brasil, 2009).
La evaluación de calidad fisiológica de semillas involucró:
1) Prueba de germinación (G): realizada según las Reglas brasileñas para la prueba de semillas - RAS (Brasil, 2009), sembrando 200 semillas en cada unidad experimental, divididas en cuatro réplicas de 50 semillas cada una. Las semillas fueron colocadas sobre un rollo de papel germitest húmedo, agregando 2.5 veces el peso del rollo de papel seco de agua destilada. Los rollos de papel germitest se colocaron en una cámara de germinación a 25 °C, el recuento de plántulas se realizó 14 d después de la siembra, y los resultados se expresan como el porcentaje de plántulas normales.
2) Primer recuento de germinación (PCG): realizado 7 d después del inicio de la prueba; requirió un conteo de los plántulas normales dentro de cada repetición, y los resultados se expresan como el porcentaje de plántulas normales.
3) Prueba de frío (CT): cuatro repeticiones de 50 semillas para cada unidad experimental se distribuyeron uniformemente sobre rollos de papel germitest y humedecidas con agua destilada en una proporción de 2.5 veces el peso del papel seco. Después, los rollos de germitest se colocaron en bolsas de plástico, se sellaron y guardaron en una cámara BOD a 10 °C ± 1 °C por 7 d. Después, los rollos se transfirieron a una cámara de germinado y se mantuvieron en las mismas condiciones que la prueba de germinado, evaluando el porcentaje de plántulas normales después de 7 d.
4) Envejecimiento acelerado (EA): las semillas se colocaron uniformemente sobre una rejilla de metal suspendida en la caja de germinación con 40 mL de agua destilada. Las cajas se tapa ron y colocaron en una cámara de crecimiento a 42 °C por 96 h. Después, las semillas se germinaron según la metodología descrita para le prueba de germinado y evaluadas el día siete. Los resultados se expresaron como el porcentaje de plántulas normales.
5) Longitud de tallo de plántula (LP) y de raíz (LR): plántulas de cuatro repeticiones de 20 semillas para cada unidad experimental se recolectaron después de 7 d en la cámara de germinado a 25 °C, y con una regla graduada (mm) se midieron las longitudes de raíz y tallos de 10 plántulas elegidos al azar.
6) Emergencia en campo (EC): 200 semillas por tratamiento se plantaron en macetas pequeñas y se registró la emergencia de plántulas en un solo conteo 21 d después de la siembra; los resultados se expresaron como el porcentaje de plántulas normales.
Los datos experimentales se analizaron con ANOVA por el Winstat Statistical Analysis System versión 1.0 y los promedios de los trtamientos se compararon con la prueba de Tukey (p≤0.05). El efecto de concentraciones de Si sobre las variables de respuesta se analizó con regresiones polinomiales (p≤0.05). Los datos sobre la base de porcentajes se transformaron [arc.sen (√x/100)] antes del análisis de varianza.
Resultados y Discusión
Solamente los efectos de factores principales se detectaron con ANOVA para número de panículas por planta (NPANPL), número de glumas estériles por planta (NSGPL), prueba de germinación (G), prueba de frío (PF), envejecimiento acelerado (AA), longitud de raíz (RL) y emergencia en campo (FE). La interacción entre los niveles de Si y la concentración de sales se observó para las variables de respuesta peso de semilla por planta (SWPL), peso de mil semillas (1000W), conteo de primera germinación (CPG) y longitud de tallo (LT) (Cuadro 1).
Cuadro 1 Análisis de varianza, cuadrados medios y su significancia por número de panículas por planta (NPANPL), número de semillas por planta (NSPL), paso de semillas por planta (SWPL), número de glumas estériles por planta (NSGPL), peso de mil semillas (1000W), conteo de primera germinación (FGC), prueba de germinación (G), prueba de frío (PF), envejecimiento acelerado (EA), longitud de tallo (LT), longitud de raíz (LR) y emergencia en campo (EC) originado de semillas del cultivar de arroz IRGA 424, debido a los niveles de cenizas de cascara de arroz carbonizado y concentraciones de NaCl aplicadas al suelo. Pelotas, Brasil, 2013.

FV: fuente de variación; GL: grados de libertad. *F-test, p≤0.05; ns: no significativo.
El número de panículas por planta (NPANPL) para el tratamiento testigo de concentración de NaCl (0 mM) fue más alto que para los otros tratamientos (Figura 1). Concentraciones mayores de NaCl contribuyeron a la formación de glumas estériles. El promedio de glumas estériles por planta (NSGPL) fue 21 unidades mayor para la concentración de 8 mM en relación con el testigo; sin embargo, no se observaron diferencias en este característica entre los tratamientos de 4 mM y 8 mM, respectivamente. Las pérdidas en productividad por salinización pueden ocurrir por varias causes, como una reducción inducida de la capacidad fotosintética (Sultana et al., 1999) y una menor acumulación de asimilados en los granos (Asch et al., 2000), lo cual reducirá la tasa de llenado debido a un suministro insuficiente de hi dratos de carbono a las panículas (Khatun y Flowers, 1995).

Figura 1 Números promedio para panículas por planta (NPANPL) y glumas estériles por planta (NSGPL) en el cultivar de arroz IRGA 424, la aplicación de diferentes niveles de cenizas de cascara de arroz carbonizadas y concentración de NaCl al suelo. Pelotas, RS, Brasil, 2013. Promedios con letras diferentes en cada factor son estadísticamente diferentes (Tukey; p ≤0.05).
Para NSPL, SWPL y 1000W, la concentración salina de 0 mM dio valores mayores a 4 y 8 mM en todas las dosis de concentraciones de SiO2 (Cuadro 2). Según Rhoades et al. (2000), la salinidad afecta el desarrollo y el rendimiento de las plantas, lo cual se manifiesta a través de las reducciones en el conteo de plantas y el desarrollo de las semillas, con síntomas similares al estrés por sequía. La salinidad del suelo puede deberse al riego con agua salina o a una combinación de factores, como la gestión de agua, suelo y cultivos, que puede aumentar la cantidad de días hasta la cosecha, y reducir los números de sitios de llenado de semillas y peso de las semillas, que impacta directamente los rendimientos promedio de las semillas.
Cuadro 2 Número promedio de semillas por planta (NSPL), peso de semillas por pianta (SWPL), peso de mil semillas (1000W), conteo de primera germinación (FGC), longitud de tallo (SL) y longitud promedio de raíz (RL) de plántulas desarrolladas de semillas del cultivar de arroz IRGA 424, debido a los niveles de cenizas de cascara de arroz carbonizada y las concentraciones del NaCl aplicadas al suelo. Pelotas, Brasil, 2013.

Promedios con diferentes letras dentro de cada factor son estadísticamente diferentes (Tukey, p≤0.05).
El peso de mil semillas varía según el genotipo y el potencial de rendimiento puede estar relacionado con el vigor de la semilla. Es influenciado por las condiciones ambientales y por el manejo, como la nutrición de la planta (Carvalho y Nakagawa, 2000). Esto se observó en nuestro estudio, ya que el estrés por salinidad interfirió con el peso de mil semillas; además, el peso de las semillas se reduce en función de la salinidad para el ricino (Silva et al., 2008) y el cacahuate (Correia et al., 2009).
La interacción entre ambos factores principales se observó para el conteo de la primera germinación y la longitud del tallo (Cuadro 2). Por lo tanto, la concentración de 0 mM dio valores mayores a los de los demás tratamientos, pero no hubo diferencias significativas para la concentración de 500 kg ha-1 SiO2 en comparación con el tratamiento de 4 mM y el de concentración de 2000 kg ha-1 Si entre tratamientos de 4 y 8 mM. Las medidas de longitud de tallo fueron mayores en el tratamiento 0 mM, mientras que para 2000 kg SiO2 ha-1 no hubo diferencias en longitud de tallo entre los tratamientos 0 mM y 4 mM. No se establecieron interacciones entre niveles de cenizas de cáscara de arroz carbonizada y concentración de NaCl en la longitud de la raíz. Las longitudes de raíz fueron mayores para el tratamiento testigo (0 mM), más allá del nivel de cenizas de cáscara de arroz carbonizada aplicada.
El promedio de panículas por planta (NPANPL) se ajustó a un modelo cuadrático (Figura 2A) con valores en aumento, hasta una dosis equivalente a 500 kg ha-1 SiO2. Las concentraciones de NaCl entre 0 y 4 mM también se ajustó a un modelo cuadrático para el número promedio de semillas por planta (NSPL) (Figura 2B). La concentración de sal de 0 mM aumentó 4.28 % (72 semillas por planta) al aumentar los niveles de SiO2 a 600 kg ha-1. A pesar de un bajo coeficiente de determinación (R²), se obtuvo la eficiencia másxima con 722 kg ha-1 de cenizas de cáscara de arroz carbonizadas, es decir, un aumento de 4.39 % (47 semillas por planta) comparado con el tratamiento testigo. La cantidad promedio de semillas por planta no cambió para los 8 mM, lo que implica una respuesta nula al aumento de las concentraciones de SiO2. Singh et al. (2005) observaron que la fertilización con Si aumentó el número de panículas por unidad de área, y la productividad al aplicar Si en dos cosechas consecutivas de arroz.

Figura 2 Número promedio de panículas por planta (A), número promedio de semillas por planta (В), peso de semillas por planta en gramos (С), número de glumas estériles por planta (D) γ peso de mil semi-Has en gramos (E) de semillas del cultivar de arroz IRGA 424, debido a los diferentes niveles de ceniza de cascara de arroz carbonizada γ concentraciones de NaCl aplicados al suelo. Pelotas, Brasil, 2013.
El peso de semillas por planta (Figura 2C) se ajustó a un modelo lineal positivo para el rango de concentración de NaCl de 0 a 8 mM, donde la mayor dosis de SiO2 aplicada al suelo (2000 kg ha-1) causó un aumento de 3 a 4 g plant-1, respectivamente. Para la concentración de 0 a 4 mM, los datos se ajustaron a un modelo cuadrático con la eficiencia máxima en 525 kg SiO2 ha-1 (29.57 g planta-1). Tahir et al. (2006) encontraron que la aplicación de silicato de calcio aumentaba significativamente el rendimiento de semillas de dos genotipos de trigo, ambos bajo condiciones normales y salinas, enfatizando su importancia en la nutrición mineral del trigo.
El número promedio de glumas estériles por planta (Figura 2D) disminuyó 0.027 unidades por cada aumento de unidades en la dosis de ceniza de cáscara de arroz carbonizada, mientras que en la dosis más alta (2000 kg ha-1) esta reducción fue 28.54 % (54 glumas por planta estéril) relativa a la dosis cero. Según Pershin et al. (1995), la fertilización con Si fomenta el rendimiento de grano y el peso de mil semillas, y recude la esterilidad de la espiguilla.
El NaCl entre 0 y 8 mM no afectó el peso de mil semillas (Figura 2E), pero no hubo diferencias con la concentración de 4 mM para las dosis de SiO2. Para 0 mM se observó un aumento en el peso de mil semillas, hasta la dosis de SiO2 de 875 kg ha-1. Para la concentración de sal de 8 mM, el peso máximo de semilla obtenido fue 833 kg ha-1 SiO2. Oliveira et al. (2015) reportaron los beneficios de aplicar Si en a granel a semillas de soya. Sin embargo, el silicato de calcio, aplicado como polvo o granulado, no modificó el peso de mil semillas y rendimiento de semillas (Juliatti et al., 2004). El peso de mil semillas es un importante indicador de la calidad que puede aumentar la productividad, ya que las semillas más pesadas pueden causar mayores rendimientos.
Los resultados para las pruebas de calidad fisiológica de las semillas, germinación, prueba de frío, envejecimiento acelerado y emergencia en campo, no presentaron interacción entre las concentraciones de NaCl y dosis de SiO2; por lo tanto, solamente se compararon medias de tratamientos para concentraciones de sal (Figura 3), y el efecto de las dosis de SiO2 se estudió con una regresión polinomial (Figura 4A, 4B y 4C). Los valores para estas variables en la concentración de NaCl de 0 mM fueron mayores que para las otras concentraciones de NaCl. Según Vieira et al. (1994) y Marcos Filho (2005), la calidad fisiológica de la semilla tiene mayor influencia de las condiciones ambientales predominantes durante las etapas de maduración y cosecha que de el mismo tipo de cultivar. Lima et al. (2005) encontraron una reducción en el porcentaje de germinación de semillas de arroz debido al aumento en la concentración de sales, lo que sugiere que la salinidad afecta el desarrollo de las plántulas normales y reduce el vigor y viabilidad de las semillas. Asimismo, Deuner et al. (2011), en diferentes genotipos de caupí, encontraron que el aumento en la concentración de sal en el suelo tenía un efecto negativo en el primer conteo de germinación y en el valor final de la germinación.
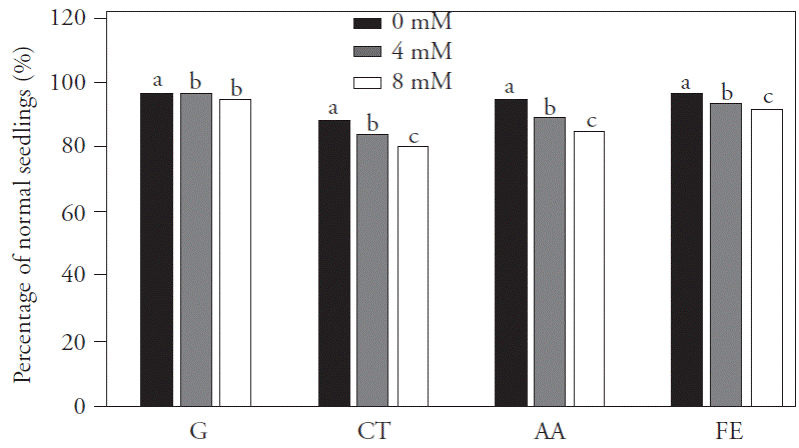
Figura 3 Porcentaje de plántulas normales de las pruebas de germinación (G), de frío (CT), envejecimiento acelerado (AA) y emergencia en campo (FE) que originan de semillas del cultivar de arroz IRGA 424, debido a los diferentes niveles de cenizas de cascara de arroz carbonizada y de concentraciones de NaCl aplicadas al suelo. Pelotas, Brasil, 2013. Los promedios con diferentes letras dentro de cada factor son estadísticamente diferentes (Tukey, p≤0.05).

Figura 4 La germinación (A), prueba de frío y envejecimiento acelerado (В) y la emergencia en campo (С) de plántulas plantadas de semillas del cultivar de arroz IRGA 424, resultante de la aplicación de varios niveles de concentración de cenizas de cascara de arroz carbonizada y NaCl aplicadas al suelo. Pelotas, Brasil, 2013.
Los valores finales de germinación (Figura 4A) no fueron afectados por los niveles de SiO2 aplicados al suelo, similares a lo encontrado en semillas de avena común (Toledo et al., 2011) y semillas de Brachiaria (Santos et al., 2010) con dosis crecientes de Si. Sin embargo, la aplicación de Si aumentó la germinación de semillas de trigo bajo estrés por salinidad (Matichenkov et al., 2005). La Figura 4B muestra que las pruebas de envejecimiento acelerado y de frío respondieron de manera semejante a las dosis crecientes de SiO2, ya que ambas mostraron un comportamiento cuadrático positivo. La prueba de envejecimiento acelerado presentó una germinación mayor (92 %) hasta 1375 kg SiO2 ha-1. El porcentaje más alto de plántulas normales para la prueba de frío se registró para 1067 kg SiO2 ha-1, con germinación de 85 %. Según Ran et al. (1997), el Si fomenta la capacidad biológica de las semillas y plántulas para tolerar condiciones ambientales severas. Respecto a la prueba de emergencia en campo, la Figura 4C muestra que 2000 kg SiO2 ha-1 produjeron un aumento de 2.6 % en comparación con el tratamiento testigo.
El aumento de la concentración de NaCl de 0 nM a 4 mM para concentraciones de cenizas de cáscara de arroz carbonizada hasta 950 a 900 kg ha-1, respectivamente, aumentó el porcentaje de plántulas normales para el primer conteo de germinación (Figura 5), mientras que concentraciones mayores redujeron los valores del conteo. El conteo de germinación más alto con una concentración de sal de 8 mM fue con una dosis de cenizas de cáscara de arroz carbonizada de 1150 kg ha-1, mientras que las dosis mayores redujeron el número de plántulas normales, pero en todos los casos, mayores al tratamiento testigo. Al comparar las tres concentraciones de sal, parecería que la concentración de NaCl más alta requiere dosis mayores de cenizas de cáscara de arroz carbonizada para alcanzar el punto de máxima eficiencia.

Figura 5 Conteo de primera germinación (A), longitud de tallo (B) y longitud de raíz (C) de plántulas plantadas de semillas del cultivar de arroz IRGA 424, resultante de la aplicación de diferentes niveles de cenizas de cáscara de arroz carbonizada y concentraciones de NaCl aplicadas al suelo. Pelotas, Brasil, 2013.
El incremento en la aplicación de cenizas de cáscara de arroz carbonizada produjo longitudes de tallos mayores (Figura 5B). Para la concentración de NaCl de 0 mM, se obtuvo el punto de eficiencia máxima con una dosis de 1333 kg ha-1 cenizas de cáscara de arroz carbonizada, lo cual aumentó 0.053 m la longitud de plántula. Para la concentración de NaCl de 4 mM se registraron aumentos en longitudes de tallo hasta la dosis de 1250 kg ha-1 de cenizas de cáscara de arroz carbonizada, lo que es un aumento de 0.063 m. El aumento en la longitud de tallo para la concentración de NaCl de 8 mM fue 0.083 m con 1667 kg ha-1 de cenizas de cáscara de arroz carbonizada. Las plántulas con una mayor tasa de crecimiento temprano tienen el potencial de generar plantas con un mayor rendimiento, ya que una mayor superficie foliar dará una tasa fotosintética mayor. Según Gustafson et al. (2004), las plantas con una alta velocidad de emergencia y crecimiento temprano tienen prioridad en el uso de recursos ambientales, por lo que tienen una ventaja competitiva en su uso.
La longitud de raíz presentó un aumento ligero con dosis crecientes de NaCl (Figura 5C) en hasta 1167 kg ha-1 de cenizas de cáscara de arroz carbonizada, con un promedio general de 0.057 m.
Las cenizas de cáscara de arroz carbonizada pueden aumentar la tolerancia de la planta a la sal, incrementando su capacidad de absorción de agua (Romero et al., 2006). Otros beneficios incluyen la mejora en la estructura foliar y el potencial fotosintético (Shu y Liu, 2001), mejora del sistema antioxidante (Zhu et al., 2004) y el aumento en la concentración de sustancias solubles en el xilema, que reduce la absorción de sodio de la planta (Liang et al., 1996; Matichenkov et al., 2001).
Conclusiones
La salinidad del suelo afecta negativamente las características agronómicas y la calidad fisiológica de las semillas de arroz.
La calidad fisiológica y el peso de las semillas de arroz son afectados positivamente por cantidades crecientes de cenizas de cáscara de arroz, incluso en la presencia de concentraciones de sal en el suelo.











 texto en
texto en 


