Introducción
Brasil es el quinto mayor productor de algodón del mundo (FAO, 2012); la tecnología y la productividad alta han permitido a Brasil pasar de ser el mayor importador al tercer exportador mayor de algodón en 12 años. En un lapso de 10 años, el cultivo de algodón de Brasil pasó de manual a mecanización total. Para 2013/2014, la superficie de cultivo de algodón en Brasil fue 1 076 900 ha con una producción de 1 638 100 Mg (CONAB, 2013).
Según Christoffoleti (2002), la utilización de herbicidas selectivos de rociado directo durante la post-emergencia inicial, junto con los herbicidas en la preemergencia y a finales de la postemergencia, es un importante sistema de manejo de malezas para el algodón en la zona centro de Brasil. El glufosinato de amonio (GA) controla eficazmente las malas hierbas en los cultivos de algodón y, en Brasil, se aplica durante la postemergencia por rociado directo sobre las superficies plantadas con algodón modificado genéticamente para que sea resistente a este herbicida (Rodrigues y Almeida, 2011). El glufosinato de amonio es una versión sintética de la fosfinotricina, un producto de degradación de bialafos producidos por Streptomyces viridochromogenes y S. hygroscopicus (Duke et al., 2000), cuyas propiedades como antibió ticos y herbicidas fueron descubiertos por Droge-Laser et al. (1994). Esto llevó a la síntesis de GA como herbicida (Manderscheid y Wild, 1986) para uso en varios cultivos, diferentes sistemas de producción y en áreas no agrícolas (Krausz et al., 1999). Es un herbicida no selectivo que controla un amplio espectro de malezas (Chompoo y Pornprom, 2008).
El glufosinato de amonio inhibe la actividad de la glutamina sintetasa (EC 6.3.1.2), que convierte el glutamato y el amonio en glutamina (Logusch et al., 1991) y el nitrógeno inorgánico en compuestos orgánicos. Es una enzima clave en el metabolismo del amoniaco que asimila nitrógeno producido por el nitrito reductasa, y el reciclado de amoníaco producido por las reacciones de fotorrespiración y desaminación (Mifflin y Habash, 2002). La inhibición de la actividad de GA conduce a una acumulación rápida de amoniaco, que causa la destrucción de células (Senseman, 2007). Por lo tanto, el aumento de amonio se usa como un indicador del rendimiento del glufosinato (Pornprom et al, 2000;. Petersen y Hurle, 2001).
La movilidad de GA es baja en las plantas y requiere cobertura amplia en el momento de la aplicación para el espectro completo de control de malezas (Corbett et al, 2004;. Steckel et al., 1997). Debido a que GA no se transloca rápidamente dentro de la planta, los síntomas se producen principalmente en las hojas (Davis et al., 2013), que presentan clorosis y mueren dos a cinco días después del tratamiento (Shin et al., 2011). La muerte de las hojas se produce por la elevación de los niveles de amonio y a los niveles reducidos de glutamina en el tejido foliar en pocas horas (Chompoo y Pornprom, 2008).
Según Kumaratilake et al. (2002), la absorción se produce en las primeras 24 h después del tratamiento GA en Lolium rigidum y Avena sterilis. Un período de 6 h sin lluvia después de la aplicación es necesario para obtener un desempeño eficiente de este herbicida (Rodrigues y Almeida, 2011).
Dada la importancia de GA para controlar malezas en los cultivos de algodón, y la falta de datos sobre la velocidad de absorción y la intensidad de los efectos en el metabolismo del algodón y las malezas importantes (Brachiaria decumbens e Ipomoea grandifolia), el objetivo de nuestro estudio fue evaluar la absorción de GA (velocidad y cantidad) del glufosinato de amonio y sus efectos sobre el metabolismo de malezas y algodón.
Materiales y Métodos
Tres experimentos se realizaron en un invernadero a temperaturas entre 15 y 28 °C, en la Universidad del Estado de São Paulo, UNESP, campus Botucatu/SP/Brasil. Las macetas (5 L capacidad) se llenaron con un sustrato de césped, vermiculita expandida y corteza de pino, enriquecido con macro y micronutrientes, con un pH de 5.8 (±0.5).
El diseño experimental fue completamente al azar con cuatro repeticiones; con cuatro plantas de la variedad de algodón FiberMax 910, y 10 plantas de B. decumbens Stapf e I. grandifolia Dammer por repetición. Los tratamientos fueron GA (0.4 kg a.i. ha-1) y cinco períodos antes de una lluvia simulada (tiempos para la absorción: 1, 3, 6, 24 y 48 h entre la aplicación y la lluvia simulada); y un testigo sin herbicida.
El herbicida se aplicó con un pulverizador estacionario equipado con una barra de pulverización con cuatro puntas Teejet XR 11002VS dispuestas a 0.5 m de separación y a una altura de 0.5 m respecto a las plantas. El sistema se manejó con una velocidad de desplazamiento de 1 m s-1, con un consumo de líquido de 200 L ha-1 y una presión constante de 1.5 kgf cm-2, usando aire comprimido. La simulación de lluvia de 40 mm en cada tratamiento se realizó con la misma estructura ya descrita, con un sistema automatizado que permite una presión constante a través de una bomba hidráulica usando una barra de pulverización con tres toberas de pulverización de alto flujo TK20-SS, espaciadas a 0.5 m de distancia, a 1.45 m por encima de la superficie de la unidad experimental. Esta estructura permitió simulaciones de lluvia de varios volúmenes. La velocidad de desplazamiento del sistema fue 3.16 m min-1, con una presión de 79.4 kPa, permitiendo formar de gotas de agua artificiales con un diámetro volumétrico medio de 1,140 μm.
En el momento de la aplicación, las plantas de algodón presentaron hojas totalmente extendidas (y una tercera en expansión) a altura aproximada de 30 cm, mientras que la altura aproximada de B. decumbens era 35 cm, y la de I. grandifolia 18 cm.
Las plantas se recolectaron para análisis de laboratorio dos días después de la aplicación del herbicida, cuando comenzaron a aparecer los primeros síntomas visuales de lesión. En estas muestras se analizaron los niveles de amoníaco, glutamina y glufosinato.
La evaluación visual del control de las lesiones y la maleza en las plantas de algodón se evaluaron a los 3, 6, 8 y 10 d después de la aplicación (DDA) del glufosinato de amonio. Las evaluaciones se basaron en una escala de 0 a 100 %, con 0 % igual a no respuesta de la planta y 100 % igual a un completo control de malezas o la muerte del algodón (Richardson et al., 2007).
La cuantificación del amoníaco
El amoníaco se cuantificó, de acuerdo con Wendler et al. (1990), mediante colorimetría por la acción de los reactivos y determinación por espectrofotometría. Para la extracción del amoníaco, todas las hojas de cada planta por repetición se colocaron en botellas de poliestireno de 300 ml. La biomasa recolectada 2 DAA del herbicida se determinó pesándola y luego agua (pH 3.5) acidificada con HCl se agregó a las botellas. Las hojas recogidas se colocaron en un baño de ultrasonidos durante 60 min, y después el amoniaco se cuantificó en una solución con una lectura de la absorbancia de las muestras a 630 nm.
Análisis de Cromatografía Líquida - Espectrometría de Masas (LC-MS / MS)
Todas las hojas de una planta por repetición se recogieron, lavaron con agua destilada y colocaron en nitrógeno líquido. Una alícuota de la muestra de 200 mg se pesó en un tubo de centrifugado, y una solución de extracción de agua de 10 mL de metanol (75:25) se agregó en el tubo y se colocó en un baño de ultrasonidos durante 30 min (que se definió por las pruebas anteriores, datos no mostrados). Después de centrifugar a 3500 g por 5 min, el sobrenadante se filtró a través de una membrana de 0.2 μm y las muestras se analizaron en un sistema de LC-MS / MS.
El glutamato, glutamina y glufosinato se cuantificaron según Barberis (2012) en un sistema de LC-MS / MS usando un HPLC (prominencia UFLC, Shimadzu Corporation., Kyoto, Japón), equipado con dos bombas LC-20AD, un autoinyector SIL-20AC, un desgasificador DGU-20A5, un sistema controlador CBM-20A y un horno de columna CTO-20AC. La HPLC se acopló con un espectrómetro de masas tipo 3200 Q TRAP triple cuádruple (Applied Biosystems).
Análisis estadístico
Para los datos de amoníaco, glutamina y glufosinato, de lesiones de las plantas de algodón y de malezas, se realizaron análisis de regresión con Sigma Plot (versión 11), y ajustando los modelos más apropiados para cada variable analizada. Una prueba t (p≤0.05) se realizó para la media de los tratamientos.
Resultados y Discusión
En las plantas de algodón, se observó un aumento del nivel de GA (absorción) después de 24 h sin lluvia (Figura 1). A pesar de que el herbicida se absorbió lentamente y se encontraron los niveles más altos en las plantas después de 24 h sin lluvia, la acumulación de amoníaco se produjo independientemente de la absorción del herbicida, en cantidades mayores. La absorción después de 2 a 5 h sin lluvia produjo una gran acumulación de amoníaco en las plantas, lo cual muestra que la cantidad de glufosinato absorbido en 5 h fue suficiente para causar daño a las plantas (Figura 2).
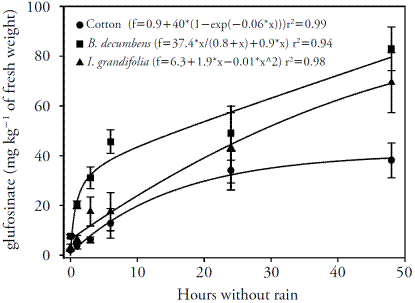
Figura 1 Concentración del glufosinato (mg kg-1 de peso fresco) en las plantas de algodón, B. decumbens e I. grandifolia para diferentes períodos sin lluvia dos días después de la aplicación (DDA). Las barras verticales representan el intervalo de confianza ± de la media (n=4) de la prueba de t (p≤0.05).
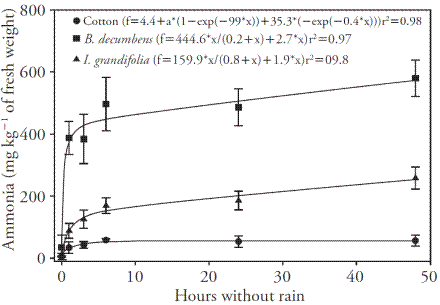
Figura 2 Concentración de amoníaco (mg kg-1 de peso fresco) en las plantas de algodón, B. decumbens e I. grandifolia para diferentes períodos sin lluvia dos días después de la aplicación (DDA). Las barras verticales representan el intervalo de confianza ± de la media (n=4) de la prueba de t (p≤0.05).
La cantidad de glufosinato absorbida por I. grandifolia fue mayor a la de las plantas de algodón y se elevó a las 48 h después de la aplicación sin lluvia. Para B. decumbens, la absorción fue más rápida e intensa en las primeras 6 h sin lluvia, y los niveles de herbicidas en las hojas aumentaron a las 48 h después de la aplicación sin simulación de lluvia (Figura 1).
Everman et al. (2009a) evaluaron la cantidad de 14C-glufosinato absorbida por cuatro especies (maíz resistente al glufosinato, Eleusine indica, Digitaria sanguinalis y Senna obtusifolia), y observaron que S. obtusifolia absorbe 80 % del GA aplicado, mientras que E. indica y D. sanguinalis absorben menos de 22 % y el maíz resistente absorbe sólo 16 %. Everman et al. (2009b) analizaron la absorción, translocación, y el metabolismo del glufosinato en el algodón transgénico y no transgénico, Amaranthus palmeri, e Ipomoea lacunosa, y señalan que estas especies se podían dividir en dos grupos en función de la absorción GA: alta (A. palmeri) y baja (algodón no transgénico y resistente al glufosinato e I. lacunose).
De manera similar a las plantas de algodón, las concentraciones de amoníaco en el interior de I. grandifolia y B. decumbens se estabilizaron en aproximadamente 2 a 5 h sin lluvia, a pesar del aumento de herbicida absorbido a partir de estos períodos. La acumulación mayor de amoníaco mostró que las cantidades de herbicida absorbido en las primeras horas después de la aplicación aumentaron los niveles de este compuesto en las plantas, y causó niveles mayores de lesiones. El algodón presentó la acumulación de amoníaco más baja, seguido de I. grandifolia, y B. decumbens tuvo los niveles más altos (Figura 2). La acumulación de amonio se usa como indicador de rendimiento del glufosinato (Petersen y Hurle, 2001). Sellers et al. (2004) evaluaron la actividad de la glutamina sintetasa y la acumulación de amonio e influencia del momento de la aplicación de glufosinato en malva, y después de aplicar 160 a 320 g ha-1 de glufosinato, la actividad de la glutamina sintetasa se redujo en al menos 50 % y la concentración de amonio fue al menos 13 veces mayor en las plantas tratadas, comparadas con las plantas testigo. Esta cantidad de acumulación es comparable a las concentraciones de amonio que alteran la ultraestructura del cloroplasto e inhiben la formación de ATP (Krogmann et al, 1959;. Puritch y Barker, 1967; Barker, 1968).
Según Pline et al. (1999), la absorción foliar de glufosinato en Solanum carolinense y Asclepias syriaca fue rápida en las primeras 12 h después del tratamiento y aumentó significativamente después de 12 h. Dado que el glufosinato de amonio presenta estructura análoga al glutamato, inhibe la glutamina sintetasa que es una enzima clave para controlar la utilización de nitrógeno dentro de las células (Coetzer y Al-Khatib, 2001). Esto causa la acumulación rápida del contenido de amoniaco (Lea et al, 1984;. Coetzer y Al-Khatib, 2001) y, después un cambio en el espectro de aminoácidos en las células vegetales (Lea et al, 1984;. Sauer et al., 1987). Tsai et al. (2006) informaron la acumulación drástica de amoníaco, un marcador bioquímico de la inhibición de la sintetasa de glutamina debido al glufosinato, en dos linajes de arroz a las 9 h después del tratamiento con 0.26 mM, de glufosinato y la acumulación continuó hasta 24 h después del tratamiento.
Las células vegetales evitan la toxicidad del amonio convirtiendo rápidamente el amonio generado a partir de la asimilación de nitrato o de la fotorrespiración (Mifflin y Habash, 2002; Taiz y Zeiger, 2013). La inhibición de la sintetasa de glutamina por la acción del glufosinato retarda la tasa de fotosíntesis en las plantas C3 y C4 (Lacuesta et al, 1993; Wild et al, 1987), lo cual se atribuye a la inhibición de la fotorrespiración y causa la acumulación del glicolato (González-Moro et al, 1993; Wendler et al, 1990). Esta acumulación inhibe la carboxilasa ribulosa-1,5-bifosfato y por tanto, reduce la asimilación de CO2 (González-Moro et al., 1997). Las funciones de fotorrespiración, junto con el ciclo de Calvin-Benson, contribuyen a una amplia gama de procesos del cloroplasto, desde la bioenergía al metabolismo del carbono y la asimilación de nitrógeno; por lo tanto, protege el aparato fotosintético bajo condiciones de estrés (Taiz y Zeiger, 2013). Esto podría explicar la mayor acumulación de amonio de B. decumbens, comparado con el algodón e I. grandifolia, porque tiene un metabolismo C3 en presencia de la fotorrespiración.
La exposición de las plantas B. decumbens al glufosinato durante 1 h antes de la lluvia fue suficiente para causar la reducción máxima (aproximadamente 80 %) del contenido de glutamina (Figura 3). El algodón mostró una reducción de 60 % en glutamina en 3 h sin lluvia, mientras que I. grandifolia tuvo los niveles más bajos de glutamina en aproximadamente 24 h sin lluvia. Esto muestra que las plantas deben absorber una mayor cantidad de herbicida para producir mayores efectos sobre el contenido de glutamina (Figura 3).
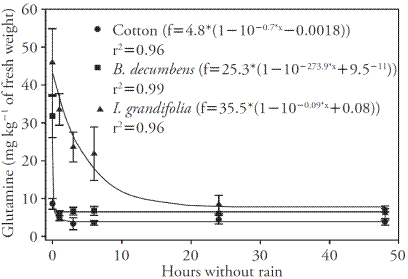
Figura 3 La concentración de glutamina (mg kg-1 de peso fresco) en las plantas de algodón, B. decumbens e I. grandifolia para diferentes períodos sin lluvia a dos días después de la aplicación (DAA). Las barras verticales representan el intervalo de confianza ± de la media (n=4) de la prueba de t (p≤0.05).
La inhibición de la sintetasa de glutamina por la acción del glufosinato genera una disminución de glutamina, inhibición de la biosíntesis de aminoácidos y acumulación de amoniaco en las plantas (Hess, 2000). Después de aplicar 1.02 mM de glufosinato, la actividad de la glutamina sintetasa en el cv TNG 67 de arroz, el FSK y R11-2 disminuyó drásticamente en 6 h después del tratamiento (Tsai et al., 2006). En Amaranthus palmeri S.Wats, 80 % de la actividad de la glutamina sintetasa fue inhibida por el glufosinato entre 6 y 24 h después del tratamiento con herbicida (Coetzer y Al-Khatib, 2001).
Las lesiones visuales de las especies analizadas aumentaron durante el período de evaluación (Cuadro 1). El algodón a los 3 y 10 DDA mostró 10 % y 95 % de lesiones, respectivamente, y esto comprobó que la cantidad de herbicida absorbido en 6 h después de la aplicación fue suficiente para promover los niveles más altos de lesión. Los síntomas de las lesiones son evidentes 3-5 d después de la aplicación de glufosinato de amonio, comenzando con clorosis y puntos de saturación líquida, seguido por una rápida necrosis y muerte de la planta (Pline et al., 1999).
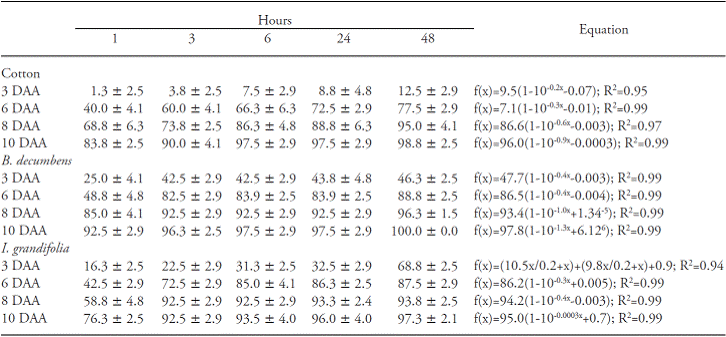
Cuadro 1 Porcentaje de daño visual en plantas de algodón (n=4) y porcentaje de control en las plantas B. decumbens (n=10) e I. grandifolia (n=10) para diferentes períodos sin lluvia.
A los 3 DDA, las plantas B. decumbens presentaron 40 % de control, que fue superior al observado en el algodón en el mismo período, y a los 10 DDA hubo 97 % de control en las plantas tratadas con 3 h de absorción de herbicida sin lluvias (Cuadro 1). En I. grandifolia, a los 3 DDA, las lesiones de las plantas aumentaron durante los períodos más largos sin lluvia, lo cual muestra que una mayor cantidad de glufosinato absorbido en los períodos más largos sin lluvia produce síntomas más intensos (Cuadro 1). Sin embargo, a los 6, 8 y 10 DDA no hubo diferencias después de 3 h sin lluvias, y alcanzó aproximadamente 90 % de control a los 10 DDA.
Anderson et al. (1993) evaluaron los efectos de las lluvias simuladas de 4, 9 y 22 mm en la eficacia del glufosinato de amonio en la cebada (Hordeum vulgare cv. Samson) y cola de zorro verde (Setaria viridis). Ellos observaron que se requería un período sin lluvia de 1 a 8 h (después de la aplicación de herbicidas) para lograr buen control en la cebada, comparado a menos de 20 min para la cola de zorro verde. Coetzer et al. (2001) estimaron la eficacia del glufosinato en el amaranto afectado por la humedad relativa y la temperatura, y 4 d después del tratamiento, las dosis de glufosinato (205, 410 y 820 g ha-1) controlaron todas las especies, en promedio más de 80 % cuando las plantas crecían con 90 % de humedad relativa, pero 820 g ha-1 glufosinato dañó más de 80 % de las plantas con 35 % de humedad relativa.
Conclusiones
La absorción de glufosinato de amonio aumentó hasta las 24 h en algodón y 48 h en B. de cumbens e I. grandifolia. A pesar del aumento en el contenido de glufosinato en los períodos más largos sin lluvia, los niveles de amonio aumentaron y los de glutamina disminuyeron. Las hojas de algodón mostraron los contenidos más bajos de glufosinato, amoniaco y glutamina. Las dos especies de maleza tuvieron las cantidades mayores de glufosinato y amoniaco, las cuales fueron menores para I. grandifolia comparada con B. decumbens. En los períodos de hasta 24 h sin lluvia, la reducción en glutamina fue menor para I. grandifolia. Por último, las lesiones ya eran severas a las tres horas lluvia para las tres especies.











 text in
text in 


