Introducción
En México existen productos fermentados artesanales que contienen diversos grupos microbianos como el pulque, una bebida tradicional fermentada (Escalante et al. 2004, 2008; Lappe et al. 2008; Torres et al. 2014). Además, Torres-Maravilla et al. (2015), identificaron y caracterizaron bacterias del género Lactobacillus del xaxtle, con propiedades probióticas. El xaxtle son los sedimentos acumulados durante la fermentación del pulque y se usan como sustitutos parciales de la levadura y del agua en la panificación artesanal en México (Barros y Buenrostro, 2004). Según Escalante et al. (2004), las bacterias ácido lácticas (BAL) son uno de los géneros de microorganismos más representativos en el pulque; sin embargo, aún no hay datos del efecto del pulque o xaxtle, o ambos, como cultivo iniciador para la fermentación de masas para pan. La tecnología sourdough (masas agrías) es el uso de las BAL en la fermentación de masas para panificación y es una práctica común para elaborar: Panettone, Pandoro y Colomba de Italia (Corsetti y Settanni, 2007; Sanz-Penella et al. 2012); el pan tipo francés de San Francisco (EE.UU.) y galletas acidificadas químicamente en EE.UU. (Arendt et al. 2007).
Liljeberg et al. (1996) indicaron que los ácidos orgánicos producidos por los microorganismos de las masas fermentadas retrasan el vaciado gástrico y reducen el índice glucémico. Además, en productos de panificación fermentados con sourdough (tiempos de fermentación 6 a 10 h), la concentración de almidón resistente y de ácido láctico aumentaron, mientras que la concentración del almidón disponible y el índice glucémico disminuyeron (Scazzina et al. 2009). El uso del xaxtle como cultivo iniciador en la fermentación de masas podría ser integrado a la tecnología sourdough para elaborar pan, debido a los efectos benéficos de las BAL y las levaduras presentes en el mismo, según Torres-Maravilla et al. (2015). Por lo tanto, el objetivo de este estudio fue evaluar el efecto de los sedimentos de pulque xaxtle como cultivo iniciador para obtener pan de bajo índice glucémico.
Materiales y métodos
Materia prima
En la región de Huiloapan, Tlaxcala, México, se recolectaron 10 L de xaxtle en marzo y abril del 2013. Las muestras fueron colocadas en frascos estériles y se mantuvieron entre 4 a 7 °C durante su traslado al laboratorio (~6 h) para ser liofilizadas (Frezer-dryer SMH-50, Usifroid, Maurepas, Francia). El recuento de células se realizó antes de elaborar cada lote de panificación para verificar el número de células viables, usando una cámara de Neubauer mediante tinción por exclusión del colorante azul de tripano (0.4 %), que permite diferenciar células vivas de muertas (Baena et al. 2006).
Caracterización fisicoquímica del xaxtle
Las características fisicoquímicas fueron evaluadas en el xaxtle fresco antes de su liofilización. El contenido de humedad se realizó por el método de presión reducida (Método 44-15.02); cenizas totales por el método de calcinación (08-03.01); proteína total por Kjeldahl (46-13.01); todos, métodos oficiales de la AACC (2001). Los valores de pH fueron evaluados con un potenciómetro (Denver Instrument pH meter AP5, Westminster, California, EE.UU.), y el contenido de azúcares reductores se determinó de acuerdo al manual ICUMSA (1964).
Aislamiento
Para el recuento de unidades formadoras de colonias (UFC), el aislamiento de las BAL y de las levaduras, se usaron diluciones seriadas de 10-1 a 10-6 desde 10 g de xaxtle liofilizado (gXL) en solución reguladora de fosfatos 0.1 M (pH 7.4). Para las BAL se usó el agar Man-Rogosa-Sharpe (MRS, Difco) y para las levaduras se empleó agar papa dextrosa (PDA, Difco) y agar dextrosa Sabouraud (DS, Difco), las placas fueron incubadas 48 h a 37 °C. El aislamiento se realizó mediante pases sucesivos en los mismos medios de cultivo. Las colonias presuntivas se seleccionaron mediante tinción Gram y la prueba de catalasa para las bacterias ácido lácticas y con tinción verde de malaquita para las levaduras.
Identificación fenotípica y genotípica de las bacterias aisladas del xaxtle
Para esta identificación se usó un perfil de fermentación de carbohidratos con tiras API 50 CHL (bioMérieux, Francia). La biomasa de las bacterias aisladas se obtuvo de 2 mL de un cultivo de 12 h en caldo MRS (Difco), el cual se usó para extraer su ADN (Martín et al., 2007). Para extraer ADN de las levaduras, la biomasa se cosechó desde las placas con agar usando el método fenol-cloroformo (Blin y Stafford, 1976).
La reacción en cadena de polimerasa (PCR) se realizó para la amplificación del gen 16S ARNr de las bacterias presentes en el xaxtle, utilizando los siguientes iniciadores: forward (5’-AGAGTTTGATCCTGGCTCAG-3’), posición equivalente 9-28 en Escherichia coli 16S ARNr) y reverse (5’GTTGCGCTCGTTGCGGGACT-3’), posición 1109-1090 en E. coli 16S ARNr) (Ramírez-Chavarín et al., 2010). La reacción de PCR fue realizada con la siguiente mezcla de reactivos: amortiguador 1X PCR (200 mM Tris-HCl, pH 8.0, 500 mn KCl); 1.5 mM MgCl2 pH 8.0; 200 mM de cada dNTP; Taq polimerasa (1.5U·mL-1); 20 pmol de oligos, 10 ng mL-1 de ADN molde; y se agregó agua destilada a la mezcla hasta obtener 50 μL. El protocolo tuvo una fase inicial de desnaturalización (94 °C por 3 min), seguida por 34 ciclos de desnaturalización a 94 °C por 1 min, alineación del iniciador a 65 °C por 90 s, y alargamiento a 72 °C por 2 min, además de 15 min adicionales para finalizar el ciclo de reacción. Para identificar levaduras se usó el par de iniciadores universales ITS 5 (5’-GGA AGT AAA AGT CGT AAC AAG G-3 ‘) hasta LR6 (5’-CGC CAG TTC TGC TTA CC-3 ‘) (Fell et al. 2000; Sampaio y Gonçalves, 2008) bajo condiciones convencionales de PCR.
Las reacciones de PCR se realizaron en un termociclador BiometraTGradient (Whatman, Biometra, Göttingen, Alemania). Los productos de amplificación de ADN se corroboraron en una electroforesis (0.8 % de agarosa) y se visualizaron por fluorescencia ultravioleta después de ser teñidos con bromuro de etidio. La purificaron de los productos de PCR se realizó con el kit QIAGEN gen cleanup y fueron secuenciados con AppliedBiosystems (ABI) Prism 3100 GeneticAnalyzer (Vernon Hills, Illinois, EE.UU.). Las homologías se realizaron en la base de nucleótidos BLAST (Basic Local AlignmentSearchTool) de la NCBI (National Center for Biotechnology Information, National Library of Medicine, EE.UU.).
Proceso de panificación
Un pan modelo se elaboró para todos los análisis con: 300 g de harina de trigo comercial; 3.6 g de NaCl; 24 g de leche entera en polvo; 60 g de huevo fresco; 16 g de materia grasa y 100 mL de agua destilada estéril. El contenido de xaxtle se agregó de acuerdo con el diseño de metodología de superficie de respuesta (MSR). Para el pan testigo se empleó levadura comercial (Saccharomyces cerevisiae). Los ingredientes se mezclaron 10 min en una batidora (Kitchen-Aid Heavy-Duty, Model K5SS, EE.UU.); la masa se incubó a 37 °C con el tiempo indicado en el diseño experimental. Después la masa se dividió en porciones de 60 g y se fermentó 30 min a 37 °C; y para obtener el pan, las masas fueron horneadas 30 min a 180 °C en un horno de columpios (Henry SimonLimited, Cheshire, R.U.).
El recuento de unidades formadoras de colonias (UFC) de BAL y de levaduras en la masa óptima (metodología de superficie de respuesta) se efectuó de acuerdo con lo descrito en la sección anterior. El pH y la acidez titulable total (ATT) fueron determinados en las masas óptimas, 10 g de masa fueron homogenizadas en 90 mL de agua destilada, el pH fue registrado con un potenciómetro (AP5, Denver instrument EE.UU.). La ATT fue valorada utilizando NaOH 0.1 N hasta llegar a un pH final de 8.5, y se expresó en mL de NaOH 0.1 N necesarios para titular 10 g de masa (Sanz-Penella et al. 2012).
Metodología de superficie de respuesta (MSR)
La MSR se utilizó para determinar las condiciones óptimas de cantidad de xaxtle liofilizado (gXL) y tiempo de fermentación (min) para la elaboración del pan. En esta investigación se usaron dos variables: la cantidad de xaxtle liofilizado (0 a 10 g de xaxtle por 100 g de harina de trigo) y el tiempo de fermentación (30 a 90 min) (Cuadro 1).
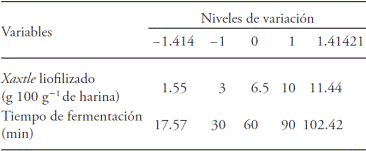
Cuadro 1 Variables independientes con su nivel de variación para la fermentación usando sedimento de pulque (xaxtle) durante proceso de panificación.
Los límites superiores e inferiores se obtuvieron de estudios preliminares. El diseño y el análisis de la MSR se realizaron con el programa DesignExpert 7.0 (Stat-Ease Inc., Minneapolis, MN, EE.UU.). El programa se basó en 13 experimentos con cinco repeticiones del punto central, cuatro puntos factoriales y cuatro puntos axiales. Las variables de respuesta fueron: volumen específico (VE) del pan con xaxtle; textura (Tx) de la corteza y luminosidad (L) de la miga. La significancia de los modelos (VE, Tx, L) se realizó con un ANDEVA para identificar el coeficiente de correlación (r) de cada respuesta. Además se usó la herramienta de optimización D-óptima del DesignExpert para obtener los gramos de xaxtle liofilizado y tiempo de fermentación para la elaboración de pan. El valor de la D-óptima es el resultado de la combinación de tres ecuaciones de superficie de respuesta (volumen específico, textura y luminosidad).
Volumen específico (VE)
El volumen específico del pan se obtuvo mediante el desplazamiento de semilla de nabo, de acuerdo con el método oficial (10-05.01) de la AACC (2001) y con la fórmula:
Volumen específico (cm3 g-1) = Volumen del pan (cm3) x peso del pan (g)
Textura (Tx)
La textura se evaluó con un penetrómetro Modelo 327 PressureTester (EFFEGI, Italia), y las medidas (kgf) se realizaron en la parte superior central de la corteza del pan.
Luminosidad (L)
La luminosidad se midió en la miga del pan, con equipo Color Made HDS (modelo 347805, Milton Roy Company, Diano Color Products, EE.UU.).
Microscopía electrónica de barrido (MEB)
La miga del pan con xaxtle y del pan testigo se cortó en cubos de 4 mm con hojas de acero inoxidable; las muestras se pusieron en una solución de glutaraldehído al 2 % (pH 7) por 2 h a 25 °C, se lavaron con solución de sacarosa al 1 % en solución amortiguadora de fosfatos 0.05 M pH 7.0, se fijaron con una solución deOsO4 al 1% por 2h, y se lavaron otra vez con la solución de fosfato de sodio al 1 % (Bozzola y Russell, 1999). Las muestras se deshidrataron en serie usando soluciones de etanol al 0, 10, 20, 30, 40, 50, 60, 70, 80, 90 %, y tres veces con etanol absoluto (10 min de exposición por cada concentración). Todo el etanol se sustituyó por CO2, usando una secadora a punto crítico (Samdri 780 B, Rockville, MA, EE.UU.), las muestras se recubrieron con partículas de oro ionizado (Desk II, Denton Vacuum, MA, E.U.A) y se observaron en un microscopio electrónico de barrido (JEOL 5410LV, Peabody, MA, EE.UU.).
Determinación de la hidrólisis del almidón in vitro
La concentración de almidón total (AT) se determinó por el método de Goñi et al. (1997), utilizando un factor de conversión de glucosa a glucano de 0.9 y la concentración de almidón resistente (AR) se cuantificó por el método de Goñi et al. (1996). El almidón potencialmente disponible (AD) se obtuvo por diferencia entre el AT y el AR.
Las tasas de hidrólisis del almidón en pan con xaxtle y el pan testigo se determinaron de acuerdo con Granfeldt et al. (1992), usando 1 g de almidón potencialmente disponible (AD). El pan de caja se utilizó como referencia. Las muestras se incubaron con α-amilasa (EC 3.2.1.1) salival de seis individuos sanos y en ayunas (masticándolas 15 s), se disolvieron en 15 mL de solución reguladora de fosfatos 0.05 M, pH 6.9 y se incubaron con pepsina (EC 3.4.23.1) a pH 1.5 (P-7012, Sigma-Aldrich, Saint Louis Missouri 6331 03, EE.UU.) a 37 °C por 30 min con agitación. El pH se ajustó a 6.9 para una segunda incubación (37 °C de 0 a 180 min) usando α-amilasa (EC 3.2.1.1) (A-3107; Sigma-Aldrich, Saint Louis Missouri 6331 03 EE.UU.) en bolsas de diálisis. Los productos hidrolizados y dializados fueron cuantificados en equivalente de maltosa con ácido 3,5-dinitrosalísico (D0550 Marca Sigma Chemical, Perth, Western Australia). La predicción de índice glucémico (pIG) se calculó usando datos del índice de hidrólisis con la fórmula:
pIG = (0.862 x HI) + 8.19
Análisis estadístico
Todos los resultados son el promedio de al menos tres repeticiones. Los grupos de datos fueron analizados con pruebas de ANDEVA y t-student. La prueba de Tukey (p≤0.05) se usó para comparar medias con el testigo mediante el software Minitab Versión 16.1.0 (Philadelphia State College, EE.UU., 2010). Además se usó el software DesignExpertPlot 7.0 (Stat-Ease Inc., Minneapolis, MN, EE.UU.) como herramienta de optimización para definir la cantidad de xaxtle y tiempo de fermentación óptimos para la elaboración del pan.
Resultados y discusión
Caracterización fisicoquímica del xaxtle
El xaxtle presentó 95 g de agua, 2.2 g de proteínas, 0.6 g de cenizas, 546.8 mg de glucosa (azúcares reductores), 1.1 g de ácido láctico (informado por 100 g de muestra) y pH de 4.1. Estos componentes químicos promueven el crecimiento de microorganismos como las BAL, que son microorganismos para mejorar las características de aroma y sabor en varios alimentos fermentados (Paramithiotiset al. 2006).
Identificación de los microorganismos del xaxtle
El recuento en 1 g de xaxtle liofilizado (gXL) fue ~1x108 células microbianas viables, que se agregaron a las masas como cultivo iniciador, de las que 7x106 UFC·g-1 fueron bacterias Gram positivas-Catalasa negativas (agar MRS) y las restantes 4x105 UFC·g-1 cepas levaduriformes (agar PDA y SD), indicando que las bacterias ácido lácticas (Gram-positivas y Catalasa-negativas) están en mayor proporción en el xaxtle. El análisis de las secuencias amplificadas del gen 16S ARNr mostró que las bacterias en el xaxtle tenían una gran similitud con el género de Lactobacillus, así como la presencia de las levaduras S. paradox MESP1 y S. cerevisiae MESP2, cuyas secuencias están en el GenBank con los números de acceso KT954183 y KT954184. Escalante et al. (2004, 2008) indicaron que los principales microorganismos presentes en la etapa final de la fermentación del pulque son los Lactobacillus (88.1 % de los clones totales). Las BAL son microorganismos importantes en el pulque porque pueden fermentar glucosa, fructosa y sacarosa, presentes en aguamiel, produciendo ácido (D o L) láctico. Además, esos microorganismos pueden resistir alta concentración de etanol y crecer en ambientes ácidos (pH 4.5) característicos del pulque (Carr et al. 2002). Aunque el pH del xaxtle fue 4.1, los recuentos bacterianos indicaron viabilidad de 7x106 UFC·gXL -1, y estos resultados son similares a los obtenidos por Valadez-Blanco et al. (2012), con 7.1x107 UFC·mL-1 para muestras de pulque de Oaxaca.
Metodología de superficie de respuesta
Volumen específico (VE)
El volumen específico (VE) es una característica importante en el pan por ser un parámetro de calidad. El coeficiente de correlación (r=0.82) del modelo mostró un ajuste de los datos experimentales y una p=0.036 (Tukey). La cantidad de xaxtle y el tiempo de fermentación están estrechamente correlacionados con la superficie de respuesta representada por la ecuación de regresión múltiple (Ecuación 1) del volumen específico del pan, que indica hasta 82 % la asociación de los dos factores (Figura 1).
VE = 1.23 + 9.37x10-3 gXL - 0.06x10-3t + 4.75x103 gXL2 + 1.09x10-4t2 - 1.03x10-3gXLt
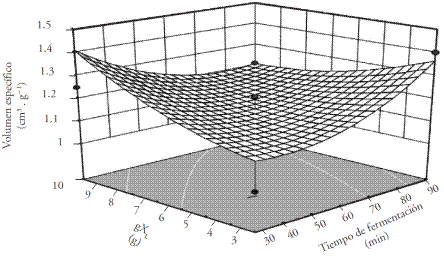
Figura 1 Análisis de superficie de respuesta del volumen específico (cm3·g-1) de pan fermentado a distintas concentraciones de xaxtle liofilizado y tiempos de fermentación.
El uso de 3 gXL como inóculo para fermentar la masa desde 30 hasta 90 min, aumentó el volumen específico (a 90 min, VE=1.31 cm3·g-1), pero este fue menor comparado con el pan testigo (VE=2.73 cm3·g-1). Lo anterior se relaciona con el reporte de Rollán et al. (2005), de que un pH de 3.5 a 4.0 en masas de panificacion puede activar las enzimas proteolíticas, modificar la estructura del gluten, y producir un menor volumen.
Las masas inoculadas con xaxtle presentaron 106 UFC por g de masa (108 UFC en 300 g de harina), de las cuales 7x104 UFC·g-1 correspondieron a las BAL y 4x103 UFC·g-1 a las levaduras. El recuento de UFC en las masas después de 90 min de fermentación fue 5.18×109 UFC·g-1 para las BAL y 1.3×105 UFC·g-1 para las levaduras. El aumento de las BAL en las masas fermentadas con xaxtle (3 gXL, 90 min fermentación) redujo (p=0.00) el pH desde 6.1 a 4.5; mientras que en las masas inoculadas con S. cerevisiae el pH se mantuvo constante a 6.1. En conjunto, estos resultados indicaron que las BAL del xaxtle pueden adaptarse a los ingredientes de panificación durante la fermentación. Las bacterias lácticas emplean varias vías metabólicas para usar el almidón como fuente de carbono, usando la vía de las pentosas, hexosas y la vía 6 fosfato gluconato/cetolasa, produciendo ácido láctico, ácido acético, en algunos casos CO2 y etanol, como productos finales de la fermentación (Corsetti y Settanni, 2007). También hay una estrecha relación entre la reducción de pH en las masas madre y el aumento de las UFC de BAL, y una relación 1:100 de levaduras con respecto a las BAL. La prevalencia de las bacterias lácticas sobre las levaduras se debe a la competencia por sustratos, como la maltosa, disacárido que forma parte de la composición química de la harina de trigo. Paramithiotis et al. (2006) señalaron que en fermentaciones en masas madre, L. brevis ACA-DC 3407 predomina sobre S. cerevisiae ACAYC 5065, porque presentan antagonismo por maltosa, reducen el crecimiento de las levaduras e influyen en la reducción del pH por la producción de ácidos ácido láctico y ácido acético. Además, Gänzle et al. (2008) y Katina et al. (2005) indicaron que los Lactobacillus influyen negativamente en la producción de CO2 por levaduras, y el resultado es un desarrollo bajo de los alveolos (porosidad) en los productos horneados y, por lo tanto, volumen específico bajo.
Textura (Tx)
En la superficie de respuesta de textura (Figura 2) se observó que el factor del contenido de xaxtle liofilizado tuvo influencia mayor sobre la textura del producto. Los datos fueron ajustados en una ecuación (2) cuadrática, el coeficiente de correlación (r=0.823) y el ANDEVA del modelo indican que el ajuste experimental tiene una p=0.014.
Tx = 0.07 + 0.27 gXL + 0.02 t + 2.32x10-3 gXL-2 - 9.79x10-5t2 2.73x10-3 gXL
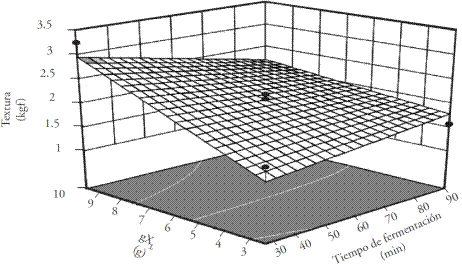
Figura 2 Análisis de superficie de respuesta de textura (kgf ) de pan a distintas concentraciones de xaxtle liofilizado y tiempos de fermentación.
En la Figura 2 se observa que con 3 g de xaxtle liofilizado por cada 100 g de harina de trigo y con un tiempo de fermentación de 90 min, la textura del pan fue 1.48 kgf, y para el pan elaborado con 3 g de S. cerevisiae y 90 min de fermentación la textura fue 0.9 kgf.
Los resultados están altamente correlacionados con los valores de volumen específico: un pan con mayor volumen se debe al desarrollo de gluten (red proteica), a la formación de alvéolos en la masa y al CO2 producido durante la fermentación, haciéndolo menos compacto y por lo tanto con una fuerza de penetración menor, lo cual se relaciona con un valor de textura más bajo (Cauvain y Young, 2007).
Estos resultados concuerdan con lo descrito por Sanz-Penella et al. (2012), quienes muestran diferencia en el aumento de la fuerza de penetración (mayor valor de textura) en panes de masas fermentadas con Bifidobacterium pseudocatenulatum ATCC27919 a concentraciones del 5, 10, 15 y 20 %, con respecto a S. cerevisiae.
Luminosidad de la miga (L)
La luminosidad de la miga del pan evalúa el grado de la luz reflejada por esta compleja estructura porosa y viscoelástica. La regresión de los datos fue ajustada a un modelo cuadrático (Ecuación 3) y el coeficiente de correlación fue 0.92 (p=0.001). Las variables influyeron hasta 91 % en el comportamiento del parámetro L (Figura 3).
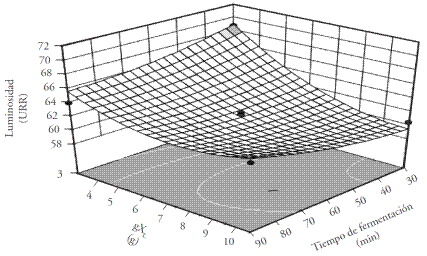
Figura 3 Análisis de la superficie de respuesta para luminosidad (U.R.R.) de pan fermentado a distintas concentraciones de xaxtle liofilizado y tiempos de fermentación.
La ecuación cuadrática es la siguiente:
L = 84.6 - 4.24 gXL - 0.22t + 0.17x10-3 gX2L + 9.58x10-1 t2 - 0.19 gXLt
El contenido de xaxtle influye en la luminosidad de las migas del pan, desde 55.6 hasta 71.2 U.R.R. (Unidades de Reflactancia Relativa), es decir, a mayor concentración de xaxtle, menor luminosidad de la miga del pan debido al color del inóculo (marrón) y al menor contenido de humedad, el cual está directamente relacionado con el parámetro L. Los resultados en nuestro estudio fueron similares a los de panes fermentados con B. pseudocatenulatum ATCC 27919 con un intervalo de luminosidad de 55.5 a 57.8 U.R.R. (Sanz-Penella et al., 2012).
Condiciones óptimas para la elaboración de pan fermentado xaxtle
La zona óptima para la elaboración de pan con xaxtle correspondió a la sobreposición de las gráficas de contorno y las ecuaciones de regresión múltiple del volumen específico del pan (cm3 g-1), textura (kgf) y luminosidad (L). Las soluciones propuestas por DesignExpert se muestran en el Cuadro 2.
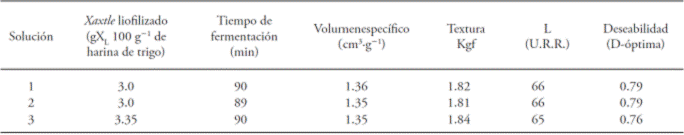
Cuadro 2 Soluciones para conocer la optimización de concentración de xaxtle liofilizado (gXL 100 g-1 harina de trigo) y el tiempo de fermentación (min) de la masa.
Para el volumen específico del pan con xaxtle la zona óptima varió de 1.23 a 1.51 cm3 g-1, la textura entre 1.73 y 1.85 kgf y la luminosidad de la miga de 66 U. R. R. de 84 a 99 min de tiempo de fermentación y una concentración de xaxtle liofilizado de 2.37 a 3.4 g por100 g de harina de trigo. De acuerdo con la D-óptima del programa, las condiciones óptimas fueron 3 g de xaxtle liofilizado y 90 min de fermentación.
Para el volumen específico del pan con xaxtle, la zona óptima varió de 1.23 a 1.51 cm3 g-1, la textura entre 1.73 y 1.85 kgf y la luminosidad de la miga de 66 U.R.R. de 84 a 99 min de fermentación y una concentración de xaxtle liofilizado de 2.37 a 3.4 g por 100 g de harina. De acuerdo con la D-óptima del programa, las condiciones óptimas fueron 3 g de xaxtle liofilizado y 90 min de fermentación.
Microestructura de la miga
En las microestructuras del pan con xaxtle y pan con S. cerevisiae se observaron gránulos de almidón (GA) de distintos tamaños (Figura 4). En el pan con xaxtle se observó una escasa película de gluten (PG), probablemente debida a la fermentación producida por las BAL presentes en el xaxtle (Figura 4a y 4b). Las BAL pueden modificar la estructura de los productos de panificación debido a su actividad proteolítica (Gänzle et al. 2008). La miga del pan con xaxtle fue más compacta que la miga del pan elaborado con S. cerevisiae, y según Kusunose et al. (1999), en la interacción entre levaduras y bacterias ácido-lácticas disminuye el CO2, debido a la competición de sustratos.

Figura 4 Micrografías de la miga del A) y B) pan con xaxtle; C) y D) pan con Saccharomyces cerevisiae. GA gránulos de almidón, FG fibrillas de gluten y PG película de gluten. 1000x (A, C), 2000x (B, D). Barra 10 μm.
Sanz-Penella et al. (2012) observaron que durante la fermentación de masas con BAL, la matriz proteínica y los granos de almidón son degradados, reduciendo significativamente el volumen específico de los productos horneados. Las masas inoculadas con xaxtle tuvieron una producción significativa (p=0.00) de ATT (ácidos orgánicos) de 11.3 mL NaOH 0.1 N mayor que las masas fermentadas con S. cerevisiae con una ATT de 2.3 mL NaOH 0.1 N. La acidez titulable total de las masas con xaxtle influyó en la formación de las estructuras durante el amasado, ya que el desarrollo del gluten es afectado por dicha acidez, lo cual se muestra en la microestructura de la miga del pan (Figura 4). El desarrollo del gluten y la correspondiente formación de la estructura se deben a que durante la incubación de las masas ocurren cambios bioquímicos, como la fermentación láctica, acética y alcohólica, además de una proteólisis debido a las enzimas endógenas microbianas que se activan por el descenso del pH (Corsetti y Settanni, 2007). El sistema proteolítico de las BAL hidrolizan las proteínas a péptidos pequeños y aminoácidos, los cuales son importantes para el crecimiento de estas bacterias. Según Zotta et al. (2007), las gliadinas, una de las proteínas del gluten, pueden fragmentarse a un tamaño de 20 a 27 kDa.
La estructura de la miga del pan elaborado con S. cerevisiae (Figura 4C y 4D) fue menos densa que la del pan elaborado con xaxtle (Figura 4A y 4B). Además, en el pan testigo se observó una película de gluten (PG) bien desarrollada con algunos espacios esféricos vacíos que corresponden a alvéolos de gas formados por la producción de CO2, y se encontró que los gránulos de almidón (GA) están recubiertos por la red proteica. La matriz proteica fue totalmente desarrollada en el pan con S. cerevisiae formando PG en la estructura, mientras que el pan con xaxtle no fue muy bien desarrollada, lo cual está relacionado con el efecto del sistema proteolítico de las BAL (Corsetti y Settanni, 2007).
Hidrólisis in vitro del almidón
El contenido de almidón total del pan con xaxtle fue 9.8 %, significativamente (p=0.003) menor que el pan con S. cerevisiae (Cuadro 3). Esto se puede explicar por la fermentación del almidón por BAL, y este almidón se usa como sustrato para producir ácidos orgánicos (Liljeberg et al. 1996). El contenido de almidón resistente total en el pan con xaxtle fue 3.57 %, similar al pan con S. cerevisiae (p=0.067). El pan con xaxtle presentó un contenido de almidón disponible de 3.93 %, significativamente menor (p=0.003) que el pan con S. cerevisae. Liljeberg et al. (1996) reportaron un incremento de almidón resistente y ácido láctico en productos elaborados con masas sourdough (más de 5 h de fermentación).

aART-AT=AD. Letras diferentes en un renglón indican diferencia significativa (p≤0.05)
Cuadro 3 Contenido de almidón total (AT), almidón resistente total (ART) y almidón disponible (AD) de pan (g por 100 g de muestra) fermentado con xaxtle y pan fermentado con S. cerevisiae.
Las curvas de hidrólisis están expresadas en porcentaje de almidón hidrolizado (%H) durante la hidrólisis in vitro (Figura 5). El pan blanco de caja de una marca comercial se usó como referencia en este análisis, con un porcentaje de hidrólisis de 25.8 %. Osorio-Díaz et al. (2005) señalaron que el pan blanco (de referencia) tuvo una hidrólisis similar después de 180 min de incubación (28 %). El comportamiento de las curvas muestra que a partir del minuto 60, la hidrólisis del pan con xaxtle presentó diferencia significativa (p=0.025) respecto al pan con S. cerevisiae.
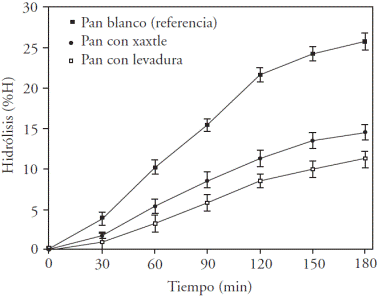
Figura 5 Porcentajes de hidrólisis del almidón determinados después de incubación con pepsina (EC 3.4.23.1) y con α-amilasa (EC 3.2.1.1) en pan blanco de caja (referencia), pan elaborado con xaxtle, pan elaborado con levadura comercial (Saccharomyces cerevisiae).
El comportamiento del grado de hidrólisis del pan con xaxtle fue influenciado por la reducción del pH y la hidrólisis de los gránulos de almidón realizada por los microorganismos del xaxtle. En algunos casos, según Scazzina et al. (2009), el uso de masas fermentadas sourdough mejoró la respuesta de glucosa en sangre, donde los ácidos orgánicos retrasaron el vaciado gástrico, incluso sin afectar la accesibilidad del almidón.
Las áreas bajo la curva de la hidrólisis del almidón para el pan con xaxtle y para el pan con S. cerevisiae fueron correlacionadas con el área del pan blanco de caja (de referencia) y se calculó la predicción de índice glucémico (pIG). La pIG del pan con xaxtle fue significativamente menor (p=0.03) con 51.8 que el pan con S. cerevisiae con 56.2. La reducción del pIG podría deberse a la acción metabólica de las bacterias ácido lácticas del xaxtle; el contenido de ácidos orgánicos en las masas con xaxtle favoreció una reducción del pIG (Åkerberg et al. 1998; Scazzina et al. 2009). La ATT de las masas inoculadas con xaxtle fue mayor (11.78 ± 0.2 mL de NaOH) que para las masas inoculadas con S. cerevisiae (2.62 ± 0.29 mL de NaOH); el contenido de ácido láctico fue mayor para las masas con xaxtle (0.11 ± 0.002 g 100 g-1 de masa), respecto a las masas con S. cerevisiae (0.02 ± 0.003 g·100 g-1 de masa). El mismo comportamiento fue observado para el ácido acético con 0.07 ± 0.001 g 100 g-1 y 0.016 ± 0.002 g 100 g-1 de masa, respectivamente.
De acuerdo con los valores de la pIG y a la clasificación de Bjorck et al. (1994), el pan elaborado con xaxtle tiene índice glucémico bajo. Además, un alimento de IG bajo produce un grado mayor de saciedad, debido principalmente a que la hidrólisis y asimilación de los hidratos de carbono es menor que en los alimentos con mayor IG Noriega et al. (2001).
Conclusiones
La cantidad óptima de xaxtle adicionada y el tiempo de fermentación de la masa durante la elaboración del pan favorecieron la reducción de pH y el aumento de acidez por las bacterias ácido lácticas, así influyendo en los cambios estructurales, en el contenido del almidón disponible y en la disminución del índice glucémico del pan. El uso del xaxtle como inóculo en panificación podría utilizarse en la fermentación de masas para obtener productos de panificación de índice glucémico bajo.











 text in
text in 


