Introducción
Los hongos forman un gran grupo eucariótico de organismos que se caracterizan por sus paredes celulares quitinosas y también por su falta de pigmento fotosintético. Si bien la mayoría de las especies fúngicas son saprófitas, un número de ellas son parásitas de plantas y dañan diferentes órganos en plantas silvestres y sembradas (Agrios, 2005; González-Fernández et al., 2010). Los fungicidas químicos son esenciales para el control efectivo de las enfermedades en plantas (Knight et al., 1997). En las dos décadas recientes se desarrollaron nuevas clases de fungicidas con nuevos modos de acción, y se identificarán nuevas moléculas en el futuro previsible (Knight et al., 1997; De Waard et al., 1993).
El uso extensivo e irracional de fungicidas sintéticos causó daños ambientales y a la salud humana, debido, sobre todo, a la exposición ocupacional y a sus residuos en productos alimenticios. Además, se detectan cada vez más poblaciones resistentes de hongos en agroecosistemas controlados artificialmente (Blasco et al., 2002; Waard et al., 2006). Para tratar con el riesgo relacionado al uso de fungicidas químicos, los microorganismos antagónicos representan una alternativa factible para el control de hongos fitopatógenos. En este contexto, la bacteria Bacillus subtilis ha mostrado una excelente capacidad de inhibir in vitro e in vivo el crecimiento y la esporulación de una amplia variedad de hongos fitopatógenos (Korsten y Jager, 1995; Podile y Laxmi, 1998; Schisler et al., 2004).
Los efectos antagónicos de B. subtilis se relacionan con al menos cinco mecanismos: 1) parasitismo directo, donde las bacterias se mueven hacia las esporas en germinación y se adhieren a la superficie por medio de la polaridad (Korsten y Jager, 1995); 2) producción de antibióticos extracelulares como bacilomicina, iturina, micosubtilina y zwittermicina (Pal y Gardener, 2006; Fickers, 2012); 3) producción de enzimas líticas como quitinasa, proteasa, b-1,3 glucanasa y celulosa (Kumar et al., 2012); 4) competencia por los nutrientes en el hospedante, que causa estrés por nutrientes e inanición en el hongo en germinación (Janiciewickz et al., 2003; y 5) estimulación de defensas del hospedante a través de la resistencia sistémica inducida por medio de la ruta del ácido jasmónico (Van Loon, 2007).
Bacillus subtilis también ha mostrado otras aplicaciones benéficas en la producción agrícola, la ingeniería ambiental y procesos industriales. Por ejemplo, algunas cepas pueden estimular el crecimiento de plantas en cultivos hortícolas, de campo y frutales (Adesemoye et al., 2008; Lugtenberg y Kamilova, 2009). Bacillus subtilis también puede usarse para la biorremediación de crudo y tierras contaminadas con metales pesados, y para la biorremediación de efluentes de las industrias textiles (Augusto-Costa y Pereira-Duta, 2001; Cubitto et al., 2004; Ajao et al., 2011).
Hay casos de éxito bien documentados de usos de B. subtilis para la producción de antibióticos, surfactantes y enzimas (Harwood, 1992; Price et al., 2007). Bacillus subtilis es una especie común en el ambiente; su taxonomía y la de especies relacionadas se estudió de manera extensa en las dos últimas décadas (Rooney et al., 2009). B. subtilis y las especies relacionadas tienen altos grados de semejanza en sus secuencias génicas 16S rRNA (99 % o más), por lo que su identidad debe ser auxiliada por otros genes que dan mayor precisión al nivel de especie.
Asimismo, hay pocas características fenotípicas y bioquímicas para diferenciar entre subespecies de B. subtilis, lo que dificulta la identificación de especies dentro del complejo B. subtilis, así como para resolver la relación evolutiva de dicha especie. En este sentido, el uso de la amplificación, secuenciación y comparación de genes gyrA que codifican para la subunidad A de la ADN girasa, y rpoB, que codifica para la subunidad b de la ARN polimerasa, puede integrarse al análisis de 16S rRNA para identificar cepas de B. subtilis (Chun y Bae, 2000; Geetha et al., 2007; Geetha y Manonmani, 2008; Geetha y Manonmani, 2010).
El presente estudio se realizó para evaluar la actividad antagónica de cepas nativas de Bacillus aisladas de la Península de Yucatán, México, y para identificar las cepas más activas por caracterización molecular usando los genes 16S rRNA, gyrA y rpoB. La hipótesis fue que conocer las características particulares de las cepas endémicas de Bacillus contribuirá a enriquecer los registros genéticos de la región, con la posibilidad de aplicaciones futuras de dichos recursos para el control de hongos fitopatógenos.
Materiales y Métodos
Aislamiento de cepas de Bacillus
Las cepas se aislaron de muestras de suelos obtenidas en la Península de Yucatán en México. Las muestras de suelos se recolectaron en áreas con vegetación natural al raspar material de superficie con una espátula esterilizada y se obtuvieron muestras de unos 200 g de una profundidad de 10 a 20 cm. Todas las muestras se colocaron en bolsas de plástico esterilizadas y almacenadas a 4°C hasta ser procesadas. El aislamiento se realizó usando la metodología descrita por Basurto-Cadena et al. (2012). Brevemente, 1 g de cada muestra se suspendió en 10 mL agua destilada estéril y pasteurizó a 80°C por 20 min. Luego, 50 μL de la suspensión se colocaron en tubos de microcentrífuga con 500 μL de agua destilada.
Alícuotas de 50 μL de las suspensiones diluidas fueron dispersadas por duplicado sobre una capa delgada de agar nutritivo (AN) (Merck, Alemania) en cajas de Petri. La incubación se realizó en condiciones aeróbicas a 30°C por 48 h. Después de la incubación, las colonias semejantes a Bacillus, identificadas de manera aproximada según su morfología, se transfirieron e incubaron en cajas nuevas de Petri por una semana, bajo las condiciones ya mencionadas, antes de ser almacenadas a 4°C. Las colonias se contaron y los resultados se expresaron como conteo de bacterias por mililitro (CFU mL-1). Antes de usarse, todos los aislamientos se reactivaron en AN por cinco días.
Evaluación de actividad antagónica
Los hongos fitopatógenos fueron donados amablemente por el Dr. Jairo Cristóbal del Laboratorio de Fitopatología del Instituto Tecnológico de Conkal. Alternaria alternata y Curvularia lunata fueron aislados originalmente de Chamaedorea elegans, y a su vez, Helminthosporium rostratum fue aislado de Heliconia wagneriana. La actividad antagónica fue evaluada por la inhibición del crecimiento de la colonia fúngica en confrontación directa y por la inhibición de la germinación conidial usando las filtraciones de cultivo de Bacillus.
Bioensayos de confrontación directa se realizaron en un medio de papa-dextrosa-agar (PDA). Brevemente, discos de PDA (diámetro de 5 cm) de cultivos axenicos fúngicos se inocularon en el centro de una caja de Petri de 15 cm de diámetro con PDA. Suspensiones de esporas (1x107 CFU mL-1) se obtuvieron de cepas de Bacillus en agua destilada estéril al raspar con una hoja de bisturí esterilizada cultivos bacteriales de 5 d de cultivo en AN. Las suspensiones de esporas bacteriales se inocularon a 2 cm del margen de los discos de PDA que contenían el cultivo fúngico. Ninguna de las colonias fúngicas testigo se confrontaron con los antagonistas. Las cajas de Petri con cultivos fúngicos se incubaron a 30 °C. La inhibición de crecimiento radial del cultivo fúngico se evaluó cada día y el porcentaje de crecimiento micelial se calculó con respecto al cultivo testigo, según lo indicado por Korsten y Jager (1995), de la siguiente forma: GI(%)=((RC-RE)/RC)x100, donde GI (%) es el porcentaje de inhibición de crecimiento micelial, RC es el radio del cultivo fúngico en la placa de Petri de control, y RE es el radio del cultivo fúngico que fue confrontado con el antagónico Bacillus.
Para las biopruebas de germinación conidial, se cultivaron cepas de Bacillus en caldo agar (BD, USA) 72 h en un agitador orbital a 150 rpm y 30 °C. Los cultivos se centrifugaron a 7000 g por 10 min y el precipitado (células vegetales y esporas) se descartó. Un estudio en nuestro laboratorio mostró que las filtraciones de cultivo esterilizado de Bacillus spp. revelaban actividad antifúngica en Colletotrichum gloeosporioides. Por ello, en este estudio se esterilizó por autoclave y se filtró a 120 °C por 15 min y se dejaron enfriar antes de usarse. Las filtraciones de cultivos fueron mezcladas con suspensiones conidiales de hongos (1:1 v/v) obtenidos de cultivos en PDA. La mezcla de filtraciones de cultivos y suspensiones conidiales se inocula ron después en una caja con PDA y observada por 12 h para germinación conidial usando un microscopio óptico (LEICA DM500®, USA) a una magnificación de 100x. Los conidios se contaron como germinados cuando el tubo de germinación alcanzaba, por lo menos, el largo de los conidios germinados, según Mahadtanapuk et al. (2007).
Extracción de ADN de cepas de Bacillus
Todas las cepas de Bacillus fueron cultivadas en un Caldo Infusión Cerebro Corazón (BHI) (BIOXON, USA) en tubos de 10 mL a 30 °C por 48 h. Los cultivos se centrifugaron a 2500 g por 5 min y lavados con una solución salina (0.85 %). El agregado se juntó y se descartó el flotante. La extracción de DNA se realizó con el kit Master Pure® Gram Positive DNA purification (Epicentre Biotechnologies, USA). Brevemente, se suspendió agredado en 150 μL amortiguador TE (Tris-EDTA) y se adicionó 1 μL de lisozima ready lyse e incubado a 37 °C por 30 min. Después se agregó 159 μL de proteinasa K y se incubó a 65 °C por 15 min; los tubos se agitaron cada 5 min. Luego los tubos se mantuvieron 2 min a 37 °C, seguido por 5 min en hielo para enfriarlos. Las muestras fueron precipitadas en una solución de 175 μL de MPC (reactivo de precipitación de proteína), agitadas vigorosamente y centrifugadas a 10 000 x g por 10 min. El flotante se separó y se mezcló con 1 μL RNasa en un tubo nuevo. Las muestras se incubaron a 37 °C por 30 min y se agregaron 500 μL de isopropanol. Los tubos se centrifugaron a 10000 x g por 10 min, se eliminó el flotante y el agregado se suspendió con 500 μL de etanol (ETOH 70 %). Los tubos se volvieron a centrifugar a 13000 x g por 1 min, se eliminó el flotante y el agregado se volvió a mezclar y se suspendió con 35 μL de amortiguador TE (10 mM Tris-HCl y 1 mM EDTA Na2, pH 8.0; PROMEGA Corp., USA). El ADN se mantuvo en un congelador a -20°C. La calidad del se confirmó por electroforesis de gel de agarosa 1.2 % (87 V por 60 min). El gel se tiño con bromuro de etidio (0.5 μg mL-1) por 30 min. Una imagen se tomó con un sistema de fotodocumentación (Canon-Biotop, USA).
Análisis de reacción en cadena de la polimerasa (PCR) para la identificación molecular
Para la identificación molecular de las cepas, se usaron los genes parciales 16S rRNA, y los rpoB y gyrA, específico de especies. La metodología para cada caso fue la siguiente:
Para el análisis de PCR del gen 16S rRNA se usaron iniciadores específicos para la región interna del “grupo B. subtilis” 16S rRNA, Bsub5F (5’-AAG TCG AGC GGA CAG ATG G-3’) y Bsub3R (5’-CCA GTT CCA ATG ACC CTC CCC- 3’) (Wattiau et al., 2001; Geetha et al., 2007). Las mezclas de reacción (25 μL) consistieron de 12.5 μL mezcla maestra 1X (PROMEGA Corp., USA), 1 μL del iniciador (0.4 mM) (IDT Technologies, USA), 9.5 μL agua libre de ADNasa y 1 μL ADN genómico. El programa de PCR consistió de desnaturalización a 94°C por 12 min, seguido de 30 ciclos de desnaturalización a 95°C por 30 s, alineamiento a 65°C por 2 min, extensión a 72°C por 2 min y una extensión final a 72°C por 7 min.
Para el análisis de PCR del gen rpoB, se usaron iniciadores específicos correspondientes a B. subtilis posición 6-585; rpoB-f (5’-AGG TCA ACT AGT TCA GTA TGG AC-3’) y rpoB-r (5’-AAG AAC CGT AAC CGG CAA CTT-3’) (De Clerck et al., 2004; Geetha y Manonmani, 2010). La mezcla de reacción (25 μL) consistió de 12.5 μL mezcla maestra 1X (PROMEGA Corp., USA), 0.5 μL iniciador (0.2 mM) (IDT Technologies, USA), 10.5 μL agua libre de ADNasa y 1 μL de ADN genómico. El programa de PCR consistió de desnaturalización a 94°C por 12 min, seguido de 40 ciclos de desnaturalización a 94°C por 30 s, alineamiento a 51°C por 45 seg, extensión a 68°C por 50 min y extensión final a 68°C por 90 seg.
Para el análisis de PCR del gen gyrA, se usaron iniciadores específicos correspondientes a B. subtilis, posición 43-1070; gryA-f (5’-CAG TCA GGA AAT GCG TAC GTC CTT-3’) y gyrA-r (5’- CAA GGT AAT GCT CCA GGC ATT GCT-3´) (De Clerck et al., 2004; Geetha y Manonmani, 2008). La mezcla de reacción de PCR (25 μL) consistió en 12.5 μL de mezcla maestra 1X (PROMEGA, Corp., USA), 0.5 μL iniciador (10 mM) (IDT Technologies, USA), 10.5 μL agua libre de ADNasa y 1 μL ADN genómico. El programa de PCR consistió en la desnaturalización a 94°C por 2 min, 40 ciclos de desnaturalización a 94°C por 30 s, alineamiento a 51°C por 45 s, extensión a 68°C por 50 min y una extensión final a 68°C por 10 min.
Los amplicones resultantes fueron visualizados en gel de agarosa 1.2 %, purificados con el kit Qiagen QIAquick (Qiagen Corp., USA) y secuenciados en ambas direcciones usando los iniciadores correspondientes (Bioscience, San Diego, CA. USA).
Análisis filogenético
Las secuencias génicas se editaron y alinearon con el software BioEdit versión 7.1.3.0 (Hall, 1999). Para obtener la identidad, las secuencias se compararon con las de la base de datos del GenBank (Centro Nacional para la Información de Biotecnología), usando el programa BLASTN (Herramienta Búsqueda Básica de Alineamiento de Nucleótidos). Todas las secuencias se depositaron en el GenBank.
Para estudiar la relación de los aislamientos con otros miembros del género Bacillus, se obtuvieron secuencias de las regiones usadas para cada gen en el GenBank y se realizaron múltiples alineamientos en el programa CLUSTALW (Larkin et al., 2007). El modelo evolutivo para cada gen fue estimado y los análisis de Neighbor-Joining con Bootstrap de 1000 repeticiones se realizaron en el programa MEGA (Molecular Evolutionary Genetics Analysis) 5 (Tamura et al., 2011).
Una matriz de particiones se construyó con las secuencias de las tres regiones analizadas. La prueba de homogeneidad sugirió que las tres regiones muestran una señal filogenética similar; por lo tanto, una combinación de tales particiones se puede construir. Bacillus sonorensis se usó como grupo externo. El análisis Neighbor-Joining se realizó con un análisis Bootstrap de 1000 repeticiones. Una matriz de distancias evolutivas se construyó usando el programa MEGA 5 para determinar la tasa evolutiva más alta según la región analizada.
Análisis de datos
Los datos experimentales se analizaron estadísticamente usando ANDEVA con un diseño completamente al azar. La prueba de Tukey se utilizó para determinar diferencias significativas entre promedios (p≤0.05), usando SAS 9.1. A menos que se indique lo contrario, todas las medidas se realizaron por triplicado. Antes del análisis, los datos en porcentajes fueron transformados en arcoseno [y=arcoseno (sqrt x/100)].
Resultados y discusión
Actividad antagónica de cepas de Bacillus sobre tres hongos fitopatógenos
La actividad antagónica de las cepas por confrontación directa y por el uso de los filtrados de cultivos libres de células se evaluó en tres hongos fitopatógenos: Alternaria alternata, Helminthosporium rostratum y Curvularia lunata. Las cepas usadas en este estudio se identificaron molecularmente como B. subtilis subsp. inaquosorum y B. subtilis subsp. subtilis. Los resultados mostraron que el porcentaje de inhibición de crecimiento micelial varió de 32 a 78 % (Cuadro 1). Además, la cepa CBK36 presentó la mayor actividad, causando más de 60 % de inhibición de crecimiento micelial entre los tres hongos evaluados. En contraste, la cepa CBMT51 presentó el efecto más bajo, menos de 40 % de la inhibición de crecimiento colonial en dos de los hongos examinados (Cuadro 1).
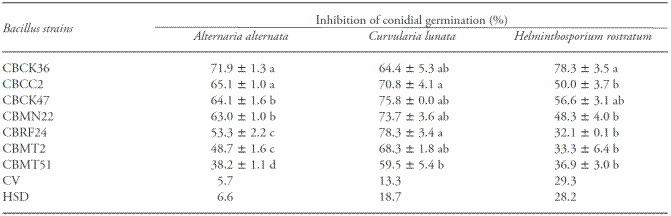
Valores promedio (±errores estándar) en una columna seguidos de diferentes letras son estadísticamente diferentes (Tukey; p≤0.05). CV (%): Coeficiente de variación; DSH: Diferencia Significativa Honesta de Tukey.
Cuadro 1 Efectos de cepas de Bacillus sobre el porcentaje de inhibición del crecimiento micelial en tres hongos fitopatógenos.
La actividad antagónica de B. subtilis sobre los hongos fitopatógenos está reportada en la literatura. Efectos in vitro, están documentados específicamente en crecimiento micelial y germinación de conidios. También hay efectos in vivo, en particular en la incidencia y severidad de manchas foliares y mildiú, pudrición poscosecha de frutas y raíces (Chaurasia et al., 2005; Guillén-Cruz et al., 2006; Zongzheng et al., 2009; Basurto-Cardena et al., 2012).
El efecto de filtrados de cultivos sobre la germinación de conidios de los hongos mostró diferencias significativas (p≤0.05). Los filtrados de las cepas CBCK36, CBMN22 y CBRF24 causaron hasta 37 % de la inhibición de la germinación de conidios en al menos dos de los hongos evaluados. Los filtrados de las cepas CBCC2 y CBCK47 causaron hasta 46 % de la inhibición de la germinación de conidios en A. alternata, aunque sus efectos sobre otros dos los hongos fueron menores (Cuadro 2).
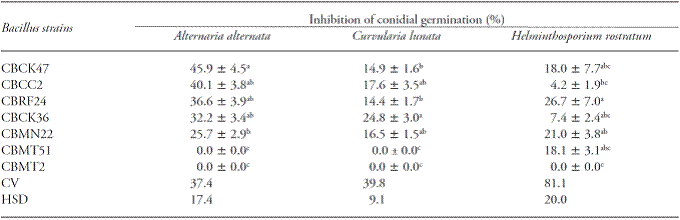
Valores promedios (± errores estándar) es una columna seguidos de diferentes letras son estadísticamente diferentes (Tukey; p≤0.05). CV (%) = Coeficiente de variación; DSH = Diferencia Significativa Honesta de Tukey.
Cuadro 2 Efecto de los filtrados de Bacillus sobre la inhibición de la germinación conidial en tres hongos fitopatógenos.
Además, el filtrado de esta cepa también mostró uno de los mayores efectos sobre la germinación de conidios de los hongos evaluados, lo cual sugiere que parte de su actividad es mediada por la producción de compuestos antifúngicos. Los filtrados de B. subtilis reprimen el crecimiento micelial, así como la germinación conidial de los hongos fitopatógenos (Zongzheng et al., 2009; Islam et al., 2012). En especial, los filtrados de las cepas CBCK36, CBCC2 y CBCK47 mostraron más de 30 % de inhibición de la germinación de conidios en al menos uno de los hongos estudiados. Al ser estos filtrados esterilizados antes de ser usados, los compuestos antifúngico responsables de los efectos mostraron resistencia al calor. Las identidades de estos compuestos no se determinaron en este estudio, aunque se podría dar una hipótesis de que los lipopéptidos resistentes al calor estén involucrados. Hay lipopéptidos antifúngicos resistentes al calor, como iturinas, extraídos del medio de cultivo de varias cepas de B. subtilis (Rezuanul et al., 2012). En efecto, los filtrados de cultivo que contienen compuestos antifúngico resistentes al calor se han usado para disminuir la incidencia y severidad de enfermedades fúngicas in vivo (Cubeta et al., 1985).
Amplificación de PCR y análisis filogenético
Para confirmar la identidad de los aislados de Bacillus, se obtuvieron secuencias de regiones parciales de los genes 16S rRNA, gyrA y rpoB por PCR. La amplificación de la región hipervariable de 16S rRNA, genes especie específicos gyrA y rpoB de las siete cepas de Bacillus produjeron amplicones de 535 pb, 960-1005 pb y 546 bp, respectivamente (Figura 1).

Figura 1 Gel de agarosa (1.2 %) electroforesis de la amplificación por PCR de los genes rpoB DNA, 16S rRNA y gyrA DNA de siete Bacillus subtilis nativas. Carriles M: marcador Promega 1 kb, 1: CBCC2, 2: CBMT2, 3: CBMN22, 4: CBRF24, 5: CBCK36, 6: CBCK47 and 7: CBMT51.
De acuerdo con este análisis, todos los aislados fueron colocados taxonómicamente como B. subtilis subsp. inaquosorum y B. subtilis subsp. subtilis en árboles filogenéticos. Chun y Bae (2000) mostraron el uso de las secuencias genéticas de rpoB en Bacillus. Luego, Geetha y Manonmani (2010) también mostraron la utilidad de esta secuencia genética para identificar el aislado B. subtilis subsp. subtilis VCRC B471. La proteína rpoB también se usó para inferir relaciones entre órdenes arquea y bacterias Gram positiva y Gram negativa (Matte-Tailliez et al., 2002; Morse et al., 2002).
La máxima identidad BLASTN de cada cepa y del género del grupo Bacillus subtilis fue confirmada (Cuadro 3). Las secuencias de PCR basados en los genes 16S rRNA, rpoB y gyrA tenían valores en el rango de 95 a 100 %, similares a los depositados en Genbank (Cuadro 3).
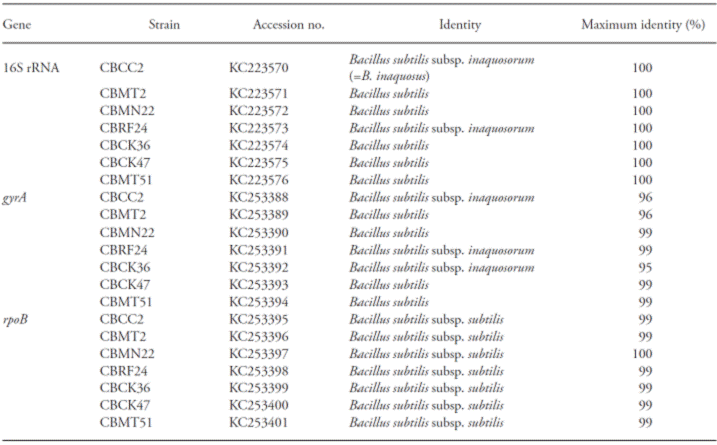
Cuadro 3 Valores máximos de identidad (%) de cepas de Bacillus identificadas con base en el análisis de los genes 16S rRNA, gyrA y rpoB.
Los amplicones obtenidos para las regiones 16S rRNA, rpoB y gyrA fueron 535, 546 y 953 bp, respectivamente. Los análisis Neighbor-Joining de cada una de las regiones (Figuras 2, 3 y 4) y la evidencia total (Figura 5) mostraron que los aislados fueron separados en dos clados. En todos los análisis, los aislados CBRF24 y CBMT2 se agruparon en un clado diferente. Al usar la región 16S rRNA, las cepas CBMT2, CBMN22, CBCK36, CBMT51 y CBCK47 formaron un clado (Figura 2), con secuencias de B. subtilis tomadas de GenBank. Estos aislados formaron un clado con valor de 100 con B. subtilis subsp. subtilis; mientras que con el análisis realizado usando las regiones gyrA y rpoB, las cepas mencionadas formaron un clado con B. subtilis subsp. inaquosorum.
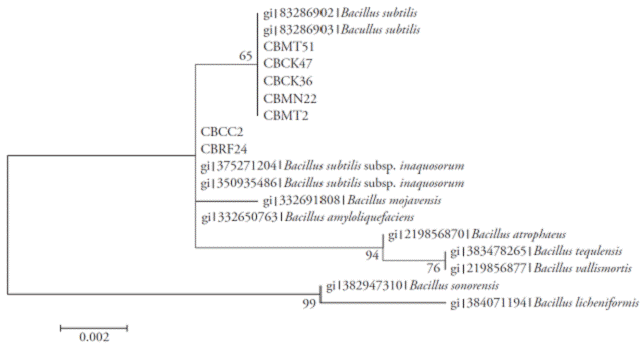
Figura 2 Árbol Neighbor-joining con valores bootstrap basados en secuencias parciales del gen 16S rRNA. Análisis realizado con un modelo de sustitución nucleotídica Jukes-Cantor.
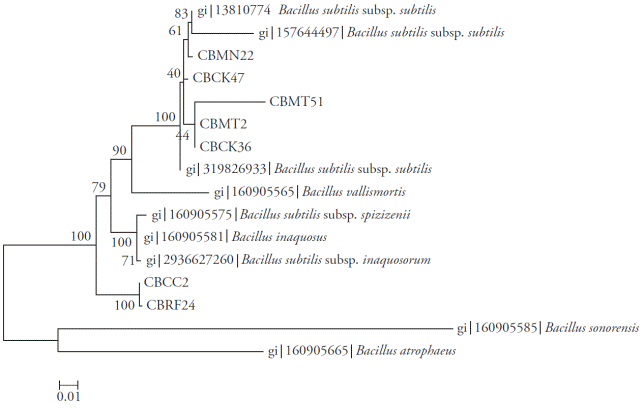
Figura 3 Árbol Neighbor-joining con valores bootstrap basados en secuencias parciales del gen gyrA. Análisis realizado con un modelo de sustitución nucleotídica Tamura-Nei con distribución gamma discreta.
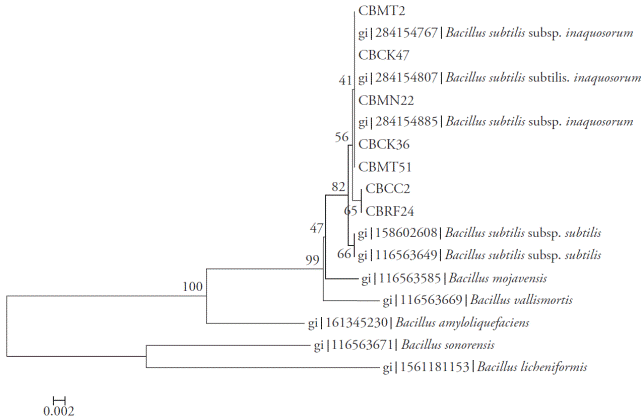
Figura 4 Árbol Neighbor-joining con valores bootstrap basados en secuencias parciales del gen rpoB. Análisis realizado con un modelo de sustitución nucleotídica Tamura-3 parámetro usando una distribución gamma discreta.
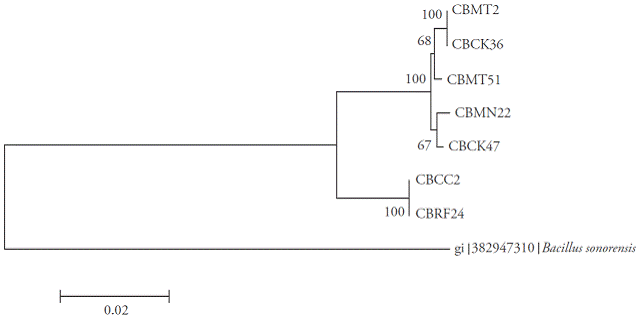
Figura 5 Árbol Neighbor-joining con valores bootstrap basados en secuencias parciales de los genes 16S rRNA, gyrA y rpoB. Anály sis realizado con un modelo de sustitución nucleotídica Tamura-3 parámetro usando una distribución gamma discreta.
El análisis de particiones de matrices separaron los aislados en dos clados distintos, formando un clado con CBRF24 y CBMT2, completamente independiente de las otras cepas (Figura 5). La amplificación, secuenciación y el análisis de secuencias de los genes 16S rRNA, rpoB y gyrA para la identificación molecular de especies de Bacillus sólo están reportados en estudios separados (Geetha et al., 2007; Geetha y Manonmani, 2008; Geetha y Manonmani, 2010). Sin embargo, en nuestra investigación, el primer análisis de secuencias de los genes 16S rRNA, gyrA y rpoB para ubicar taxonómicamente a siete cepas nativas de B. subtilis se intregó de manera exitosa. Esta técnica molecular nos permitió inferir las especies de Bacillus y la existencia de dos nuevas subespecies. Aunque la secuencia genética16S rRNA fue muy útil para determinar las especies bateriales, en el género Bacillus han surgido algunos problemas (Wattiau et al., 2001; Janda et al., 2007).
Matrices de distancia evolutiva
La región que presentó las distancias evolutivas menores fue el 16S rRNA (de cero a 0.002), seguida del gen rpoB (hasta 0.004). En contraste, el gen gyrA mostró la tasa evolutiva mayor (hasta 0.09), resultando incluso más alta que la obtenida por las particiones de matrices, que incluye información de las tres regiones analizadas (0.034 máximo).
Las distancias mayores observadas fueron entre los aislados CBRF24 y CBMT2. Así, para el 16S rRNA, una determinación adecuada de la subespecie B. subtilis podría resultar difícil. En contraste, para el gen gyrA, su tasa evolutiva más alta permitió colocar a B. subtilis en el nivel de subespecie. En particular, el análisis comparativo de secuencias de gyrA probó ser robusto para una clasificación e identificación rápida B. subtilis y taxones relacionados (Chun y Bae, 2000), como lo muestra nuestro estudio. La caracterización de todas las cepas a nivel de subespecie no fue posible con los datos obtenidos. Las cepas CBMT2 y CBRF24 podrían, a la larga, formar nuevas subespecies, porque las demás cepas se agruparon en clados con diferentes subespecies.
Conclusiones
Las cepas de Bacillus nativas de la Península de Yucatán, México, fueron identificadas como Bacillus subtilis subsp. inaquosorum y Bacillus subtilis subsp. subtilis por el análisis de los genes 16S rRNA, gyrA y rpoB. Siete cepas presentaron actividad antagónica en la inhibición de crecimiento micelial en los hongos fitopatógenos Alternaria alternata, Helminthosporium rostratum y Curvularia lunata. Los filtrados libres de células de CBCK36, CBCC2 y CBCK47 presentaron inhibición de crecimiento micelial y causaron diferentes grados de inhibición de germinación de conidios en los hongos fitopatógenos evaluados. La cepa CBCK36 presentó la actividad más alta de inhibición de crecimiento fúngico micelial.











 texto en
texto en 


