Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agrociencia
versão On-line ISSN 2521-9766versão impressa ISSN 1405-3195
Agrociencia vol.49 no.7 Texcoco Out./Nov. 2015
Fitociencia
Morfogénesis in vitro de peciolos de Jatropha curcas L.
In vitro petiole morphogenesis of Jatropha curcas L.
Iván L. Pequeño-Granado1, M. Carmen Ojeda-Zacarías1*, Emilio Olivares-Sáenz1, Francisco Zavala-García1, Omar G. Alvarado-Gomez1, Leobardo Iracheta-Donjuan2
1 Universidad Autónoma de Nuevo León. Facultad de Agronomía. Unidad Marín, Carretera Zuazua-Marín km 17.5 del municipio de Marín, Nuevo León, México. * Autor responsable. (ojedacz@yahoo.com.mx).
2 Instituto Nacional Investigaciones Forestales, Agrícolas y Pecuarias, Campo Experimental Rosario Izapa, km 18 de la carretera Tapachula a Cacahoatán, 30870 Tuxtla Chico, Chiapas, México.
Recibido: julio, 2014.
Aprobado: junio, 2015.
Resumen
Jatropha curcas es una especie con potencial para elaborar biodiésel y el suministro de material elite para siembra es crítico debido a desventajas de propagación tradicional. El cultivo de tejidos vegetales es una alternativa para obtener material vegetal de calidad para siembra. Por lo tanto, el objetivo de este estudio fue evaluar la viabilidad de tres edades fenológicas de peciolo (1.er, 2.° y 3.er nudo), así como el efecto de la polivinilpirrolidona (PVP) sobre la viabilidad de explantes de los genotipos INI-3 e INI-6 de J. curcas y la expresión morfogénica de peciolos del genotipo INI-6 en dos medios de cultivos (Yasuda y MS) con diferentes dosis de TDZ, BA y AIB. El establecimiento in vitro evaluó la PVP en genotipos INI-3 y INI-6 con un diseño completamente al azar (DCA) con arreglo factorial 2x2 y 90 repeticiones por tratamiento. Las variables evaluadas fueron viabilidad y presencia de callo; la viabilidad se evaluó por prueba de Ji-cuadrada (X2) y el peso del callo por ANDEVA. En la etapa de inducción se analizaron dos medios de cultivo adicionados con TDZ, BA y AIB en explantes del genotipo INI-6 debido a su mayor viabilidad, en un DCA con arreglo factorial 2x2x2x3, tres repeticiones, donde la variable evaluada fue presencia de callo mediante un análisis de regresión logística (ARL). Los resultados mostraron que la viabilidad es independientes del genotipo, de acuerdo al valor de X2 (p=0.700), pero dependiente del tipo de peciolo (p=0.019) e incorporación de PVP (p=0.001). La presencia y producción de callo fueron influenciadas por el genotipo expresado en el X2 y peso de callo por un ANOVA. La etapa de inducción mostró que el AIB y TDZ están relacionados con la presencia de callo con base en el ARL.
Palabras clave: Euphorbiacea, cultivo de tejidos vegetales, peciolo, PVP, callo.
Abstract
Jatropha curcas is a species with a biodiesel production potential. The supply of elite planting material is critical due to traditional spread disadvantages. Plant tissue culture is an alternative to obtain quality plant material for planting. For these reasons, the objective of this study was to evaluate the feasibility of three phenological ages of petioles (1st, 2nd and 3rd node), and the effect of polyvinylpyrrolidone (PVP) on explants viability of the INI-3 and INI-6 genotypes of J. curcas and the petioles morphogenetic expression of the INI-6 genotype in two culture media (Yasuda and MS) with different doses of TDZ, BA and AIB. The in vitro establishment evaluated the PVP of the INI-3 and INI-6 genotypes with a completely randomized design (CRD) in a 2x2 factorial arrangement and 90 repetitions per treatment. The evaluated variables were viability and callus presence; viability was assessed with the Chi-square test (X2) and the callus weight by an ANOVA. During the induction stage, two media culture added with TDZ, BA and AIB were evaluated in the INI-6 genotype due to their increased viability, in a DCA with a 2x2x2x3 factorial arrangement. Three replications, where the evaluated variable was the callus presence, using a logistic regression analysis (LRA). The results show that the viability is independent from the genotype, according to the X2 value (p=0.700), but dependent of the petiole type (p=0.019) and PVP addition (p = 0.001). The presence and callus production were influenced by the genotype expressed in the X2 and callus weight by an ANOVA. The induction stage showed that the AIB and TDZ are related to the callus presence based on the LRA.
Keywords: Euphorbiacea, plant tissue culture, petiole, PVP, callus.
INTRODUCCIÓN
El cultivo in vitro de plantas o cultivo de tejidos vegetales se utiliza principalmente en estudios celulares y con fines de propagación clonal (Yesil-Celiktas y Vardar-Sukan, 2013), y es factor importante en cultivos agrícolas donde la calidad del material vegetal de siembra es un aspecto significativo en la producción (De Filippis, 2012). En cultivos agrícolas es importante usar material vegetal clonal, como en Jatropha curcas, porque el suministro de material elite para siembra es un problema crítico para transformar la especie en un cultivo viable (Jingura, 2012), debido a las desventajas de la propagación clonal mediante el uso de estacas (Sujatha et al., 2005; Brittaine y Lutaladio, 2010; Mukherjee et al., 2011; Tomar et al., 2014). Jatropha curcas es una especie que sobresale en la producción de semillas con 46 a 64 % de aceite (Martinez-Herrera et al., 2010), y con potencial para la elaboración de biodiésel (Ceasar y Ignacimuthu, 2011).
En las técnicas del cultivo in vitro se recomienda utilizar peciolos debido a su mayor resistencia a la variación genética (Pierik, 1991), y usar el medio de cultivo MS (Murashige y Skoog, 1962) porque estimula y mejora la respuesta de los tejidos de J. curcas, por lo cual es el más usado en estudios de regeneración de la especie (Ceasar y Ignacimuthu, 2011; Mukherjee et al. , 2011). La regeneración in vitro de J. curcas se realiza usando peciolos in vivo (Sujatha y Mukta, 1996; Kumar y Reddy, 2010) e in vitro (Kumar y Reddy, 2010) y peciolos cotiledónares in vivo e in vitro (Kumar et al., 2010; Kumar y Reddy, 2012). En J. curcas, Kumar y Reddy (2010, 2012) reportan una significativa respuesta de brotes adventicios, la cual es directamente proporcional a la concentración de TDZ empleado en el medio de cultivo con una concentración máxima de 9.08 μM. Sin embargo, en arce plateado (Acer saccharinum L.), dosis de 0.1 a 10 μM el TDZ produce excesivo crecimiento de callo y detención del desarrollo de brotes (Preece et al., 1991). Además dosis altas de TDZ (1000 μM) en fresno blanco (Fraxinus americana) pueden detener el crecimiento de callo y ser letales (Preece y Bates, 1992). El TDZ se usa para inducir la brotación adventicia y lateral en Cercis candensis, Fraxinus americana, Malus domestica, Theobroma cacao, Juglans nigra, y Prunus persica (Huetteman y Preece, 1993). Asimismo, J. curcas presenta la inducción de brotes mediante el uso de BAP en combinación con AIB (Sujatha y Mukta, 1996). No obstante, la mayoría de estos estudios fueron realizados con genotipos hindús de J. curcas y material proveniente de plántulas con rendimientos desconocidos, por lo cual se deben estudiar los factores que afectan la regeneración de J. curcas en genotipos mexicanos de alto rendimiento porque hay amplias variaciones genéticas entre genotipos (Basha y Sujatha, 2007), y la regeneración de esta especie es genotipo-dependiente (Kumar y Reddy, 2010; Mukherjee et al., 2011; Kumar y Reddy, 2012).
De igual importancia, el oscurecimiento de tejidos es una grave problemática en el cultivo in vitro de especies leñosas y en particular al evaluar tejidos maduros (De Filippis, 2014). Además, se usa PVP como enjuague al explante o incorporado al medio de cultivo para prevenir el oscurecimiento de tejidos (Krishna et al., 2008; Azofeifa, 2009), y se utiliza en la reducción de oscurecimiento en Abelmoschus esculentus (Ganesan et al. , 2007) y Mangifera indica (Chavan et al., 2000; Krishna et al., 2008). Asimismo, Varshney y Johnson (2010) reportan la regeneración vegetal hasta un 90 % en medios adicionados con PVP y ácido cítrico además de reguladores de crecimiento en J. curcas.
Por lo tanto, el objetivo de este estudio fue evaluar la viabilidad de tres edades fenológicas de peciolo (1.er, 2.° y 3.er nudo), el efecto de la polivinilpirrolidona sobre la viabilidad de explantes de los genotipos INI-3 e INI-6 de J. curcas y la expresión morfogénica de peciolos del genotipo INI-6 en dos medios de cultivos (Yasuda y MS) adicionados con diferentes dosis de reguladores de crecimiento (TDZ, BA y AIB).
MATERIALES Y MÉTODOS
Esta investigación se realizó en el Laboratorio de Biotecnología Vegetal de la Facultad de Agronomía, unidad Marín de la Universidad Autónoma de Nuevo León (UANL), ubicado en la carretera Zuazua-Marín km 17.5 del municipio de Marín, Nuevo León, México (25° 25' 27" N, 100° 03' 19" O, y 393 msnm), desde agosto del 2012 a marzo del 2014. El material vegetal fue recolectado de árboles adultos en producción de J. curcas de los genotipos INI-6 y INI-3, del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Campo Experimental Rosario Izapa, km 18 de la carretera Tapachula a Cacahoatán, 30870 Tuxtla Chico, Chiapas, México (14° 30' y 15° 00' N, 92° 00' y 92 30' O, y 435 msnm).
Técnica de desinfección del material vegetal
La predesinfección consistió en seleccionar material vegetal de peciolos de hojas en óptimas condiciones de árboles adultos en campo, del primer al tercer nudo tomando como referencia de la parte apical de la rama a la base de esta. Los peciolos fueron clasificados en 1.er, 2.° y 3.er nudo de edad fenológica, para determinar la capacidad de viabilidad del explante al agente desinfectante. Este material vegetal fue lavado con jabón líquido y agua potable, se transfirió a una solución antioxidante (sacarosa 30 g L-1 y ácido L-ascórbico 100 mg L-1) por 20 min, luego una inmersión en fungicida-bactericida compuesta de Amistar® (azoxistrobin 50 %) 1.0 g L-1, Bavistin® (carbendazim 50 %) 1.0 g L-1, Novobacter® (oxitetraciclina 5 %) 1.0 g L-1 por 20 min, finalizando con un enjuague de agua potable. La desinfección se realizó en una campana de flujo laminar mediante la inmersión de explantes en etanol al 70 %, por 30 s, seguido de la inmersión en hipoclorito de sodio al 3.24% (Cloralex®), adicionado con 0.1 % de tween-20, más tres enjuagues con agua bidestilada estéril.
Etapa de establecimiento aséptico de explantes
Para la siembra se utilizaron secciones de peciolo de 1.5 cm de longitud y establecidos en posición horizontal en medio basal MS más sacarosa 30 g L-1, glutatión reducido (Sigma) 25 mg L-1, ácido ascórbico (Sigma) 20 mg L-1, CuSO4 25 mg L-1, BA (Sigma) 3.0 mg L-1, Phytagel (Sigma) 4.5 g L-1, con o sin la adición de 500 mg L-1 de PVP (Sigma), como factor de estudio. El pH del medio de cultivo fue ajustado a 5.8±0.02 usando 1 N KOH o HCl y esterilizado previamente a 1.2 kg cm-2 de presión a 121 °C durante 20 min. Concluida la siembra las unidades experimentales fueron incubadas en condiciones controladas de 26± 2 °C en oscuridad por 15 d. El diseño experimental fue completamente al azar con un arreglo factorial 2x2: factor A, los genotipos INI-3 e INI-6; factor B, las dosis de PVP, testigo y 500 mg L- 1; con 90 repeticiones por tratamiento y un explante por unidad experimental.
Las diferencias estadísticas entre explantes viables fueron analizadas mediante una comparación múltiple de proporciones, la cual equivale a una comparación múltiple de medias por Tukey en un análisis de varianza de una vía (Zar, 2010). Las variables evaluadas en la etapa de establecimiento fueron: porcentaje de viabilidad, presencia de callo, peso fresco de callo y su relación con los factores genotipo y PVP. Las variables cualitativas fueron: viabilidad de explantes y presencia de callo, y fueron evaluadas mediante una prueba de Ji-cuadrada, mientras que la variable cuantitativa peso de callo se evaluó con un análisis de varianza. Los datos fueron analizados utilizando SPSS versión 20.
Inducción morfogénica en explantes cultivados in vitro
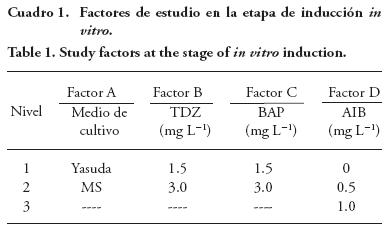
Los explantes viables sin presencia de callo del genotipo INI-6 fueron subcultivados en los medios básicos Yasuda (Yasuda et al., 1985) y MS enriquecidos 30 g L-1 de sacarosa y 4.5 g L-1 Phytagel™, más TDZ 1.5 y 3.0 mg L-1, BA 1.5 y 3.0 mg L-1 y AIB 0, 0.5 y 1.0 mg L-1. Sólo se usó el genotipo INI-6 por presentar el mayor porcentaje de explantes viables. El medio Yasuda se usó para evaluar la respuesta de tejidos in vitro de J. curcas sobre una presentación reducida en sales minerales en comparación con el medio MS. Los explantes fueron incubados a 26 ±2 °C y un fotoperiodo de 16 h luz con lámparas fluorescentes a una intensidad lumínica de 35-40 μmol m-2 s-1. El diseño experimental fue completamente al azar con un arreglo factorial 2x2x2x3, con 24 tratamientos y tres repeticiones, donde el factor A: medios de cultivo, factor B: niveles de TDZ, factor C: niveles de BAP, factor D: niveles de AIB (Cuadro 1). La unidad experimental fue frascos de vidrio (66 mm x 59 mm) con 15 mL de medio de cultivo conteniendo tres explantes por repetición. La variable presencia de callo fue evaluada con un análisis de regresión logística después de ocho semanas in vitro del cultivo.
RESULTADOS Y DISCUSIÓN
Etapa de establecimiento aséptico de explantes
Relación peciolo-viabilidad
Las frecuencias de explantes viables entre explantes de peciolos del 1.er, 2.° y 3.er nudo en base a la yema terminal presentaron una relación dependiente en el análisis de Ji-cuadrada, por lo cual se realizó una comparación múltiple de proporciones (CMP) que expresó que la mayor proporción de explantes viables se presentó en el segundo nudo con 93.33 %, seguido del primer nudo con 86.95 % de viabilidad, y el tercer nudo con 65.38 % (Figura 1). Estos resultados son similares a los publicados por Misra et al. (2010) en explantes de hojas de J. curcas donde los explantes del segundo nudo presentaron el mayor porcentaje de respuesta in vitro.

Letras distintas en las columnas de la figura muestran diferencias estadísticas significativas entre porcentajes (X2, p≤0.05). Las medidas se presentan con media ± error estándar. Los porcentajes fueron calculados a partir de las frecuencias de explantes viables.
Relación viabilidad-genotipo
El porcentaje de viabilidad de explantes presentó diferencia entre genotipos, mostrando un mayor porcentaje el genotipo INI-6 (40.2 y 82.3 %) en comparación con el genotipo INI-3 (30.4 y 70.9 %) en el testigo y 500 mg L-1 de PVP) (Cuadro 2). Con base en los resultados se realizó una tabla de contingencia con una prueba de Ji-cuadrada para determinar si la viabilidad es dependiente de los genotipos de estudio. El resultado fue que las variables estudiadas son independientes y no hay una relación significativa entre los genotipos y el porcentaje de viabilidad (Cuadro 3).


Relación viabilidad-PVP
Los porcentajes de viabilidad aumentaron en el tratamiento con PVP comparado con el tratamiento testigo (Cuadro 3), por lo cual se realizó una tabla de contingencia con una prueba de Ji-cuadrada para determinar si existe relación entre la viabilidad y la adición de PVP. El resultado fue una relación dependiente entre las variables (Cuadro 4), lo cual indica que la adición de PVP a medio de cultivo favorece las frecuencias de explantes viables en ambos genotipos.

Relación PVP-callo
La PVP se encuentra relacionada con la presencia de callo (Cuadro 3), por lo cual su incorporación al medio de establecimiento provocó la proliferación de callo en ambos genotipos de estudio (Cuadro 3). La presencia de callo blanco fue evidente a los 15 d de cultivo en las áreas de corte de peciolos, lo cual concuerda con lo publicado por Reustle y Natter (1994), quienes muestran que la aplicación de PVP en el inicio del cultivo es esencial para la formación de micro-callo en protoplastos de vid (Vitis sp.).
Relación callo-genotipo
Las frecuencias de explantes con presencia de callo difieren entre los genotipos de estudio y el resultado fue un porcentaje mayor de inducción de callo en el genotipo INI-3 (70.9 %), a diferencia del genotipo INI-6 (50.6 %), por lo cual se realizó una tabla de contingencia con una prueba de Ji-cuadrada para comprobar la relación entre genotipo e inducción de callo en explantes, y el resultado fue una relación dependiente (Cuadro 3). Lo anterior es similar a los resultados publicados por Kumar y Reddy (2010) quienes evaluaron peciolos y peciolos cotiledonares, y encontraron diferencias en el porcentaje de inducción de brotes entre genotipos de J. curcas.
Efecto de PVP sobre la producción de callo
La producción de callo fue diferente entre los genotipos de estudio a los 15 d de cultivo en medio de establecimiento con PVP. El peso fresco fue mayor en el genotipo INI-3 (90.3 mg) que en el genotipo INI-6 (39.4 mg) y mediante un análisis de varianza se encontró una diferencia significativa (p≤0.01) entre ellos (Cuadro 4). Estos resultados indican que tanto la inducción como la producción de callo fresco en J. curcas son influenciados por el genotipo, lo cual es similar a lo reportado por Basha y Sujatha (2007), quienes mencionan que la dependencia genotípica es uno de los factores más grandes que afectan la regeneración de J. curcas.
Inducción morfogénica en explantes cultivados in vitro
En esta etapa solamente los explantes asépticos del genotipo INI-6 fueron evaluados in vitro a las ocho semanas porque presentaron el mayor porcentaje de viabilidad, con una apariencia hinchada y en algunos tratamientos la presencia de callo (Cuadro 5), y solamente se pudo observar el desarrollo de protuberancias en explantes. Al realizar un análisis de regresión logística sobre las frecuencias de explantes con callo se encontró que los factores AIB y TDZ están relacionados estadísticamente con la variable callo (Cuadro 6), y las estimaciones del modelo se ajustan a un nivel aceptable con base en la prueba de Hosmer y Lemeshow. Además, la prueba de Omnibus sobre los coeficientes del modelo mostró que estos son estadísticamente diferente de cero (Cuadro 6).

Estos resultados son similares a los mencionados por Sujatha y Mukta (1996), quienes evaluaron explantes de hoja en J. curcas y muestran que la ausencia de AIB reduce significativamente la formación de callo. Según Basalma et al. (2008), hay capacidad conjunta del AIB y TDZ para la formación de callo en cártamo (Carthamus tinctorius L.), mientras que Landi y Mezzetti (2006) reportan 99.3 % de presencia de callo en hojas de diferentes especies de Fragaria en medios adicionados con 4.54 μM de TDZ y 0.98 μM de AIB. Khurana-Kaul et al. (2010) encontraron estructuras nodulares en explantes de hoja de J. curcas cultivados en matraces Erlenmeyer de 100 cm3 con medio MS adicionado con 0.90 μM de TDZ y 0.98 μM AIB; además, definen estas estructuras como posibles brotes no bien diferenciados.
CONCLUSIONES
El uso de la PVP en el medio de establecimiento aumentó la frecuencia de explantes viables con respecto al testigo en los genotipos INI-6 e INI-3, en tanto que el genotipo INI-6 presentó el mayor porcentaje de viabilidad en comparación al genotipo INI-3. La PVP en esta misma etapa indujo la producción de callo en ambos genotipos, y el genotipo INI-3 mostró un mayor porcentaje de explantes con callo respecto al genotipo INI-6. También la producción de callo es afectada por el genotipo porque el genotipo INI-3 produjo más callo por explante que el genotipo INI-6. Esta respuesta podría ser un método eficiente para aumentar la viabilidad de explantes e inducir la producción de callo en el establecimiento in vitro. En la etapa de inducción los factores AIB y TDZ afectan significativamente la presencia de callo en el genotipo INI-6 después de ocho semanas del cultivo in vitro, lo cual explica la importancia del manejo de estos reguladores de crecimiento en el control de la producción de callo en este genotipo de J. curcas.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) y al Programa de Apoyo a la Investigación Científica y Tecnológica de la Universidad Autónoma de Nuevo León (PAICYT-UANL) por el apoyo financiero para la realización de esta investigación. Al Laboratorio de Biotecnología Vegetal de la Facultad de Agronomía (unidad Marín) de la Universidad Autónoma de Nuevo león (UANL) por las facilidades y apoyos en infraestructura y equipo científico.
LITERATURA CITADA
Azofeifa A. 2009. Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agromeso 20: 153-175. [ Links ]
Basalma D., S. Uranbey, S. Mirici, and Ö. Kolsarici 2008. TDZ x IBA induced shoot regeneration from cotyledonary leaves and in vitro multiplication in safflower (Carthamus tinctorius L.). Afr. J. Biotechnol. 7: 960-966. [ Links ]
Basha, S. D., and M. Sujatha. 2007. Inter and intra-population variability of Jatropha curcas (L.) characterized by RAPD and ISSR markers and development of population-specific SCAR markers. Euphytica 156: 375-386. [ Links ]
Brittaine, R., and N. Lutaladio. 2010. Jatropha: A smallholder bioenergy crop. The potential for pro-poor development, integr crop manag. FAO. Rome, Italy. 96 p. [ Links ]
Ceasar, S. A., and S. Ignacimuthu. 2011. Applications of biotechnology and biochemical engineering for the improvement of Jatropha and biodiesel: A review. Renew. Sust. Energ. Rev. 15: 5176-5185. [ Links ]
Chavan S. S., S. S. Ranade, A. C. Deore, R. S. Deshpande and B. L. Dhonukshe 2000. Ann. Plant Physiol. 14: 178-181. [ Links ]
De Filippis, L. F. 2012. Breeding for biotic stress tolerance in plants. In: Ashraf M., M. Öztürk, M. S. A. Ahmad and A. Aksoy (eds). Crop Production for Agricultural Improvement. Springer Netherlands. pp: 145-200. [ Links ]
De Filippis L. F. 2014. Crop improvement through tissue culture. In: Ahmad P., Wani, M. R., Azooz, M. M. and Tran, L.-S. P.s (eds.). Improvement of crops in the era of climatic changes. Springer New York. pp: 289-346. [ Links ]
Ganesan M., R. Chandrasekar, B. D. Ranjitha Kumari and N. Jayabalan 2007. Somatic embryogenesis and plant regeneration of abelmoschus esculentus through suspension culture. Biol. Plant. 51: 414-420. [ Links ]
Huetteman C. A. and J. E. Preece 1993. Thidiazuron: A potent cytokinin for woody plant tissue culture. Plant Cell Tiss. Org. Cult. 33: 105-119. [ Links ]
Jingura, R. 2012. Socio-economy, agro-ecological zones, agronomic practices and farming system of Jatropha curcas L. In sub-saharan africa. In: Carels N., M. Sujatha, and B. Bahadur (eds). Jatropha, Challenges for a New Energy Crop. Springer New York. pp: 53-69. [ Links ]
Khurana-Kaul V., S. Kachhwaha and S. L. Kothari 2010. Direct shoot regeneration from leaf explants of Jatropha curcas in response to thidiazuron and high copper contents in the medium. Biol. Plant. 54: 369-372. [ Links ]
Krishna H., R. K. Sairam, S. K. Singh, V. B. Patel, R. R. Sharma, M. Grover, L. Nain and A. Sachdev 2008. Mango explant browning: Effect of ontogenic age, mycorrhization and pre-treatments. Sci. Hortic. 118: 132-138. [ Links ]
Kumar, N., and M. P. Reddy. 2010. Plant regeneration through the direct induction of shoot buds from petiole explants of Jatropha curcas: A biofuel plant. Ann. Appl. Biol. 156: 367-375. [ Links ]
Kumar, N., and M. P. Reddy. 2012. Thidiazuron (TDZ) induced plant regeneration from cotyledonary petiole explants of elite genotypes of Jatropha curcas: A candidate biodiesel plant. Ind. Crop. Prod. 39: 62-68. [ Links ]
Kumar, N., K. G. Vijay Anand, and M. P. Reddy. 2010. In vitro plant regeneration of non-toxic Jatropha curcas L.: Direct shoot organogenesis from cotyledonary petiole explants. J. Crop Sci. Biotechnol. 13: 189-194. [ Links ]
Landi L. and B. Mezzetti 2006. TDZ, auxin and genotype effects on leaf organogenesis in Fragaria. Plant Cell Rep. 25: 281-288. [ Links ]
Martinez-Herrera, J., A. L. Martinez-Ayala, H. Makkar, G. Francis, and K. Becker. 2010. Agroclimatic conditions, chemical and nutritional characterization of different provenances of Jatropha curcas L. From Mexico. Eur. J. Sci. Res. 3: 396-407. [ Links ]
Misra, P., N. Gupta, D. Toppo, V. Pandey, M. Mishra, and R. Tuli. 2010. Establishment of long-term proliferating shoot cultures of elite Jatropha curcas L. By controlling endophytic bacterial contamination. Plant Cell Tiss. Org. Cult. 100: 189-197. [ Links ]
Mukherjee, P., A. Varshney, T. S. Johnson and T. B. Jha. 2011. Jatropha curcas: A review on biotechnological status and challenges. Plant Biotechnol. Rep. 5: 197-215. [ Links ]
Murashige, T., and F. Skoog. 1962. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiol. Plant. 15: 473-497. [ Links ]
Pierik, R. L. M. 1991. Commercial aspects of micropropagation. In: Prakash, J., and R. L. M. Pierik (eds). Horticulture — New Technologies and Applications. Springer Netherlands. pp: 141-153. [ Links ]
Preece J. and S. Bates. 1992. In vitro studies with white ash (Fraxinus americana) nodules. In: Ahuja M. R.s (ed.). Woody plant biotechnology. Springer US. pp: 37-44. [ Links ]
Preece J. E., C. A. Huetteman, W. C. Ashby and P. L. Roth 1991. Micro-and cutting propagation of silver maple. I. Results with adult and juvenile propagules. J. Am. Soc. Hortic. Sci. 116: 142-148. [ Links ]
Reustle, G., and I. Natter. 1994. Effect of polyvinylpyrrolidone and activated charcoal on formation of microcallus from grapevine protoplasts (Vitis sp.). Vitis 33: 117-121. [ Links ]
Sujatha, M., H. P. S. Makkar, and K. Becker. 2005. Shoot bud proliferation from axillary nodes and leaf sections of non-toxic Jatropha curcas L. Plant Growth Regul. 47: 83-90. [ Links ]
Sujatha, M., and N. Mukta. 1996. Morphogenesis and plant regeneration from tissue cultures of Jatropha curcas. Plant Cell Tiss. Org. Cult. 44: 135-141. [ Links ]
Tomar, N. S., M. A. Ahanger and R. M. Agarwal. 2014. Jatropha curcas: An overview. In: Ahmad, P., and M. R.Wani (eds). Physiological Mechanisms and Adaptation Strategies in Plants under Changing Environment. Springer New York. pp: 361-383. [ Links ]
Varshney A. and T. S. Johnson 2010. Efficient plant regeneration from immature embryo cultures of Jatropha curcas, a biodiesel plant. Plant Biotechnol. Rep. 4: 139-148. [ Links ]
Yasuda, T., Y. Fujii, and T. Yamaguchi. 1985. Embryogenic callus induction from Coffea arabica leaf explants by benzyladenine. Plant Cell Physiol. 26: 595-597. [ Links ]
Yesil-Celiktas, O., and F. Vardar-Sukan. 2013. Downstream processes for plant cell and tissue culture. In: Chandra, S., H. Lata, and A. Varma (eds). Biotechnology for Medicinal Plants. Springer Berlin Heidelberg. pp: 1-27. [ Links ]
Zar, J. H. 1999. Biostatistical Analysis. 4 th. Ed. Prentice Hall, New Jersey. 944 p. [ Links ]














