Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agrociencia
versão On-line ISSN 2521-9766versão impressa ISSN 1405-3195
Agrociencia vol.49 no.1 Texcoco Jan./Fev. 2015
Ciencia de los alimentos
Efecto del tratamiento térmico en la humectación de películas comestibles de proteína aislada de suero de leche y goma de mezquite (Prosopis spp.)
Thermal treatment effect on wettability of edible films from whey protein isolated and mesquite (Prosopis spp.) gum
Martín R. Porras-Godínez1, Ruth Pedroza-Islas2*, Guadalupe Franco-Rodríguez3, Eduardo San Martín-Martínez1
1 Centro de Investigación en Ciencia Aplicada y Tecnología Avanzada del Instituto Politécnico Nacional. Legaria 694. Colonia Irrigación. 11500. D.F., México. (contacmart@hotmail.com, sanmartinedu@hotmail.com).
2 Universidad Iberoamericana. Paseo de la Reforma 880. Colonia Lomas de Santa Fe. 01219. D.F., México. * Autor responsable (ruth.pedroza@ibero.mx).
3 Facultad de Estudios Superiores Cuautitlán. Universidad Nacional Autónoma de México. Avenida 1° de Mayo s/n, Colonia Santa María las Torres. 54740. Cuautitlán Izcalli, Estado de México, México. (guadalupana_2@yahoo.com.mx).
Recibido: julio, 2014.
Aprobado: noviembre, 2014.
Resumen
Las películas y recubrimientos comestibles se usan para mejorar la calidad de los productos alimenticios al actuar como barrera contra gases, humedad y aromas, retardar las reacciones de deterioro y prolongar la vida útil de los alimentos. Para formar las películas se usan biopolímeros solos o mezclados, aprovechando las características de estos materiales y sus posibles interacciones en favor de mejores propiedades barrera. En este estudio se elaboraron películas compuestas de proteína aislada de suero de leche (WPI) y goma de mezquite (Prosopis spp.) (GM) y se evaluó el efecto del tratamiento térmico en la humectación, determinado por ángulo de contacto, las transiciones térmicas por calorimetría diferencial de barrido (DSC) y las interacciones proteína-polisacárido, por análisis de espectroscopia de infrarrojo (FT-IR). Los resultados indicaron que la desnaturalización térmica y el incremento de la proporción de GM en las películas redujeron las propiedades de humectación. La entalpia y la temperatura de fusión se incrementaron con el aumento de GM en las mezclas. Los espectros FT-IR confirmaron las interacciones proteína-polisacárido y proteína-proteína, por la modificación en las bandas de los grupos hidroxilo (-OH), de los enlaces C-H, C-O, C-C y de los grupos tiol (-SH). Los resultados de este estudio confirmaron el potencial de uso de mezclas de WPI y GM para obtener películas comestibles.
Palabras clave: Películas comestibles, proteína aislada de suero de leche goma de mezquite, humectación.
Abstract
Edible films and coatings are used to improve the quality of food products by acting as barriers against gases, moisture and aromas, delaying reactions of deterioration and prolonging the useful life of food. To form the films, biopolymers are used alone or mixed to take advantage of the characteristics of these materials and their possible interactions for better barrier properties. In this study, films made of protein isolated from whey (WPI) and mesquite (Prosopis spp.) gum (GM) were made, and the effect of heat treatment on their wettability was assessed. Determinations were contact angle, heat transitions by differential scanning calorimetry (DSC) and the interactions polysaccharide-protein by infrared spectroscopy (FT-IR). The results indicated that heat denaturalization and an increase in the proportion of GM in the films reduced humectation properties. Enthalpy and melting temperature increased with an increase of GM in the mixtures. The FT-IR spectra confirmed the interactions protein-polysaccharide and protein-protein, by the modifications in the bands of the hydroxyl group (-OH), in the C-H, C-O, C-C bonds, and in the thiol (-SH) groups. The results of this study confirmed the potential use of WPI and GM mixtures to obtain edible films.
Key words: Edible films, whey protein isolate, mesquite gum, humectation.
INTRODUCCIÓN
Las películas comestibles pueden aumentar la vida de anaquel de los alimentos y mejorar las características sensoriales, ya que actúan como una barrera contra la migración de nutrimentos, humedad y solutos e incluso pueden usarse para incorporar aditivos (Kim y Ustunol, 2001). Un interés adicional es la búsqueda para reducir la contaminación ambiental causada por materiales sintéticos empleados en envolturas altamente especializadas (Pereda et al., 2012), las que podrían ser sustituidas por películas comestibles y biodegradables.
Los materiales más empleados para obtener películas comestibles son las proteínas y los polisacáridos, por su capacidad de formar una matriz continua además de ser recursos naturales renovables y abundantes (Ghanbarzadeh et al., 2010; Vu et al., 2011). La proteína aislada del suero de leche (WPI) con un contenido de proteína mayor al 90 % es obtenida como el subproducto del procesamiento de los quesos, se usa con éxito como materia prima para la elaborar este tipo de películas, y ofrece una excelente barrera al oxígeno a humedades relativas bajas e intermedias y alta permeabilidad al vapor por su naturaleza hidrofílica (Pérez-Gago y Krochta, 2002).
La necesidad de mejorar las propiedades tecnológicas de películas basadas en un solo material como proteínas y polisacáridos ha generado el diseño de películas a partir de sus mezclas combinando las ventajas de cada material (Osés et al., 2009a). También se han evaluado los efectos de factores físicos (tratamiento térmico, pH, fuerza iónica) sobre las propiedades funcionales de las proteínas (Chanasattru et al., 2007). La incorporación de lípidos se evaluó en la formulación de películas para aumentar las propiedades de barrera a la humedad, pero las reacciones de oxidación limitan significativamente su empleo (Kim y Ustunol, 2001).
La goma de mezquite (GM) es un exudado natural producido por árboles de mezquite (Prosopis spp.); es una sal neutra de polisacárido ramificado de naturaleza ácida formado por un núcleo de residuos de β-D-galactosa y cadenas laterales de oligosacáridos (Pérez-Orozco et al., 2011), que contiene una fracción proteínica mayor a 6 % (Bosquez-Molina et al., 2003). La GM forma películas con buenas propiedades barrera al vapor de agua, cuando se combina con pequeñas proporciones de materiales lipídicos (Díaz-Sobac et al., 2002). Además puede mejorar la flexibilidad de las películas de WPI, proporcionando propiedades de menor esfuerzo y de mayor elongación a la ruptura, con potencial de uso como un plastificante (Osés et al., 2009a). Sin embargo, es importante evaluar otras características como la humectación ya que modifica las propiedades barrera de la película, por lo cual los objetivos del presente estudio fueron evaluar el efecto del tratamiento térmico sobre las propiedades de humectación y el comportamiento térmico de las películas a base de WPI-GM, así como la naturaleza de las interacciones proteína-polisacárido involucradas en la respuesta.
MATERIALES Y MÉTODOS
Reactivos y materiales
En la elaboración de las películas se usó WPI (Bi-Pro, contenido proteínico ≈90 %, Davisco Foods International, EE.UU.) y GM (Natural Products, México). Como plastificante se usó sorbitol (Panreac Química S.A., España).
Obtención de las dispersiones
Las dispersiones acuosas de WPI y GM se prepararon al 10 % (p/p) y se almacenaron a 5 °C por 24 h para su completa hidratación. Las dispersiones de WPI se calentaron mediante un baño con agitación a 90 °C por 20 min (Pérez-Gago y Krochta, 2002). Las dispersiones de GM se trataron a 80 °C por 15 min (Pérez-Orozco et al., 2011). Para muestras testigo se omitió el tratamiento térmico en las dispersiones de WPI y en las de GM. Como plastificante se usó sorbitol en 30 % (p/p con respecto a los hidrocoloides) y se incorporó en la dispersión de GM. Después se elaboraron mezclas de las dispersiones acuosas en las siguientes proporciones de WPI-GM: 91-9, 93-7, 95-5, 97-3, 99-1, con un agitador magnético por 10 min, a velocidad constante y se usó una bomba de vacío para eliminar las burbujas de aire. El pH de cada una de las dispersiones se determinó con un potenciómetro (Corning Instruments, EE.UU.).
Evaluación de potencial zeta (z)
Las dispersiones acuosas de WPI y GM fueron analizadas con un equipo Zetasiser Nano-ZS (Malvern Instruments, Worcestershire, UK) para determinar su potencial-z (García- Márquez et al., 2014). Las mediciones se realizaron por triplicado y a 25 °C.
Preparación de las películas
Doce g de solución WPI-GM se vertieron sobre placas niveladas de policloruro de vinilo, las cuales fueron acopladas con un anillo de 12 cm de diámetro para delimitar los bordes. Después la solución se secó 24 h a 20 °C. Las películas se acondicionaron a una humedad relativa de 50±1 % (Osés et al., 2009b).
Evaluación de las propiedades de humectación
El ángulo de contacto formado entre una gota de agua y una de las caras superficiales de las películas (la expuesta al aire de secado) se cuantificó con un goniómetro (TANTEC, EUA). La medición del ángulo de contacto aparente (Marmur, 2006) correspondió al método de la gota dispuesta (Kwok y Newman, 1999), donde una gota de agua desionizada (20 µL) se dejó caer a 5 mm de altura sobre la película colocada horizontalmente. Cada evaluación se realizó a 20±1 °C, por cuadruplicado.
Determinación del comportamiento térmico
Las determinaciones del comportamiento térmico de las películas WPI-GM se realizaron con un microcalorímetro diferencial de barrido (DSC) (Micro DSC 3.2 Setaram Scientific, EE.UU.). Las películas se trituraron, pesaron (aproximadamente 0.2 g por muestra) y se depositaron en celdas de acero inoxidable selladas herméticamente (Hatakeyama y Quinn, 2000). Las muestras se calentaron aplicando una rampa de calentamiento de 25 a 105 °C con 0.5 °C min-1. El microcalorímetro DSC se calibró con un estándar de Indio caracterizado por una temperatura de fusión de 156.6 °C y una entalpia asociada de 28.71 J g-1 (TA Instruments, New Castle, DE, EE.UU.) (Ramos et al., 2013). Una celda con alúmina (Al2O3) se usó como referencia. El software SETSOF (Setaram Scientific, EE.UU.) se empleó para obtener las transiciones térmicas: Temperatura onset (To), temperatura de fusión (Tf) y la entalpia de fusión (ΔHf). Cada evaluación fue realizada por duplicado.
Análisis de espectroscopia de infrarrojo
Los espectros de las películas se determinaron usando un espectrómetro de infrarrojos Cary 630 por Transformadas de Fourier (FT-IR, Agilent Technologies, EE.UU.) en modo de reflectancia total atenuada (ATR). El espectro FT-IR fue obtenido en un intervalo de longitud de onda de 600 a 4000 cm-1 usando 16 barridos a una resolución de 18 cm- 1. Tres réplicas por tratamiento fueron recolectadas, y para el análisis se seleccionaron cuatro regiones espectrales: 800-1150 para determinar la presencia de grupos C-C, C-O y C-H; 1600-1900 cm-1 para determinar la presencia de amidas primarias, secundarias; los grupos -SH se evaluaron entre 2200-1900 cm-1; y de 3000-3600 cm-1, por su relevancia para determinar grupos -OH (Barth, 2007).
Análisis estadístico de los resultados
El diseño experimental fue unifactorial, el factor fue la variación de concentración de WPI en relación a GM, y se mantuvo una concentración de 10 % (p/p) en la dispersión. Los tratamientos fueron cinco niveles de concentración (WPI-GM: 919, 93-7, 95-5, 97-3, 99-1). Los resultados se analizaron con un ANDEVA, se usó la distribución t de Student, y las medias de los tratamientos se compararon con la prueba de Tukey (p≤0.05) usando Minitab versión 16 para Windows (Minitab, Inc.).
RESULTADOS Y DISCUSIÓN
Tanto la WPI como la GM fueron compatibles en solución y pudieron mezclarse sin separación de fases aparente. Las películas obtenidas fueron translúcidas, flexibles (cuando se aplicó un tratamiento térmico), homogéneas sin que se detectaran poros o rupturas.
Las proteínas del WPI pueden formar redes tridimensionales que atrapan agua y otros componentes solubles (Chanasattru et al., 2007) y forman geles cuando son previamente calentadas para inducir el desdoblamiento molecular, lo cual permite la exposición de sus grupos sufhidrilo internos así como de los grupos hidrofóbicos. Este desdoblamiento da lugar a interacciones intermoleculares proteína-proteína (fuerzas entrópicas e interacciones dipolares y electrostáticas), las que junto con las reacciones de intercambio interacciones sulfhidrilo/disulfuro, están involucradas en la formación de las matrices que resultan en películas (Guckian et al., 2006).
Las películas obtenidas con las mezclas WPI-GM pudieron despegarse de las placas con facilidad pero aquellas sin tratamiento térmico, aunque contenían sorbitol como plastificante, fueron frágiles lo que requirió un manejo cuidadoso para el desprendimiento de la superficie de soporte y para las evaluaciones posteriores. Cuando proteínas globulares nativas son dispersas en agua a pH neutral, no se forman de una matriz estructural porque las fuerzas repulsivas intermoleculares son mayores que las atractivas (Byant y McClements, 1998).
Evaluación del potencial zeta
Las proteínas y polisacáridos en solución presentan una carga eléctrica generada por la presencia de grupos ionizables y las condiciones de la solución como pH, concentración y disponibilidad de contraiones. El potencial z o potencial eléctrico de superficie de mezclas de WPI y GM en diferente proporción se presenta en el Cuadro 1; las temperaturas de 20 y 90 °C corresponden a las condiciones de tratamiento térmico de la solución polimérica.
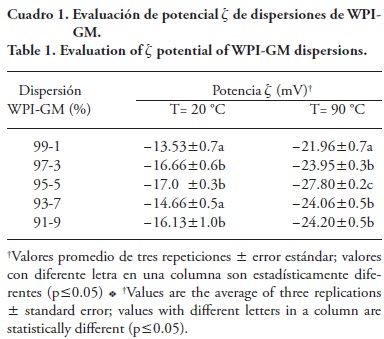
Según Loveday et al. (2014), la estabilización de agregados de hidrocoloides con proteínas como la WPI con polisacáridos ocurre principalmente por interacciones electrostáticas. Estas interacciones son afectadas por la proporción entre biopolímeros, el pH y el punto isoeléctrico (pI) y modifican el potencial z. El tratamiento térmico a 90 °C de WPI aumentó la carga neta de todas las mezclas por el desdoblamiento de las cadenas proteínicas y la exposición de sus residuos ácidos (Cuadro 1), los que a pH>pI están ionizados; también quedan expuestos otros sitios reactivos (aminoácidos) lo que aumenta las probabilidades de interacciones con los polisacáridos. En estos últimos, también ocurre una ionización de los grupos ácidos que adquieren carga negativa (—COO-) (Cuadro 1). La interacción entre polisacáridos aniónicos con proteínas aniónicas (pH> pI) ocurre por las interacciones entre los sitios reactivos aniónicos de los polisacáridos y los pocos sitios reactivos catiónicos de las proteínas, formando agregados aniónicos proteína-polisacárido, donde la proporción del polisacárido tiene una función relevante en la solubilidad de los agregados (Tolstoguzov, 2006). En ambos casos, con o sin tratamiento térmico se obtuvo un valor máximo negativo para la mezcla WPI-GM 95-5. Cabe mencionar que el pH de las dispersiones WPI-GM se mantuvo en un intervalo de 6.86 a 6.70, donde el aumento en la proporción de GM en la mezcla disminuyó progresivamente este parámetro. Para las dispersiones acuosas de los biopolímeros estudiados, se encontró que al calentar la de GM (80 °C/15 min) el pH pasó de 5.3 a 4.8 y el potencial z de -15.23 mV a -17.1 mV, mientras que para la dispersión de WPI los valores de pH variaron de 6.8 a 6.6 (90 °C/20 min), y los del potencial 2 fueron de -15.80 mV a -28.33 mV, respectivamente, coincidiendo con lo encontrado por Kováčová et al. (2009) y Klein et al., (2010) en dispersiones de WPI.
Humectación de las películas experimentales
La medición del ángulo de contacto, el cual se refiere al ángulo formado entre la gota de agua depositada y la película, y los datos obtenidos, son indicadores directos de la capacidad de humectación de una superficie (Carneiro-da-Cunha et al., 2009; Kokoska et al., 2010); también puede interpretarse como el grado de hidrofobicidad del material de contacto. Los resultados obtenidos para el parámetro de humectación de las películas elaboradas con WPI-GM se muestran en el Cuadro 2.
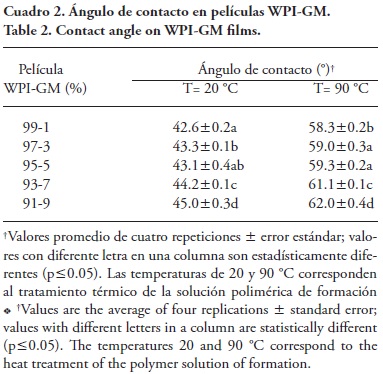
Existe una diferencia en la humectación por efecto del tratamiento térmico de las soluciones, es decir, la exposición al calor disminuyó la humectación de la película. Esto coincide con lo observado por Guckian et al. (2006) de que las películas de WPI sin tratamiento térmico son solubles, mientras que al aplicar calor a las soluciones de WPI se obtienen películas insolubles.
Al calentar las proteínas del suero lácteo a 80 °C a pH neutral, ocurre un desdoblamiento de la estructura globular exponiendo los grupos libres tiol (—SH) reactivos, y la desnaturalización puede ser completada en 12.5 min de exposición al calor (Baier et al., 2004). Generalmente las películas con valores altos de ángulo de contacto exhiben una alta concentración de grupos hidrófobos en la superficie, lo cual aumenta sus propiedades barrera contra la humedad (Tang y Jiang, 2007) y reduce su humectación. Además, la concentración de GM en las películas afectó su humectación y a mayor concentración, mayor ángulo de contacto (Cuadro 2).
Las condiciones del medio acuoso pueden intervenir en la naturaleza e intensidad de las interacciones entre las proteínas y los polisacáridos, por ejemplo, a baja fuerza iónica y pH neutral, tanto la WPI (Kováčová et al., 2009) como la GM (Pérez-Orozco et al., 2011) se encuentran cargados negativamente y permanecen cosolubilizados en el medio acuoso. Incluso, en valores cercanos al punto isoeléctrico de las proteínas, es posible que se formen complejos proteína-polisacárido debido a la interacción electrostática (Jones y McClements, 2011), lo cual puede resultar en cambios de las propiedades hidrofóbicas, como se observó al aumentar la concentración de GM en las películas. El tratamiento térmico genera la pérdida de la estructura terciaria exponiendo los aminoácidos que se encontraban en capas interiores, y además favorece la interacción entre proteína-proteína (Pérez-Gago y Krochta, 2001) y proteína-polisacárido al desnaturalizar la fracción proteínica de GM (Osés et al., 2009a), obteniendo estructuras con menor solubilidad.
Determinación del comportamiento térmico
El efecto del tratamiento con calor de las soluciones de WPI-GM sobre las propiedades térmicas de las películas experimentales fue analizado por medio de calorimetría diferencial de barrido (DSC, siglas en inglés). Un termograma DSC de las películas a base de WPI-GM en proporción 95-5, con dos diferentes temperaturas de tratamiento, se presenta en la Figura 1.
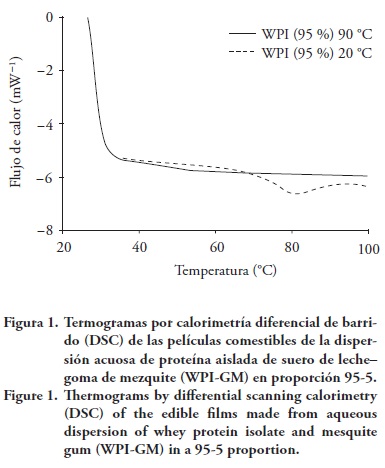
Fioramonti et al. (2014) reportan que sobre 85 °C ya no se observan transiciones debido al tratamiento térmico por ocurrir una desnaturalización completa de las proteínas de WPI. También puede inferirse que la presencia del sorbitol en las películas fue compatible con los polímeros de prueba, ya que solo se presentó un pico endotérmico. Si algunos de los dos biopolímeros (WPI o GM) fuera inmiscible con el plastificante, la mezcla podría exhibir más de un pico correspondiente a las fases no mezcladas (Ramos et al., 2013).
Las películas elaboradas sin tratamiento térmico (a temperatura ambiente, 20 °C) mostraron una transición térmica correspondiente a una temperatura de fusión (Tf) de 81 ±0.2 °C. La temperatura de desnaturalización de WPI es alrededor de 73 °C (Fioraminti et al., 2014), de tal manera que la presencia del polisacárido modifica ese parámetro, lo cual coincide con los resultados de este estudio (Cuadro 3).
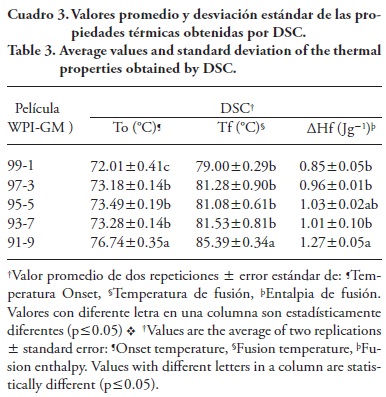
Estos resultados son semejantes a lo reportado por Noisuwan et al. (2008), quienes encontraron una Tf de 79 °C en mezclas de WPI y almidón de arroz, mientras que las películas elaboradas después de calentar la solución de WPI (90 °C por 20 min) no mostraron cambios de transición de fase.
La presencia de polisacáridos a bajas concentraciones (2% p/v) en mezclas de WPI con pectina y goma guar no modificaron la estabilidad térmica de la proteína; sin embargo, concentraciones mayores de polisacáridos, como las usadas para GM en el presente estudio, afectaron las propiedades térmicas de la proteína (Ibanoglu, 2005). El aumento en la concentración de GM en las películas, tendió a aumentar los valores de ΔHf (Cuadro 3), lo cual puede significar una mayor estabilidad térmica de las películas. Esta modificación probablemente se debe a la interacción electrostática entre las fracciones de proteína (WPI) cargadas positivamente y los grupos —COO- del polisacárido (GM), aumentando la contribución entálpica (Noisuwan et al., 2008) o bien a un incremento en las interacciones proteína-proteína (Ramos et al., 2013). Según Sobral et al. (2011), decrementos en To y Tf podrían reflejar un aumento en el volumen libre en la red que integra la estructura de la película y en la movilidad de los segmentos de las cadenas poliméricas que la componen. Como se observa en el Cuadro 3, ambos parámetros aumentaron y pudo ocurrir una mayor interacción entre los biopolímeros a medida que la proporción de GM aumentó en la mezcla.
Análisis FT-IR
La espectroscopia de infrarrojo FT-IR es una técnica usada para estudiar sistemas a base de hidrocoloides ya que hay regiones fácilmente identificables en el espectro del infrarrojo medio, donde la absorción de proteína (Wang et al., 2013) y polisacárido (Espinosa-Andrews et al., 2010) se registra de manera diferente. El espectro FT-IR en la región de 600 a 3600 cm-1 (Figura 2) se empleó para analizar el efecto del tratamiento térmico sobre las modificaciones estructurales de las películas a base de WPI-GM, y se eligió la concentración 95-5 para esta evaluación.
Las características más importantes en un espectro que involucre proteínas son los picos localizados en la región de 1650 y 1540 cm-1 que corresponden a las bandas de amida I y amida II respectivamente (Wang et al., 2013). Para los hidratos de carbono puede localizarse una serie de picos superpuestos en la región de 1180-953 cm- 1 resultantes de la vibración de enlaces tipo C—C, C—O y C—H (Wang et al., 2013). Se observa una modificación en la banda de absorción 1100 cm- 1 donde las películas sin tratamiento térmico exhibieron una proporción alta de estas estructuras, en contraste con otras películas con tratamiento térmico donde se reducen de forma notable probablemente debido a la interacción del polisacárido con las proteínas inducido por la desnaturalización térmica (Figura 2). También se observa una ligera disminución en la banda 1420 cm-1 que corresponde a los grupos simétricos de —COO- de los ácidos glucurónicos de la GM (López-Franco et al., 2008) probablemente por interacción con los grupos (—NH3+) de aminoácidos como lisina, arginina e histidina que se presentan en forma ionizada alrededor de pH 7.0.
Barth (2007) indica que la región de 2551 cm-1 a 1849 cm-1 corresponde a las vibraciones de los grupos tiol (—SH) presentes en la cisteína, en ese sentido se observa una disminución en el intervalo correspondiente, para la muestra tratada a 90 °C (Figura 2) y esta disminución se podría relacionar con la formación de enlaces disulfuro (S—S) en películas con tratamiento térmico. De acuerdo con Pérez-Gago y Krochta (2001), la degradación de la estructura nativa de las proteínas ocasionada por tratamiento térmico, expone los grupos —SH originalmente ocultos dentro de la macromolécula permitiendo la formación de enlaces covalente intermoleculares (S—S), explicable en películas con mayor resistencia al vapor de agua.
En la región entre 3000 y 3600 cm-1, correspondiente a las vibraciones de enlaces tipo —OH, disminuyó la intensidad de la banda 3330 cm-1 característica de polisacáridos (López-Franco et al., 2008; Espinosa-Andrews et al., 2010), en la película con tratamiento térmico, sugiriendo que estos grupos interactúan con la WPI. Por tanto, los datos obtenidos de un análisis FTIR indican que la desnaturalización térmica modifica la estructura de WPI, lo cual coincide con estudios de Zhang y Zhong (2012) y Qian et al., (2014).
CONCLUSIONES
El tratamiento térmico de las dispersiones de hidrocoloides modificó el potencial eléctrico de superficie, aumentando la carga neta para todas las proporciones proteína-polisacárido. El tratamiento térmico de la WPI influyó en la humectación de la superficie de las películas, asimismo por la proporción de GM en la mezcla.
A través de un análisis DSC se encontró que el valor de ΔHf de las películas obtenidas con dispersiones acuosas de WPI-GM tratadas térmicamente, se incrementó a medida que aumentó la concentración de GM en la mezcla.
La caracterización por espectroscopia de infrarrojo (FT-IR) proporcionó información para la comprensión del efecto del tratamiento térmico en las interacciones proteína-proteína y proteína-polisacárido, a través de la modificación en bandas de absorción de grupos funcionales relacionados con la humectación de las películas comestibles.
De acuerdo con este estudio, es posible reducir la humectación de las películas comestibles a partir de WPI-GM por efecto del tratamiento térmico y la proporción de polisacárido.
AGRADECIMIENTOS
Porras-Godínez, agradece al CONACyT-México por el apoyo otorgado a esta investigación.
LITERATURA CITADA
Barth, A. 2007. Infrared spectroscopy of proteins. Biochim Biophys Acta. 1767: 1073-1101. [ Links ]
Baier, S. K., E. A. Decker, and D. J. McClements. 2004. Impact of glycerol on thermostability and heat-induced gelation of bovine serum albumin. Food Hydrocolloid. 18: 91-100. [ Links ]
Bosquez-Molina, E., I. Guerrero-Legarreta, and E. J. Vernon-Carter. 2003. Moisture barrier properties and morphology of mesquite gum-candelilla wax based edible emulsion coatings. Food Res Int. 36: 885-893. [ Links ]
Byant, C. M., and D. J McClements. 1998. Molecular basis of protein functionality with special consideration of cold-set gels derived from heat-denatured whey. Trends Food Sci. Tech. 9: 143-151. [ Links ]
Carneiro-da-Cunha, M. G., M. A. Cerqueira, B. W. S. Souza., M. P. Souza, J. A. Teixeira, and A. A. Vicente. 2009. Physical properties of edible coatings and films made with a polysaccharide from Anacardium occidentale. J. Food Eng. 95: 379-85. [ Links ]
Chanasattru, W., E. A. Decker, and D. J. McClements. 2007. Modulation of thermal stability and heat-induced gelation of β—lactoglobulin by high glycerol and sorbitol levels. Food Chem. 103: 512-520. [ Links ]
Díaz-Sobac, R., H. García, C. I. Beristain, and E. J. Vernon-Carter. 2002. Morphology and water vapor permeability of emulsion films based on mesquite gum. J. Food Process Pres. 29: 129-141. [ Links ]
Espinosa-Andrews H., O. Sandoval-Castilla, H. Vázquez-Torres, E. J. Vernon-Carter, C. Lobato-Calleros. 2010. Determination of the gum arabicchitosan interactions by Fourier Transform Infrared Spectroscopy and characterization of the microstructure and rheological features of their coacervates. Carbohyd Polym. 79: 541-546. [ Links ]
Fioramonti, S. A., A. A. Perez, E. E. Aríngoli, and A. C. Rubiolo. 2014. Design and characterization of soluble biopolymer complexes produced by electrostatic self-assembly of a whey protein isolate and sodium alginate. Food Hydrocolloid. 35: 129-136. [ Links ]
García-Márquez, E., A. Román- Guerrero, F. Cruz-Sosa, C. Lobato-Calleros, J. Álvarez-Ramírez, E. J. Vernon-Carter, and H. Espinosa-Andrews. 2014. Effect of layer (calcium phosphate-chitosan)-by-layer (mesquite gum) matrix on carotenoids-in-water-emulsion properties. Food Hydrocolloid. in press.1-8.
Ghanbarzadeh, B., H. Almasi, and A. A. Entezami. 2010. Physical properties of edible modified starch/carboxymethyl cellulose films. Innov Food Sci Emerg Tech. 11: 697-702. [ Links ]
Guckian, S., C. Dwyer, M. O'Sullivan, E. D. O'Riordan, and F. J. Monahan. 2006. Properties of and mechanisms of protein interactions in films formed from different proportions of heated and unheated whey protein solutions. Eur Food Res Technol. 223: 91-95. [ Links ]
Hatakeyama, T., and F.X. Quinn. 2000. Thermal analysis fundamentals and applications to polymer science. Second edition. John Wiley & Sons. Baffins Lane, Chichester. pp: 45-65. [ Links ]
Ibanoglu, E. 2005. Effect of hydrocolloids on the thermal denaturation of proteins. Food Chem. 90: 621-626. [ Links ]
Jones, O. G., and D. J. McClements. 2011. Recent progress in biopolymer nanoparticle and microparticle formation by heat-treatment electrostatic protein-polysaccharide complexes. Adv Colloid Interfac. 167: 49-62. [ Links ]
Kim, S.J., and Ustunol, Z. 2001. Solubility and moisture sorption isotherms of whey protein-based edible films as influenced by lipid and plasticizer incorporation. J. Agric Food Chem. 49: 4388-4391. [ Links ]
Klein M., A. Aserin, P. Ben Ishai, N. Garti. 2010. Interactions between whey protein isolate and gum arabic. Colloid Surfac B: Biointerfac. 79: 377-383. [ Links ]
Kokoska, S., F. Debeaufort, A. Lenart, and A. Voilley. 2010. Water vapor permeability, thermal and wetting properties isolate based edible films. Int Dairy J. 20: 53-60. [ Links ]
Kováčová, R., A. Synytsya and J. Štětina. 2009. Characterisation of whey proteins-pectin interaction in relation to emulsifying properties of whey proteins. Czech J. Food Sci. 27: 4-8. [ Links ]
Kwok, D. Y., and A. W. Neumann. 1999. Contac angle measurement and contact angle interpretation. Adv Colloid Interfac. 81: 167-249. [ Links ]
López-Franco Y. L., A. M. Calderón de la Barca, M. A. Valdez, M. G. Peter, M. Rinaudo, G. Chambat, and F. M. Goycoolea. 2008. Structural characterization of Mesquite (Prosopis velutina) gum and its fractions. Macromol Biosci. 8: 749-757. [ Links ]
Loveday, S. M., A. Ye, S. G. Anema, and H. Singh. 2014. Tuning heat-induced colloidal aggregation of whey proteins, sodium caseinate and gum arabic: Effect of protein composition, preheating and gum arabic level. Food Res Int. 62: 128-136. [ Links ]
Marmur, A. 2006. Measurement and interpretation of contact angles. Soft Matter. 2: 12-17. [ Links ]
Noisuwan, A., J. Bronlund, B. Wilkinson, and Y. Hemar. 2008. Effect of milk protein products on the rheological and thermal (DSC) properties of normal rice starch and waxy rice starch. Food Hydrocolloid. 22: 174-183. [ Links ]
Osés, J., M. Fabregat-Vázquez, R. Pedroza-Islas, S. A. Tomás, A. Cruz-Orea, and J. I. Maté. 2009a. Development and characterization of composite edible films based on whey protein isolate and mesquite gum. J. Food Eng. 92: 56-62. [ Links ]
Osés, J., I. Fernández-Pan, M. Mendoza, and J. I. Maté. 2009b. Stability of the mechanical properties of edible films base on whey protein isolate during storage at different relative humidity. Food Hydrocolloid. 23: 125-131. [ Links ]
Pereda, M., G. Amica, and N. E. Marcovich. 2012. Development and characterization of edible chitosan/olive oil emulsion films. Carbohyd Polym. 87: 1318-1325. [ Links ]
Pérez-Gago, M. B., and J. M. Krochta. 2001. Denaturation time and temperature effects on solubility, tensile properties, and oxygen permeability of whey protein edible films. J. Food Sci. 66: 705-710. [ Links ]
Pérez-Gago, M. B., and J. M. Krochta. 2002. Formation and properties of whey protein films and coatings. In: Protein-Based Films and Coatings. Aristippos Gennadios (ed.) B. Raton, FL. February 7, 2002, Ed. CRC Press. pp: 159-180. [ Links ]
Pérez-Orozco, J. P., E. Barrios-Salgado, A. Román-Guerrero, and R. Pedroza-Islas. 2011. Interacción goma de mezquite-quitosano en la interfase y su influencia en la estabilidad de emulsiones múltiples W1/O/W2. Rev Mex Ing Quim. 10: 487-99. [ Links ]
Qian, L., K. Baohua, H. Jianchun, S. Changyan, and L. Peijun. 2014. Structure and antioxidant activity whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions. Food Struct. 1: 145-154. [ Links ]
Ramos, O. L., I. Reinas, S. I. Silva, J. C. Fernandes, M. A. Cerqueira, R. N. Pereira, A. A. Vicente, M. F. Poças, M. E. Pintado, and F. X. Malcata. 2013. Effect of whey protein purity and glycerol content upon physical properties of edible films manufactured therefrom. Food Hydrocolloid. 30: 110-122. [ Links ]
Sobral, P. J., R. A. de Carvalho, I.C. Freitas M., A. M. Q. Barbosa B., and E. S. Monterrey-Quintero. 2011. Phase transitions in biodegradable films based on blends of gelatin and poly (vinyl alcohol). Ciencia Tecnol Alim. 31: 372-379. [ Links ]
Tang, C.H., and Y. Jiang. 2007. Modulation of mechanical and surface hydrophobic properties of food protein films by transglutaminase treatment. Food Res Int. 40: 504-509. [ Links ]
Tolstoguzov, V. 2006. Phase behavior in mixed polysaccharide systems. In. Food polysaccharides and their applications. A. M. Stephen, G. O. Phillips, P.A. Williams. 2nd. Ed. ed. CRC Press, Taylor and Francis group. Boca Raton, FL. pp: 589-627. [ Links ]
Vu, K. D., R. G. Hollingsworth, E. Leroux, S. Salmieri, and M. Lacroix. 2011. Development of edible bioactive coating based on modified chitosan for increasing the shelf life of strawberries. Food Res Int. 44: 198-203. [ Links ]
Wang, W., Y. Bao, and Y. Chen. 2013. Characteristics and antioxidant activity of water-soluble Maillard reaction products from interaction in a whey protein isolate and sugar system. Food Chem. 139: 355-361. [ Links ]
Zhang Y., and Q. Zhong. 2012. Effects of thermal denaturation on binding between bixin and whey protein. J. Agric Food Chem. 60: 7526-7531. [ Links ]














