Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.47 no.3 Texcoco abr./may. 2013
Protección vegetal
Evaluación de aislados nativos mexicanos de Beauveria bassiana (Bals.) Vuill. (Hypocreales: Cordycipitaceae) provenientes de zonas citrícolas para su producción masiva en cultivo sumergido y bifásico
Evaluation of Mexican native isolates of Beauveria bassiana (Bals.) Vuill. (Hypocreales: Cordycipitaceae) from citrus-growing areas of mass production in submerged and biphasic culture
F. Lizeth Gandarilla-Pacheco, Luis J. Galán-Wong, Katiushka Arévalo-Niño, Myriam Elías-Santos, Isela Quintero-Zapata*
Instituto de Biotecnología, Facultad de Ciencias Biológicas. Universidad Autónoma de Nuevo León. 66450. San Nicolás de los Garza, N. L. México. * Autor responsable. (isela.quintero@uanl.edu.mx).
Recibido: octubre, 2012.
Aprobado: febrero, 2013.
Resumen
La comprensión de los aspectos básicos del desarrollo de los hongos entomopatógenos y el conocimiento detallado de los requerimientos nutricionales para su crecimiento y esporulación es esencial para la producción masiva y comercialización. El objetivo de este estudio fue evaluar la producción de blastoesporas en un medio de cultivo sumergido y de conidios en un cultivo bifásico, de cuatro aislados nativos y una cepa de B. bassiana con potencial para controlar Diaphorina citri (Hemiptera: Liviidae), pertenecientes a la colección del Instituto de Biotecnología, FCB-UANL, México. El diseño experimental fue completamente al azar y las medias se compararon con la prueba Tukey (p≤0.05). En el medio de cultivo líquido formulado con glucosa y casaminoácidos, la producción de blastoesporas a las 72 h mostró para la cepa GHA la mayor (p≤0.05) concentración (2.20x108 mL-1) y una biomasa de 26 g L-1, y en el aislado HIB-4 ocurrió la producción menor (p≤0.05) de blastoesporas (5.25x107 m L-1) y biomasa de 7 g L-1. El aislado HIB-2 presentó 56 % de germinación en tierra de diatomeas como soporte y fue el valor mayor entre los hongos estudiados. En la fase sólida (grano de arroz), a los 14 d de incubación, el aislado HIB-4 presentó una producción de 1.82x109 conidios g-1 y la cepa GHA produjo 2.35x108 conidios g-1. La viabilidad fue superior a 90 % para todos los hongos durante 4 semanas de almacenamiento a 4 °C. Así, es factible producir blastoesporas y conidios de aislados nativos de B. bassiana con potencial para el manejo de plagas que afectan las regiones citrícolas de México.
Palabras clave: hongos entomopatógenos, conidios, blastoesporas, cultivo sumergido, bifásico.
Abstract
Comprehension of the basic aspects of entomopathogenic fungi development and detailed knowledge of nutritious requirements for their growth and sporulation are fundamental for mass production and commercialization. The objective of this study was to evaluate the production of blastospores in submerged culture medium and of conidia in biphasic culture of four native isolates and a B. bassiana strain showing potential for the control of Diaphorina citri (Hemiptera: Liviidae), which belong to the collection of the FCB-UANL Institute of Biotechnology, México. The experimental design was completely randomized and means were compared using Tukey test (p≤0.05). In the liquid culture medium formulated with glucose and casamino acids, at 72 h, blastospore production had the highest (p≤0.05) concentration for GHA strain (2.20x10-8 mL-1) and biomass of 26 gL- 1, while the HIB-4 isolate showed the lowest blastospore production (p≤ 0.05) (5.25x107 m L-1) and biomass of 7 g L-1. Isolate HIB-2 had 56 % germination in diatomaceous earth for support, being the highest value among the studied fungi. In solid hase (rice grain), at 14 d of incubation, HIB-4 isolate presented a production of 1.82x109 conidia g-1, and GHA strain producted was 2.35x108 conidia g-1. Viability was higher than 90 % for all fungi during 4 weeks of storing at 4 °C. Thus, it is feasible produce blastospores and conidia of native isolates of B. bassiana with the potential of controlling pests which affect the citrus-growing regions of México.
Key words: entomopathogenic fungi, conidia, blastospores, submerged culture, biphasic.
INTRODUCCIÓN
En México hay una variedad amplia de cultivos con importancia económica y atacados por insectos diferentes que provocan anualmente pérdidas considerables. Los cítricos son atacados por al menos 74 especies de artrópodos perjudiciales (López-Arroyo et al., 2004), como Diaphorina citri el vector del Huanglongbing. Esta enfermedad es una de las más devastadoras de los cítricos, afecta la calidad de los frutos para consumo humano e incluso puede causar pérdida total de áreas cultivadas (SENASICA, 2012) (Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria; http://www.senasica.gob.mx).
Una alternativa para la problemática de las plagas de cítricos y el uso desmedido de plaguicidas, es el control biológico aplicado exitosamente contra plagas en el país (Rodríguez y Arredondo, 2007). En la citricultura hay diversas plagas en las cuales se puede aplicar agentes de control biológico. Los entomopatógenos son un grupo con potencial para el manejo de plagas y entre los más destacados está Beauveria bassiana por su capacidad de infectar más de 200 especies en nueve órdenes de insectos y ser la especie más ampliamente distribuida de su género en el mundo (Zimmermann, 2007). Algunos productos registrados y comercializados son BotaniGard®, BeaSin® o Naturalis®-L y otros están en desarrollo (de Faria y Wraight, 2007).
Un factor clave en la selección de nuevos aislados como agentes potenciales para control biológico, específicamente en hongos entomopatógenos, es la capacidad de producción en grandes cantidades (i.e., altas tasas de esporulación), crecimiento rápido y mantener su viabilidad e infectividad (Feng et al., 1994). Pero una limitante para lograr estos objetivos son el medio y el método de cultivo ya que la elección de ambos parámetros depende en gran medida de las especies fúngicas a usar y el tipo de propágulo requerido para la formulación y el método de aplicación (Derakhshan et al., 2008). La mayoría de las especies de hongos puede producirse fácilmente en medios sólidos, donde el hongo crece en forma de micelio superficial y produce conidios en hifas aéreas; algunos sustratos naturales son medios de cultivo adecuados, como arroz o salvado de trigo. Pero la producción de hongos en sustratos sólidos dificulta la automatización del proceso y carece de una economía de escala satisfactoria. Además, pocas especies de entomopatógenos pueden producir conidios en cultivo sumergido. Esta dificultad puede ser parcialmente resuelta en cultivo bifásico, en el cual el o los cultivos sumergidos se usan para producir abundante micelio que luego se transfieren a un sustrato sólido para inducir la producción de conidios aéreos (Wraight et al. , 2001). La mayoría de los sistemas de producción industrial de hongos usan este tipo de cultivo de dos etapas. Específicamente, B. bassiana fue desarrollado en cultivo sólido (Kamp y Bidochka, 2002), cultivo líquido o sumergido (Leckie et al., 2008) y en una variedad amplia de sustratos naturales (Rajanikanth, et al., 2011). La investigación de las condiciones nutricionales de los hongos entomopatógenos es importante para mejorar la producción en masa y acelerar la comercialización de plaguicidas biológicos potenciales (Sun y Liu, 2006), así como la selección de cepas o aislados nativos e ingredientes industrializados de costo bajo en el mercado. También debe conocer la habilidad de aislados nativos de hongos entomopatógenos para producir propágulos en diferentes condiciones nutricionales. Cuatro aislados nativos de B. bassiana mostraron potencial para el control de D. citri (Gandarilla-Pacheco et al., 2011). Por tanto el objetivo del presente estudio fue evaluar su producción de blastoesporas y conidios, en un medio de cultivo líquido con glucosa y casaminoácidos y en un medio de cultivo bifásico con grano de arroz como sustrato, respectivamente.
MATERIALES Y MÉTODOS
Microorganismos
Los aislados de B. bassiana fueron obtenidos de suelos de la región citrícola del municipio de Ahome, estado de Sinaloa, México, 10 msnm. El método para el aislamiento de los diferentes hongos entomopatógenos fue descrito por Galán-Franco et al (2011). Los cultivos madre (i.e. stock) se depositaron en la colección del laboratorio L6 del Instituto de Biotecnología, Facultad de Ciencias Biológicas-Universidad Autónoma de Nuevo León (FCB-UANL). Para su conservación se usaron viales criogénicos (Corning, N.Y., EE.UU.) con 1 mL de glicerol al 10 % v/v y almacenadas a -80 °C. Los aislados nativos utilizados corresponden a las claves HIB-2, HIB-3, HIB-4, HIB-5 y la cepa con clave GHA de B. bassiana.
Producción de blastoesporas en cultivo sumergido
Composición del medio
Los componentes del medio basal por litro fueron los siguientes: KH2PO4, 2.0 g; CaCl2 2H2O, 0.4 g; MgSO4 7H2O, 0.3 g; CoCl2 6H2O, 37 mg; FeSO4 7H2O, 50 mg; MnSO4 H2O, 16 mg; ZnSO4 7H2O, 14 mg. Al medio basal se agregaron glucosa (Jalmek, San Nicolás de los Garza, N. L., México) 80 g L-1 y 25 gL-1 de casaminoácidos (BD, N. J., EE.UU.). La solución de glucosa fue esterilizada por separado antes de agregarse al medio basal (adaptado de Jackson et al. , 2003; Jackson y Payne, 2007).
Producción de blastoesporas
Todos los hongos fueron cultivados 14 a 21 d en agar papa dextrosa (DIBICO, México, D.F.) a 25 ±2 °C. Después se prepararon suspensiones de 5x105 conidios mL-1 con agua destilada estéril para inocular el cultivo líquido (sumergido). Se usaron matraces bafleados (Pyrex, N.Y., EE.UU.) de 250 mL con 100 mL de medio, se incubaron a 28 °C y 300 rpm en un incubador con agitación orbital (New Brunswick Scientific, N. J., EE.UU.) (adaptado de Jackson y Payne, 2007). Al final del crecimiento se determinó la concentración de blastosporas y biomasa, y después del secado el porcentaje de viabilidad.
Mediciones de crecimiento
Durante el crecimiento de los hongos en medio líquido se contaron blastoesporas mL-1 (24, 48 y 72 h) y al final (72 h) se determinó el peso seco. La concentración de blastoesporas se definió usando una cámara de Neubauer (Fisher Scientific, Pitrsburgh, EE.UU.) después de realizar diluciones (10-6 a 10-8). Para medir la biomasa se determinó el peso seco, se tomó 1.0 mL de cultivo y se filtró a vacío a través de membranas de microfibra de vidrio con filtros de 110 mm de diámetro (GF/A; Whatman Inc., Clifton, N.J., EE.UU.) y se lavaron con 1.0 mL de agua destilada. Los filtros se secaron 24 h a 100 °C y se pesaron. La concentración de blastosporas se expresó en blastoesporas mL-1, y la biomasa con base al peso seco en gL-1.
Recuperación y formulación de blastoesporas
Las blastoesporas fueron recuperadas mediante secado por aire. Después de 72 h de incubación se cosecharon los cultivos de todos los experimentos o suspensiones de esporas, las blastoesporas fueron filtradas dos veces a través de una doble gasa para eliminar el exceso de micelio. Después el cultivo se separó en dos partes: la primera fue formulada con tierra de diatomeas 5 % (p/v) (Sigma Aldrich, San Luis MO, EE.UU.), y la segunda con Silica 5 % (p/v) (óxido de silicio 99 % puro; Materias Primas Monterrey, Monterrey, México); ambas suspensiones se filtraron a vacío a través de un embudo Buchner usando papel filtro Whatman No. 1. Los filtrados obtenidos se secaron 24 h a temperatura ambiente (25-28 °C), se colocaron en bolsas de plástico y almacenaron a 4 °C.
Estudios de sobrevivencia
La viabilidad de las formulaciones de blastoesporas de B. bassiana se determinó por secado con aire. De cada bolsa se tomaron 50 mg de blastoesporas secas y se adicionaron a 50 mL de caldo papa dextrosa (Bioxon, N. J., EE.UU.) en un matraz Erlenmeyer bafleado de 250 mL de capacidad. Después de 6 h de incubación a 28 °C y 300 rpm en un incubador con agitación orbital (New Brunswick Scientific, N. J., EE.UU.), se contaron 100 blastoesporas microscópicamente para evaluar el tubo germinativo. El criterio para tomar en cuenta una espora viable es cuando se forma un tubo germinativo, tan largo como la mitad del diámetro de la espora (Goetrel e Inglis 1997). La viabilidad se expresó en porciento de germinación.
Producción de conidios en sustrato sólido
Preparación del precultivo
Todos los aislados de B. bassiana fueron cultivados en agar papa dextrosa (DIBICO, México, D.F.) entre 14 y 21 d a 25±2 °C. Después se prepararon suspensiones de 5x106 conidios mL-1 con agua destilada estéril para inocular 1000 μL en matraces Erlenmeyer bafleados (Pyrex, N.Y., EE.UU.) de 250 mL conteniendo 100 mL de caldo dextrosa Sabouraud (Bioxon, N. J., EE.UU.). Se incubaron por 72 h, a 28 °C y 300 rpm en un incubador con agitación orbital (New Brunswick Scientific) (adaptado de Jackson y Payne, 2007).
Preparación e inoculación del sustrato
Se utilizaron bolsas de polietileno de alta densidad (HDPE) con capacidad de 1 kg. En cada bolsa se colocaron 50 g de arroz (Oryza sativa L.) y 60 % de agua bidestilada, se esterilizaron a 121 °C, 15 PSI por 15 min. Todas las bolsas se inocularon con 1000 μL de cada una de las suspensiones del precultivo tratando de esparcirlas de manera uniforme sobre el sustrato y al terminar fueron selladas herméticamente. Posteriormente se incubaron 14 d a temperatura ambiente (25-28 °C) y se expusieron a la luz blanca de las lámparas del laboratorio (12:12 h L:O). Las bolsas fueron agitadas cada tercer día para esparcir las esporas homogéneamente sobre el sustrato. Al final del tiempo de crecimiento se determinó la concentración de conidios y el porcentaje de viabilidad (adaptado de Sandoval-Coronado et al., 2010).
Medición de la productividad del sustrato
A los 14 d de incubación se determinó la concentración de conidios por gramo de arroz de cada bolsa. Se realizaron diluciones 10-6 a 10-9 en una solución Tween 80 (Sigma Aldrich, San Luis MO, EE.UU.) al 0.1 % (v/v) y se contaron los conidios usando una cámara de Neubauer (Fisher Scientific, Pitrsburgh, EE.UU.).
Viabilidad de las esporas
Se adicionó 1 g de arroz a 50 mL de caldo papa dextrosa (Bioxon, N. J., EE. UU.). Este cultivo se mantuvo en agitación rotatoria 6 h a 300 rpm a 25 ±2 °C. Después de la incubación se tomaron muestras directas de los cultivos y se contaron 100 esporas (germinadas y no germinadas), para cuantificar la proporción de esporas viables según el criterio de la longitud del tubo germinativo. La viabilidad se expresó en porciento de germinación.
Análisis estadístico
Los resultados se expresaron como valores promedios más la desviación estándar (DE). Para verificar la normalidad de los datos se realizó la prueba de Kolmogorov-Smirnov, previa conversión de los resultados a su logaritmo (log10) para introducirlos en el programa estadístico, y en caso de cumplir con este parámetro se realizó un análisis de varianza (ANDEVA) y una prueba de Tukey (p≤ 0.05) para las medias. Los datos fueron analizados con el programa IBM SPSS® v.19 Inc., Nueva York, EE.UU. Los experimentos se realizaron por triplicado y se repitieron al menos en dos ocasiones.
RESULTADOS Y DISCUSIÓN
Producción de blastoesporas
La producción de blastoesporas en medio líquido aumentó exponencialmente y a las 24 y 72 h la producción mostró diferencias significativas (p≤0.05) entre los hongos. A las 24 h de incubación el aislado HIB-3 mostró la menor producción de blastoesporas, mientras que el HIB-4 presentó el índice más elevado. A las 72 h se detuvo la fermentación y al final de la misma la cepa GHA presentó la producción mayor de blastoesporas (Cuadro 1).

Biomasa seca
La producción de biomasa en medio líquido a las 72 h mostró diferencias significativas (p≤0.05) entre los aislados de B. bassiana. La cepa GHA mostró la mayor producción (26 g L-1) y el aislado HIB-4 tuvo sólo 7 g L-1. Los aislados HIB-2 (15.3 g L-1), HIB-3 (13.3 g L-1) y HIB-5 (18.4 g L-1) no fueron diferentes (p>0.05) (Figura 1).

Sobrevivencia de las blastoesporas
La viabilidad de las blastoesporas recuperadas en los soportes inertes mostró diferencias significativas (p≤ 0.05) entre los hongos. El aislado HIB-2 presentó el porcentaje de germinación mayor (56 %) y la cepa GHA sólo alcanzó 23 % de germinación en la tierra de diatomeas, mientras que para la Silica el mayor índice de germinación fue para la cepa GHA (39 %) y el menor para el aislado HIB-5 (19 %) (Figura 2).

Las fermentaciones para la producción de blastoesporas pueden proveer ciertas ventajas con respecto a los medios de cultivo sólidos. Samson et al. (1988) describen las fermentaciones líquidas como rápidas y sin problemas de contaminación, y una de sus ventajas radica en poder controlar los parámetros durante el proceso. Hay estudios de fermentaciones para mejorar la producción de conidios o blastoesporas de diferentes hongos entomopatógenos, los cuales varían el contenido de carbono y nitrógeno en los medios de cultivo, por ser los dos requerimientos nutricionales principales en el desarrollo de la esporulación (Jackson et al., 2003).
En el presente estudio se evaluó la producción de blastoesporas de aislados nativos y una cepa de B. bassiana en un medio de cultivo líquido que se utiliza principalmente para producir esporas de P. fumosoroseus (Jackson y Payne, 2007). Los resultados a las 72 h mostraron rendimientos similares a los reportados para P. fumosoroseus, pero B. bassiana parece preferir fuentes de nitrógeno distintas a los casaminoácidos. Así, la cepa GHA produce hasta 5.1x109 blastoesporas mL-1 en un medio con 40 g L-1 de glucosa y 6 g L-1 de peptona de colágena a las 120 h de incubación, mientras que a las 72 h con 80 g L-1 de glucosa y 12g L-1 de peptona de colágena la producción es 8.90x108 blastosporas mL-1 (Sandoval Coronado et al., 2010). Además de los factores nutricionales, la producción de blastoesporas puede ser afectada por el sistema de agitación usando para su producción, como lo reportan Villalba et al. (2010). Ellos evaluaron la producción de blastoesporas de un cepa de B. bassiana mediante agitación orbital, lineal y mecánica, y esta última mostró una concentración 20 veces superior a la de los otros sistemas de agitación. En el presente estudio se usó un agitador orbital lo cual pudo influir en la producción de blastoesporas obtenida ya que este tipo de agitación permite el crecimiento del hongo con la elongación polar y bipolar del micelio en mayor proporción, respecto a la división de las blastoesporas que es menor debido al movimiento dirigido en un solo sentido, el cual no permite un intercambio gaseoso adecuado. Por tanto, no se espera encontrar una mayor masa de cuerpos hifales o blastoesporas bajo este sistema, porque no hay una fuerza con suficiente capacidad para separar estas células del micelio y generar un nuevo ciclo de crecimiento vegetativo para el hongo.
Eyal et al. (1994) reportan que la formulación de medios de cultivo con fuentes complejas de nitrógeno como líquido de remojo de maíz y de carbono como melazas favorecen primordialmente la producción de micelio, mientras que el uso de monosacáridos como la glucosa favorece la formación de blastoesporas. Lo anterior se debe a que las fuentes de nitrógeno orgánico favorecen el crecimiento hifal porque en esta etapa del desarrollo del microorganismo la reserva endógena de nitrógeno se ha agotado ya que se usa para sintetizar proteínas de novo durante los eventos iniciales de la germinación (Smith y Grula,1981).
Una clave para la recuperación de las blastoesporas es la elección de una técnica de secado adecuada. Numerosos materiales inertes y orgánicos se usan como agentes para estabilizar diferentes propágulos de hongos (Jackson et al., 1997). Los resultados del presente estudio muestran que el soporte usado para el secado afectó la sobrevivencia de las blastoesporas. Sandoval-Coronado et al. (2001) reportan una viabilidad de 69.6 % en un medio con casaminoácidos y 21.9 % en un medio con peptona de colágena como fuente de nitrógeno para blastoesporas de P. fumosoroseus con tierra de diatomeas al 5 %, y concluyen que el medio de producción y el soporte usado durante el secado pueden afectar la tolerancia a la desecación y estabilidad en el almacenamiento de las blastoesporas. Por tanto, el medio de producción debe proporcionar un ambiente nutritivo que maximice la producción de blastoesporas capaces de resistir la desecación, mientras que los soportes deben proveer una matriz que proteja a las blastoesporas de las condiciones de almacenamiento. Esto coincide con el informe de Jackson (1999) de que la fuente de nitrógeno presente en el medio puede impactar en la tolerancia a la desecación de las blastoesporas.
Producción de conidios en sustrato sólido
La producción de conidios en grano de arroz (Oryza sativa L.) fue 108 a 109 conidios g-1 y hubo diferencias significativas (p≤0.05) entre los hongos evaluados. El valor mínimo de 2.35x108 conidios g-1 se registró para la cepa GHA y el máximo de 1.82x109conidios g- 1 para el aislado HIB-4; los aislados HIB-2, HIB-3 e HIB-5 presentaron una producción de 1.22x109, 3.90x108 y 8.90x108 conidios g-1 (Figura 3). Los valores de germinación en promedio fueron superiores al 90 % a las cuatro semanas de almacenamiento (Cuadro 2).

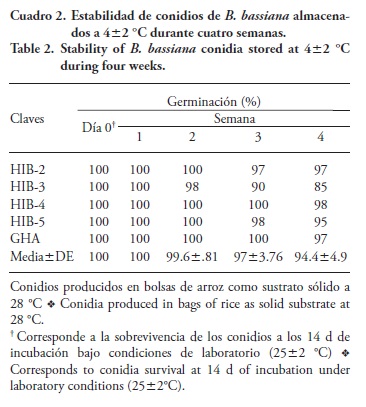
El arroz es el sustrato más usado para la producción masiva de hongos entomopatógenos por mantener las condiciones físicas con una adecuada superficie efectiva para el crecimiento micelial, un adecuado balance nutricional, y condiciones específicas acordes a los requerimientos del aislamiento en aireación y humedad. En algunos hongos como Lecanicillium lecanii, la cantidad de conidios puede disminuir debido a la alta compactación que ejerce el hongo sobre el arroz, lo que evita aireación interna y reducción de la producción conidial (Cortez-Madrigal, 2007). Esto pudo ocurrir con B. bassiana, ya que el grano de arroz presentó dificultades por su tendencia a permanecer apelmazado después del proceso de esterilización. Es probable que este sustrato requiera un menor tiempo de hidratación, aunque los rendimientos obtenidos coinciden con los reportados por Posada-Flórez (2008) de valores menores a 1x1010 conidios g-1 arroz para B. bassiana en un medio de cultivo bifásico, con una germinación promedio de 24 y 48 h del 80 y 75 % en periodos de 15, 25, 35 y 45 d.
El rendimiento de la esporulación sobre un sustrato puede ser influenciado por factores como la técnica de cultivo, concentración del inóculo inicial, condiciones de temperatura, humedad, aireación, y tiempo de incubación (Figueroa et al., 2007). Incluso la elección del sustrato es un factor crítico ya que hay marcadas diferencias principalmente de origen nutricional, y dependerá de factores de acuerdo a cada caso. Para considerar un sustrato como idóneo para la producción de conidios de una cepa o aislado de un entomopatógeno debe tener una alta productividad y rendimiento, lo cual depende de un contenido alto de carbohidratos, nitrógeno, microelementos, vitaminas del complejo B y una concentración alta de iones necesarios para el crecimiento, esporulación y conservación de la patogenicidad de los hongos entomopatógenos (Volcy y Pardo, 1994). Lo anterior impactaría directamente en su uso potencial como fuentes de inóculo para controlar plagas de importancia agrícola.
CONCLUSIONES
Los análisis a los entomopatógenos utilizados en el presente estudio mostraron que la biomasa recuperada estuvo acorde a la concentración de blastoesporas, mientras que en la formulación, recuperación y germinación hubo diferencias entre los hongos evaluados. Respecto a la producción y viabilidad de conidios en el medio bifásico, estos resultados fueron superiores a los obtenidos para las blastoesporas en el medio líquido. Este estudio contribuye a comprender algunos aspectos esenciales para seleccionar un método de cultivo, así como los requerimientos nutricionales para la producción de conidios y blastoesporas de aislados nativos de B. bassiana con potencial para manejar plagas con importancia agrícola.
AGRADECIMIENTOS
Al CONACYT por la beca otorgada a F. L. Gandarilla Pacheco (Reg. No. 266825) y a los proyectos PAICYT CN 100811 y PROMEP /103.5/09/1306. P/CA: UANL-CA- 11. Los autores agradecen la ayuda en aspectos técnicos a K.C. Jiménez y L. E. Araujo.
LITERATURA CITADA
Cortez-Madrigal, H. 2007. Producción de Lecanicillium (= Verticillium) lecanii en diferentes sustratos y patogenicidad. Agric. Téc. Méx. 33: 83-87. [ Links ]
de Faria, M. R., and S. P. Wraight. 2007. Mycoinsecticides and Mycoacaricides: A comprehensive list with worldwide coverage and international classification of formulation types. Biol. Control 43: 237-256. [ Links ]
Derakhshan, A., R. J. Rabindra, B. Ramanujam, and M. Rahimi. 2008. Evaluation of different media and methods of cultivation on the production and viability of entomopathogenic fungi Verticillium lecanii (Zimm.) Viegas. Pak. J. Biol. Sci. 11: 1506-1509. [ Links ]
Eyal, J., J. F. Walter, L. Osborn, and Z. Landa. 1994. Method for production and use of pathogenic fungal preparation for pest control. U.S. Patent # 5, 360,607. [ Links ]
Feng, M. T., G. Poprawski, and G. Khachatourians. 1994. Production, formulation and application of the entomopathogenic fungus Beauveria bassiana. Biocontrol Sci. Techn. 4:334. [ Links ]
Figueroa, L. M., A. Varela, y D. Corredor. 2007. Evaluación de sustratos naturales para la propagación masiva del hongo entomopatógeno Paecilomyces fumosoroseus (Deuteromicotina: Hyphomycetes). Revista de Investigación 7: 127-131. [ Links ]
Galán- Franco, L. A., A. Morales-Loredo, G. Álvarez-Ojeda, J. I. López-Arroyo, K. Arévalo-Niño, C. Sandoval-Coronado, and I. Quintero-Zapata. 2011. Isolation and characterization of entomopathogenic fungi obtained from citrus-growing areas of México. Southwest. Entomol. 36:443-449. [ Links ]
Gandarilla-Pacheco F. L., J. I. López-Arroyo, I. Quintero-Zapata, R. Rodríguez-Guerra, y C. F. Sandoval-Coronado. 2011. Bioensayos para la evaluación de Beauveria bassiana (Balsamo) Vuillemin contra ninfas de Diaphorina citri Kuwayama (Hemiptera: Psyllidae). In: Elías-Santos M., K. Arévalo-Niño, I. Quintero-Zapata, C. Solís-Rojas, C. F. Sandoval- Coronado, H. A. Luna-Olvera, B. Pereyra-Alférez, L. H. Morales-Ramos, y M. G. Maldonado- Blanco (eds). Memorias XXXIV Congreso Nacional de Control Biológico. Monterrey, N. L., México, UANL, FCB-IB. pp: 135-140. [ Links ]
Goetrel, M. S., and G. D. Inglis. 1997. Fungi: Hyphomycetes. In: Lacey L.A. (ed). Manual of Techniques in Insect Pathology. Academic Press, Inc., San Diego, pp. 213—249. [ Links ]
Jackson, M. A. 1999. Method for producing dessication tolerant Paecilomyces fumosoroseus spores. U.S. Patent #5, 968,808. [ Links ]
Jackson, M. A., M. R. Mc Guire, L. A. Lacey, and S. P. Wraight. 1997. Liquid culture production of desiccation tolerant blastospores of the bioinsecticidal fungus Paecilomyces fumosoroseus. Mycol. Res. 101: 35-41. [ Links ]
Jackson, M. A., S. Cliquet, and L. B. Iten. 2003. Media and fermentation processes for the rapid production of high concentrations of stable blastospores of the bioinsecticidal fungus Paecilomyces fumosoroseus. Biocontrol Sci. Techn.13: 23 -33. [ Links ]
Jackson, M. A., and A. R. Payne. 2007. Evaluation of the desiccation tolerance of blastospores of Paecilomyces fumosoroseus (Deuteromycotina: Hyphomycetes) using a lab-scale, air-drying chamber with controlled relative humidity. Biocontrol Sci. Techn. 17: 709-719. [ Links ]
Kamp, A. M., and M. J. Bidochka. 2002. Conidium production by insect pathogenic fungi on commercially available agars. Letr. Appl. Microbiol. 35: 74-77. [ Links ]
Leckie, B. M., B. H. Ownley, R. M. Pereira, W. E. Klingeman, C. J. Jones, and K. D. Gwinn. 2008. Mycelia and spent fermentation broth of Beauveria bassiana incorporated into synthetic diets affect mortality, growth and development of larval Helicoverpazea (Lepidoptera: Noctuidae). Biocontrol Sci. Techn. 180: 697-710. [ Links ]
López-Arroyo, J. I., J. Loera Gallardo, M. A. Miranda Salcedo, M. A. Reyes Rosas, y M. A. Rocha Peña. 2004. Manejo integrado de plagas de cítricos. In: Memorias del Simposio Internacional Manejo Fitosanitario del Cultivo de los Cítricos. Sociedad Mexicana de Fitopatología. Veracruz, Ver. México. [ Links ]
Posada-Flórez, F. J. 2008. Production of Beauveria bassiana fungal spores on rice to control the coffee berry borer, Hypothenemus hampei in Colombia. J. Insect Sci. 8: 1-13. [ Links ]
Rajanikanth, P., G. V. Subbaratnam, and S. J. Rahaman. 2011. Evaluation of pathogenicity to Spodoptera litura Fabricius of different Beauveria bassiana Vuillemin isolates mass multiplied on economically viable substrates. Int. J. Bioresource Stress Manage. 2: 293-297. [ Links ]
Rodríguez del Bosque L. A., y H. C. Arredondo Bernal. 2007. Teoría y Aplicación del Control Biológico. Sociedad Mexicana de Control Biológico. México, D.F. 303 p. [ Links ]
Samson, R., H. Evans, and J. Latgé. 1988. Atlas of Entomopathogenic Fungi. Springer-Verlag, Berlin. 300 p. [ Links ]
Sandoval-Coronado, C. F., I. Quintero-Zapata, M. G. Maldonado-Blanco, M. Elías-Santos, y L. J. Galán-Wong. 2010. Producción de blastoesporas de Beauveria bassiana en un medio de cultivo líquido a base de glucosa y peptona de colágena. In: Coria-Ávalos V. M., M. B. N. Lara-Chávez, G. Orozco-Gutiérrez, H. J. Muñoz-Flores, y R. Sánchez-Martínez (eds). Memoria XXXIII Congreso Nacional de Control Biológico. Michoacán, México, INIFAP-CIRPAC. pp: 416-419. [ Links ]
Sandoval-Coronado, C. F., H. A. Luna-Olvera, K. Arévalo-Niño, M. A. Jackson, T. J. Poprawski, and L. Galán-Wong. 2001. Drying and formulation of blastospores of Paecilomyces fumosoroseus (Hyphomycetes) produced in two different liquid media. World J. Microb. Biot. 17: 423-428. [ Links ]
Smith, R., and J. Grula. 1981. Nutritional requirements for conidial germination and hyphal growth of Beauveria bassiana. J. Invertebr. Pathol. 37: 222-230. [ Links ]
Sun, M. H., and X. Z. Liu. 2006. Carbon requirements of some nematophagous entomopathogenic and mycoparasitic hyphomycetes as fungal biocontrol agents. Mycopathologia 161: 295-305. [ Links ]
Villalba, P. L., H. Grillo-Ravelo, y R. Cupull. 2010. Evaluación de tres sistemas de agitación para la producción de blastosporas del hongo Beauveria bassiana (Bálsamo) Vuillemin. Centro Agrícola. 37: 17-21. [ Links ]
Volcy C., y V. Pardo. 1994. Principios de Micología. Decimo novena edición. Centro de publicaciones, Universidad Nacional de Colombia. 141 p. [ Links ]
Wraight, S., M. Jackson, and S. Kock. 2001. Production, stabilization and formulation of fungal biocontrol agents. In: Butr, T. M., C. Jackson, and N. Magan (eds). Fungi as Biological Control Agent: Progress, Problems and Potencial. CABI Publishing Series. Wallingford, U.K. pp: 253-280. [ Links ]
Zimmermann, G. 2007. Review on safety of the entomopathogenic fungi Beauveria bassiana and Beauveria brongniartii. Biocontrol Sci. Techn. 17: 553-596. [ Links ]














