Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.46 no.6 Texcoco ago./sep. 2012
Recursos naturales renovables
Variación genética entre procedencias de Lupinus elegans Kunth, zonificación altitudinal y migración asistida
Genetic variation between Lupinus elegans Kunth provenances, altitudinal seed zoning and assisted migration
José C. Soto–Correa1, Cuauhtémoc Sáenz–Romero1*, Roberto Lindig–Cisneros2, Nahum Sánchez–Vargas1, José Cruz–de–León3
1 Instituto de Investigaciones Agropecuarias y Forestales, Universidad Michoacana de San Nicolás de Hidalgo (IIAF–UMSNH). Km 9.5 carretera Morelia–Zinapécuaro, Tarímbaro Michoacán 58880. (jocasoco@hotmail.com) *Autor responsable: (csaenzromero@gmail.com) (nsanchesv@yahoo.com).
2 Centro de Investigaciones en Ecosistemas, Universidad Nacional Autónoma de México (CIEco–UNAM). Antigua Carretera a Pátzcuaro No. 8701, Col. Ex–Hacienda de San José de La Huerta, Morelia Michoacán 58190. (rlindig@oikos.unam.mx).
3 Facultad de Ingeniería en Tecnología de la Madera, Universidad Michoacana de San Nicolás de Hidalgo (FITECMA–UMSNH). Edificio D Ciudad Universitaria, Av. Francisco J. Mujica s/n, Col. Felicitas del Río, Morelia Michoacán 58030. (josecruzde@yahoo.com.mx).
Recibido: noviembre, 2011.
Aprobado: agosto, 2012.
Resumen
Lupinus elegans Kunth es una especie usada en programas de reforestación ecológica y agroforestal en México y en otros países, es tolerante a condiciones de estrés y fija nitrógeno. Para comprender la estructura de la diferenciación genética entre poblaciones y acoplar los genotipos a los ambientes contemporáneos y futuros (debido al cambio climático), el objetivo del presente estudio fue evaluar la variación genética de caracteres cuantitativos entre 12 poblaciones de L. elegans, recolectadas a lo largo de un gradiente altitudinal, en el centro–este de Michoacán. En agosto del 2009 se sembró un ensayo de procedencias en campo (sitio de bosque de pino–encino, paraje La Cruz, cerca de La Mina y el mirador Mil Cumbres, centro–este de Michoacán, a 2700 m de altitud), con un diseño de bloques completos al azar. Para el sitio del ensayo se estimó la temperatura media anual, la precipitación media anual, y se calculó un índice anual de aridez para el clima contemporáneo y para el 2030. A los 10 meses de edad se registró la altura y biomasa aérea de la planta. Mediante un análisis de la varianza se detectaron diferencias genéticas significativas en el crecimiento entre poblaciones, en altura (p = 0.001) y biomasa aérea (p = 0.001). Hubo una asociación entre altura de planta y biomasa con la altitud de procedencia de las poblaciones, poblaciones de mayores altitudes tuvieron plantas con altura (r2=0.49; p<0.011) y biomasa (r2=0.48; p<0.011) mayor, que poblaciones de altitudes bajas. Aparentemente, las poblaciones de L. elegans se han diferenciado genéticamente en respuesta a un gradiente de selección, que consiste en sitios más fríos y húmedos a mayor altitud y más cálidos y secos a menor altitud. Para la recolección y manejo de la semilla con fines de restauración ecológica y conservación se definieron cuatro zonas altitudinales de 150 m de intervalo altitudinal cada una, con límites a los 2300, 2450, 2600, 2750 y 2900 m. Debido a la necesidad de realizar una migración asistida de L. elegans para compensar el cambio climático predicho para el 2030, se sugiere realizar un movimiento altitudinal hacia arriba de 550 m aproximadamente de las poblaciones de esta especie, en tres movimientos sucesivos de 150 m.
Palabras clave: Lupinus elegans, cambio climático, caracteres cuantitativos migración asistida, procedencias, variación genética altitudinal.
Abstract
Lupinus elegans Kunth is a species used in ecological and agroforestry reforestation programs in Mexico and other countries. It is tolerant to conditions of stress and it fixes nitrogen. To understand the structure of genetic differentiation among populations and to match genotypes to contemporary and future (due to climate change) environments, this study evaluated genetic variation of quantitative traits among 12 populations of L. elegans, collected along an altitudinal gradient in the east–central region of Michoacan. In August 2009, field provenance trials were planted (pine–oak forest, site La Cruz, near La Mina and the panoramic lookout Mil Cumbres, in east–central Michoacan, 2700 m altitude), with a complete randomized block design. For the trial site, mean annual temperature and precipitation were estimated, and an annual aridity index was calculated for contemporary climate and for the climate in 2030. At 10 months of age, plant height and aerial biomass were recorded. Using an analysis of variance, significant genetic differences in height (p = 0.001) and aerial biomass (p = 0.001) were detected among the populations. Plant height and biomass were associated with the provenance altitude of the populations; populations originating from higher altitudes had taller plants (r2=0.49; p<0.011) and more biomass (r2=0.48; p<0.011) than the populations at lower altitudes. Apparently, the L. elegans populations have differentiated genetically in response to a selection gradient, consisting of colder, more humid sites at higher altitudes, and hotter, drier sites at lower altitudes. For collection and management of seed destined for ecological restoration and conservation, four altitudinal zones of 150 m of altitudinal range each were defined: 2300, 2450, 2600, 2750 and 2900 m. Due to the need for assisted migration of L. elegans to compensate the climate change predicted for 2030, it is recommended that populations of this species be moved approximately 550 m higher in three successive movements of 150 m each.
Key words: Lupinus elegans, climate change, quantitative traits, assisted migration, provenance, altitudinal genetic variation.
INTRODUCCIÓN
Las poblaciones de especies forestales con distribución natural en un gradiente altitudinal tienden a diferenciarse genéticamente en repuesta a diferentes factores ambientales, lo cual es un mecanismo de adaptación de las especies y poblaciones al ambiente (Oleksyn et al., 2001; Rehfeldt, 2004; Viveros–Viveros et al., 2009). La distribución de las especies está determinada en gran medida por las variables climáticas (precipitación y temperatura) y, por tanto, los cambios en el clima modifica su distribución y abundancia (Fitzpatrick et al., 2008; Rehfeldt et al., 2009; Vitasse et al., 2009a).
El calentamiento global aumentará la temperatura y reducirá la precipitación en México, lo cual se ha modelado en diferentes escenarios climáticos (Sáenz–Romero et al., 2010). Esto disminuirá los intervalos actuales de clima propicio para la distribución de casi todas las especies del bosque de pino–encino del país (Gómez–Mendoza y Arriaga, 2007). Por tanto, los bosques se enfrentarán a un desfasamiento adaptativo (estarán creciendo en un sitio con un clima que se ha modificado y para el cual ya no están adaptados) y a la necesidad de migrar a sitios con ambientes a los cuales están adaptados (Rehfeldt et al., 2012). La posibilidad de migrar dependerá de la capacidad de dispersión de las especies y de las barreras a la migración; sin embargo, la velocidad el cambio climático es mayor que la capacidad de desplazamiento de muchas especies (Pearson, 2006). En consecuencia, es indispensable comprender la relación de acoplamiento de las poblaciones al clima y realizar un manejo adecuado para la adaptación al cambio climático y mitigar los efectos negativos del desfasamiento adaptativo causado por el calentamiento global, mediante migración asistida (Rice y Emery, 2003).
Lupinus elegans Kunth es una especie importante en los bosques de pino y pino–encino del centro oeste de México; tolera condiciones de estrés, fija nitrógeno (Alvarado–Sosa et al., 2007), es endémica de México y se distribuye entre 1800 y 3000 m de altitud en los estados de Guerrero, Jalisco, Michoacán, Morelos y Zacatecas (Dunn, 2001). En ensayos de rehabilitación (restauración ecológica sin pretender reproducir el ecosistema natural original) muestra una capacidad notable para mejorar las condiciones del suelo y facilitar el establecimiento de especies nativas arbóreas del sotobosque de bosque de coníferas (Lindig–Cisneros et al., 2007).
Los ensayos de procedencias permiten determinar diferencias genéticas al cultivar en un mismo ambiente (bajo un diseño experimental) individuos de distintas procedencias y permitir la expresión de diferencias en el crecimiento debida al control genético (Zobel y Talbert, 1988; White et al., 2007). Integrar la modelación del clima con los ensayos de procedencias es una necesidad derivada del cambio climático porque el acoplamiento entre genotipos y ambientes requiere predecir el sitio donde habrá un clima al cual están adaptadas las poblaciones locales. Para México hay modelos climáticos "spline", basados en modelos de circulación global y en escenarios de emisiones de gases de efecto de invernadero, que permiten predecir variables climáticas (precipitación, temperatura, índice de aridez y otras) para sitios específicos de México en un período de tiempo contemporáneo o futuro (Sáenz–Romero et al., 2010). Estos modelos climáticos permiten evaluar relaciones entre las plantas y el clima mediante la identificación de las variables climáticas que condicionan la distribución de las especies (Rehfeldt, 2006; Rehfeldt et al., 2009; Vitasse et al., 2009a). Así, los modelos planta–clima son una herramienta para predecir dónde y cuándo existirá un clima propicio para una especie determinada, y con esa información diseñar programas de restauración y conservación forestal (Rehfeldt et al., 2009; van Zonneveld et al., 2009; Sáenz–Romero et al., 2010).
Los objetivos del presente estudio fueron determinar: 1) si hay diferenciación genética para caracteres cuantitativos entre poblaciones de L. elegans, 2) si la diferenciación genética sigue un patrón altitudinal o asociado a otras variables climáticas, y 3) cuanto se deben desplazar altitudinalmente las poblaciones de L. elegans para evitar el desfasamiento adaptativo y para reacoplar las poblaciones en un escenario de cambio climático, utilizando la predicción de un modelo climático.
Las hipótesis fueron: 1) hay diferenciación genética entre poblaciones de L. elegans como lo indican Lara–Cabrera et al. (2009); 2) las poblaciones originadas a menor altitud crecerán más que las originadas a mayor altitud, suponiendo que la variación estará asociada a un patrón altitudinal y que expresa el mismo patrón que otras especies forestales (las de menor altitud crecen más que las de mayor altitud; Sáenz–Romero et al., 2012); 3) la temperatura y precipitación predicha para el año 2030 en los sitios donde ahora crecen las poblaciones será diferente a la contemporánea, pero el desacoplamiento puede mitigarse mediante una migración altitudinal hacia arriba (Sáenz–Romero et al., 2010).
MATERIALES Y MÉTODOS
Recolección de semilla
Se recolectó semilla de naturaleza exogámica de 11 individuos de cada una de 12 poblaciones naturales de L. elegans en un gradiente altitudinal, con una exposición suroeste en la zona de Mil Cumbres, en la región centro–este del estado de Michoacán, desde 2312 m hasta 2885 m de altitud (Cuadro 1). La recolección se realizó entre diciembre del 2008 y febrero del 2009. Se llamará procedencia a los sitios de origen donde se recolectó la semilla y población al conjunto de individuos de una procedencia representados en el experimento por las muestras.
Modelación climática
Para determinar una posible relación entre las variables de crecimiento y el clima (contemporáneo y futuro) de cada procedencia, se usaron las coordenadas geográficas y altitud de cada sitio de recolección y del sitio del ensayo para obtener una serie de valores de variables climáticas para el clima contemporáneo (promedio del período 1961–1990) y el clima futuro (promedio de la década centrada en el año 2030), con un modelo climático de "thin plate splines" desarrollado para México (Crookston, 2010; Saenz–Romero et al., 2010). Este modelo se basa en la interpolación de superficies de datos usando el software ANUSPLINE (Hutchinson, 2004), con datos mensuales normalizados de temperatura (máxima, promedio y mínima) y precipitación, de aproximadamente 4000 estaciones climatológicas de México, sur de EE.UU., Guatemala, Honduras y Cuba. Los modelos de clima futuro consisten en ajustar nuevamente el modelo con ANUSPLINE pero después de modificar los valores mensuales de cada estación meteorológica, con estimaciones del Panel Intergubernamental de Cambio Climático (IPCC) (Sáenz–Romero et al., 2010). Para el clima futuro se obtuvieron estimaciones de tres modelos de circulación global (Canadiense, Hadley y Física de Fluidos) y de dos escenarios de emisiones de gases de efecto invernadero (CO2, metano y otros). Los escenarios fueron A, elevadas emisiones; B, bajas emisiones. Esto resultó en seis estimaciones para cada sitio (3 modelos climáticos× 2 escenarios de emisiones), que se promediaron. Las variables estimadas fueron temperatura media anual (TMA), precipitación media anual (PMA), índice anual de aridez (IAA= (DD50.5)/ PMA; DD5 = grados día >5 °C) (Sáenz–Romero et al., 2010) (Cuadro 1). El índice de aridez está estrechamente relacionado con la distribución de especies y tipos de vegetación (Rehfeldt, 2006).
Establecimiento del experimento
La semilla recolectada en las 12 poblaciones fue limpiada y escarificada (inmersión por 30 min en H2SO4 al 97 % Fermnt® para reblandecer la testa), en el laboratorio de Genética Forestal del Instituto de Investigaciones Agropecuarias y Forestales, Universidad Michoacana de San Nicolás de Hidalgo, en Morelia, Michoacán. La escarificación se realizó para asegurar la germinación al momento del establecimiento del experimento (Medina–Sánchez y Lindig–Cisneros, 2005). El ensayo de procedencias se estableció en un sitio abierto de bosque mixto de Pinuspseudostrobus Lindl, Quercus spp. y Abies religiosa (HBK) Schl. & Cham., a una altitud de 2700 m en el paraje La Cruz, cerca del poblado La Mina y el mirador Mil Cumbres (Michoacán). El sitio es muy cercano al sitio de origen de la población número 5 (Cuadro 1). En el sitio se eliminó la maleza y se cercó para evitar la depredación por animales. El diseño experimental del ensayo en campo fue de seis bloques completos al azar, con 12 poblaciones, y parcelas discontinuas con cinco individuos distribuidos al azar dentro de cada bloque. El espaciamiento fue 50×50 cm.
Para establecer el ensayo a finales de julio del 2009 en cada bloque se sembraron directamente las semillas escarificadas, sembrando tres semillas (3 cm entre una y otra, en triángulo) de una misma procedencia a 2.5 cm de profundidad (Gómez–Romero y Lindig–Cisneros, 2009). Después se eliminó una o dos plantas de la misma población para evitar la competencia entre ellas. Una vez establecido el ensayo, se evaluó el porcentaje de supervivencia (cada mes), crecimiento en altura (cada dos meses, cm) y peso seco final (a los 10 meses, g). El peso seco de las plantas se evaluó en dos bloques (una evaluación preliminar del peso seco de las plantas eliminadas para dejar un solo individuo por parcela mostró grandes diferencias estadísticamente significativas entre procedencias, por lo cual se consideró que cosechar dos bloques sería suficiente). Para evaluar el peso seco se recolectó la parte aérea de cada planta y la muestra se secó en un horno (Feliza®, México) 72 h a 60 °C (Sáenz–Romero et al., 2012).
Análisis estadístico
Para determinar diferencias significativas entre procedencias se realizaron análisis de varianza usando el procedimiento GLM (SAS, 2004), con el siguiente modelo estadístico:

donde Yijk=observación, µ=efecto de la media general, Bi=efecto del i–ésimo bloque, Pj=efecto de la i–ésima población, Bi*PJ=efecto de la ij–ésima interacción bloque*población, eijk= error.
Para evaluar la relación entre las características geográficas de cada procedencia (altitud sobre el nivel del mar o variables climáticas) y el crecimiento promedio por población en el ensayo (altura de planta o biomasa aérea), se realizaron análisis de regresión lineal con el siguiente modelo:

donde Yij=media de la población (altura de planta o biomasa), β0= intercepto, β1=pendiente, Xi=altitud (m sobre el nivel del mar) u otra variable climática estimada de la i–ésima procedencia, eij=error.
Se realizó una zonificación altitudinal para decidir la recolección y reubicación de semillas de L. elegans, con fines de rehabilitación ecológica y conservación. La zonificación consistió en dividir el intervalo altitudinal de distribución natural de la especie en la región, en zonas o bandas altitudinales. La división se basó en encontrar experimentalmente la diferencia altitudinal entre medias por población, necesaria para considerar que dos poblaciones son genéticamente diferentes a partir de la diferencia mínima significativa (DMS) entre poblaciones para un carácter cuantitativo (Sáenz–Romero, 2004; Sáenz–Romero y Tapia–Olivares, 2008; Viveros–Viveros et al., 2009), en este caso biomasa aérea. Para la estimación de la DMS se usó un valor elevado de error alfa (α = 0.2) porque ello conduce a reglas de manejo más conservadoras debido a que el valor resultante de intervalo de altitud (que hace a dos poblaciones significativamente diferentes) es menor, y por tanto habrá más restricciones en el movimiento de la semilla (Sáenz–Romero et al., 2006). La delimitación altitudinal se realizó ajustando un modelo de regresión lineal del promedio del peso seco de la parte aérea por población contra la altitud de la procedencia. Con el valor de DMS para peso seco se encontró su equivalencia en diferencia altitudinal entre poblaciones. Luego se definió un límite altitudinal inferior de una primera zona altitudinal a la altitud predicha por la línea de regresión, correspondiente a la población de menor altitud; el límite superior de esa zona se definió con base a la DMS, y así sucesivamente se definieron los límites altitudinales para cada zona, hasta cubrir el intervalo altitudinal de L. elegans en la región estudiada. Sáenz–Romero (2004) describe el método detalladamente.
RESULTADOS Y DISCUSIÓN
El análisis de varianza mostró diferencias significativas entre poblaciones en altura de planta (p< 0.001) y peso seco de la parte aérea (p< 0.001), lo cual indica que las poblaciones están genéticamente diferenciadas entre sí, mientras que para la supervivencia no hubo diferencias significativas (p = 0.21) (Cuadro 2). Lo anterior concuerda con una diferenciación genética descrita entre poblaciones de L. elegans, de Michoacán, para caracteres cuantitativos y por marcadores moleculares (Lara–Cabrera et al., 2009).
Hubo un patrón significativo de variación entre poblaciones a lo largo del gradiente altitudinal, donde las poblaciones originadas a mayor altitud presentan mayor altura (r2 = 0.49, p = 0.011) y mayor biomasa aérea (r2 = 0.49, p = 0.010) (Figura 1), mientras que poblaciones originadas a menor altitud presentan plantas con menor estatura y menor biomasa. Este patrón altitudinal fue contrario a lo esperado.
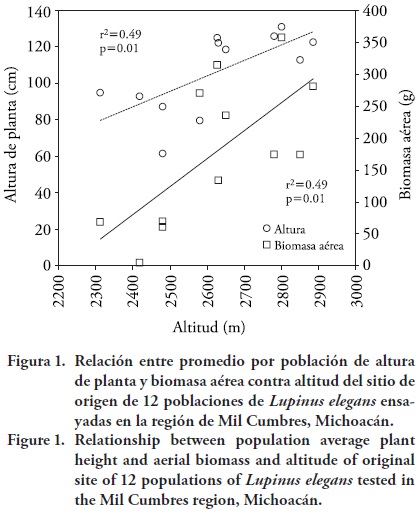
Hubo una asociación significativa entre la altitud de las procedencias y el índice anual de aridez (IAA); así, para el clima contemporáneo los sitios de menor altitud presentan valores mayores y por tanto son más áridos (más cálidos y más secos), mientras que en los sitios de mayor altitud hay valores de IAA menores y por tanto son menos áridos (menos cálidos y más húmedos) (r2= 0.62, p= 0.002; Figura 2). Por tanto, es posible que el grado de aridez actúe como una importante presión de selección para diferenciar genéticamente a las poblaciones (Rehfeldt, 1989). También hubo una asociación significativa entre la biomasa aérea promedio por población y el índice de aridez (r2 = 0.62, p = 0.002), donde poblaciones recolectadas de sitios secos (a menor altitud), producen plantas con una menor biomasa, mientras que poblaciones de sitios menos secos (a mayor altitud), producen plantas con mayor biomasa (Figura 3).
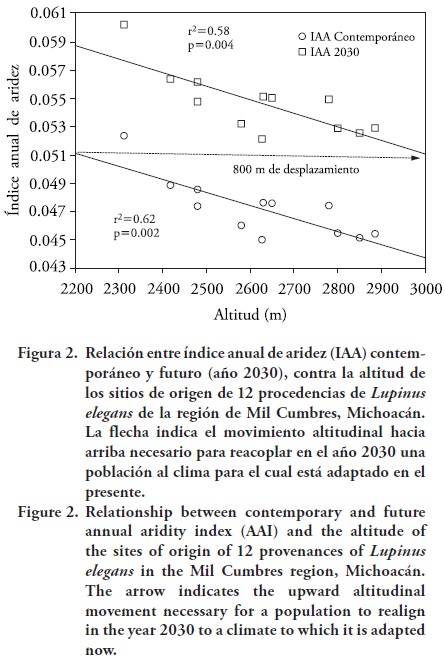
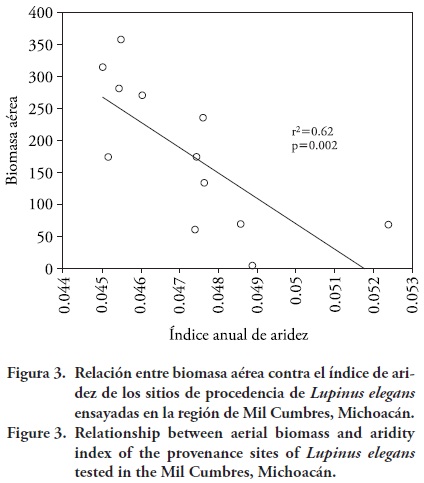
Esto puede interpretarse en dos sentidos no excluyentes: 1) es posible que el menor crecimiento de las poblaciones de los sitios más áridos sea una estrategia para evadir el estrés por sequia (Levitt, 1980; Sikuku et al., 2010) y que esté genéticamente condicionado, y 2) las poblaciones de L. elegans crecen mejor en sitios cercanos a su lugar de origen; esto se mostró en ensayos de translocación en jardín común (Lara–Cabrera et al., 2009) y aplica en el presente estudio porque el sitio del ensayo de campo está ubicado cerca de las poblaciones de mayor altitud (Cuadro 1).
El análisis de regresión entre la altura de planta contra el IAA presentó una tendencia similar a la biomasa aérea, donde poblaciones originadas en sitios menos secos producen plantas de mayor estatura, y poblaciones de sitios más secos producen plantas de menor estatura. Sin embargo, esta tendencia no fue significativa (r2 = 0.16, p = 0.20).
El examen del gradiente ambiental altitudinal separando sus componentes en precipitación y temperatura (para mayor claridad en este análisis, considerando temperatura media anual en vez de grados día), no mostró una asociación significativa entre la precipitación de los sitios y la biomasa aérea de las plantas (r2 = 0.24, p = 0.10). Esto puede deberse a que la diferencia entre el sitio más lluvioso y menos lluvioso es aproximadamente 100 mm (Cuadro 1). Sin embargo, con una temperatura más elevada a menores altitudes, el balance hídrico es menos favorable para la planta, comparada con la de un sitio de mayor elevación, menor temperatura y la misma precipitación, debido a que la evapotranspiración es mayor en un sitio más cálido. Es decir, la falta de diferencias en precipitación no debe llevar a la conclusión de que no hay un gradiente de disponibilidad de humedad para la planta; porque sí lo hay, dado que en la región estudiada la precipitación no aumenta en paralelo al aumento de la temperatura causada por la disminución de la altitud.
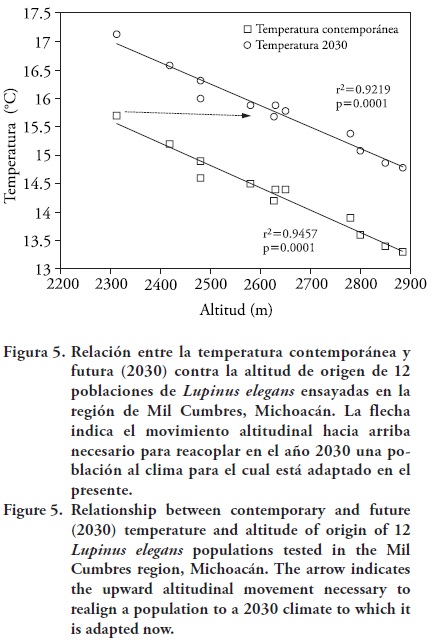
En contraste, sí hubo una asociación significativa de la temperatura media anual con la biomasa aérea (r2 = 0.52, p = 0.007) (Figura 4). Esto muestra la mayor influencia de la temperatura para moldear la diferenciación genética entre poblaciones; además es un indicador de que las diferencias ambientales a lo largo del gradiente altitudinal en realidad están dominadas por la temperatura (Figura 5). Los resultados de estudios entre poblaciones de especies forestales a través de gradientes ambientales en zonas templadas, muestran que la temperatura es el principal limitante en el crecimiento en plantas (Rehfeldt et al., 2009), y la variable climática tiene el mayor efecto en la fenología del desarrollo (Vitasse et al., 2009b) En particular, para leguminosas de climas templados la temperatura es determinante en la distribución y adaptación de las especies, y en algunos casos las altas temperaturas afectan adversamente el crecimiento y la producción de materia seca (Bascur, 1996).

Implicaciones de manejo en relación al cambio climático
Debido al calentamiento global, en México las temperaturas medias anuales aumentarían 1.5 °C en el año 2030, promediando las predicciones de seis escenarios climáticos derivados de la combinación de tres modelos de circulación global y dos escenarios de emisiones (Sáenz–Romero et al., 2010). Esto pondrá a prueba la capacidad de adaptación de las especies y poblaciones a las nuevas condiciones ambientales y tendrían que adaptarse reduciendo o aumentado la velocidad de su crecimiento (Vitasse et al., 2009c), u optar por migrar latitudinalmente hacia los polos o en altitud a mayor elevación (Lenoir et al., 2008). Pero poblaciones de Pinus sylvestris en Siberia debieran migrar a una velocidad de 8 a 14 km al año, lo cual biológicamente es imposible (Tchebakova et al., 2005). Para evitar un desfasamiento adaptativo y afrontar estos cambios, la planeación de una migración asistida podría mitigar el efecto del cambio climático (Rice y Emery, 2003; McLachlan et al., 2007).
Considerando el gradiente de temperaturas a lo largo del gradiente altitudinal en el área de estudio, sería necesario un movimiento de 300 m de altitud para que las poblaciones quedaran acopladas a la temperatura media anual a la cual están adaptadas ahora, pero que ocurrirá en el 2030 en otro sitio (Figura 6). Este movimiento altitudinal es de menor magnitud (menos de la mitad) que la predicha basada en el IAA (Figura 3). Para decidir cuál es el movimiento correcto, sería necesario construir un modelo clima–planta específico para L. elegans, como los realizados para Pinus chiapensis (Sáenz–Romero et al., 2010) o para Picea chihuahuensis, P. martinezii y P. mexicana (Ledig et al., 2010), y así determinar cuáles variables climáticas son más importantes y la magnitud de importancia de cada una. Mientras no esté disponible ese modelo, probablemente es prudente realizar experimentalmente un movimiento altitudinal que sea el promedio entre la predicha por la temperatura media anual (300 m) y para el IAA (800 m); es decir, un movimiento de 550 m. Sin embargo, entre mayor sea el movimiento altitudinal, mayor será el riesgo de daño por heladas (Sáenz–Romero y Tapia–Olivares, 2008), por lo cual se debe realizar ensayos de migración cuantificando el daño por heladas. Para efectos de manejo cabe preguntarse: ¿cuándo realizarlo? ¿en un solo movimiento? Esto se discute a continuación en la sección de zonificación.
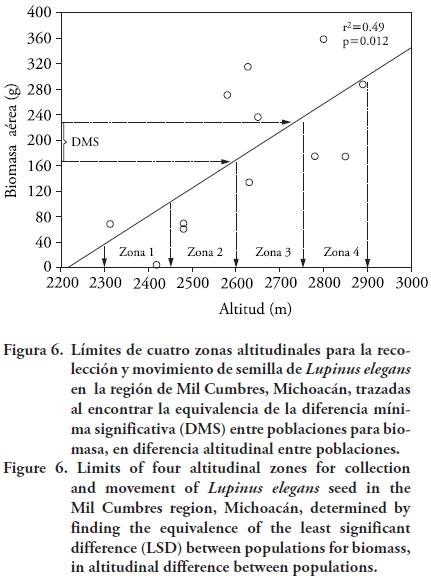
Zonificación altitudinal y migración asistida
Se construyó una zonificación altitudinal para sugerir el movimiento de semillas de L. elegans en la región de Mil Cumbres, Michoacán, usando los datos de biomasa aérea y altura de planta, porque fueron significativos y presentaron un patrón altitudinal bien definido. El valor de la DMS (α = 0.2) entre procedencias fue 68 g para biomasa aérea (Figura 6) y 12 cm para altura de planta. Al trasladar este valor a una diferencia altitudinal mínima significativa entre poblaciones, el valor fue 157 m de diferencia altitudinal para biomasa y 145 m para altura de planta. Es razonable por tanto considerar que las poblaciones se diferencian aproximadamente cada 150 m de cambio altitudinal. Con el intervalo de distribución altitudinal de L. elegans en la región se definieron cuatro zonas altitudinales para L. elegans con límites indicados en la Figura 6 y Cuadro 3.

Los lineamientos generales para la utilización de la zonificación son los siguientes: 1) Para conservación y restauración ecológica, las semillas recolectadas en una zona se deben usar dentro de la misma zona, o dentro de un intervalo de ±75 m en altitud, entre el lugar donde se recolecta la semilla y el sitio a ser sembrado, lo que corresponde a la mitad de la anchura de una zona altitudinal; así se esperaría mantener la adaptación de los genotipos al ambiente del sitio de plantación. 2) Para adaptarse al cambio climático se sugiere desplazarse hacia arriba el máximo del ancho de la zona altitudinal (150 m), en al menos tres ocasiones sucesivas entre el presente y el año 2030, a fin de aproximarse al movimiento altitudinal requerido de 550 m, que es un promedio de lo predicho con base en la temperatura (300 m) y en base al IAA (800 m); tal movimiento es viable porque el tiempo generacional es relativamente corto, de 4 a 5 años (Dunn, 2001). En términos generales, podría hacerse un movimiento altitudinal, de manera sucesiva, cada seis años (en 2012, 2018 y 2024), para acoplarse al año 2030.
Perspectivas y limitaciones. Durante el tiempo que permanecen las poblaciones migradas en el sitio de plantación, habría cierto grado de flujo genético con las poblaciones locales vecinas. Esto sería positivo en cuanto a que aumentará la diversidad genética y ampliará la base genética sobre la cual actuará la selección natural. Sin embargo, sería negativo en cuanto a que disminuirá la adaptación a un clima que será cada vez más seco, al ser la población migrada "contaminada" por alelos locales adaptados para el clima original del sitio (más frío y húmedo). El efecto del flujo genético con las poblaciones locales sería menos relevante para la población migrada entre más grande sea ésta. La forma y tamaño que deberían tener las poblaciones migradas, es un tema aún por desarrollar.
Hay conclusiones derivadas acerca de las diferencias genéticas entre poblaciones que surgen a partir de un ensayo de procedencias ubicado en un solo sitio. Por tanto, no se cuantificaron las diferencias del crecimiento debidas a efectos ambientales, a la interacción genotipo × ambiente ni a la plasticidad fenotípica, para lo cual se requerirían al menos dos sitios de ensayo donde las poblaciones evaluadas sean desplazadas de manera recíproca preferentemente. Es posible que en sitios de ensayo con climas diferentes, las procedencias de L. elegans habrían mostrado un patrón de variación diferente. Por ello, es recomendable continuar con este tipo de ensayos en más de una localidad simultáneamente, de preferencia a lo largo de gradientes ambientales.
CONCLUSIONES
Hubo un patrón altitudinal en el cual poblaciones de L. elegans procedentes de una altitud menor producen plantas de menor altura y biomasa aérea, que poblaciones procedentes de altitud mayor, las que muestran altura y biomasa mayor. Las diferencias genéticas entre poblaciones son el resultado de adaptación a los gradientes ambientales.
Para reacoplar las poblaciones de L. elegans al clima para el cual están adaptadas y que ocurrirá en otro sitios, sería necesario realizar una migración asistida altitudinalmente hacia arriba, desplazando las poblaciones 550 m, en tres movimientos sucesivos de 150 m cada uno, en los años 2012, 2018 y 2024.
AGRADECIMIENTOS
Se agradece el financiamiento del Fondo Mixto CONACyT–Michoacán (FOMIX 2009–127128), de la Coordinación de la Investigación Científica de la UMSNH y de fondos Institucionales del CIEco–UNAM. Se agradece la ayuda de Esperanza Loya, Lorena Ruiz, Alfredo Camarillo y otras personas en el establecimiento, mantenimiento y evaluación del ensayo. Comentarios de Horacio Paz y Erick de la Barrera (CIEco–UNAM), de Philipe Lobit (IIAF–UMSNH) y de tres revisores anónimos, contribuyeron a mejorar significativamente el manuscrito.
LITERATURA CITADA
Alvarado–Sosa, P., A. Blanco–García, and R. Lindig– Cisneros. 2007. Test of alternative nursery propagation conditions for Lupinus elegans Kunth plants, and effects on field survival. Rev. Fitotec. Mex. 30(2): 201–204. [ Links ]
Bascur, G. 1996. Caracterización del crecimiento y comportamiento agronómico del Lupino (Lupinus angustifolius) en el Secano centro norte. In: Avances de Investigación en Lupino. Serie Carillanca. 51: 68–76. [ Links ]
Crookston, N. L. 2010. Research on Forest Climate Change: Potential Effects of Global Warming on Forests and Plant Climate Relationships in Western North America and Mexico http://forest.moscowfsl.wsu.edu/climate/ (Consultado: julio, 2010). [ Links ]
Dunn, D. B. 2001. Lupinus. In: Calderón de R., G. R., y J. Rzedowski. Flora Fanerogámica del Valle de México. Ed. Instituto de Ecología, A. C., CONABIO. Pátzcuaro, Michoacán México. pp: 290–300. [ Links ]
Fitzpatrick, C. M., D. A. Gove, J. N. Sanders, and R. R. Dunn. 2008. Climate change, plant migration, and range collapse in a global biodiversity hotspot: the Banksia (Proteaceae) of Western Australia. Global Change Biol. 14: 1337–1352. [ Links ]
Gómez–Mendoza, L., and L. Arriaga. 2007. Modeling the effect of climate change on the distribution of oak and pine species of Mexico. Conservation Biol. 21(6): 1545–1555. [ Links ]
Gómez–Romero, M., y R. Lindig–Cisneros. 2009. Emergencia de plántulas de Lupinus elegans Kunth y Crotalaria pumila Ort (Fabaceae) de semillas sembradas a diferentes profundidades. Biológicas 11: 37–42. [ Links ]
Hutchinson, M. F. 2004. ANUSPLIN version 4.3 user guide. Centre for Resource and Environmental Studies, The Australian National University, Canberra, 54 p. [ Links ]
Lara–Cabrera, S., N. Alejandre–Melena, E. Medina–Sánchez, and R. Lindig–Cisneros. 2009. Genetic diversity in populations of Lupinus elegans Kunth, implications for ecological restoration. Rev. Fitotec. Mex. 32: 79–86. [ Links ]
Ledig, F. T., G. E., Rehfeldt, C. Sáenz–Romero, and C. Flores–López, 2010. Projections of suitable habitat for rare species under global warming scenarios. Am. J. Bot. 97(6): 970–987. [ Links ]
Lenoir, J., J. C. Gégout, P. A. Marquet, P. de Ruffray, and H. Brisse. 2008. A significant upward shift in plant optimum elevation during the 20th Century. Science 320: 1768–1770. [ Links ]
Levitt, J. 1980. Responses of Plants to Environmental Stresses. Vol II. Water, radiation, salt and others. Academic Press, New York. 606 p. [ Links ]
Lindig–Cisneros, R., y A. Blanco–García, C. Sáenz–Romero, P. Alvarado–Sosa, y N. Alejandre–Melena. 2007. Restauración adaptable en la meseta Purépecha, Michoacán, México: hacia un modelo de estados de transiciones. Soc. Bot. Méx. 80: 25–31. [ Links ]
McLachlan, J., J. J. Hellmann, and M. W. Schwartz. 2007. A framework for debate of assisted migration in an era of climate change. Cons. Biol. 21: 297–302. [ Links ]
Medina–Sánchez, E. I., and R. Lindig–Cisneros. 2005. Effect of scarification and growing media on seed germination of Lupinus elegans. H. B. K. Seed Sci. Technol. 33: 237–241. [ Links ]
Oleskyn, J., P. B. Reich, M. G. Tjoelker and W. Chalupka. 2001. Biogeographic differences in shoot elongation pattern among European Scots pine populations. For. Ecol. Manage. 148(1–3): 207–220. [ Links ]
Pearson, R. G. 2006. Climate change and the migration capacity of species. Trends Ecol. Evol. 21(3): 111–113. [ Links ]
Rehfeldt, G. E. 1989. Ecological adaptations in Douglas–fir (Pseudotsuga menzienssii var. Glauca): a synthesis. For. Ecol. Manage. 28: 203–215. [ Links ]
Rehfeldt, G. E. 2004. Interspecific and intraspecific variation in Picea englemanii and its congeneric cohorts: biosystematics, genecology and climate change. Gen. Tech. Rep. RMRS–GTR–134. USDA For. Serv. 18 p. [ Links ]
Rehfeldt, G. E. 2006. A spline model of climate for the western United States. USDA Forest Service Gen. Tech. Rep. RMRS–GTR–165. Fort Collins, Clorado, U.S. Department of Agriculture, Forest Service, Rocky Mountain Research Station. 21 p. [ Links ]
Rehfeldt, G. E., D. E. Ferguson, and N. L. Crookston. 2009. Aspen, climate and sudden decline in western USA. For. Ecol. Manage. 258: 2353–2364. [ Links ]
Rehfeldt, G. E., N. L. Crookston, C. Sáenz–Romero, and E Campbell. 2012. North American vegetation analysis for land use planning in a changing climate: A statistical solution to large classification problems. Ecological Applications 22(1): 119–141. [ Links ]
Rice, K. J., and N. C. Emery. 2003. Managing microevolution: restoration in the face of global change. Frontiers Ecol. Environ. 1: 469–478. [ Links ]
Sáenz–Romero, C. 2004. Zonificación estatal y altitudinal para la colecta y movimiento de semillas de coníferas en México. In: Vargas–Hernández J. J., B. Bermejo–Velázquez, y F. T. Ledig (eds). Manejo de Recursos Genéticos Forestales. México, CONAFOR–Comisión Forestal de América del Norte. pp: 72–86. [ Links ]
Sáenz–Romero, C., R. Guzmán–Reyna and G. E. Rehfeldt. 2006. Altitudinal genetic variation among Pinus oocarpa populations in Michoacán, México; implications for seed zoning, conservation of forest genetic resources, tree breeding and global warming. For. Ecol. Manage. 229: 340–350. [ Links ]
Sáenz–Romero, C., and B. Tapia–Olivares. 2008. Genetic variation in frost damage and seed zone delineation within an altitudinal transect of Pinus devoniana (P. michoacana) in Mexico. Silvae Genetica 57(3): 165–170. [ Links ]
Sáenz–Romero, C., G. E. Rehfeldt, N. L. Crookston, P. Duval, R. St–Amant, J. Beaulieu, and B. A. Richardson. 2010. Spline models of contemporary, 2030, 2060 and 2090 climates for Mexico and their use in understanding climate–change impacts on the vegetation. Climatic Change 102: 595–623. [ Links ]
Sáenz–Romero, C., G. E. Rehfeldt, J. C Soto–Correa., S. Aguilar–Aguilar, V. Zamarripa–Morales, and J. López–Upton. 2012. Altitudinal genetic variation among Pinus pseudostrobus populations from Michoacán, México; two location shadehouse test results. Rev. Fitotec. Mex. 35(2): 111–120. [ Links ]
SAS Institute Inc. 2004. SAS / STAT 9.1 User's Guide. SAS Institute Inc. Cary, North Carolina, USA. 4975 p. [ Links ]
Sikuku P. A., G. W. Netondo, J. C. Onyango and D. M. Musyimi. 2010. Effects of water deficit on physiology and morphology of three varieties of nerica rainfed rice (Oryza sativa L.). J. Agric. Biol. Sci. 5(1): 23–28. [ Links ]
Tchebakova, N. M., G. E. Rehfeldt, and E. I. Parfenova. 2005. Impacts of climate change on the distribution of Larix spp. and Pinus sylvestris and their climatypes in Siberia. Mitig. Adapt. Strateg. Glob. Change 11(4): 861–882. [ Links ]
van Zonneveld, M., J. Koskela, B. Vinceti, y A. Jarvis. 2009. Repercusiones del cambio climático en la distribución de los pinos tropicales en Asia sudoriental. Unasylva 60: 231–232. [ Links ]
Viveros–Viveros, H., C, Sáenz–Romero, J. J. Vargas–Hernández, J. López–Upton, G. Ramírez–Valverde, and A. Santacruz–Varela. 2009. Altitudinal genetic variation in Pinus hartwegii Lindl. I: Heigh growth, shoot phenology, and frost demange in seedlings. For. Ecol. Manage. 257: 836–842. [ Links ]
Vitasse, Y., A. J. Porté, A. Kremer, R. Michalet, and S. Delzon., 2009a. Responses of canopy duration to temperature changes in four temperate tree species: relative contributions of spring and autumn leaf phenology. Oecology 161: 187–198. [ Links ]
Vitasse, Y., S, Delzon, C. C. Bresson, R. Michalet, and A. Kremer. 2009b. Altitudinal differentiation in growth and phenology among populations of temperate–zone tree species growing in a common garden. Can. J. For. Res. 39: 1259–2009. [ Links ]
Vitasse, Y., S. Delzon, E. Dufréne, J. Y. Pontailler, J. M. Louvet, A. Kremer, and R. Michalet. 2009c. Leaf phenology sensitivity to temperature in European trees: Do within–species populations exhibit similar response? Agric. For. Meteorol. 149:735–744. [ Links ]
White, T. L, W. T. Adams, and D. B. Neale. 2007. Forest Genetics. CABI Publishing, Oxfordshire, UK. [ Links ]
Zobel, B. y J. Talbert. 1988. Técnicas de Mejoramiento Genético de árboles Forestales. Limusa. México, D. F. 545 p. [ Links ]














