Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.46 n.5 Texcoco Jul./Aug. 2012
Ciencia de los alimentos
Diferencias estructurales y reológicas entre almidones de frutas y cereales
Structural and rheological differences between fruit and cereal starches
M. Guadalupe Casarrubias-Castillo, Guadalupe Méndez-Montealvo*, S. Leticia Rodríguez-Ambriz, M. María Sánchez-Rivera, L. Arturo Bello-Pérez
Centro de Desarrollo de Productos Bióticos del Instituto Politécnico Nacional. Km 8.5, Carretera Yautepec-Jojutla, Colonia San Isidro, apartado postal 24. 62731, Yautepec, Morelos, México.* Autor responsable. (cmendez@ipn.mx).
Recibido: septiembre, 2011.
Aprobado: julio, 2012.
Resumen
Los almidones se usan con varios fines en la industria según sus propiedades funcionales, las cuales son influenciadas por su organización estructural. El objetivo de este estudio fue evaluar las características morfológicas, fisicoquímicas y reológicas de almidones de cereales (maíz y cebada; Zea mays L. y Hordeum vulgare L.) y frutas (plátano y mango; Musa paradisiaca y Mangifera indica). Los gránulos del almidón de maíz eran esféricos, ovales y poligonales, entre 5 y 20 μm; los de cebada eran esféricos, entre 2 y 5 μm y ovales entre 15 y 25 μm; los de mango eran esféricos o de domo y punta, entre 5 y 12 μm; los de plátano eran alargados, con longitud promedio de 40 a 45 μm. El patrón de difracción de rayos X de los almidones de los cereales fue tipo A- y el de los frutos tipo C-. Éstos alcanzaron perfiles de formación de pasta mayores e índices de consistencia mayores que los de cereales; todos mostraron un comportamiento no-Newtoniano. En sus geles, el nivel de reorganización de los almidones no dependió de su fuente, sino de su estructura. La temperatura de pico y entalpía de gelatinización se relacionaron directamente con el tamaño de los gránulos. Sin embargo, su porcentaje de retrogradación fue independiente del tamaño de gránulo y del patrón de difracción de rayos X. Por tanto, la organización de los cristales dependió de la conformación de las dobles hélices de la amilopectina. Se concluye que el uso de los almidones depende de su organización estructural que le confiere características independientes de la fuente.
Palabras clave: almidón, formación de pastas, gel, rayos X.
Abstract
Starches are used for several purposes in industry depending on their functional properties, which are affected by their structural organization. The objective of this study was to evaluate the morphological, physicochemical and rheological characteristics of cereals (maize, Zea mays L., and barley, Hordeum volgare L.) and fruits (banana, Musa paradisiacal, and mango, Mangifera indica) starches. Maize starch granules were spherical, elliptical and polygonal, between 5 and 20 μm; those of barley were spherical between 2 and 5 μm and oval, between 15 and 25μm; those of mango starch were spherical or dome-shaped and split, with sizes between 5 and 12μ m; those of banana were long, with an average length of 40 to 45 μm. The X-ray diffraction pattern of cereal starches was type A- and that of fruits was type C-. The latter had higher pasting profiles and higher indexes of consistency than cereal starches. All starches exhibited non-Newtonian behavior. In their gels, the level of reorganization of the starches was not dependent on their source, but on their structure. Peak temperature and enthalpy of gelatinization was directly related to granule size. Their percentage of retrogradation, however, was independent of granule size and of X-ray diffraction pattern. Therefore, crystal organization depended on the conformation of the double helices of amylopectin. It is concluded that the use of starches depends on their structural organization that confers certain characteristics, regardless of the source.
Key words: starch, pasting formation, gel, X-rays.
INTRODUCCIÓN
El almidón modifica la textura de los alimentos por lo que industrialmente se usa como espesante, estabilizador coloidal y adhesivo. Hay varios métodos para caracterizar el almidón y así seleccionar variedades o genotipos que presenten propiedades específicas. El tamaño del gránulo afecta la composición, propiedades reológicas y transiciones de fase producidas al calentar una dispersión de almidón (Kulp, 1973). Además, la pérdida del orden de los componentes del almidón, amilosa y amilopectina puede estar relacionada con cambios irreversibles en sus propiedades, como hinchamiento, formación de pasta y disolución (Biliaderis, 1991).
El viscoamilógrafo Brabender, el analizador rápido de viscosidad (ARV) y los viscosímetros rotacionales se usan para medir la viscosidad de las pastas de almidón (Wiesenborn et al., 1994) y el reómetro para evaluar las propiedades viscoelásticas de los almidones (Hsu et al., 2000). El estudio de la micro-estructura de las pastas-geles de almidón es necesario para entender la relación entre composición química y propiedades viscoelásticas características (Singh et al., 2003). Aunque Bello-Pérez y Paredes López (2009), Bello-Pérez et al. (2010) y Rivas-González et al. (2008) analizaron aspectos morfológicos, fisico-químicos y estructurales de diversos almidones, no se ha establecido la relación entre el origen y sus características para la formación de pastas o viscosidad. Por tanto el objetivo de este estudio fue evaluar la influencia del origen del almidón en sus características morfológicas, propiedades fisicoquímicas y reológicas que proviene de cereales o frutos.
MATERIALES Y MÉTODOS
Aislamiento del almidón
El almidón de frutos de plátano (Musaparadisiaca L.) y mango (Mangifera indica Var. Tommy Atkins) inmaduros, adquiridos en el mercado de Cuautla Morelos, México, fue aislado en una planta piloto mediante el procedimiento propuesto por Flores-Gorosquera et al. (2004). El almidón de cebada (Hordeum vulgare L.) fue extraído con el procedimiento propuesto por Adkins y Greenwood (1966), y el de maíz (Zea mays L.) fue donado por Industrializadora de Maíz S.A. de C.V. (Guadalajara, Jalisco, México).
Microscopía electrónica de barrido
Las muestras de almidón se espolvorearon sobre una cinta conductora de cobre de doble adhesión fijada en un soporte de aluminio del microscopio electrónico de barrido (MEB) JEOL (modelo JSEM 35CX; Japan Electronic Optical Limited, Japón). Las muestras se cubrieron con una capa de carbón de 30 nm de espesor depositada al vacío (10-5 Torr) en una evaporadora JEOL. La capa uniforme en la superficie se logró con el adaptador rotatorio de ángulo variable de la evaporadora. Las muestras se colocaron en el ionizador de metales, se recubrieron con una capa de oro de 60 nm, se observaron y fotografiaron en el MEB a un voltaje de 8 KV (Ottenhof, 2003).
Difracción de rayos X
Las muestras se colocaron sobre el porta muestras del di-fractómetro de rayos X (Bruker D5005); de ángulo ancho, equipado con fuente de cobre, operado a 40 kV y 30 mA, produciendo una radiación de CuKa con una longitud de onda de 1.54 A. Los datos se recolectaron en un intervalo de 4 a 38° cada 0.1°, con velocidad de barrido de 60 s/°. La línea base del difractograma se corrigió en el intervalo de barrido y el vector se normalizó con el programa OPUS 3.0 (Bruker, UK) (Ottenhof, 2003).
Formación de pastas y curvas de flujo de los almidones
Se prepararon dispersiones al 5 % (p/v) de sólidos totales en agua destilada y se colocaron en un reómetro (TA Instruments AR 1000-N; New Castle, EE.UU.), con sistema de placas paralelas. La placa superior fue de acrílico con textura estriada, de 60 mm de diámetro, y el espesor de muestra fue 1 mm. El sistema de placas se cubrió con aceite mineral para evitar la evaporación del agua durante la prueba. La medición se realizó durante un ciclo de calentamiento de 25 °C hasta 90 °C y se hizo una etapa isotérmica por 10 min; se enfrió a 25 °C y se mantuvo por 10 min. Se usó una velocidad de calentamiento-enfriamiento de 2.5 °C min-1 y una velocidad de cizallamiento de 50 s-1. Después el equipo se programó para dos ciclos: ascendente y descendente de 0.03 a 100 s-1, y un tercer barrido descendente de 100 a 0.03 s-1. En los datos obtenidos del tercer ciclo se aplicó la ecuación de la ley de la potencia de Ostwald-de Waele en función del esfuerzo de corte (Τ), dondeγ=f(τ), para calcular los parámetros de índice de consistencia (K, Pa.sn) e índice de comportamiento de flujo (n, adimensional), con lo que se definió el comportamiento del fluido (Steffe, 1992; Tecante y Doublier, 1999). Las determinaciones se hicieron por triplicado.
Método oscilatorio de baja amplitud: cinética de gelificación
Las propiedades viscoelásticas de las dispersiones se midieron con pruebas oscilatorias de baja amplitud en un reómetro (TA Instruments AR 1000-N; New Castle, EE.UU.) en un sistema de placas paralelas de 60 mm de diámetro (placa superior de acrílico y estriada) y espesor de muestra de 1 mm; las placas paralelas se cubrieron con aceite mineral. Los barridos de amplitud de la deformación se realizaron en un intervalo de 0.03 a 5 %, frecuencia de 1Hz, en un ciclo de calentamiento de 25 a 90 °C y barridos a 90 °C (Etapa 1), enfriamiento de 90 a 25 °C y barridos a esta temperatura final (Etapa 2). Para determinar la región viscoelástica lineal (RVL) se usó una velocidad de calentamiento-enfriamiento de 2.5 °C min-1. Los barridos de frecuencia se realizaron en el intervalo de 0.1 a 10 Hz, con amplitud de deformación de 0.5 %, con el mismo procedimiento de calentamiento-enfriamiento. En las dos etapas se obtuvieron los módulos de almacenamiento (G', Pa) y pérdida (G", Pa). Las determinaciones fueron por triplicado.
Caracterización térmica
Las propiedades térmicas de gelatinización y retrogradación se evaluaron con un calorímetro de barrido diferencial (TA Instruments, 2010; New Castle, EE.UU.). La gelatinización de los almidones se evaluó con el método propuesto por Paredes-López et al. (1994): 2 mg de muestra seca se colocaron en una charola de aluminio con 7 μL de agua desionizada y se deja equilibrar a temperatura ambiente 1 h antes de realizar el análisis. Como referencia se usó una charola sin muestra. La muestra equilibrada se sometió a un programa de calentamiento en el intervalo de 30 a 120 °C, con velocidad de calentamiento de 10 °C min-1. Las temperaturas de inicio (Ti, °C), pico (Tp, °C) y final (Tf °C), y la diferencia de entalpia (ΔH, J g-1) se obtuvieron directamente con el programa TA Instruments 2010 versión 2.1. Las determinaciones fueron por triplicado.
Para estudiar la retrogradación de los almidones las muestras gelatinizadas se almacenaron 7 d a 4 °C, después se equilibraron por 1 h a temperatura ambiente y se analizaron en las mismas condiciones de barrido de gelatinización. Los parámetros de Ti, Tp, Tf (oC) y ΔH (Jg-1) de retrogradación se colocaron con el programa de TA Instrument.
RESULTADOS Y DISCUSIÓN
Microscopía electrónica de barrido
Los gránulos de los almidones de cereales y frutos difirieron en su morfología (Figura 1). El almidón de maíz (Figura 1A) mostró formas esférica, oval y con predominio de poligonal, con tamaño pequeño (aproximadamente 5 μm) y grande (hasta 20 μm). En el almidón de cebada (Figura 1B) hubo dos poblaciones de gránulos: pequeños (2-5 μm) y esféricos; grandes (15-25 μm) y lenticulares. Los gránulos del almidón de mango con forma esférica o de domo y puntas, presentaron hendiduras que podrían deberse al crecimiento no uniforme del gránulo o a un colapso durante el secado, y tamaños de 5 a 12 μm (Figura 1C). El almidón de plátano tuvo un gránulo más grande, con longitud promedio de 40 a 45 μm y radio de 10 a 12 μm (Figura 1D). El tamaño y forma de los gránulos depende de la estructura de la amilo-pectina. Los gránulos alargados tienen amilopectina con pocas ramificaciones pero largas, y gránulos pequeños y esféricos con mayor número de ramificaciones y cadenas cortas (Jane et al. 1999). Así, el origen botánico determina tamaño y forma de los gránulos. Además, esta característica repercute en algunas propiedades fisicoquímicas, funcionales y nutricionales: gránulos grandes pueden generar viscosidad alta de pasta y los pequeños mayor digestibilidad (Biliaderis, 1991).
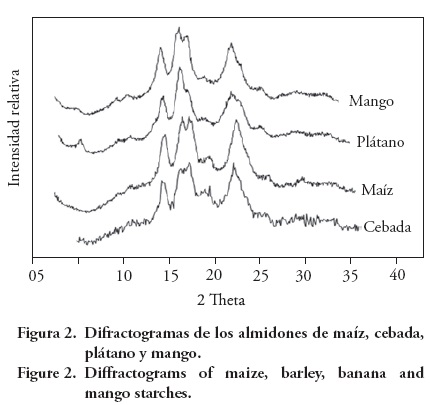
Difracción de rayos X
Los almidones de maíz y cebada tenían patrón de difracción de rayos X tipo A- (Figura 2); en este tipo compacto de paquete cristalino de las dobles hélices hay contenido bajo de moléculas de agua y forma una celda unitaria del tipo monoclínico. Según Eliasson y Gudmundsson (1996), la formación de los cristales tipo A- es favorecida por la presencia de longitud de cadena promedio corta. Los almidones de plátano y mango presentaron un patrón de rayos X tipo C-, que es una mezcla de los patrones A- y B-. La presencia del pico a 2θ=5.4° indica el polimorfismo tipo B-y estructura más hidratada y más abierta. La presencia del pico a 2θ=5.4° es más evidente en el almidón de plátano. El orden de los gránulos de almidón puede variar del hilio (centro) a la periferia. Los gránulos de almidón de chícharo (Pisum sativum) son ricos en tipo B- en el centro de las estructuras, mientras que en la periferia son ricos en el tipo polimórfico A-(Tester et al. 2004); un caso similar se observó en los almidones de los frutos. Aunque todos los almidones mostraron ligera diferencia en el pico a 20=20° debida al complejo amilosa-lípido (Morrison, 1995), fue más evidente en cereales.
Formación de pastas
En los perfiles de formación de pasta se apreció la diferencia entre los almidones de cereales y frutos; los últimos tuvieron mayor viscosidad durante el perfil completo (Figura 3). En la etapa de calentamiento la viscosidad aumentó gradualmente hasta un valor máximo. El almidón de cereales presentó pico de viscosidad menor que el de los frutos; un pico de viscosidad mayor refleja la facilidad de los gránulos para hincharse libremente antes de romperse (The-baudin et al., 1998). En todos los casos la viscosidad aumentó durante la etapa de enfriamiento debido a la reorganización de las cadenas lineales lixiviadas durante las etapas de calentamiento, y mayor número de zonas de unión durante la formación de la pasta y, por tanto, una red que retiene más agua (Mali et al., 2003). Esta tendencia puede estar asociada con la organización interna de los gránulos, porque de acuerdo al patrón de difracción de rayos-X los almidones de los frutos presentaron combinación de estructuras y por ser abierta da la posibilidad de hincharse en mayor proporción, lo cual concuerda con los perfiles de formaciones de pasta. En contraste, la estructura del almidón de cereales fue más cerrada (Patrón de difracción tipo A-), lo que limita su hinchamiento. Además, la interacción con lípidos (pico 2θ=20°) reduce su capacidad de hinchamiento.
Curvas de flujo
Los almidones de los frutos tuvieron viscosidad mayor que los cereales en el intervalo de velocidad de corte analizado, y este comportamiento coincide con la tendencia en la formación de pastas.
Para ajustar los datos experimentales (R>0.99) se usó el modelo de Ostwald de Waele (Ley de la Potencia) (Cuadro 1). Todos los almidones presentaron un índice de comportamiento de flujo (n) menor a 1, definiéndolos como fluidos no-Newtoniano; su viscosidad decrece al aumentar la velocidad de corte (Figura 4). Este comportamiento se denomina reofluidizante y ocurre cuando el esfuerzo desorganiza el arreglo de las moléculas de la matriz. La fuente del almidón no tuvo relación con el valor de n porque todos los almidones tuvieron valores similares.


El índice de consistencia (K) no mostró la misma tendencia que n y el orden de K fue: mango > plátano > maíz > cebada. Los valores coincidieron con el comportamiento de formación de pasta y los almidones de los frutos tuvieron más consistencia que los de los cereales. El tamaño de gránulo es relevante en las características reológicas, pero es más importante la organización interna de sus componentes. El almidón de plátano tuvo tamaño mayor de gránulo, pero el de mango tuvo valores mayores en la formación de pastas y curvas de flujo.
Método oscilatorio de amplitud baja: cinética de gelificación
La gelatinización se caracteriza por el incremento de los módulos dinámicos, como los módulos de almacenamiento (G') y de pérdida (G''), atribuídos al hinchamiento de los gránulos y la lixiviación de la amilosa. Posterior al calentamiento, cuando la dispersión de almidón gelatinizado se enfría, se forma un gel. Para analizar sus características dinámicas se definió la región viscoelástica lineal con la amplitud de la deformación (gráficos no mostrados) en esta región. Las propiedades reológicas no dependen del esfuerzo ni de la deformación. Con los gráficos se estableció que 0.5 % de deformación es adecuado para realizar los barridos de frecuencia en la cinética de calentamiento-enfriamiento.
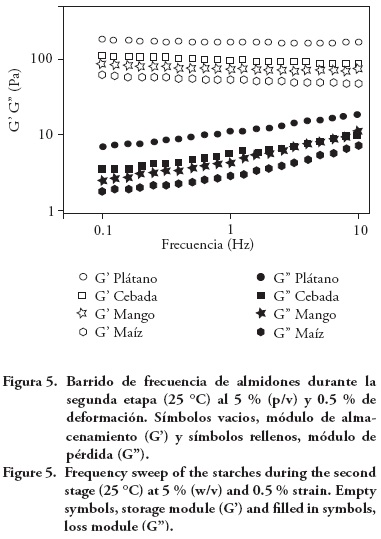
En los barridos de frecuencia a 90 y 25 °C, G' fue mayor que G'' en el intervalo de frecuencia analizado; a 90 °C fue el hinchamiento mayor de los gránulos (gráfico no mostrado) donde el almidón de plátano alcanzó los valores mayores de G' y de G'', lo que se relaciona al tamaño mayor de sus gránulos. A 25 °C (Figura 5), todos los almidones tuvieron G' constante en el intervalo de frecuencia analizado y G" presentó dependencia ligera, manifestándose así el re-ordenamiento de la amilosa durante la formación del gel y con ello la formación de la matriz tridimensional que ocluye a los gránulos de almidón ricos en amilopectina. El almidón de plátano también mostró los valores mayores de G' y G". De acuerdo con Espinosa-Solís et al. (2009) y Bello-Pérez et al. (2010), esta respuesta se debe al contenido mayor de amilosa (plátano 36.2 %, mango 31.1 %, maíz 29.7 % y cebada 28.4 %). Sin embargo, en los módulos la tendencia fue almidón de plátano seguido de cebada, mango y maíz. El porcentaje de amilosa afecta la formación de la red tridimensional, pero la amilopectina en los gránulos de almidón hinchados también es importante. El almidón de cebada tiene menos amilosa y por tanto más amilopectina, por lo que su organización interna le permite mayor movilidad y mayor G' respecto a los almidones de mango y maíz. El tamaño de granulo y contenido de amilosa fueron mayores en plátano; por tanto, su gel fue más resistente a la deformación y sus valores fueron de los módulos mayores.
Caracterización térmica
El almidón de cebada presentó los valores menores en la transición ocasionada por la gelatinización en la temperatura de pico (Tp, 61.8 °C) y en el cambio en entalpía (ΔHg, 10.4 J g-1) (Cuadro 2), mientras que los almidones de maíz y mango tuvieron valores similares, mayores a los de cebada y menores a los de plátano. Éste mostró temperatura pico de 77.4 °C y cambio en entalpia de 14.2 J g-1. La temperatura de gelatinización y el cambio de entalpía presentaron la misma tendencia que el tamaño de gránulos: cebada tuvo el tamaño menor de gránulo, maíz y mango tuvieron valor similar y el de plátano fue el mayor. Tester (1997) señala que el grado de perfección de los cristales refleja temperatura de gelatinización mayor, pero la heterogeneidad de los gránulos y cristales presentes también se puede evaluar con el intervalo de gelatinización. El almidón de plátano mostró el mayor intervalo, similar al de cebada, y menor al de mango y maíz; esta tendencia es como la observada en G'y G".
El almidón de plátano tuvo el intervalo de temperatura de retrogradación más amplio, lo que indicó que los cristales formados durante el almacenamiento fueron heterogéneos. Además tuvo grado de retro-gradación mayor, pues requirió mayor temperatura y cambio de entalpia para desorganizar sus cristales (Cuadro 3), y su porcentaje de retrogradación fue el mayor de todos. El almidón de maíz tuvo porcentaje de retrogradación similar al de plátano, y el de cebada y mango tuvieron porcentajes menores. Esto se relaciona con la organización de las ramificaciones de la amilopectina, la presencia de dobles hélices y distribución de las cadenas de tamaño diferente de amilopectina.
CONCLUSIONES
El uso de los almidones depende de su organización estructural más que de la fuente de la cual provienen. Los almidones obtenidos de frutos presentaron patrón de difracción tipo C y mayores capacidades de formación de pastas. Sin embargo, en las propiedades térmicas, como temperatura promedio de pico y entalpía de gelatinización, la respuesta se relaciona directamente con el tamaño de gránulo, y la capacidad de formación de geles (pruebas dinámicas) se asocia con la heterogeneidad de los cristales en los almidones, dada por el intervalo de gelatinización. Las diferencias fisicoquímicas, funcionales y reológicas de los almidones de cereales y frutos se deben a sus características de tamaño, forma y arreglo cristalino, por lo cual puede tener diferentes aplicaciones.
AGRADECIMIENTOS
Se agradece el apoyo económico de SIP-IPN, COFAA-IPN y EDI-IPN.
LITERATURA CITADA
Adkins, G. K., and C. T. Greenwood. 1966. The isolation of cereal starches in the laboratory. Starch/Starke 7: 213-218. [ Links ]
Bello-Pérez, L. A., and O. Paredes-López. 2009. Starches of some food crops, changes during processing and their nutraceutical potential. Food Eng. Rev. 1: 50-65. [ Links ]
Bello-Pérez, L. A., M. M. Sánchez-Rivera, C. Núñez-Santiago, S. L. Rodríguez-Ambriz, and A. D. Román-Gutiérrez. 2010. Effect of the pearled in the isolation and the morphological, physicochemical and rheological characteristics of barley starch. Carbohydrate Polymers 81: 63-69. [ Links ]
Biliaderis, C. G. 1991. The structure and interactions of starch with food constituents. Can. J. Physiol. Pharmacol. 69: 60-78. [ Links ]
Eliasson, A. C., and M. Gudmundsson. 1996. Starch: Physicochemical and functional aspects. In: Eliasson, A. C. (ed). Carbohydrates in Food. Marcel Dekker Inc., New York, U.S.A. pp: 431-482. [ Links ]
Espinosa-Solis, V., J. L. Jane, and L. A. Bello-Pérez. 2009. Phy-sicochemical characteristics of starches from unripe fruits of mango and banana. Starch/starke 61: 291-299. [ Links ]
Flores-Gorosquera, E., F. J. García-Suárez, E. Flores-Huicochea, M. C. Núñez-Santiago, R. A. González-Soto, y L. A. Bello-Pérez. 2004. Rendimiento del proceso de extracción de almidón a partir de frutos de plátano (Musa paradisiaca) estudio en planta piloto. Acta Científica Venezolana 55: 86-90. [ Links ]
Hsu, S., S. Lu, and C. Huang. 2000. Viscoelastic changes of rice starch suspensions during gelatinization. J. Food Sci. 65: 215-220. [ Links ]
Jane, J., Y. Y. Chen, L. F. Lee, A. E. McPherson, K. S. Wong, M. Radosavljevic, and T. Kasemsuwan. 1999. Effects of amylo-pectin branch chain length and amylose content on the ge-latinization and pasting properties of starch. Cereal Chem. 76: 629-637. [ Links ]
Kulp, K. 1973. Characteristics of small-granule starch of flour wheat. Cereal Chem. 50: 666-679. [ Links ]
Mali, S., C. Ferrero, V. Redigonda, A. P. Belia, M. V. E. Grossmann, and N. E. Zaritzky. 2003. Influence of pH and hydrocolloids addition on yam (Discorea alata) starch pastes stability. Lebensmittel-Wissenschaft Und-Technologie 36: 475-481. [ Links ]
Morrison W.R. 1995. Starch lipids and how they relate to starch granule structure and functionality. Cereal Foods World 40: 437-446. [ Links ]
Ottenhof, M. A. 2003. A multi-technique study of the retrogradation of concentrated starch systems. Ph.D. Thesis. Division of Food Science. University of Nottingham, UK. [ Links ]
Paredes-López, O., L. A. Bello-Pérez, and M. G. López. 1994. Amylopectin structural, gelatinization and retrogradation studies. Food Chem. 50: 411-418. [ Links ]
Rivas-González, M., M. G. Méndez-Montealvo, M. M. Sánchez-Rivera, M. C. Núñez-Santiago, y L. A. Bello- Pérez. 2008. Caracterización morfológica, molecular y fisicoquímica de almidón de plátano oxidado y lintnerizado. Agrociencia 42: 487-497. [ Links ]
Singh, N., J. Singh, L. Kaur, N. Singh-Sodhi, and B. Singh-Gill. 2003. Morphological, thermal and rheological properties of starches from different botanical sources. Food Chem. 81: 219-231. [ Links ]
Steffe, J. F. 1992. Rheological Methods in the Food Process Engineering. Freeman Press. East Lansing. Michigan. 418 p. [ Links ]
Tecante, A., and J. L. Doublier. 1999. Steady flow and viscoelastic behaviour of crosslinked waxy corn starch-k-carrageenan pastes and gels. Carbohydrate Polymers 40: 221-231. [ Links ]
Tester, R. F., J. Karkalas, and X. Qi. 2004. Starch-composition, fine structure and architecture. J. Cereal Sci. 39: 151-165. [ Links ]
Tester, R. F. 1997. Starch: the polysaccharide fractions. In: Starch: Structure and Functionality. UK: The Royal Society of Chemistry. Cambridge. pp: 163-171. [ Links ]
Thebaudin, J. Y., A. C. Lefebvre, and J. L Doublier. 1998. Rheology of starch pastes from starches of different origins: applications to starch-based sauces. Lebensmittel-Wissenschaft und-Technologie 31: 354-360. [ Links ]
Wiesenborn, D. P., P. H. Orr, H. H. Casper, and B. K. Tacke. 1994. Potato starch behaviour as related to some physical/chemical properties. J. Food Sci. 59:644-648. [ Links ]














