Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.46 no.4 Texcoco may./jun. 2012
Ciencia animal
Efecto del pH y del líquido ruminal clarificado en la estabilidad de un producto enzimático fibrolítico
Effect of pH and clarified ruminal fluid on the stability of an exogenous fibrolityc enzyme product
Edgar Meraz-Romero1*, Octavio Loera-Corral2, Germán D. Mendoza-Martínez3, Marcos Meneses-Mayo4, Mario A. Cobos-Peralta4, David Hernández-Sánchez4, Sergio C. Angeles-Campos1, Lucas G. Melgarejo-Velasquez1, J. Manuel Pinos-Rodríguez5
1 Departamento de Nutrición Animal y Bioquímica, Facultad de Medicina Veterinaria y Zootecnia. UNAM. 04510. Ciudad Universitaria, D. F. México. (emerazr@yahoo.com.mx). * Autor responsable.
2 Biotecnología, Universidad Autónoma Metropolitana–Iztapalapa. 09340. D. F. México
3 Departamento de Producción Agrícola y Animal. Universidad Autónoma Metropolitana–Xochimilco. 04960. D. F. México.
4 Ganadería, Campus Montecillo, Colegio de Postgraduados. 56230. Montecillo, Estado de México.
5 Instituto de Investigación en Zonas Desérticas, Universidad Autónoma de San Luis Potosí. 78377. San Luis Potosí, México.
Recibido: octubre, 2011.
Aprobado: marzo, 2012.
Resumen
Las enzimas fibrolíticas exógenas no son sintetizadas por los microorganismos ruminales, por lo cual se adicionan al alimento para aumentar la degradación de la fibra. El objetivo de este estudio fue evaluar in vitro la actividad xilanasa, celulasa y lacasa, así como la estabilidad enzimática de xilanasas y celulasas de un producto enzimático fibrolítico (Fibrozyme, Alltech, Inc.). El diseño experimental fue completamente al azar y los tratamientos fueron: amortiguador pH 6.0, amortiguador pH 7.0 y líquido ruminal clarificado pH 6.5. Los datos se analizaron con mediciones repetidas en el tiempo, mediante el procedimiento Mixto de SAS y la prueba de Tukey (p≤0.05). El producto enzimático exógeno contenía xilanasas 292 UI g-1 y celulasas 36 UI g-1, sin actividad de lacasas. En amortiguador con pH 6 las celulasas fueron más estables que las xilanasas, y ambas enzimas mostraron actividad hasta las 46 h. Las constantes de velocidad de inactivación enzimática (k) fueron —0.054 h-1 en xilanasas y —0.008 h-1 en celulasas, y los tiempos de vida media (t½) 12.8 y 87.7 h. En amortiguador pH 7 las celulasas se mantuvieron más estables y las xilanasas perdieron su actividad a las 32 h; los valores de k fueron —0.07 h-1 y — 0.009 h-1 , y de t½ 9.9 y 77 h para xilanasas y celulasas. En el medio con líquido ruminal clarificado, las celulasas mantuvieron más estable su actividad y las xilanasas la perdieron en 4 h (k=—1.815 h-1 y —0.026 h-1; t½ — 0.38 y 26.87 h para xilanasas y celulasas). Se concluye que in vitro, el pH y las enzimas contenidas en el líquido ruminal clarificado afectan la estabilidad del producto enzimático fibrolítico exógeno.
Palabras clave: celulasas, enzimas fibrolíticas, estabilidad enzimática, xilanasas.
Abstract
Exogenous fibrolytic enzymes are not synthesized by the ruminal microorganisms, so they are added to feed in order to increase fiber degradation. The objective of this study was to evaluate in vitro xilanase, cellulose and laccase activity, as well as xylanase and cellulose enzymatic stability of an enzymatic fibrolytic product (Fibrozyme Alltech, Inc.). The experimental design was completely randomized and treatments were: buffer pH 6.0, buffer pH 7.0 and clarified ruminal fluid pH 6.5. Data were analyzed using the SAS Mixed procedure and the Tukey test (p≤0.05). The exogenous enzyme product contained 292 IU xylanase g-1 and 36 IU cellulase g-1 , without laccase activity. In buffer with pH 6 cellulases were more stable than the xylanases, and both enzymes showed activity until 46 h. The speed constants of enzymatic inactivation (k) were — 0.054 h-1 in xylanases and —0.008 h-1 in cellulases, and half life time (t½) of 12.8 and 87.7 h. In buffer pH 7 cellulases remained more stable and the xylanases lost their activity at 32 h; values of k were —0.07 h-1 and — 0.009 h-1, and t½ of 9.9 and 77 h for xylanases and cellulases. In the medium with clarified ruminal fluid, cellulases maintained more stable their activity and xylanases lost it in 4 h (k—1.815 h-1 and —0.026 h-1; t½=0.38 and 26.87 h for xylanases and cellulases). It is concluded that in vitro pH and enzymes contained in the clarified ruminal fluid affect the stability of the exogenous fibrolytic enzyme product.
Key words: cellulases, fibrolytic enzymes, enzymatic stability, xylanases.
INTRODUCCIÓN
En estudios in vitro e in sacco las enzimas fibrolíticas mejoran la degradación de la materia seca (MS; Almaraz et al., 2010; Gallardo et al., 2010) y según Pinos et al. (2002) una mezcla de enzimas hidrolíticas fue más efectiva para aumentar la digestión in vivo. El modo de acción de estas enzimas en los rumiantes es una combinación de efectos antes (tiempo de interacción enzima-sustrato) y después de la alimentación (pH ruminal; Colombatto et al., 2007). Al respecto, Kung et al. (2000) afirman que la adición de enzimas al alimento puede crear un complejo enzima-alimento estable el cual protege a las enzimas de la proteólisis ruminal. Las enzimas fibrolíticas, aisladas de cultivos de hongos y bacterias, aumentan la degradación durante el proceso de ensilaje de algunos forrajes (Stokes, 1992); además, mejoran la digestibilidad in vitro de la MS y la fibra detergente neutra (FDN; Feng et al., 1996), y una mezcla de enzimas con varias actividades puede ser más efectiva (Yang et al., 1999).
Fibrozyme es un producto comercial (Alltech Inc., Nicholasville, KY, USA) a base de celulasas, hemicelulasas y proteasas, tiene grado alto de glucosilación que puede contribuir a su estabilidad en el rumen, y su actividad xilanásica es 100 UI g-1 (Tricarico et al., 1998). La actividad de las enzimas en productos enzimáticos comerciales para rumiantes se mide según las recomendaciones del fabricante (aproximadamente 60 °C y pH entre 4 y 5; Coughlan, 1985), pero esas condiciones no son representativas del ambiente ruminal (39 °C y pH 6.0 a 6.7) donde actúan las enzimas (Van Soest, 1994). Además, las condiciones y métodos usados en diversos estudios varían, y esto dificulta una comparación de los productos o la predicción de su eficacia en dietas para rumiantes (Beauchemin et al., 2003).
El objetivo del presente estudio fue caracterizar in vitro la actividad de xilanasas, celulasas y lacasas de un producto enzimático fibrolítico exógeno, y evaluar la estabilidad enzimática con pH diferentes y en líquido ruminal clarificado.
MATERIALES Y MÉTODOS
Este estudio se llevó a cabo en el Laboratorio de Enzimología y Biología Molecular de la Universidad Autónoma Metropolitana, Unidad Iztapalapa, México, D. F. Una muestra del producto enzimático fibrolítico Fibrozyme se utilizó en todas las pruebas.
Contenido de proteína
Para analizar el contenido de proteína se disolvió 1 g (por duplicado) del producto enzimático en 50 mL de agua destilada por 1 h con un agitador magnético, se centrifugó a 12 100 x g por 20 min y se guardó el sobrenadante (extracto enzimático) en refrigeración a 4 °C, para análisis posteriores. A 800 mL de extracto enzimático diluido (1:20) en amortiguador de acetatos (0.1 M, pH 5), se añadieron 200 mL de reactivo de Bradford (Bio-RAD) y se agitó con un vórtex. La reacción duró 5 min y la absorbancia se leyó a 595 nm en una celdilla de acrílico en un espectrofotómetro (DU 640 Beckman, EE.UU.). La cantidad de proteína se determinó a dos pH con seroalbúmina bovina en solución de 0.15 M NaCl (Bradford, 1976). Se diluyeron 50 mL de amortiguador de citratos (50 mM y pH 5.3) en 450 mL de agua destilada; en 50 mL de esa solución se disolvió 1 g del producto por 1 h con un agitador magnético, se centrifugó a 12 100 x g por 20 min, y al sobrenadante (extracto enzimático) se agregaron 50 mL de amortiguador de citratos (50 mM y pH 6) o de fosfatos (50 mM y pH 7), según correspondiera. Se mantuvo a 4 °C y se midió el contenido de proteína.
Actividad de xilanasas
Esta actividad se midió con el método del ácido dinitrosalicílico (DNS; Miller, 1959), para azúcares reductores, modificado por Loera y Córdova (2003) y Márquez-Araque et al. (2007), descritas a continuación. El sustrato fue xilano (Sigma-Aldrich X-0627) al 0.5 % (2.5 g de xilano en 0.5 L de amortiguador de citratos 50 mM y pH 5.3). La curva estándar se preparó con una solución de xilosa 10 mM (0.15 g en 100 mL-1 de amortiguador de citratos 50 mM y pH 5.3). La mezcla de la reacción de la muestra contenía 0.9 mL de sustrato y 0.1 mL del extracto enzimático diluido (1:100), en tubos de ensaye por triplicado. La incubación duró 5 min a 50 °C, se aplicaron 1.5 mL DNS, se hirvieron 5 min, luego los tubos se metieron en un recipiente con hielo y se midió la absorbancia a 540 nm. Para cada muestra se preparó un blanco con 0.9 mL de sustrato incubado 5 min a 50 °C, luego se aplicó 1.5 mL DNS y 0.1 mL del extracto enzimático diluido (1:100), se hirvió 5 min, se depositó en un recipiente con hielo, y se midió la absorbancia a 540 nm. Se usó un blanco general con 0.9 mL sustrato y 0.1 mL amortiguador de citrato pH 5.3, se incubó 5 min a 50 °C, se aplicó 1.5 mL DNS, se hirvió 5 min, se depositó en un recipiente con hielo, y la absorbancia se midió a 540 nm.
Actividad de celulasas
Esta actividad se midió con la concentración de azúcares reductores con el método del DNS (Miller, 1959) modificado por Loera y Córdova (2003) y por Purkarthofer et al. (1993), descrito a continuación. El sustrato fue carboximetil celulosa (Sigma-Aldrich C4888) al 0.5 % (2.5 g de carboximetil celulosa en 0.5 L de amortiguador de citratos 50 mM y pH 4.8); además, se preparó una solución de glucosa 10 mM (0.18 g glucosa 100 mL-1 de amortiguador de citratos 50 mM y pH 4.8) para la curva estándar. La mezcla de la reacción para cada muestra contenía 0.9 mL de sustrato y 0.1 mL del extracto enzimático diluido (1:100). Se usaron tubos de ensaye por triplicado, la incubación fue de 60 min a 50 °C, se agregó 1.5 mL de DNS y se hirvió 5 min; los tubos se metieron en un recipiente con hielo y se midió la absorbancia a 540 nm. Para cada muestra se preparó un blanco con 0.9 mL de sustrato, se incubó 60 min a 50 °C, se agregó 1.5 mL de DNS y 0.1 mL del extracto enzimático diluido (1:100), se hirvió por 5 min, se depositó en un recipiente con hielo, y la absorbancia se midió a 540 nm. El blanco general contenía 0.9 mL de substrato y 0.1 mL de amortiguador de citrato pH 5.3, que se incubó 60 min a 50 °C, se agregó 1.5 mL de DNS y se hirvió 5 min; luego se depositó en un recipiente con hielo y se midió la absorbancia a 540 nm.
Actividad de lacasas
Esta actividad se determinó en un sistema de reacción de 1 mL el cual contenía 0.1 mL de amortiguador de acetatos (0.1 M y pH 5.0), 0.7 mL de agua destilada, 0.1 mL del extracto enzimático sin diluir y 0.1 mL de substrato ABTS [(0.69 g de ABTS 2,2'azino-bis(3-etilbenzeno-thiazolina-6-ácido sulfónico)] disuelto en 250 mL de amortiguador de acetatos (0.1 M y pH 5.0). El coeficiente de extinción molar para el ABT S fue 36 000 M-1 cm-1. El sistema de reacción sin substrato se preincubó 1 min a 40 °C, se adicionó el sustrato y se midieron los incrementos de la absorbancia, a 420 nm, después de 0, 1, 2, 3 y 5 min. Una unidad de actividad (UI) se definió como la cantidad de enzima que produce 1 µmol de substrato oxidado por minuto en las condiciones de reacción. La determinación de la actividad de lacasas en todos los casos se hizo por duplicado (Bourbonnais et al, 1997).
Estabilidad enzimática
Esta actividad se evaluó por duplicado con 50 mL de amortiguador de citratos 50 mM pH 5.3 diluidos en 450 mL de agua destilada; se usaron 50 mL de esa dilución para disolver 1 g del producto enzimático por 1 h con un agitador magnético, y se centrifugó 20 min a 12 100 x g. Al sobrenadante se agregaron 50 mL de amortiguador de citratos (0.05 M y pH 6) o amortiguador de fosfatos (0.05 M y pH 7), para un volumen de 100 mL, y se colocó 1 mL de esa solución en microtubos, incubando a 39 °C. La estabilidad enzimática de xilanasas y celulasas se midió en las mezclas de reacción indicadas para cada tipo de enzima después de 0, 0.5, 1, 2, 4, 6, 8, 12, 16, 24, 28, 32 y 46 h.
La estabilidad enzimática también se midió en medio de líquido ruminal clarificado pH 6.5, se usó líquido ruminal fresco de dos vacas Holstein con cánula ruminal y alimentadas con alfalfa fresca (60 %) y ensilado de maíz (40 %). Se recolectaron 250 mL de fluido ruminal filtrados con gasas para separar partículas grandes y se centrifugó a 15 300 x g por 10 min; el sobrenadante se esterilizó 15 min en una autoclave a 120 °C y 15 psi, se centrifugó 10 min a 15 300 x g y se esterilizó 15 min a 120 °C y 15 psi (Cobos y Yokoyama, 1995). Se disolvió 1 g del producto enzimático con un agitador magnético por 1 h, por duplicado en 50 mL de amortiguador de citratos (50 mM y pH 5.3) . Luego se centrifugó 20 min a 12, 100 x g; 1 mL del sobrenadante se mezcló con 9 mL del medio con líquido ruminal clarificado, para tener una dilución 1:10. Se colocó 1 mL de esa solución en un microtubo y se incubó a 39 °C. El extracto enzimático también fue probado en el medio con líquido ruminal clarificado, pero en una dilución 1:100. Se midió la estabilidad enzimática de xilanasas y celulasas con las mezclas de reacción para cada tipo de enzima, a 0, 0.5, 1, 2, 4, 6, 8, 12, 16, 24, 28 y 32 h.
Análisis estadístico
El diseño experimental fue completamente al azar y los tratamientos fueron: amortiguador pH 6.0, amortiguador pH 7.0 y líquido ruminal clarificado pH 6.5, con seis tubos para cada tiempo. Los análisis se realizaron para 1, 12, 24 y 46 h de incubación para xilanasas y 1, 12, 24 y 32 h para celulasas. Los datos se analizaron con mediciones repetidas en el tiempo, mediante el procedimiento Mixto (SAS, 2004). El modelo estadístico fue:

donde Yijk= variable respuesta (actividad residual de xilanasas y celulasas); µ= media general; Ti= efecto fijo debido al i-ésimo tratamiento; Mj= efecto debido al j-ésimo tiempo; T*Mij= efecto de la interacción entre el i-ésimo tratamiento y el j-ésimo tiempo; C(T)ik = efecto aleatorio de la k-ésima repetición (tubo) anidada en el i-ésimo tratamiento; εijk= error experimental del i-ésimo tratamiento, j-ésimo tiempo y k-ésima repetición.
Las medias se compararon con la prueba de Tukey (p≤0.05; Steel et al., 1997). Los datos también se ajustaron a un modelo de cinética de primer orden (Chang, 1986).
RESULTADOS Y DISCUSIÓN
Contenido de proteína y caracterización del producto enzimático fibrolítico exógeno
El producto enzimático conserva una gran cantidad del material fermentado y restos celulares y su contenido de proteína fue 9.40 mg g-1. Este resultado fue menor al reportado (5.71 % de proteína en el producto enzimático) por Ramírez et al. (2005). Colombato et al. (2003) reportan un contenido de proteína más alto en 22 productos enzimáticos comerciales, en comparación al del presente estudio. Esta variación de los resultados puede deberse a los métodos usados para determinar proteína y al tipo de enzima (sólida o líquida).
Según Alltech, la actividad xilanásica del producto Fibrozyme es 100 UI g , pero en el presente estudio la actividad fue mayor (292 ±0.20 UI g-1 ) y aproximada a la reportada (222.16 UI g-1 ) por Ramírez et al. (2005). En condiciones similares (pH 6.5 y 39 °C) se ha encontrado una gran variación de xilanasas (148 a 583 UI g-1) y celulasas (163 a 791 UI g-1) (Giraldo et al., 2008; Hristov et al., 2008; Ranilla et al., 2008), la cual se puede atribuir a las diferencias de temperatura y pH estándares para medir la actividad.
El producto enzimático mostró actividad de celulasas (36±0.007 UI g-1) menor a la reportada (56.87 UI g-1) por Ramírez et al. (2005) con pH 6.5. Aunque en el producto enzimático predominan las xilanasas, también hay trazas de celulasas, β-glucanasas, amilasas y proteasas (Frumholtz y Beauchemin, 1999). No se detectaron lacasas, lo cual es consistente con el hecho de que los hongos usados para producir el producto enzimático son Aspergillus niger y Trichoderma longibrachiatum los cuales no son lignilóticos (Pendleton, 1998).
Al medir la estabilidad enzimática en amortiguador con pH 6, las xilanasas y las celulasas tuvieron actividad hasta las 46 h de incubación a 39 °C (Figura 1 y Cuadro 1), y fue mayor en las celulasas (66 %) y menor en las xilanasas (18.5 %). El producto enzimático contiene una gran actividad de xilanasas al inicio y después de 30 min su actividad comienza a disminuir, mientras que las celulasas se mantienen más estables, lo cual puede estar asociado con la naturaleza y estructura propia de la enzima.

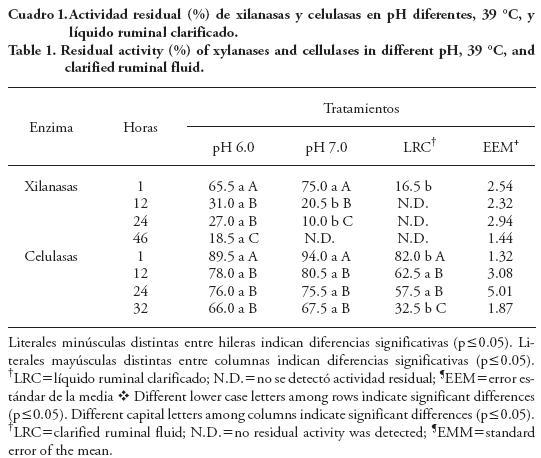
En la Figura 1 se observan los resultados ajustados a un modelo de decaimiento de primer orden, donde la constante de velocidad de inactivación enzimática (k) para xilanasas fue —0.054 h-1 y para celulasas — 0.008 h-1, con un tiempo de vida media (t½) 12.8 h y 87.7 h. Estos resultados son mayores a los reportados por Ramírez et al. (2005; 4.02 h ), pero el tiempo de incubación (24 h) fue menor al del presente estudio (46 h).
Las enzimas fibrolíticas exógenas producidas por los hongos tienen un pH óptimo de actividad menor al de las secretadas por los microorganismos ruminales. Morgavi et al. (2001) señalan que la actividad xilanolítica de las enzimas ruminales fue óptima en pH de 6.0 a 6.5, mientras que para la xilanasa de T. longibrachiatum el efecto hidrolítico fue mayor en pH 5.0. En bovinos productores de carne y leche que consumen dietas con mayor proporción de granos se reduce la digestión de la fibra debido a que el pH ruminal a menudo es menor a 6.0 (Elam, 1976). En situaciones donde la degradación de la fibra no es completa, las enzimas exógenas pueden mejorar la degradación de los carbohidratos estructurales (Krause et al., 1998).
En el medio con pH 7, únicamente la actividad de las celulasas se mantuvo después de 46 h de incubación, mientras que casi la mitad de la actividad de las xilanasas se perdió después de 6 h y a las 32 h no hubo actividad residual (Figura 2). De manera similar a los estudios de estabilidad con pH 6, las celulasas aunque en menor cantidad en el producto enzimático, se mantienen más estables porque a las 46 h mostraban 60 % de actividad.
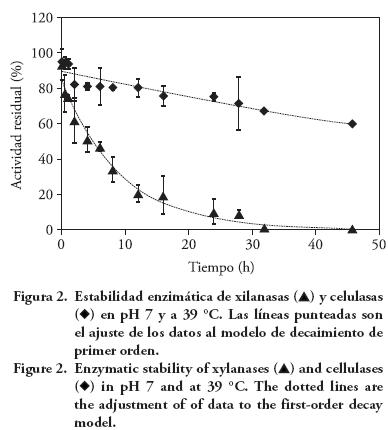
Con los resultados ajustados a un modelo de disminución de primer orden (Figura 2) se calculó que k de las xilanasas fue —0.07 h-1 (t½=9.9 h) y de las celulasas —0.009 h-1 (t½=77 h). Esto indica probablemente que las celulasas tienen mayor tiempo de vida que las xilanasas y el pH afecta la reducción de la actividad enzimática, porque el tiempo de vida media para xilanasas disminuye 30 % con el aumento de pH de 6 a 7. Estos resultados coinciden con los de Morgavi et al. (2001), quienes señalan que las enzimas fibrolíticas exógenas producidas por hongos tienen un pH óptimo de actividad menor que las secretadas por los microorganismos ruminales. Además, Ramírez et al. (2005) indican que Fibrozyme tuvo mayor actividad en una solución con pH 5.5 que en pH 6.5. Por tanto, la disminución de la actividad de xilanasas en pH 6 fue moderada en el presente estudio.
Las actividades enzimáticas en el medio con líquido ruminal clarificado disminuyeron a valores indetectables después de 30 min de incubación a 39 °C. Por tanto, se usaron diluciones 1:10, equivalente al aumento de dosis del producto enzimático en un tratamiento previo del sustrato o durante la administración en la dieta para rumiantes. Los resultados de la estabilidad enzimática en medio con líquido ruminal clarificado (Figura 3) muestran que la actividad enzimática de xilanasas disminuye desde los 30 min y a las 4 h no se detectó actividad, lo cual contrastó con las celulasas que mantienen 50 % de su actividad después de 20 h. Morgavi et al. (2000) midieron la estabilidad de cuatro preparaciones comerciales de enzimas fibrolíticas exógenas, de los hongos Irpex lacteus, Trichoderma viride, Aspergillus niger, y una mezcla similar a I. lacteus incubadas 6 h con líquido ruminal de borregos. Las xilanasas producidas por A. niger no fueron afectadas por la incubación y mantuvieron 100 % de su actividad 6 h, mientras que las provenientes de T. viride y de la mezcla retuvieron 75 %. Estos resultados son distintos a los del presente estudio donde no se detectó actividad de xilanasas después de 4 h de incubación, porque el producto enzimático proviene de la fermentación con A. niger y T. viride. Las variaciones en resultados se deben posiblemente al tiempo de incubación de las muestras para medir la actividad; Morgavi et al. (2000) usaron 30 min y en el presente estudio fueron 5 min.

Las enzimas adicionadas pero no ligadas a su substrato pueden ser rápidamente hidrolizadas por las proteasas de los microorganismos ruminales; sin embargo, la glucosilación de las enzimas fibrolíticas reduce efectivamente esa proteólisis (Howes et al., 1998). En el presente estudio la actividad de las xilanasas se redujo aceleradamente, por lo cual sufren hidrólisis por no tener el mismo grado de glucosilación que las celulasas. Además, en este estudio se usó líquido ruminal clarificado y la actividad de las enzimas debió mantenerse 100 % porque este medio carece de microorganismos ruminales vivos. Posiblemente el proceso de clarificado elimina las bacterias, pero no las proteasas las cuales podrían hidrolizar las xilanasas presentes en el producto enzimático. La k de las xilanasas ( — 1.815 h-1 ) y celulasas ( — 0.026 h-1) y los valores de t½ (0.38 h para xilanasas y 26.87 h para celulasas) indican que las celulasas tienen un tiempo de vida 70 veces mayor que las xilanasas.
Los resultados de estabilidad enzimática con líquido ruminal clarificado son diferentes a los reportados por Morgavi et al. (2000) quienes evaluaron la estabilidad de enzimas fibrolíticas exógenas y señalan que las xilanasas producidas por A. niger mantuvieron 100 % o más de su actividad después de 6 h de incubación con líquido ruminal. Este aumento de la actividad se puede atribuir a que las bacterias del líquido ruminal sin clarificar usado en el presente estudio estaban produciendo xilanasas, lo cual aumentó la actividad. Los resultados de adición de enzimas fibrolíticas exógenas en dietas para rumiantes, no siempre son positivos o son variables. El pH y las bacterias ruminales pueden ser un factor preponderante para un buen desempeño de esas enzimas cuando se usan en la nutrición de rumiantes.
Un aspecto no considerado en este estudio fue el efecto de la aplicación de enzimas al alimento, lo cual incrementa la unión de la enzima con el sustrato y aumenta la resistencia de las enzimas a la proteólisis durante el tiempo que permanece en el rumen (Beauchemin et al., 2003), lo cual podría explicar la degradación rápida en el líquido ruminal clarificado.
CONCLUSIONES
Los resultados del perfil enzimático indicaron variaciones en las concentraciones de enzimas reportadas previamente. Entonces, la actividad de enzimas estaría en función del método y temperatura empleados para medir su actividad, lo cual repercute directamente en el efecto que causará al adicionarse a una dieta. La variación en los resultados está relacionada con la actividad y cantidad de enzimas presentes en el producto, sin descartar el grado de glucosilación que presenten las enzimas.
Los tiempos de vida media de la enzima y el porcentaje de actividad, como los calculados en este estudio, pueden usarse para diseñar tratamientos previos a dietas a base de concentrados y forrajes.
LITERATURA CITADA
Almaraz, I., S. S. González, J. M. Pinos-Rodríguez, and L. A. Miranda. 2010. Effects of exogenous fibrolytic enzymes on in sacco and in vitro degradation of diets and on growth performance of lambs. Ital. J. Anim. Sci. 9: 6-10. [ Links ]
Bailey, M. J., P. Biely, and K. Poutanen. 1992. Interlaboratory testing methods for the assay of xylanase activity. J. Biotechnol. 23: 257-270. [ Links ]
Beauchemin, K. A., D. Colombato, D. P. Morgavi, and W. Z. Yang. 2003. Use of exogenous fibrolytic enzymes to improve feed utilization by ruminants. J. Anim. Sci. 81 (E. Suppl. 2): E37-E47. [ Links ]
Bourbonnais, R., G. Paice M., B. Freiermuth, E. Bodie, and S. Borneman. 1997. Reactivities of various mediators and laccases with kraft pulp and lignin model compounds. App. Envirom. Microbiol. 63(12): 4627-4632. [ Links ]
Bradford, M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principie of protein-dye binding. Anal. Biochem. 72: 248-254. [ Links ]
Chang, R. 1986. Fisicoquímica con Aplicaciones a Sistemas Biológicos. Edit. Continental. Primera Edición. México, D. F. pp: 475-512. [ Links ]
Cobos, M. A., and M. T. Yokoyama. 1995. Clostridium paratrificum var. ruminantium: colonization and degradation of shrimp carapaces in vitro observed by scanning electron microscopy. In: Wallace, R. J., and Lahlou-Kassi (eds). Rumen Ecology Research Planning. Proceedings of a workshop held at the International Livestock Research Institute (ILRI), Addis Ababa, Ethiopia. pp: 151-161. [ Links ]
Colombato, D., D. P. Morgavi, A. F. Furtado, and K. A. Beauchemin. 2003. Screening of exogenous enzymes for ruminant diets: Relationship between biochemical characteristics and in vitro ruminal degradation. J. Anim. Sci. 81: 2628-2638. [ Links ]
Colombatto, D., F. L. Mould, M. K. Bhat, and E. Owen. 2007. Influence of exogenous fibrolytic enzyme level and incubation pH on the in vitro ruminal fermentation of alfalfa stems. Anim. Feed Sci. Thechnol. 137: 150-162. [ Links ]
Coughlan, M. P. 1985. The properties of fungal and bacterial cellulases with comment on their production and application. Biotechnol. Genet. Eng. Rev. 3: 39-109. [ Links ]
Elam, C. J. 1976. Acidosis in feedlot cattle: Practical observations. J. Anim. Sci. 43: 898-901. [ Links ]
Frumholtz, P. , y K. Beauchemin. 1999. El uso de enzimas en rumiantes. In: Memorias del seminario de Biotecnología para la Alimentación Animal. AMENA. México, D. F. pp: 85-94. [ Links ]
Feng, P. , C. W. Hunt, G. T. Pritchard, and W. E. Julien. 1996. Effect of enzyme preparations on in situ and in vitro degradation and in vivo digestive characteristics of mature cool-season grass forage in beef steers. J. Anim. Sci. 74: 1349-1357. [ Links ]
Gallardo, I., R. Bárcena, J. M. Pinos-Rodríguez, M. Cobos, L. Carreón, M. E. Ortega. 2010. Influence of exogenous fibrolytic enzymes on in vitro and in sacco degradation of forages for ruminants. Ital. J. Anim. Sci. 9: 34-38. [ Links ]
Giraldo, L. A., M. L. Tejido, M. J. Ranilla, S. Ramos, and M. D. Carro. 2008. Influence of direct-fed fibrolytic enzymes on diet digestibility and ruminal activity in sheep fed a grass hay-based diet. J. Anim. Sci. 86: 1617-1623. [ Links ]
Howes, D. J., J. M. Tricarico, K. Dawson, and P. Karnezos. 1998. Fibrozyme, the first protected enzyme for ruminants: improving fiber and animal performance. In: Lyons T. P. , and K. A. Jacques (eds). Biotechnology in the Feed Industry. Proceedings of the Fourteenth Annual Symposium Nottingham University Press, Loughborough, Leics, UK. pp: 393-403. [ Links ]
Hristov, A. N., C. E. Basel, A. Melgar, A. E. Foley, J. K. Ropp, C. W. Hunt, and J. M. Tricarico. 2008. Effect of exogenous polysaccharide-degrading enzyme preparations on ruminal fermentation and digestibility of nutrients in dairy cows. Anim. Feed Sci. Thechnol. 145: 182-193. [ Links ]
Krause, M., K. A. Beuachemin, L. M. Rode, B. I. Farr, and P. Norgaard. 1998. Fibrolytic enzyme treatment of barley grain and source of forage in high-grain diets fed to growing cattle. J. Anim. Sci. 76: 2912-2920. [ Links ]
Kung, Jr., L., R. J. Treacher, G. A Nauman, A. M. Smagala, K. M. Endres, and M. A. Cohen. 2000. The effect of treating forages with fibrolytic enzymes on its nutritive value and lactation performance of dairy cows. J. Dairy Sci. 83: 115-122. [ Links ]
Loera, O., and J. Córdova. 2003. Improvement of xylanase production by a parasexual cross between Aspergillus niger strain. Brazilian Arch. Biol. Thechnol. 46(2): 177-181. [ Links ]
Márquez-Araque, A. T., G. D. Mendoza M., S. S. González M., S. E. Búntinx D., and O. Loera C. 2007. Fibrolytic activity of enzymes produced by Trametes sp. EUM1, Pleurotus ostreatus IE8 and Aspergillus niger AD96.4 in solid fermentation. Interciencia 32(11): 780-785. [ Links ]
Miller, G. L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31: 426-428. [ Links ]
Morgavi, D. P. , K. A. Beauchemin, V. L. Nsereko, L. M. Rode, T. A. McAllister, A. D. Iwaasa, Y. Wang, and W. Z. Yang. 2001. Resistance of feed enzymes to proteolytic inactivation by rumen microorganisms and gastrointestinal proteases. J. Anim. Sci. 79: 1621-1630. [ Links ]
Morgavi, D. P. , C. J. Newbold, D. E. Beever, and R. J. Wallace. 2000. Stability and stabilization of potential feed additive enzymes in rumen fluid. Enzyme Microbiol. Thech. 26: 171-177. [ Links ]
Pendleton, B. 1998. The regulatory environment. In: Muirhead, S. (ed). Direct-Fed Microbial, Enzyme and Forage Additive Compendium. The Miller Publishing Company, Minnetonka, Minessota. Vol. 4: 47-52. [ Links ]
Pinos, J. M., S. S. González, G. Mendoza, R. Barcena, M. A. Cobos, A. Hernández, and M. E. Ortega. 2002. Effect of exogenous fibrolytic enzyme on ruminal fermentation and digestibility of alfalfa and rye-grass hay fed to lambs. J. Anim. Sci. 80: 3016-3020. [ Links ]
Purkarthofer, H., M. Sinner, and W. Steiner. 1993. Cellulase-free xylanase from Thermomyces lanuginosus: Optimization of production in submerged and solid state culture. Enzyme Microbiol. Thechnol. 15: 677-682. [ Links ]
Ramírez, L., E. Aranda, G. D. Mendoza, L. Landois, L. A. Miranda, y M. M. Crosby. 2005. Caracterización de productos fibrolíticos comerciales utilizados en la alimentación de rumiantes. Vet. Méx. 36(1): 1-9. [ Links ]
Ranilla, M. J., M. L. Thejido, L. A. Giraldo, J. M. Tricárico, and M. D. Carro. 2008. Effects of an exogenous fibrolytic enzyme preparation on in vitro ruminal fermentation of three forages and their isolated cell walls. Anim. Feed Sci. Technol. 145: 109-121. [ Links ]
SAS. System for Windows. 2004. SAS User's Guide Statistics, SAS Inst. Inc. Cary North Carolina. USA. [ Links ]
Steel, R. G. D., Torrie J. H., and Dickey D. A. 1997. Principles and Procedures of Statistics: A Biometrical Approach. 3rd edition. McGraw Hill Book Co. New York. 165 p. [ Links ]
Stokes, M. R. 1992. Effect of an enzyme mixture, an inoculant, and their interaction on silage fermentation and dairy production. J. Dairy Sci. 75: 764-773. [ Links ]
Tricarico, J. M., K. A. Dawson, and K. E. Newman. 1998. Effects of a microbial enzyme preparation (Fibrozyme) on ruminal digestion of fescue hay. J. Anim. Sci. 76 (Suppl. 1): 289. [ Links ]
Van Soest, P. J. 1994. Nutritional Ecology of the Ruminant. 2nd. ed. Cornell Univ. Press, Ithaca, NY. 375 p. [ Links ]
Yang, W. Z., K. A. Beauchemin, and L. M. Rode. 1999. Effects of an enzyme feed additive on extent of digestion and milk production of lactating dairy cows. J. Dairy Sci. 82: 391-403. [ Links ]














