Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.45 no.4 Texcoco may./jun. 2011
Protección vegetal
Caracterización del cortejo y cópula en Callisphyris apicicornis: herramienta para definir la viabilidad para desarrollar estrategias de manejo
Characterization of courtship and mating in Callisphyris apicicornis: tool to define the viability to develop management strategies
Tomislav Curkovic-S*. , Javier Muñoz-M.
Departamento de Sanidad Vegetal, Universidad de Chile. Casilla 1004. Santiago, Chile. *Autor responsable (tcurkovi@uchile.cl).
Recibido: Enero, 2011.
Aprobado: Marzo, 2011.
Resumen
La caracterización del comportamiento de cortejo y cópula en Callisphyris apicicornis (Coleoptera: Cerambycidae) es importante en el eventual desarrollo de estrategias de control/ manejo, basadas en la modificación de conductas mediadas por la feromona sexual de esta especie plaga. Las secuencias conductuales de C. apicicornis fueron filmadas en campo (La Pintana, Región Metropolitana, Chile, entre los meses de septiembre y diciembre de 2009 y 2010). Además se registró la temperatura ambiental, velocidad del viento y hora. Los videos permitieron identificar y describir los pasos que forman las secuencias y sus respectivas frecuencias. Los resultados evidenciaron que en esta especie la secuencia es altamente estereotipada y no ocurre azarosamente, atributos que sugieren una pre-programación de los individuos expuestos a estos estímulos químicos, lo que permitiría el contacto con cebos tóxicos o sistemas de monitoreo específicos que contengan la feromona de la especie. En machos la secuencia consiste en: acercamiento, monta, aproximación de genitalias, cópula, desacople, guardia y alejamiento. La hembra, en general, permanece inmóvil durante esta etapa, excepto cuando rechaza al macho, escapando de él o golpeándolo con sus patas traseras. Estas conductas fueron influidas significativamente por la temperatura ambiental, mientras que la velocidad del viento y la hora del día no influyeron significativamente. Además, se observó que la hembra de C. apicicornis fue capaz de atraer a machos de otra especie (Hephaestion violaceipennis) perteneciente a la misma subfamlia (Lepturinae), los cuales fueron rechazados de la misma manera que lo fueron los conespecíficos.
Palabras clave: estereotipia, ecogramas, feromonas, Lepturinae.
Abstract
The characterization of courtship and mating behaviors in Callisphyris apicicornis (Coleoptera: Cerambycidae) is important in the eventual development of strategies of control/management, based on behavior modification mediated by the sex pheromone of this species. The behavioral sequences of C. apicicornis were filmed in the field (La Pintana, Región Metropolitana, Chile, between September and December 2009 and 2010). Also temperature, wind speed, and time were registered. The videos helped identify and describe the steps included in the sequences and their respective frequencies. Results showed that in this species the sequence is highly stereotyped, of first order and does not occur randomly, attributes that suggest a pre-programming of the individuals that would allow contact with toxic baits or specific monitoring systems. In males, the sequence consists of: approach, mounting, approximation of genitalia, copulation, undocking, guarding, and departure. The female generally remains stationary during this stage, except when it rejects the male, escaping from it or hitting it with its hind legs. These behaviors were significantly influenced by environmental temperature, whereas wind speed and time of day did not significantly affect behavior. It was also noted that the female of C. apicicornis was able to attract males of another species (Hephaestion violaceipennis) belonging to the same subfamily (Lepturinae), which were rejected in the same way the conspecifics were.
Keywords: stereotyping, ethograms, pheromones, Lepturinae.
INTRODUCCIÓN
La sierra del manzano, Callisphyris apicicornis E & G. (Coleoptera: Cerambycidae), insecto nativo de Chile, se distribuye desde la Región de Valparaíso a La Araucanía (Artigas, 1994). De hábito xilófago y muy polífaga, tiene 19 hospederos (Prado, 1991; Barriga et al, 1993; Artigas, 1994), incluyendo especies de importancia frutal como Ribes spp. (Grossulariaceae), Acca sellowiana (O. Berg) Burret (Myrtaceae), Cydonia oblonga Mili, y Malus domestica Borkh (Rosaceae), en las cuales se le considera plaga (Curkovic, 2008).
La larva vive y se desarrolla exclusivamente en madera viva (Barriga et al, 1993), incluyendo ramas y troncos funcionales, en los cuales construye galerías longitudinales subcorticales y hace cortes transversales, que pueden ocasionar su fractura y caída (Artigas, 1994). Las larvas y pupas se encuentran protegidas bajo la corteza, lo que impide controlarlas por métodos convencionales pues no quedan expuestas a los tratamientos con insecticidas (Curkovic, 2008). El control natural es ejercido por especies de Tachinidae (Diptera) (Barriga, 1990) y Aulacidae (Hymenoptera) (Elguetay Lanfranco, 1994), pero su eficiencia es reducida, alcanzando alrededor del 10 % de parasitismo para el caso del aulácido (datos no publicados obtenidos de crianzas de C. apicicornis; T. Curkovic). La poda de ramas afectadas, como práctica cultural, puede permitir la eliminación de los individuos en la madera deteniendo la infestación, pero ello requiere la detección oportuna de los síntomas, lo que es difícil en el campo. Por esto es necesario encontrar nuevas formas de manejo para C. apicicornis. Una estrategia propuesta en otros cerambícidos (Lacey et al, 2004; Silk et al, 2007) es la modificación y manipulación del comportamiento sexual de adultos, frecuentemente mediado por semioquímicos (Rhainds et al, 2001; Hanks et al, 2007), lo cual requiere estudios de la conducta y de la química ecológica de estos organismos (Harris y Foster, 1995). En cerambícidos, la química ecológica tiene un incipiente desarrollo con la identificación de feromonas sexuales en varias especies (Millar et al, 2009). Paralelamente ha sido necesario estudiar la conducta sexual para identificar la forma y las condiciones en que los insectos producen feromonas, y sus respuestas a estos compuestos (Crook et al, 2004, Morewood et al, 2004; Fonseca y Zarbin, 2009). Así, se han desarrollado tecnologías que incorporan feromonas como atrayentes, las cuales contribuyen al manejo de estas especies (Reddy, 2007)- Sin embargo, hay pocos estudios de comportamiento en insectos plaga en Chile (Curkovic y Ferrera, 2008).
El comportamiento sexual inducido por semio-químicos en insectos presenta varias etapas: 1) el llamado, que frecuentemente implica posturas o movimientos que ayudan a la emisión y posterior distribución de las feromonas (Cade, 1985); 2) la búsqueda y orientación, respuesta al llamado que hace el sexo opuesto mediante maniobras que favorecen la ubicación de la fuente (e.g. vuelo en zig-zag; Kennedy, 1977); 3) el cortejo, que incluye una serie de movimientos y posturas que ocurren cuando ambos sexos interactúan a corta distancia, previo a la cópula (Alexander et al., 1997), lo que contribuye a la identificación y evaluación de un potencial compañero sexual; y 4) la cópula, que incluye el acople y transferencia de material genético del macho a la hembra (Cade, 1985). El cortejo y la cópula no se han descrito en C. apicicornis, pero el estudio de estos comportamientos es importante para diseñar estrategias de control basadas en feromonas específicas. Por ejemplo, la caracterización del cortejo y del primer contacto puede ser fundamental en el desarrollo de atracticidas orientados a la eliminación de machos de insectos (Curkovic et al., 2006). Por ello, los objetivos del presente trabajo fueron: 1) describir y caracterizar el cortejo y cópula en C. apicicornis; y 2) determinar su asociación con la temperatura ambiental, la velocidad del viento y la hora del día en que se observaron estas conductas.
MATERIALES Y MÉTODOS
Lugar y época y de estudio
Los estudios se hicieron en la Estación Experimental Antumapu (34° 14' 31" S; 70° 38' 08" O), Facultad de Ciencias Agronómicas de la Universidad de Chile, Comuna de La Pintana, Santiago, Chile. La crianza de insectos se efectuó en el laboratorio de Comportamiento y Ecología Química de Insectos, del Departamento de Sanidad Vegetal de la misma Facultad. Las observaciones se hicieron durante dos temporadas, entre fines de septiembre y principios de diciembre, en 2008-2009 y 2009-2010. El reducido período de tiempo de trabajo en cada año se debió a que la actividad de adultos de C. apicicornis se restringe a alrededor de 10 semanas en esta zona (Curkovic, 2008).
Recolección, crianza y manipulación de insectos
Las hembras y algunos machos usados en este estudio se obtuvieron de ramas de membrillero (C. oblonga), feijoa (A. sellowiand) y crategus (Crataegus oxyacantha L.), en los que se detectaron los síntomas característicos de infestación de C. apicicornis, descritos por Barriga et al. (1993). La mayoría de las observaciones se hicieron de machos que provenían del entorno y que arribaron a los sitios donde se mantenían las hembras. La madera infestada se obtuvo en Lo Cañas (Santiago; 33° 32' 04" S; 70° 33' 24" O), El Olivar (Región del Libertador General Bernardo O'Higgins, 34° 13' 56" S; 70° 52' 25" O) y Antumapu. La madera recolectada fue examinada para verificar el estado de desarrollo y sexo de la pupa (los machos tienen antenas más largas y abdomen más corto que las hembras; Curkovic, 2008). La madera infestada con machos se mantuvo separada de la de hembras en baterías Flanders, bajo fotoperíodo ambiente, con temperatura promedio de 20±5° C y humedad relativa de 50±5 % (registradas con termo-higrómetro digital Boeco, BOE 330, Alemania). Las baterías se revisaron diariamente entre septiembre y diciembre, y los adultos nacidos se mantuvieron aislados en frascos plásticos trasparentes (6.6 cm alto y 4 cm de diámetro) y se alimentaron a través de mechas de algodón embebidas en una solución de agua y azúcar al 5 %. Los individuos no copularon en el período previo a las observaciones de campo. Estos machos criados fueron llevados al campo en los mismos frascos tapados que se colocaron alrededor de 3 m viento abajo. Los frascos se abrieron luego de una aclimatación de cada individuo por alrededor de 10 min. Cabe señalar que no se observó ninguna diferencia entre la conducta de machos criados y aquellos que arribaron desde el entorno. Cada hembra (n=31; edad 1 d) fue trasladada al campo en frascos plásticos transparentes y liberada sobre una ramilla de Tamarixparviflora DC (en el sitio de observación), a una altura de 1.5 m del nivel del suelo. Tres de ellas escaparon al soltarlas y las demás permanecieron sobre la rama. Cada hembra se usó hasta que ocurrió una secuencia de cópula completa, aunque cuatro individuos copularon dos veces como consecuencia de desacoples anticipados. El observador se ubicó a alrededor de 1 m de distancia de la hembra y esperó hasta la aproximación de los machos (n = 55 provenientes del entorno y 4 criados).
Filmación de secuencias de comportamiento y registro de condiciones ambientales
Al observar un macho acercándose a una distancia aproximada de 20 cm de la hembra, se inició la filmación de la secuencia con cámara de video (Sony Handycam, HDR-SR10, Japón) y zoom óptico (15x). Se realizaron filmaciones de machos acercándose a las hembras de C. apicicornis en los instantes previos, durante e inmediatamente después de la cópula. Las observaciones se hicieron entre las 10:00 y las 14:00 h, período de mayor actividad de llamado en hembras y vuelo orientado en machos. Las grabaciones se reprodujeron directamente desde la cámara a un televisor (LG, LCD 26LG30R, Corea), lo que permitió definir la secuencia de pasos observables, homogéneos (excluyendo aquellos muy infrecuentes) y discretos (con un inicio y un final claramente definido), durante el cortejo y la cópula. Al iniciar las filmaciones se registró la velocidad del viento y temperatura ambiental con un termo-anemómetro (Extech Instrument, 407119, EE.UU.). También se registró el horario en que ocurrió el cortejo y cópula.
Análisis de los resultados
El registro del número de machos que completaron las secuencias de cortejo y cópula, se dispuso en tablas de contingencia 6X6 (Fagen y Young, 1978). En cada celda se anotó el número de individuos que, haciendo un paso en particular (columnas), había realizado un paso previo (filas), considerando que la transición de un paso a otro depende sólo de la identidad de la unidad de conducta previa (= cadena de Markov de primer orden; Fagen y Young, 1978; Liimatainen y Hoikkala, 1998). Las probabilidades de transición se obtuvieron dividiendo las frecuencias de cada celda por el total de individuos de cada fila. Para evaluar el grado de dependencia general entre los pasos que conformaron las secuencias de cortejo y cópula en machos, se usó la prueba exacta de Fisher (p<0.05) (SPSS Statistics 15). Las probabilidades de transición se utilizaron en la construcción de un etograma (Osorio-Osorio y Cibrián-Tovar, 2000) que muestra la secuencia de pasos y rutas que pueden seguir los individuos. La variabilidad de la secuencia de cortejo y cópula de machos se calculó con el índice de estereotipia (IE) usado por Girling y Cardé (2006). Las mediciones de las variables ambientales (temperatura, velocidad del viento) y de la hora del día en que ocurrieron las conductas de interés, se sometieron a regresión logística binaria para evaluar si cada variable independiente era significativa (p<0.05) respecto de la ocurrencia del cortejo y cópula (Minitab Statistical software 13.32). La validez del modelo se explicó mediante el porcentaje de concordancia. Para las hembras no se usaron estos procedimientos cuantitativos debido a que permanecieron mayoritariamente inmóviles durante las filmaciones, excepto en los casos en que hubo rechazo.
RESULTADOS Y DISCUSIÓN
Descripción de las conductas de cortejo y cópula
Los pasos que forman la secuencia de cortejo y cópula se presentan en el Cuadro 1 y la Figura 1. Se observó que el macho de C. apicicornis vuela en zig-zag hacia la hembra que se encuentra llamando; el vuelo finaliza con un descenso cerca de la hembra. En otras especies, durante esta fase previo a la monta, hay una activa y relativamente prolongada interacción que involucra contacto entre las antenas de los machos y diferentes partes del cuerpo de las hembras (Michelsen, 1963, 1966), lo que podría interpretarse como una evaluación propia de una conducta de cortejo formal. Sin embargo, la aproximación y el intento de monta del macho de C. apicicornis sólo consistió en contactos breves entre sus antenas y patas, y el cuerpo de la hembra. Este tipo de aproximación es compatible con el uso de trampas o cebos tóxicos (Curkovic et al., 2006), estrategias que requieren el contacto entre el insecto y la fuente para monitoreo y control, siempre que no necesiten al mismo tiempo de otras pistas (por ejemplo visuales o auditivas).

La aproximación del macho de C. apicicornis tuvo dos respuestas en las hembras: 1) aceptación (31 secuencias terminaron en cópula), permitiendo al macho realizar los pasos subsecuentes; o 2) rechazo (27 secuencias no exitosas), caracterizado por el escape (ocurrió en 13 de las 27 secuencias) de la hembra que se aleja caminando rápidamente, similar a lo reportado para Phytoecia rufiventris Gautier (Coleoptera: Cerambycidae) (Wang et al., 1996). Las hembras que escapaban eran perseguidas por el macho que no lograba montarlas, y finalmente desistía de perseguirlas. A veces la hembra, en lugar de escapar, se mantuvo en su lugar y rechazó al macho con un golpe (también en 13 de 27 secuencias) propinado con sus patas traseras, impidiéndole aproximarse. La secuencia no exitosa restante ocurrió cuando un macho se aproximó a la hembra (que no escapó ni lo pateó), pero luego de inspeccionarla se alejó sin intentar montarla. Los machos se aproximaron a las hembras principalmente por el costado o por su parte posterior, pero ello no parece incidir en el resultado final, pues las respectivas proporciones de individuos fueron similares en secuencias exitosas y no exitosas. Según estos resultados, el cortejo en C. apicicornis es poco evidente, sin una interacción que involucre posturas o maniobras complejas, observándose sólo la decisión final (i.e. aceptación o rechazo) de la hembra ante la aproximación del macho, similar a lo que se ha informado para P. rufwentris (Wang et al., 1996). Los rechazos observados en C. apicicornis sugieren que la hembra podría reconocer y evaluar al macho que se aproxima, pero el mecanismo usado es desconocido. Los machos de C. apicicornis no rechazados se montaron sobre la hembra. Durante esta etapa las hembras permanecieron estacionarias, posadas o colgando de la rama. Las antenas del macho se dirigían siempre hacia adelante, pero las de la hembra permanecían fijas hacia abajo. Una vez encima de la hembra, el macho intentó el acople inmediatamente. La cópula duró 10 a 15 min en promedio, tiempo durante el cual hubo repetidos contactos entre palpos labiales y mandíbulas del macho y el cuerpo de la hembra, similar a lo descrito en Dectes texanus texanus LeConte (Crook et al, 2004). En dos ocasiones, cuando una pareja de C. apicicornis se encontraba en cópula, un segundo macho se aproximó y se montó sobre el primero, quedando los tres individuos uno encima de otro. Montas entre machos han sido reportadas para P. rufwentris, incluso con intentos de cópula homosexual (Wang et al., 1996). En C. apicicornis cuando ocurrió esta monta triple se observó que la cópula sólo se efectuó entre la hembra y el macho que se encontraba inmediatamente encima de ella. En algunas ocasiones ocurrió un desacople ocasionado por la llegada del segundo macho. La hembra de C. apicicornis suele estar inmóvil durante la cópula, pero ocasionalmente (7/31 secuencias) se desplaza a lo largo de la rama con el macho sobre su dorso, provocando también el desacople, similar a lo observado con Tetraopes tetrophthalmus (Forster) (DroneyyThaker, 2006). En todos los desacoples observados en C. apicicornis, los machos se alejaron de la hembra volando y even-tualmente algunos regresaron para iniciar una nueva secuencia. La cópula finalizó cuando se separaron las genitalias de los individuos. Entonces el macho se alejó volando, mientras que la hembra permaneció inmóvil. Por ello, se considera que la cópula en C. apicicornis es finalizada por los machos, similar a lo descrito en P. rufiventris (Wang et al., 1996). En tres secuencias los machos de C. apicicornis, luego de finalizar la cópula se mantuvieron inmóviles sobre la hembra, lo que podría corresponder a una conducta de guardia, cuya función en otras especies es evitar que un macho que llegue posteriormente, copule con la hembra ya cubierta. Esta conducta se ha descrito para los cerambícidos Oemona hirta (F.) (Wang y Davis, 2005) y Anoplophora glabripennis (Motschulsky) (Morewood et al., 2004).
Análisis cuantitativo de la secuencia de cortejo/cópula
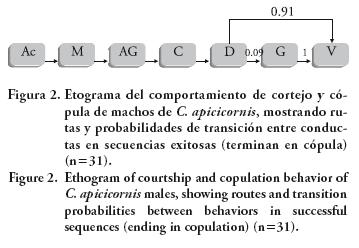
Los resultados indican que las secuencias no ocurren por azar (p< 0.001) y por tanto existe asociación entre los pasos que conforman el cortejo y la cópula. Considerando que la tabla de contingencia analizada se construyó con el criterio de cadenas de Markov de primer orden (Fagen y Young, 1978), esta relación se puede designar como una de dependencia de primer orden. Además, la magnitud de esta asociación es elevada, lo que se refleja en el valor del coeficiente de contingencia (0.89). El etograma (Figura 2) muestra que la secuencia es unidireccional y altamente estereotipada (IE=0.98), pues presenta sólo una ruta alternativa hecha por 9 % de los individuos, los que hacen guardia post cópula, mientras que 91 % se salta este paso y va directamente del desacople al vuelo de alejamiento del macho.
Asociación de variables ambientales y hora del día con el comportamiento
Los registros ambientales (Figura 3) se obtuvieron sólo al momento de iniciarse cada secuencia. La regresión logística entre la ocurrencia (o no ocurrencia) de las conductas (variable dependiente) y las condiciones ambientales y hora del día (variables independientes), mostró que el comportamiento de cortejo y cópula es influido significativamente sólo por la temperatura (p = 0.023). El porcentaje de concordancia fue 73-8 %. Las secuencias exitosas ocurrieron entre 17 a 28 °C. No se encontraron referencias respecto a las conductas de cortejo y cópula y su relación con la temperatura, la velocidad del viento y la hora del día para Cerambycidae; sin embargo, una disminución de la temperatura ambiental reduce significativamente el cortejo en Drosophila melanogaster (Diptera: Drosophillidae) (Shreve et al., 2004). La hora del día (10:48 a 13:12) y la velocidad del viento (de 0 a 3 m s-1 ) registradas al inicio de las secuencias, no fueron significativos (p = 0.47; p = 0.86) en la ocurrencia del cortejo y cópula.

Atracción de otras especies
Las hembras de C. apicicornis, y presumiblemente la feromona sexual que emite durante el llamado, fueron atractivas para machos de Hephaestion violaceipenis F. & G., otra especie de Cerambycidae nativo de Chile y perteneciente a la misma subfamilia (Lepturinae; Cerda, 1986). Esto es similar a lo reportado por Krahmer (1990), quien informa de la aproximación de machos de Platynocera viridis (F. & G.) (también un Lepturinae) a una hembra de Callisphyris macropus Newman. Estas observaciones permiten plantear la hipótesis de que estas especies de cerambícidos nativos de Chile, filogenéticamente relacionadas entre ellas, comparten compuestos feromonales en su proceso de comunicación sexual. Ello sugiere que en el caso de las especies que compartan estos canales de comunicación, que sean sincrónicas y simpátricas, otros mecanismos desconocidos permitirían lograr el necesario aislamiento reproductivo entre ellas. Es posible que el estudio de las conductas que desarrollan las diferentes especies emparentadas contribuya a dilucidar esta pregunta.
CONCLUSIONES
El contacto inicial entre machos y hembras de C. apicicornis previo a la cópula, fue breve y simple, y no corresponde a un cortejo elaborado. Sin embargo, se observaron conductas de rechazo por la hembra, lo que sugiere algún mecanismo de reconocimiento específico y evaluación del macho que se aproxima a ella.
Las conductas de cortejo y cópula se pueden definir como secuencias de primer orden, altamente estereotipadas y no azarosas, y por tanto parecen responder a una pre-programación de los individuos, dirigida presumiblemente por estímulos químicos (feromona sexual). Ello sugiere que, en el evento de la exposición de machos a la feromona sexual específica (por ejemplo incorporada a un atracticida o en un emisor usado en sistemas de monitoreo), los individuos se aproximarán y contactarán la fuente, de modo que será posible la intoxicación con el insecticida incorporado en el cebo tóxico específico o la captura del macho que contacta la trampa.
De las variables ambientales, sólo la temperatura fue significativa en la ocurrencia del cortejo y cópula (principalmente entre 19 y 23 °C), mientras que la velocidad del viento (0 a 3 m s-1 ) y la hora del día (entre 10:00 y 14:00 h) no fueron significativas.
Las hembras de C. apicicornis atrajeron a machos de H. violaceipennis (ambos pertenecientes a la subfamilia Lepturinae), lo que sugiere la posibilidad del uso de señales químicas similares entre Géneros filogenéticamente cercanos.
AGRADECIMIENTOS
A Conicyt de Chile por financiar el proyecto Fondecyt 11070072 "Caracterización del comportamiento de llamado, orientación y cortejo en Callisphyris apicicornis (Coleoptera: Cerambycidae) y evaluación de la respuesta de machos a volátiles aislados desde hembras vírgenes conespecíficas".
LITERATURA CITADA
Alexander, R., D. Marshall, and J. Cooley. 1997. Evolutionary perspectives in insect mating. In: Choe, J. C, and B. J. Crespi (ed). Mating Systems in Insects and Arachnids. Cambridge University Press, pp: 4-31. [ Links ]
Artigas, J. 1994. Callisphyris vespa Fairmaire & Geramain. Sierra del manzano. In: Entomología Económica. Insectos de linteres Agrícola, Forestal, Médico y Veterinario (nativos, introducidos y susceptibles de ser introducidos). Ediciones Universidad de Concepción, Vol. II, pp: 140-141. [ Links ]
Barriga, J. 1990. Parásitos y depredadores de larvas de Cerambycidae y Buprestidae (Coleóptera) en Chile. Rev. Chilena Entomol. 18: 57-59. [ Links ]
Barriga, J., T. Curkovic, T. Fichet, J. Henríquez, y J. Macaya. 1993. Nuevos antecedentes de coleópteros xilófagos y plantas hospederas en Chile, con una recopilación de citas previas. Rev. Chilena Entomol. 20: 65-91. [ Links ]
Cade, W. 1985. Insect mating and courtship behavior. Comprehensive Insect Physiol. Biochem. Pharmacol. 9: 591-619. [ Links ]
Cerda, M. 1986. Lista sistemática de los cerambícidos chilenos (Coleoptera: Cerambycidae). Rev. Chilena Entomol. 14: 29-39. [ Links ]
Crook, D., J. Hopper, S. Ramaswamy, and R. Higgins. 2004. Courtship Behavior of the Soybean Stem Borer Dectes texanus texanus (Coleoptera: Cerambycidae), evidence for a female contact sex pheromone. Ann. Entomol. Soc. Am. 97: 600-604. [ Links ]
Curkovic, T., J. Brunner, and P. Landolt. 2006. Courtship behavior in Choristoneura rosaceana and Pandemis pyrusana (Lepidoptera: Tortricidae). Ann. Entomol. Soc. Am. 99: 617-624. [ Links ]
Curkovic, T. 2008. La sierra del manzano: antecedentes biológicos y bases para el desarrollo del control de adultos. Aconex 98: 10-14. [ Links ]
Curkovic, T., y C. Ferrera. 2008. Manejo etológico de plagas nativas en Chile en base al estudio del comportamiento y química ecológica. Rev. Antumapu 6: 3-5. [ Links ]
Droney, D., and M. Thaker. 2006. Factors influencing mating duration and male choice in the red milkweed Tetraopes tetrophthalmus (Forster) (Coleoptera: Cerambycidae). Ethol. Ecol. Evol. 18: 173-183. [ Links ]
Elgueta, M., y D. Lanfranco. 1994. La familia Aulacidae en Chile (Hymenoptera: Evanioidea). Rev. Chilena Entomol. 21: 85-97. [ Links ]
Fagen, R., and D. Young. 1978. Temporal patterns of behaviors: durations, intervals, latencies, and secuencies. In: Colgan, P (ed). Quantitative Ethology. Willey, New York, pp: 100-107. [ Links ]
Fonseca, M., and H. Zarbin. 2009. Mating behaviour and evidence for sex-specific pheromones in Hedypathes betulinus (Coleoptera: Cerambycidae: Lamiinae). J. Appl. Entomol. 133: 695-701. [ Links ]
Girling, R., and R. Cardé. 2006. Analysis of the courtship behavior of the navel orangeworm, Amyelois transitella (Walker) (Lepidoptera: Pyralidae), with a commentary on methods for the analysis of sequences of behavioral transitions.]. Insect Behav. 19: 497-520. [ Links ]
Hanks, L., J. Millar, J. Moreira, J. Barbour, E. Lacey, J. McElfresh, F. Rayreuter, and A. Ray. 2007. Using Generic pheromone lures to expedite identification of aggregation pheromones for the Cerambycid beetles Xylotrechus nauticus, Phymatodes lecontei, and Neoditus modestus modestus. J. Chem. Ecol. 33: 889-907. [ Links ]
Harris, M., and S. Foster. 1995. Behavior and integration. In: Bella, W. J., and R. T. Cardé (eds). Chemical Ecology of Insects. Chapman & Hall. Sunderland, England, pp: 3-48. [ Links ]
Kennedy, J. 1977. Olfactory responses to distant plants and other odor sources. In: Shorey, H., and J. McKelvey, Jr. (eds). Chemical Control of Insect Behavior. Theory and Applications. Willey-Interscience. pp: 67-91. [ Links ]
Krahmer, E. 1990. Feromona de una especie de cerambycidae atrae a los machos de otro género (Coleóptera). Rev. Chilena Entomol. 18: 95. [ Links ]
Lacey, E., J. Matthew, J. Ginzel, J. Millar, and L. Hanks. 2004. Male produced aggregation pheromone of the Cerambycid beetle Neoclytus acuminatus acuminatus. J. Chem. Ecol. 30: 1493-1507. [ Links ]
Liimatainen, J., and A. Hoikkala. 1998. Interactions of the males and females of three sympatric drosophila virilis-group species, D. montana, D. littoralis, and D. lummei, (Díptera: Drosophilidae) in intra- and interspecific courtships in the wild and in the laboratory. J. Insect Behav. 11: 399-417. [ Links ]
Michelsen, A. 1963. Observations on the sexual behavior of some longicorn beetles, subfamily Lepturinae (Coleoptera: Cerambycidae). Behavior 34: 329-355. [ Links ]
Michelsen, A. 1966. The sexual behavior of the some longhorned beetles (Col., Cerambycidae). Entomologiske Meddeleiser 34: 329-355. [ Links ]
Millar, J., L. Hanks, J. Moreira, J. Barbour, and E. Lacey. 2009. Pheromone chemistry of cerambycid beetles. In: Nakamura, K., and J. Millar (eds). Chemical Ecology of Wood-Boring Insects. Forestry and Forest Products Research Institute, Ibaraki, Japan, pp: 52-79. [ Links ]
Morewood, W., P. Neiner, J. Sellmer, and K. Hoover. 2004. Behavior of adult Anoplophora glabripennis on a variety of trees under greenhouse conditions. J. Insect Behav. 17: 215-226. [ Links ]
Osorio-Osorio, R., y J. Cibrián-Tovar, J. 2000. Conducta de cortejo del barrenador de la caña de azúcar Diatraea considerata Heinrich (Lepidoptera: Pyralidae). Agrociencia 34: 619-626. [ Links ]
Prado, E. 1991. Artrópodos y sus enemigos naturales asociados a plantas cultivadas en Chile. Instituto de Investigaciones Agropecuarias INIA, Santiago, Chile. 207 p. [ Links ]
Reddy, G. 2007 Improved semiochemical-based trapping method for old-house borer, Hylotrupes bajulus (Coleoptera: Cerambycidae). Environ. Entomol. 36: 281-286. [ Links ]
Rhainds, M., C. Chiew Lan, S. King, L. Zhen-Mo, and G. Gries. 2001. Pheromone communication and mating behaviour of coffee white stem borer Xylotrechus qadripes Chevrolat (Coleoptera: Cerambycidae). Appl. Entomol. Zool. 36: 299-309. [ Links ]
Shreve S., J. Kelty, and R. Lee. 2004. Preservation of reproductive behaviors during modest cooling: rapid cold-hardening fine-tunes organismal response. J. Exp. Biol. 207: 1797-1802. [ Links ]
Silk, P., J. Sweeney, J. Wu, J. Price, J. Gutowski, and E. Kettela. 2007. Evidence for a male produced pheromone in Tetropium fuscum (F.) and Tetropium cinnamopterum (Kirby) (Coleoptera: Cerambycidae). Naturwissenschaften 94:697-701. [ Links ]
Wang, Q., L. Chen, J. Li, andX. Yin. 1996. Mating behavior of Phytoecia rufiventris Gautier (Coleoptera: Cerambycidae). J. Insect Behav. 9: 47-60. [ Links ]
Wang, Q., and L. Davis. 2005. Mating behavior of Oemona hirta (F.) (Coleoptera: Cerambycidae: Cerambycinae) in laboratory conditions. J. Insect Behav. 18: 187-191. [ Links ]














