Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agrociencia
versão On-line ISSN 2521-9766versão impressa ISSN 1405-3195
Agrociencia vol.45 no.2 Texcoco Fev./Mar. 2011
Recursos naturales renovables
Composición isotópica de carbono en follaje de Pinus pinceana Gordon sometido a estrés hídrico y térmico
Carbon isotopic composition in foliage of Pinus pinceana Gordon seedlings subjected to water and temperature stress
R. Julián Martiñón–Martínez, J. Jesús Vargas–Hernández*, Armando Gómez–Guerrero, Javier López–Upton
Forestal. Campus Montecillo. Colegio de Postgraduados. 56230. Montecillo, Estado de Mexico. * Autor responsable: (vargashjcolpos.mx).
Recibido: Mayo, 2010.
Aprobado: Febrero, 2011.
Resumen
Pinus pinceana Gordon crece en condiciones semiáridas en el noreste y centroeste de México. Probablemente enfrenta un riesgo alto de desaparecer debido al incremento de la temperatura y de la sequía asociadas al cambio climático que se pronostica. Con el propósito de conocer los mecanismos fisiológicos en la adaptación de esta especie a condiciones de estrés ambiental, y definir opciones de manejo para la conservación y restauración de sus poblaciones naturales, se estudió la variación en la composición de isótopos de carbono (δ13C) y en la tasa relativa de crecimiento (TRC) en plantas de seis poblaciones de P. pinceana sometidas a estrés hídrico y por alta temperatura en condiciones de invernadero. Las poblaciones estudiadas representaron un transecto de norte a sur de la distribución natural de la especie en México. En un experimento factorial se probaron dos ambientes de temperatura [sin modificar la temperatura (T0) y con incremento de 2 °C (T1) en la temperatura media] y dos niveles de humedad [contenido gravimétrico de 50 % (S0) y 12–20 % (S1) de humedad del suelo]. La temperatura no influyó en el valor de δ13C, pero el estrés hídrico ocasionó una reducción significativa en la discriminación de 13C (mayor (δ13C); el efecto fue mayor sin estrés de temperatura (T0). Se encontró una variación significativa entre las poblaciones en los valores δ13C. En las dos condiciones de humedad, las poblaciones del norte presentaron mayor δ13C y mayor TRC en altura, comparadas con las del sur. Los valores de δ13C de las poblaciones se correlacionaron en forma positiva con la TRC en altura, pero no con la acumulación de biomasa. El análisis de los resultados muestra que la eficiencia en el uso del agua, estimada de manera indirecta a través del valor de δ13C, tiene una función importante en la capacidad de adaptación de las poblaciones de P. pinceana a las condiciones de sequía que enfrenta en su habitat natural. Además es posible identificar poblaciones de la especie con posibilidades de ajustarse a condiciones de mayor estrés ambiental asociadas al cambio climático.
Palabras clave: adaptación, cambio climático, discriminación isotópica de carbono, eficiencia en el uso del agua, estrés hídrico, tasa relativa de crecimiento.
Abstract
Pinus pinceana Gordon grows in semiarid conditions in the northeast and central east of México. Probably it is facing a high risk of disappearing due to increased temperature and drought associated with the climate change forecast. In order to understand the physiological mechanisms in the adaptation of this species to environmental stress conditions and define management options for the conservation and restoration of its natural populations, we studied the variation in carbon isotope composition (δ13C) and in the relative growth rate (RGR) in plants of six populations of P. pinceana subjected to water stress and high temperature under greenhouse conditions. The study populations represented a north–south transect of the natural distribution of the species in Mexico. In a factorial experiment, two temperature environments were tested [without changing the temperature (T0) and with an increase of 2 °C (T1) in average temperature] and two levels of humidity [gravimetric content of 50 % (S0) and 12–20 % (Sj) soil moisture]. Temperature did not influence the value of δ13C, but water stress caused a significant reduction in 13C discrimination (higher δ13C). The effect was greater without stress temperature (To). A significant variation among populations was found in δ13C values. In the two moisture conditions, the northern populations exhibited greater δ13C and higher RGR in height, compared to the southern. The (δ13C values of populations were positively correlated with the RGR in height, but not with biomass accumulation. The analysis of results shows that water use efficiency, estimated indirectly through the value of δ13C, has an important role in the adaptation capacity of P. pinceana populations to the drought conditions it faces at its natural habitat; it is also possible to identify populations of the species with the possibility to adjust to conditions of greater environmental stress associated with climate change.
Key words: adaptation, climate change, carbon isotope discrimination, water use efficiency, water stress, relative growth rate.
INTRODUCCIÓN
La composición isotópica de carbono (δ13C) es un indicador de la proporción de los isótopos estables de carbono (13C/12C) en un material respecto a un compuesto estándar (Boutton, 1991). La variación de δ13C en tejido vegetal se usa como un estimador indirecto (substituto) de la eficiencia en el uso del agua, debido a su relación con los procesos de intercambio de CO2 y agua que ocurren a través de los estomas (Farquhar et al., 1982; Farquhar et al., 1989. Esto es posible ya que la planta, como un sistema, tiende a un balance entre el nivel de pérdida de agua por transpiración y la fijación de carbono con una determinada proporción de 13C/12C en la fotosíntesis (Zhang et al., 1997). La relación entre δ13C y la eficiencia en el uso del agua ha sido verificada experimentalmente en diferentes especies leñosas (Correia et al., 2008; Voltas et al., 2008; Letts et al., 2009). Un incremento en la eficiencia del uso del agua indica mayor fijación de carbono con menos agua (Nilsen y Orcutt, 1996).
El mecanismo por el que se genera una señal particular de δ13C en tejido vegetal en plantas C3 como los pinos, se explica por procesos físicos y bioquímicos. Durante el proceso físico la fracción más ligera 12CO2 tiende a difundirse más rápido hacia el interior de la hoja que la fracción pesada 13CO2 (Schlesinger, 1997). En el proceso bioquímico, la enzima involucrada en la fijación del carbono (ribulosa–l,5–bisfosfato carboxilasa oxigenasa o RUBISCO) discrimina la fracción 13CO2 cuando los estomas están abiertos y las plantas están hidratadas (Schlesinger, 1997). La discriminación de 13CO2 disminuye cuando los estomas se cierran por el estrés hídrico; los cambios en δ13C en el tejido vegetal reflejan el historial del estado hídrico ocasionado por las condiciones ambientales (Gómez–Guerrero et al., 2002; García–García et al., 2003).
Ante el escenario de cambio climático, dos factores de estrés muy importantes en las plantas son la sequía y el incremento de la temperatura (Loreto y Centritto, 2008); desafortunadamente, en pocas ocasiones se estudia el efecto combinado de estos dos factores (Xu y Zhou, 2005). Algunas especies arbóreas endémicas de México, como Pinus pinceana Gordon que crece en condiciones semiáridas en rodales puros o mezclados con P. cembroides Zuce. (Perry 1991), tienen un riesgo alto de desaparición debido al aumento de la temperatura y a la reducción de la precipitación, con un mayor índice de aridez, por el cambio climático pronosticado para la región noreste de México, donde se distribuye la especie (Sáenz–Komemetai, 2010).
Además de su relevancia ecológica, P. pinceana es económicamente importante para los habitantes de las comunidades rurales cercanas, quienes obtienen ingresos por la venta de su semilla comestible. Las poblaciones remanentes de P. pinceana cubren pocas hectáreas y se distribuyen en forma dispersa sobre las laderas de las montañas de la Sierra Madre Oriental, desde Coahuila hasta Hidalgo (Molina et al., 2001; Ramírez–Herrera et al., 2008; Villarreal–Quintanilla et al., 2009). Debido a lo anterior, es importante saber cómo responden algunas especies vulnerables como P. pinceana ante factores de estrés hídrico y térmico, para analizar si hay diversidad entre poblaciones en la forma de respuesta y planear así estrategias para su conservación.
El propósito de este estudio fue analizar la variación en δ13C del follaje y en la tasa relativa de crecimiento en seis poblaciones de P. pinceana en condiciones de estrés hídrico y térmico. La hipótesis fue que existe una variación significativa entre poblaciones en condiciones de estrés hídrico y térmico, en la discriminación isotópica de carbono y la tasa relativa de crecimiento de las plantas, y que hay una correlación positiva entre estas dos variables. La información es importante para pronosticar la eficiencia relativa en el uso del agua de las poblaciones remanentes de P. pinceana, en los escenarios de sequía y aumento de la temperatura asociados al cambio climático.
MATERIALES Y MÉTODOS
Material biológico y condiciones del ensayo
Se consideraron seis poblaciones de P. pinceana estudiadas por Martiñón–Martínez et al. (2010), a lo largo de un transecto latitudinal en su área de distribución natural (Cuadro 1). Las poblaciones se eligieron con base en su localización geográfica, cuatro de ellas en la región norte y dos en la región sur, así como en el crecimiento de las plantas mostrado en el trabajo de Martiñón–Martínez et al. (2010). Para el experimento se usaron plantas de 25 meses de edad, de buen vigor y 30 cm de altura, crecidas en contenedores de 350 cm3 y con un riego a capacidad de campo cada semana. Al iniciar el experimento, las plantas se trasplantaron a envases de plástico (1500 cm3 de capacidad) con un sustrato de corteza de pino molida, agrolita y suelo agrícola arenoso (25:25:50). El invernadero se separó en dos secciones de 7 m2 con una cortina de plástico y una franja de amortiguamiento de 1.5 m de ancho entre ellas para generar los dos ambientes de temperatura. En la primera sección no se modificó la temperatura, pero en la segunda se colocaron dos calefactores domésticos para elevar la temperatura del aire en 2 °C (en promedio), respecto a la primera sección. La temperatura del aire se registró con dos sensores electrónicos y lecturas cada 15 min. La temperatura varió de 10.3 a 39.2 °C en el ambiente sin modificación de temperatura (T0) y de 12.7 a 41.3 °C en la sección con temperatura modificada (T1). En cada ambiente de temperatura se evaluaron dos niveles de humedad: contenido gravimétrico de 50 % (S0, equivalente a capacidad de campo) y 12–20 % (S1, por debajo de –1.5 Mpa) de humedad del suelo durante 160 d, de acuerdo al procedimiento descrito por Martiñón–Martínez et al. (2010). Para mantener la cantidad de agua perdida por evapo–transpiración en S0, se registró el peso inicial del sistema completo (maceta, suelo, agua y planta) y cada 6 d se repuso el agua perdida. En S1 el suelo no se regó desde el inicio del experimento hasta que se llegó a un contenido gravimétrico del 12 %, y sólo en dos ocasiones (días 85 y 135) se repuso parte del agua perdida por evapotranspiración, para llevarlo a 20 % (Martiñón–Martínez et al., 2010).
Variables evaluadas
Al inicio del experimento se determinó la altura y el diámetro del tallo de todas las plantas (N= 480) y la biomasa total en una muestra de seis plantas por población. Al final del experimento se realizó un análisis destructivo de las plantas en el ensayo para determinar la altura, el diámetro del tallo y la biomasa total. El follaje formado en las condiciones de estrés durante el experimento se identificó con marcas de hilo de color colocadas en el tallo de las plantas. Las muestras vegetales se secaron en estufa a 70 °C hasta peso constante. Con los datos de diámetro y biomasa de las plantas muestreadas al inicio del ensayo se determinó una relación alométrica para estimar la biomasa inicial de las plantas no destruidas. Con los valores iniciales y finales de las plantas se calculó la tasa relativa de crecimiento (TRC) en altura y biomasa para cada población y tratamiento, de acuerdo con la siguiente fórmula (Zhang et al., 1996):

donde, X2 = valor de la característica al final del experimento; X1 = valor de la característica al inicio del experimento; T2 = tiempo al final del experimento; y T1 = tiempo al inicio del experimento.
La composición isotópica de carbono se meidió en el follaje formado durante el periodo del ensayo. Una muestra de cinco acículas por planta sirvió para hacer una muestra compuesta asociada a cada unidad experimental, con un total de 96 muestras (seis poblaciones X cuatro repeticiones X cuatro tratamientos). Las acículas se pulverizaron por 72 h continuas en un molino de balines diseñado en el Postgrado Forestal del Colegio de Postgraduados. Se colocaron 1600 mg (800 mg C aproximadamente) de muestra en cápsulas de estaño y se determinó δ13C con un espectrómetro de masas (Europa Scientific ANCA–HYDRA 20–20) en la Universidad de California–Davis. Los datos se expresaron con respecto al estándar internacional PDB (Pee Dee Belemnite, roca caliza fósil de la formación cretácica Pee Dee en Carolina del Sur, EUA;Boutton, 1991).
Diseño experimental y análisis estadístico
El experimento fue un factorial en parcelas divididas anidadas en dos ambientes de temperatura, con cuatro repeticiones (bloques) dentro de cada ambiente. En cada bloque, los tratamientos de humedad se asignaron a las parcelas grandes y las poblaciones a las parcelas pequeñas. Se realizó un análisis de varianza (SAS Institute, 1998) para (δ13C en follaje, considerando todos los factores como efectos fijos, de acuerdo con el siguiente modelo estadístico:
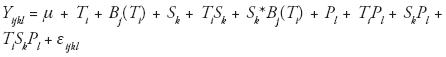
donde, Yijkl = valor de la observación de la 1–ésima población, en el k–ésimo tratamiento de sequía, en el j–ésimo bloque, del i–ésimo ambiente de temperatura; μ = media poblacional; Ti = efecto del i–ésimo ambiente de temperatura; Bj(Ti) = efecto del j–ésimo bloque dentro del i–ésimo ambiente de temperatura (error a); Sk = efecto del k–ésimo nivel de sequía; TiSk = efecto de la interacción del i–ésimo ambiente de temperatura con el k–ésimo nivel de sequía; Sk*Bj(Ti) = error b (error de parcela grande); Pl= efecto de la 1–ésima población; TiPl = efecto de la interacción del i–ésimo ambiente de temperatura con la 1–ésima población; SkPl = efecto de la interacción del k–ésimo nivel de sequía, con la 1–ésima población; TiSkPl = efecto de la interacción del i–ésimo ambiente de temperatura con el k–ésimo nivel de sequía con la 1–ésima población; y εijkl = error experimental (error de parcela chica).
Para evaluar las diferencias significativas entre tratamientos o entre poblaciones, se compararon las medias con la prueba de Tukey (p≤0.05) y una prueba de contrastes entre las poblaciones de las dos regiones geográficas (norte vs. sur). Para conocer la relación entre el comportamiento de cada población en condiciones de estrés y su capacidad productiva, se hizo un análisis de correlación entre los valores de (513C con la TRC en altura y la biomasa total.
RESULTADOS Y DISCUSIÓN
Composición isotópica de carbono en follaje de Pinus pinceana
El promedio de δ13C en follaje de P. pinceana fue –24.14 ‰, con valores extremos de –25–42 a –22.70 ‰; el valor promedio de las poblaciones varió de –24.48 a –23–70 ‰ (Figura 1). El promedio de la especie es mayor a –27 ‰, valor encontrado en otras coniferas de diferentes ambientes ecológicos (Zhang et al., 1997; Brodribb y Hill, 1998; Anekonda etal., 2004). Sin embargo, algunos pinos con distribución en elevaciones mayores a 1500 m presentan Ó13C de –24 a –23 ‰ (Warren et al., 2001). En un experimento de estrés por sequía establecido en el mismo lugar donde se hizo este estudio, el valor de δ13C en follaje de poblaciones de P. greggii. Engelm. varió de –29–5 a –28.5 ‰ (García–García et al., 2003); sólo la población de mayor altitud (2613 m) y ambiente más árido presentó δ13C de –23–6 ‰.

Hay cierta relación con la altitud y los resultados de P. pinceana, ya que las poblaciones 5 y 7 muestran los valores más altos de δ13C y su distribución altitudinal es mayor; sin embargo, la relación no es consistente al considerar que la población tres es la segunda en altitud y su valor de δ13C es más bajo. La discriminación relativamente baja de P. pinceana podría reflejar una estrategia de adaptación para fijar la mayor cantidad de carbono en las condiciones de sequía en que se desarrolla. Brodribb y Hill (1998) encontraron que el δ13C de 13 coniferas varió de –29–0 a –24.5 ‰, aunque no se detectó una correlación significativa entre δ13C y variables ambientales. Panek (1996) reportó una variación de δ13C en follaje de Pseudotsuga menziesii (Mirb.) Franco de –26.53 a –19.56 ‰ en un transecto con precipitación contrastante (300 a 1640 mm). Sin embargo, se debe considerar que en ese estudio se eliminó la lignina del follaje previo al análisis de δ13C, lo cual tiende a enriquecer las muestras en 13C (Gómez–Guerrero et al., 2002). No obstante, hay una correlación alta (0.92) en la determinación de δ13C con muestras procesadas y las de follaje crudo (Warren et al., 2001).
Efecto del estrés sobre la composición isotópica
Los valores de δ13C se modificaron por el nivel de humedad y por la interacción de humedad x temperatura, pero la temperatura por sí sola no influyó en δ13C (Cuadro 2). Este resultado indica cambios en δ13C con el nivel de humedad pero la respuesta depende del nivel de temperatura. Cuando ésta no se modificó (T0) las diferencias entre niveles de humedad fueron evidentes pero el efecto desaparece en condiciones de temperatura elevada (Figura 2). En S0 y S1 los valores promedio de δ13C fueron –24.42 ‰ y –23.86 ‰, con diferencia significativa (p≤0.01), aunque de sólo 0.56 ‰. En otros estudios se han encontrado mayores diferencias en δ13C en función de la especie y de la intensidad y duración del estrés en las plantas. Zhang et al. (1997) reportaron una diferencia de 1.5 ‰ en follaje de P. ponderosa Dougl. entre plantas con riego y sometidas a estrés hídrico. En ambientes naturales las variaciones en precipitación, humedad relativa y déficit de presión de vapor dan lugar a diferencias en δ13C en tejidos vegetales de hasta 5 ‰ (Panek y Waring 1995; García–García et al., 2004).

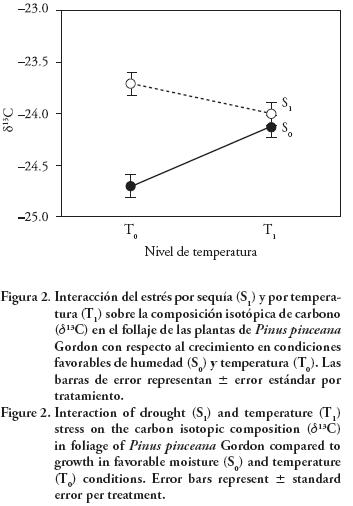
El efecto del estrés hídrico sobre la composición isotópica de carbono fue evidente en condiciones favorables de temperatura (T0). Los valores de δ13C aumentaron de –24.7 a –23.7 ‰, por el estrés hídrico, mientras en T1 los valores fueron –24.2 y –24.0 â°, para riego y sequía (Figura 2). Los resultados sugieren que cuando las plantas experimentaron estrés hídrico, el estrés térmico aumentó la discriminación de 13C, mientras que en condiciones de riego, el estrés térmico redujo la discriminación de 13C. En estudios con pastos perennes se ha observado un efecto positivo en la partición de carbono a la raíz cuando se combina un aumento en la temperatura nocturna con una sequía severa, pero un efecto opuesto si la sequía es moderada (Xu y Zhou, 2005). Posiblemente el efecto de la temperatura no fue suficiente para causar estrés en P. pinceana. En cambio, en un experimento con plantas de P edulis Engelm. donde se aumentó la temperatura en 4.3 °C, el efecto de ésta amplificó el estrés hídrico, con una mortalidad cinco veces mayor (Adams et al., 2009).
Diferencias entre poblaciones en la discriminación isotópica
Entre poblaciones se encontraron diferencias (p≤0.01) en δ13C; los valores promedio en las poblaciones del norte y sur fueron –23.99 y –24.43 ‰, con diferencias (p≤0.01) entre las regiones según la prueba de contrastes. Además, las diferencias entre las poblaciones en δ13C se mantuvieron en condiciones de estrés hídrico y térmico, pues las interacciones sequía X población y temperatura X población no fueron significativas (Cuadro 2). Al igual que en P. greggii (García–García et al., 2003), los resultados indican un comportamiento distinto entre poblaciones de P. pinceana del norte y sur. En promedio, las poblaciones del norte parecen responder más rápido al cierre de estomas por efecto de la sequía, dando como resultado mayor enriquecimiento de 13C. Se han detectado diferencias en las estrategias de adaptación a la sequía entre las plantas de estas regiones, como el mayor contenido de cera cuticular (Ramírez–Herrera, 2007), el menor tamaño y la menor relación parte aérea/raíz (Martiñón et al., 2010) en las poblaciones del norte. No existen datos de precipitación en los sitios donde crece P. pinceana, pero generalmente se supone menor humedad en la región norte que en la región sur (Ramírez–Herrera, 2007).
Olivas et al. (2000) también encontraron diferencias importantes entre poblaciones de P. ponderosa en la composición isotópica de carbono en el follaje de plantas sometidas a condiciones de estrés hídrico. Como en el caso de P. pinceana, las poblaciones originarias de sitios más secos presentaron menor discriminación del isótopo pesado; en ese estudio tampoco se encontró un efecto significativo de la interacción entre las poblaciones y el nivel de humedad sobre el valor promedio en δ13C, y algo similar ocurrió en árboles adultos de P. ponderosa (Cregg et al., 2000) y Picea mariana (Mill.) BSP (Flanagan y Johnsen, 1995) en condiciones de campo.
Tasa relativa de crecimiento
La tasa relativa de crecimiento (TRC) en altura se redujo significativamente (p≤0.05) en condiciones de estrés hídrico y térmico, aunque el efecto del estrés hídrico fue mayor (Figura 3). La TRC en biomasa sólo se modificó (p≤0.05) con el estrés hídrico. De acuerdo con la prueba de contrastes, las poblaciones del norte tuvieron una TRC promedio en altura más elevada (p≤0.01) que las del sur, aunque hay una amplia variación entre ellas (Figura 4).
Relación entre δ13C, tasa relativa de crecimiento y productividad potencial
La composición isotópica de carbono (δ13C) de las poblaciones se relacionó positivamente (r=0.71) con su tasa relativa de crecimiento en altura (Figura 5A); las poblaciones con menor discriminación en 13C presentaron una mayor TRC en altura. Sin embargo, δ13C no se correlacionó de manera significativa con la TRC en biomasa. La correlación positiva entre δ13C y la TRC en altura (r = 0.86) se mantuvo en condiciones de sequía (Figura 5B), pero desapareció en condiciones favorables de humedad. Flanagan y Johnsen (1995) también observaron una elevada correlación positiva entre δ13C y la altura de los árboles en familias de Picea mariana (Mill) B.S.P. en un sitio de ambiente seco, pero la correlación se perdió en sitios más húmedos. La relación entre δ13C y biomasa depende también de la especie; por ejemplo, Zhang et al. (1996) encontraron correlaciones significativas de δ13C con el crecimiento en altura y biomasa en Larix occidentalis Nutt. y Pseudotsuga menziesii pero no en Pinus ponderosa. Los resultados en diferentes especies de coniferas, incluyendo P. pinceana, parecen indicar que la eficiencia relativa en el uso del agua (estimada con δ13C) es importante para el crecimiento y productividad de las plantas cuando se presentan condiciones de baja humedad en el suelo, aunque los mecanismos fisiológicos responsables de la variación en el crecimiento difieren entre ellas.
El valor de δ13C de las poblaciones en condiciones de sequía se correlacionó positiva (r=0.66) y significativamente con la TRC en altura en condiciones favorables de humedad (Figura 5C), pero no con la productividad potencial de las poblaciones, medida en términos de la acumulación de biomasa total de las plantas en condiciones ambientales favorables (Figura 5D). La productividad potencial y la eficiencia relativa en el uso del agua en condiciones de sequía (estimada con δ13C) se comportaron como características independientes en este estudio, por lo que las poblaciones de P. pinceana con mayor biomasa en condiciones favorables no necesariamente son las más eficientes en el uso del agua al enfrentar condiciones de sequía. Sin embargo, como la correlación no fue negativa, también es posible encontrar poblaciones con valores en las dos características mayores al promedio de las otras, como la de Santa Elena, Coahuila (Figura 5D).
CONCLUSIONES
Pinus pinceana mostró una variación significativa en δ13C como resultado del estrés hídrico, pero no por estrés térmico. Dado que una menor discriminación en el isótopo pesado de carbono se asocia con una mayor eficiencia en el uso del agua de las plantas, esta característica tiene una gran importancia en la capacidad de adaptación de las poblaciones a las condiciones de estrés hídrico comunes en su habitat natural. Las diferencias en δ13C entre las poblaciones son consistentes con las diferencias en la tasa relativa de crecimiento y en otras características morfológicas y fisiológicas descritas en estudios anteriores, posiblemente una manifestación de la selección natural en respuesta al gradiente ambiental dentro del área de distribución natural de la especie en las zonas semiáridas de México.
Los valores de δ13C de las poblaciones en condiciones de sequía no mostraron una correlación significativa con su productividad potencial; si estas características son independientes, es posible encontrar poblaciones con mayor δ13C (y mayor eficiencia relativa en el uso del agua) en condiciones de estrés hídrico y al mismo tiempo aumentar o mantener la productividad de la especie. Poblaciones como la de Santa Elena, Coahuila, al combinar favorablemente estas dos características son importantes para iniciar un programa de restauración y conservación ecológica de la especie frente a las condiciones esperadas de mayor estrés ambiental debido al cambio climático.
AGRADECIMIENTOS
A SEMARNAT–CONACYT por el financiamiento recibido a través del proyecto 2002–C01–1429 "Ecología, genética de poblaciones y estrategias de conservación de poblaciones naturales de Pinus pinceand". Este proyecto forma parte de una de las Tareas del Grupo de Trabajo en Recursos Genéticos Forestales de la Comisión Forestal para América del Norte.
LITERATURA CITADA
Adams, H. D., M. Guardiola–Claramonte, J. C. Villegas, C. B. Zou, P. A. Troch, and T. E. Huxman. 2009. Temperature sensitivity of drought–induced tree mortality portends increased regional die–off under global–change–type drought. Proc. Nati. Acad. Sci. USA. 106: 7063–7066. [ Links ]
Anekonda, T, C. Jones, B. N. Smith, and L. D. Hansen. 2004. Differences in physiology and growth between coastal and inland varieties of Douglas–fir seedlings in a common garden. Thermochimica Acta 422: 75–79. [ Links ]
Brodribb, T., and R. S. Hill. 1998. The photosynthetic drought physiology of a diverse group of southern hemisphere conifer species is correlated with minimum seasonal rainfall. Functional Ecol. 12: 465–471. [ Links ]
Boutton, T. W. 1991. Stable carbon isotope ratios of natural materials: I. Sample preparation and mass spectrometric analysis. In: Coleman, D. C, and B. Fry (eds). Carbon Isotope Techniques. Academic Press, San Diego, pp: 155–171. [ Links ]
Correia, I., M. H. Almeida, A. Aguiar, R. Alia, T.S. David, and J. S. Pereira. 2008. Variations in growth, survival and carbon isotope composition (delta C–13) among Pinus pinaster populations of different geographic origins. Tree Physiol. 28: 1545–1552. [ Links ]
Cregg, B. M., J. M. Olivas–García, and T C. Hennessey. 2000. Provenance variation in carbon isotope discrimination of mature ponderosa pine trees at two locations in the Great Plains. Can. J. For. Res. 30: 428–439. [ Links ]
Farquhar, G. D., M. H. O'Leary, and J. A. Berry. 1982. On the relationship between carbon isotope discrimination and the intercellular carbon dioxide concentration in leaves. Aust. J. Plant Physiol. 9: 121–137. [ Links ]
Farquhar, G. D., K. T Hubick, A. G. Condon, and R. A. Richards. 1989. Carbon isotope fractionation and plant water use efficiency. In: Rundel, P. W., J. R. Ehleringer, and K. A. Nagy (eds). Stable Isotopes in Ecological Research. Springer–Verlag, New York, pp: 21–40. [ Links ]
Flanagan, L. B., and K. H. Johnsen. 1995. Genetic variation in carbon isotope discrimination and its relationship to growth under field conditions in full–sib families of Picea mariana. Can. J. For. Res. 25: 39–47. [ Links ]
García–García, R., A. Gómez–Guerrero, J. López–Upton, y J. J. Vargas–Hernández. 2003. Composición isotópica de carbono y crecimiento de Pinus greggii Engelm. en vivero. Agrociencia 37: 467–475. [ Links ]
García–García, R., A. Gómez–Guerrero, J. López–Upton, J. J. Vargas–Hernández, and W. R. Horwath. 2004. Tree growth and 13C among populations of Pinus greggii Engelm. at two contrasting sites in central Mexico. For. Ecol. Manage. 198: 237–247. [ Links ]
Gómez–Guerrero, A., M. J. Singer, R. F. Powers, and W. R. Horwath. 2002. Soil compaction effects on water status of ponderosa pine assessed through 13C/12C composition. Tree Physiol. 22:459–467. [ Links ]
Letts, M. G., K. N. Nakonechny, K. E. Van Gaalen, and C. M. Smith. 2009. Physiological acclimation of Pinus flexilis to drought stress on contrasting slope aspects in Waterton Lakes National Park, Alberta, Canada. Can. J. For. Res. 39: 629–641. [ Links ]
Loreto F, and M. Centritto. 2008. Leaf carbon assimilation in a water–limited world. Plant Biosystems 142: 154–161. [ Links ]
Martiñón–Martínez, R. J., J. J. Vargas–Hernández, J. López–Upton, A. Gómez–Guerrero, y H. Vaquera–Huerta. 2010. Respuesta de Pinus pinceana Gordon a estrés por sequía y altas temperaturas. Fitotecnia Mex. 33: 239–248. [ Links ]
Molina R, R, P. Delgado, D. Pinero, N. Pérez N., and E. Alvarez B. 2001. Do rare pines need different conservation strategies?. Evidence from three Mexican species. Can. J. Bot. 79: 131–138. [ Links ]
Nilsen, E. T., and D. M. Orcutt. 1996. The Physiology of Plants Under Stress: Abiotic Factors. John Wiley & Sons, New York. 689 p. [ Links ]
Olivas G., J. M., B. M. Cregg, and T. C. Hennessey. 2000. Genotypic variation in carbon isotope discrimination and gas exchange of ponderosa pine seedlings under two levels of water stress. Can. J. For. Res. 30: 1581–1590. [ Links ]
Panek, J. A. 1996. Correlations between stable carbon–isotope abundance and hydraulic conductivity in Douglas–fir across a climate gradient in Oregon, USA. Tree Physiol. 16: 747–755. [ Links ]
Panek, J. A., and R. H. Waring. 1995. Carbon isotope variation in Douglas–fir foliage: improving the δ13C–climate relationship. Tree Physiol. 15: 657–663. [ Links ]
Perry, J. P. Jr. 1991. The Pines of México and Central America. Timber Press, Portland, Oregon, USA. 231 p. [ Links ]
Ramírez–Herrera, C. 2007. Quantitative trait variation and allo–zyme diversity of Pinus pinceana. Ph. D. Thesis in Forestry. University of New Brunswick, Canada. 213 p. [ Links ]
Ramírez–Herrera C, T. Beardmore, and J. Loo. 2008. Overcoming dormancy of Pinus Pinceana seeds. Seed Sci. Tech. 36: 1–20. [ Links ]
Sáenz–Romero, C, G. E. Rehfeldt, N. L. Crookston, P. Duval, R. St–Amant, J. Beaulieu, and B. A. Richardson. 2010. Spline models of contemporary, 2030, 2060 and 2090 climates for Mexico and their use in understanding climate–change impacts on the vegetation. Climatic Change 102: 595—623. [ Links ]
SAS Institute. 1998. SAS/STAT User's release 6.03. SAS Institute, Cary, N. C. 1028 p. [ Links ]
Schlesinger, W. H. 1997. Biogeochemistry: An Analysis of Global Change. 2nd ed. Academic Press, San Diego. 588 p. [ Links ]
Villarreal–Quintanilla, J. A., O. Mares–Arreóla, E. Cornejo–Oviedo, y M. A. Capó–Arteaga. 2009. Estudio florístico de los piñonares de Pinus pinceana Gordon. Acta Bot. Mex. 89: 87–124. [ Links ]
Voltas, J., M. R. Chambel, M. A. Prada, and J. P. Ferrio. 2008. Climate–related variability in carbon and oxygen stable isotopes among populations of Aleppo pine grown in common–garden tests. Trees 22: 759–769. [ Links ]
Warren, C. R., J. F. McGrath, and M. A. Adams. 2001. Water availability and carbon isotope discrimination in conifers. Oecología 127:476–486. [ Links ]
Xu, Z. Z., and G. S. Zhou. 2005. Effects of water stress and nocturnal temperature on carbon allocation in the perennial grass, Leymus chinensis. Physiol. Plant. 123: 272–280. [ Links ]
Zhang, J. W, J. D. Marshall, and L. Fins. 1996. Correlated population differences in dry matter accumulation, allocation, and water–use efficiency in three sympatric conifer species. For. Sci. 42: 242–249. [ Links ]
Zhang, J. W, Z. Feng, B. M. Cregg, and C. M. Schumann. 1997. Carbon isotopic composition, gas exchange, and growth of three populations of ponderosa pine differing in drought tolerance. Tree Physiol. 17: 461–466. [ Links ]














