Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.8 Texcoco nov./dic. 2010
Fauna silvestre
Presencia de Helmintos en el pato triguero (Anas platyrhynchos diazi) del altiplano zacatecano, México
Presence of helminths in the mexican duck (Anas platyrhynchos diazi) of the zacatecano plateau, Mexico
Marisa Mercado–Reyes1*, Sofía Angulo–Castillo1, Fernando Clemente–Sánchez2, Alan Hernández–Llamas1, J. Ignacio Gonzáles–Rojas3, Enrique López–Torres1, Patricio Tavizón–García1
1 Laboratorio de Biología de la Conservación, Unidad Académica de Biología Experimental, Universidad Autónoma de Zacatecas, Calzada de la Revolución Mexicana s/n, Guadalupe, Zacatecas, 98600, México. * Autor responsable: (lailammr@gmail.com).
2 Área de Fauna Silvestre, Colegio de Post–graduados, Campus San Luis Potosí, Iturbide 73, Salinas, San Luis Potosí, 78620, México.
3 Laboratorio de Biología de la Conservación, Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, San Nicolás de los Garza Nuevo León, 66451, México.
Recibido: Enero, 2010.
Aprobado: Octubre, 2010.
Resumen
Las aves acuáticas, como el pato triguero (Anas platyrhynchos diazi), son portadoras de parásitos que pueden afectar a las poblaciones de diferentes especies distribuidas en el altiplano zacatecano, México. El presente estudio tuvo como objetivos identificar las especies de helmintos de la población de pato triguero del altiplano zacatecano, y comparar la composición de helmintos de acuerdo al sexo de los patos. Se recolectaron aleatoriamente 24 patos triguero (14 machos y 10 hembras) de en los cuerpos de agua: presa La Zacatecana, bordo El Maguey, bordo Matanuzka y sistema de bordos de la UMA Los Jales del altiplano zacatecano. En cada pato recolectado se realizó la necropsia para obtener e identificar sus parásitos y determinar el nivel de parasitosis. Ocho parásitos pertenecientes a cuatro clases fueron identificados: Trematoda (3), Nematoda (2), Acantocephala (2) y Cestoda (1), y correspondientes a ocho familias: Polyntorphidae (1), Hymenolepididae (1), Psilostomidae (1), Paranfistomidae (1), Echinostomatidae (1), Trychostrongylidae (1), Trichuridae (1) y Echinorhynquidae (1). El parásito con mayor prevalencia fue Zygocotyle lunata (66.67 %), y las especies con menor prevalencia fueron Echinostomum revolutum, Capillaria sp. y Polymorphus ondatrae (4.17 % para cada una). La prevalencia de helmintos entre los sexos de anátidos fue similar (p>0.05); sin embargo, la intensidad parasitaria por clase de helminto entre sexos indicó una diferencia significativa (p≤0.05) para tremátodos, acantocéfalos y cestodos. Los resultados del presente trabajo concuerdan con los reportados por varios autores para diferentes especies de patos.
Palabras clave: acantocephala, aves acuáticas, Cestoda, Nematoda, parásitos, Trematoda.
Abstract
Waterfowl, such as the Mexican duck (Anas platyrhynchos diazi), are carriers of parasites that can affect the populations of different species distributed in the Zacatecano plateau, México. The objectives of the present study were to identify the species of helminths of the Mexican duck population of the Zacatecano plateau, and to compare the composition of helminths according to the sex of the ducks. Twenty four Mexican ducks (14 males and 10 females) were randomly collected in the following bodies of water: La Zacatecana dam, El Maguey pond, Matanuzka pond and the UMA pond system Los Jales of the Zacatecano Plateau. Necropsy was made in each collected duck to obtain and identify their parasites and to determine the level of parasitosis. Eight parasites belonging to four classes were identified: Trematode (3), Nematode (2), Acanthocephala (2) and Cestode (1), and corresponding to eight families: Polyntorphidae (1), Hyntenolepididae (1), Psilostomidae (1), Paranfistomidae (1), Echinostomatidae (1), Trychostrongylidae (1), Trichuridae (1) and Echinorhynquidae (1). The parasite with highest prevalence was Zygocotyle lunata (66.67%), and the species with lowest prevalence were Echiostomum revolutum, Capillaria sp. and Polymorphus ondatrae (4.17% for each one). The prevalence of helminths between the sexes of Anatidae was similar (p>0.05). However, the parasitic intensity per class of helminth between sexes indicated a significant difference (p≤0.05) for trematodes, acanthocephala and cestodes. The results of the present study agree with those reported by various authors for different species of ducks.
Key words: acanthocephala, waterfowl, Cestode, Nematode, parasites, Trematode.
Introducción
En el altiplano zacatecano existen hábitats importantes para varias especies de aves acuáticas, como el pato triguero (Anas platyrhynchos diazi). En México, debido a sus características poblacionales esta ave es considerada por la Norma Oficial Mexicana (NOM–059–SEMARNAT–2002) como especie amenazada. Pertenece a la subfamilia Anatinae, dentro de la tribu Anatini en la cual se encuentran los patos de superficie, denominados de esta forma por el hábito de alimentarse en la capa superior de los cuerpos de agua o en aguas poco profundas (Batt, 1992). El pato triguero es una especie residente (Leopold, 1983) en su área de distribución, aunque algunos autores describen desplazamientos locales temporales de acuerdo con la disponibilidad de agua y alimento (Johnsgard, 1961; Williams, 1980). En el estado de Zacatecas esta ave se distribuye en presas, ciénagas y bordos durante todo el año. Hay poca información acerca de la biología y otros aspectos de la especie en México a pesar de su estado de conservación (Pérez et al., 2002); además, se carece de información actualizada acerca de sus parásitos.
Las aves silvestres son huéspedes potenciales de diversos parásitos, por lo que la ocurrencia de parasitosis es una regla general (Fried y Franson, 1999). El desarrollo y localización de las parasitosis están determinados por una gama amplia de factores ambientales (Wobser, 2007); algunos parásitos requieren la presencia de dos o más hospederos debido a su adaptación a ciclos de vida que involucran diferentes ambientes bióticos (Olsen, 1974). La concentración de individuos en áreas pequeñas está relacionada con la fragmentación y pérdida del hábitat, lo que promueve el intercambio y transmisión de parásitos; como consecuencia se incrementa el potencial de estos patógenos y pueden afectar la supervivencia de especies con distribución limitada o poblaciones pequeñas (Holmes, 1996). Los humedales del altiplano zacatecano presentan un deterioro ambiental progresivo debido a diversos procesos antropogénicos que se desarrollan a sus alrededores. Por tanto, la contaminación por la presencia de aguas negras, desechos mineros y la actividad agropecuaria son factores que predisponen la generación de enfermedades parasitarias en las poblaciones de aves acuáticas.
Los helmintos son parásitos frecuentes en las aves acuáticas y usualmente no producen efectos letales (Gray et al., 1989); particularmente, los tremátodos poseen ciclos de vida en los que generalmente requieren moluscos acuáticos como huéspedes intermediarios por lo que los anátidos son huéspedes potenciales de estos parásitos. Los cestodos y acantocéfalos sólo en cargas altas causan impactos fisiológicos importantes en el ciclo de vida de las aves acuáticas (patos, gansos y cisnes), convirtiéndose en un factor predisponente para otras enfermedades (Fried y Franson, 1999). Los helmintos identificados en pato triguero son los mismos parásitos descritos en otras aves acuáticas, entre los que están tremátodos, cestodos y acantocéfalos (Farias y Canaris, 1986). La generación de conocimiento acerca de la biología de la población y del parásito permitirá predecir amenazas a especies y comunidades vulnerables (Smith et al., 2006). Debido a la probabilidad del desarrollo de infecciones parasitarias en el pato triguero en el altiplano zacatecano, los objetivos del presente estudio fueron identificar los helmintos que infectan al pato triguero en esa área, así como determinar diferencias en la composición de helmintos entre machos y hembras de esta ave.
MATERIALES Y MÉTODOS
Se recolectaron 24 patos triguero (14 machos y 10 hembras) con una escopeta calibre 12, y un permiso especial de recolecta científica (SEMARNAT–08–017) autorizado por la Dirección General de Vida Silvestre (DGVS). Los animales fueron cazados entre mayo y agosto del 2005 en cuatro cuerpos de agua seleccionados aleatoriamente, del centro del estado de Zacatecas, México, ubicados en la región fisiográfica de los Valles Centrales (Figura 1): presa La Zacatecana (municipio de Guadalupe) y bordo El Maguey (municipio de Zacatecas), bordo Matanuzka en la parte sur del estado (municipio de Ojocaliente) y el sistema de bordos de la UMA Los Jales (municipio de Fresnillo; Cuadro 1). La vegetación de la zona se compone de pastizal y matorral semiárido (Rzedowski, 1981). Los ejemplares fueron transportados al laboratorio para identificar los parásitos.
Recolección e identificación de parásitos
En cada ejemplar se hizo la necropsia y análisis de visceras según lo descrito por Hoeve y Scott (1988), Kalla et al. (1997) y Hung (2002), con las siguientes modificaciones: todos los órganos fueron disecados e identificados, colocados en contenedores separados con agua salina amortiguada estéril (pH 7.3) e inspeccionados con un microscopio estereoscópico Leica de luz reflejada (Wetzlar, Alemania). La tráquea, esófago, ductos biliares, uréteres, intestino delgado, intestino grueso y ciegos se disecaron longitudinalmente para examinar el lumen. El revestimiento de la molleja se removió e inspeccionó debajo de ella. La cloaca y la bursa se invirtieron para su análisis; los pulmones, hígado, corazón y cápsula renal fueron inspeccionados después de separarlos. En todos los casos, los parásitos fueron identificados con base en estudios morfológicos detallados y claves de identificación para nematodos (Yorke y Maplestone, 1926; Schurmans, 1951; Anderson, 1992), tremátodos (McDonald, 1981; Tantaleán et al., 1992) y helmintos (Guillen y Morales, 2003). Los parásitos y ejemplares de pato fueron procesados para su conservación y están depositados en el Laboratorio de Biología de la Conservación de la Unidad Académica de Biología Experimental de la Universidad Autónoma de Zacatecas, México. Se determinó la prevalencia, definida como el número de hospederos infectados con al menos un parásito, dividido entre el total de individuos analizados (Bush et al., 1997) y presentada como porcentajes. La intensidad total parasitaria fue definida como número total de parásitos por huésped parasitado (Muñoz et al., 2002). Los datos obtenidos no se ajustaron a una distribución normal, por lo que se realizó la prueba la prueba no paramétrica de Kruskall–Wallis para comparar prevalencia e intensidad total parasitaria entre sexos del pato triguero (Gladden y Canaris, 2009). Los análisis estadísticos se realizaron con el programa SPSS (Ferrán, 2002).
RESULTADOS Y DISCUSIÓN
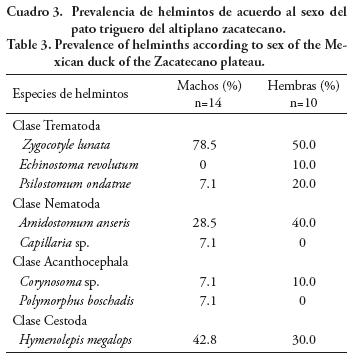
De los 24 patos triguero analizados, 20 individuos (83–33 %) presentaron infección parasitaria por una o más especies de helmintos. Ocho especies de helmintos fueron identificadas e incluyeron tres de tremátodos (Zygocotile lunata, Echinostoma revolutum y Psilostomum ondatrae), dos de nematodos (Amidostomum anserisy Capillaria sp.), dos de acantocéfalos (Corynosoma sp. y Polymorphus boschadis) y una de cestodo (Hymenolepis megalops) (Cuadro 2). Las especies Z. lunata, H. megalops y A. anseris presentaron prevalencias altas: 66.6 %, 37.5 % y 33.3 %. En contraste, Farias y Canaris (1986) identificaron 25 especies de helmintos en 79 % de 129 patos triguero en el norte–centro de México (Aguascalientes, Jalisco, Durango y Chihuahua) y suroeste de USA (New Mexico y Texas), entre ellas a Z. lunata, H. megalops y E. revolutum. Estos autores refieren una prevalencia para tremátodos de 68.2 %, cestodos 98.4 %, acantocéfalos 6.9 % y nematodos 13.1 %. Además, Shaw y Kocan (1980) describen una prevalencia de helmintos de 47.8 %, 72.4 %, 26.1 % y 20.3 % para géneros de tremátodos, cestodos, nematodos y acantocéfalos, en el 90.1 % de 71 ejemplares de pato de collar (Anasp. platyrhynchos), pato calvo (Anas americana), cerceta de alas azules (Anas discors) y cerceta común (Anas creced) analizados en el centro de Oklahoma, EE.UU. Las diferencias entre el número de especies de helmintos obtenidos en el presente estudio y los descritos en las publicaciones de los autores mencionados probablemente se deben al tamaño de la muestra usada. Sin embargo, los porcentajes de prevalencia en los tres análisis son similares, con excepción de los cestodos y tremátodos. Los contrastes se pueden explicar por la diferencia entre los periodos de muestreo y la localización de las áreas de estudio.

En el análisis de la intensidad total parasitaria por clase de helmintos se observaron 44 especímenes de tremátodos, 27 de cestodos, 13 de nematodos y 4 de acantocéfalos. Al respecto, Farjana et al. (2008) refieren la presencia de más de una especie de tremátodos en un individuo de pato infectado, y que su densidad en el hospedero está relacionada con la presencia de moluscos acuáticos, los cuales a su vez son huéspedes intermediarios de las especies de helmintos. Los cestodos se encuentran frecuentemente en la fauna silvestre; sin embargo, sólo las cargas parasitarias altas pueden disminuir la salud del huésped. Los acantocéfalos tienen como huésped intermediario algunas especies de crustáceos, por lo que se infiere que las aves acuáticas son huéspedes potenciales de estos helmintos. La mortalidad a causa de la infección por acantocéfalos sólo se ha reportado en patos en regiones árticas y se atribuye a sus hábitos alimenticios (Fried y Franson, 1999).
Las infecciones únicas, dobles y mixtas de las ocho especies de parásitos identificados correspondieron a 9 (45 %), 6 (30 %) y 5 (25 %) de las aves infectadas, de 1 a 4 especies de parásitos por individuo, y un total de 1 a 14 parásitos por pato. Según Shaw y Kocan, (1980), la intensidad de las infecciones, la prevalencia y las especies de parásitos dependerán de las especies de hospederos examinadas y de la época de muestreo. Además, la eficiencia de dispersión de los patógenos se encuentra limitada por factores bióticos y abióticos del ambiente (Hubálek, 2004). Por ejemplo, Villatoro y Sáenz (2005) determinaron que el efecto de los patógenos sobre sus huéspedes podría cambiar en dependencia de la conexión entre los fragmentos de hábitat remanente, debido a que los humedales del altiplano zacatecano están sujetos a alteraciones antropógenas como las relacionadas con las actividades salineras y agropecuarias y a la contaminación por las escorrentías de aguas negras (rastros, desechos de las comunidades adyacentes y mineros). Por lo anterior, es probable el incremento de la diversidad de parásitos con consecuencias para las aves acuáticas (Spalding et al., 1993, Santiago y Weis, 2008).
La prevalencia en hembras del pato triguero fue 80 %, mientras que para los machos fue 87.7 % (Cuadro 3). La prueba no paramétrica de Kruskall– Wallis mostró similitud (p>0.5) en la prevalencia de helmintos entre machos y hembras de los ejemplares analizados. Además, se observó diferencia (p≤0.5) en la prevalencia de las clases de tremátodos, cestodos y acantocéfalos entre los sexos de los patos. Esta diferencia se confirmó con el análisis de la intensidad total parasitaria entre sexos (p≤0.5) para Z. lunata (trematoda), Corynosoma sp. (acantocefala) y H. megalops (cestoda). Muniz–Pereira y Amato (1998) también reportan diferencia significativa en la prevalencia de H. megalops entre hembras (83.3 %) y machos (40 %) del pato cariblanco (Anas bahamensis) y del pato brasileño (Amawnetta brasiliensis). Los citados autores postulan que diferencias en el aporte nutricional entre sexos de los anátidos es un factor que incrementa la posibilidad de infección de helmintos en las hembras, ya que por sus requerimientos nutricionales durante la época reproductiva aumenta la diversidad de fuentes de alimentación, lo que las predispone a un mayor riesgo de contraer infecciones parasitarias al ingerir alimentos contaminados. Los resultados de un estudio en pato doméstico en semicautiverio (Yousuf et al., 2009) confirman parcialmente que la prevalencia alta de helmintos en las hembras se debe a los hábitos alimenticios y crianza de los polluelos. En contraste, Nowicki et al. (1995) señalan que existen diferencias en la intensidad de las infecciones entre hembras y machos pero no en la prevalencia entre sexos en el ganso canadiense (Branta canadensis).
CONCLUSIONES
Los helmintos identificados en el pato triguero del altiplano zacatecano son parásitos comunes entre varias especies de patos de superficie. La similitud entre estas parasitosis y las descritas en otras partes de México y en EE.UU. sustenta la hipótesis de una estrecha relación entre la distribución de los helmintos y la probabilidad de su transmisión durante el proceso de migración, ya que el altiplano zacatecano forma parte de los hábitats invernales de varias aves acuáticas dentro de la ruta migratoria central en México.
Las prácticas ineficientes del manejo y aprovechamiento no sostenible de los humedales potencializan la transmisión de los parásitos en los hábitats de las aves acuáticas. Las actividades antropogénicas han modificado los humedales del altiplano y pueden provocar un aumento de la intensidad y desarrollo de las parasitosis en el pato triguero y otras especies acuáticas. La presencia de estas especies de helmintos es la evidencia del desarrollo de sus ciclos biológicos en el área, lo cual es un factor de riesgo para las poblaciones de pato triguero en los humedales de la región.
AGRADECIMIENTOS
Los autores agradecen a Fondos Mixtos CONACYT y al Gobierno del Estado de Zacatecas por el apoyo financiero otorgado; a la Dirección General de Vida Silvestre por su colaboración; a la Dra. Irene de Haro Arteaga, docente investigadora de Laboratorio de Parasitología de la Universidad Autónoma de México por su participación en la identificación de parásitos. Todo lo anterior en la realización del presente proyecto.
LITERATURA CITADA
Anderson, R. C. 1992. Nematode Parasites of Vertebrales. Their Development and Transmission. Department of Zoology University of Guelp. Ontario, Canada, pp: 545–550. [ Links ]
Batt, B. D. J. 1992. Introduction, the waterfowl. In: Batt, B. D. J., A. D., Afton, M. G., Anderson, C. D., Ankney, D. H., Johnson, J. A., Kadlec, and G. L., Krapu (eds). Ecology and Management of Breeding Waterfowl. University of Minnesota Press, Minneapolis, pp: 13–20. [ Links ]
Bush, A. O., K. D. Lafferty, J. M. Lotz, and A. W. Shostak. 1997. Parasitology meets ecology on its own terms: Margolis et al. revisited. J. Parasitol. 83: 575–583. [ Links ]
Farias, J. D., and A. G. Canaris. 1986. Gastrointestinal helminths of the Mexican duck, Anas platyrhynchos diazi Ridgway from north central Mexico and southwestern United States. J.Wildl. Dis. 22:51–54. [ Links ]
Farjana, T, K. R. Islam, and M. M. H. Mondal. 2008. Population density of helminths in ducks: effects of host's age, sex, breed and season. Bangl.J. Vet. Med. 6: 45–51. [ Links ]
Ferrán A. M. 2002. Curso de SPSS para Windows. Ed. McGraw–Hill, España. 401 p. [ Links ]
Fried, M., and J.C. Franson. 1999. Field manual of wildlife diseases: General field procedures and diseases of birds. US Geological Service, Biological Resources Division, Washington, D. C. 424 p. [ Links ]
Gladden, B. W., and A. G. Canaris. 2009. Helminth parasites of the bufflehead duck, Bucephala albeola, wintering in the chihuahua desert with a checklist of helminth parasites reported from this host. J. Parasitol. 95: 129–136. [ Links ]
Gray, C. A., P. N. Gray, and D. B. Pence. 1989. Influence of social status on the helminth community of late–winter mallards. Can. J. Parasitol. 67: 937–1944. [ Links ]
Guillen G., y E. Morales. 2003. Primeros registros de helmintos parásitos en Yulial ardesiaca (Aves: Rallidae) para el Perú: Pantanos de Villa–Lima. Rev. Perú Biol. 10: 203–208. [ Links ]
Hoeve, J., and M. E. Scott. 1988. Ecological studies on Cyathocotyle bushiensis (Digenea) and Sphaeridiotrema globulus (Digenea), possible pathogens of dabbling ducks in Southern Quebec. J. Wildl. Dis. 24: 407–21. [ Links ]
Hubálek, Z. 2004. An annotated checklist of pathogenic microorganisms associated with migratory birds. J. Wildl. Dis. 40: 639–659. [ Links ]
Hung, N. H. 2002. Study on tapeworms (class: Cestode) in duck in the Chau Thanh and O Mon districts of Cantho Province. 2002. Res. Topics Liv. Prod. 12: 220–225. [ Links ]
Johnsgard PA. 1961. Evolutionary relationship among the North American mallards. Auk 78: 3–43. [ Links ]
Kalla, P. I., R. W. Dimmick, and S. Patton. 1997. Helminths in Ruffed Grouse at the host's southeastern range boundary. J. Wildl. Dis. 33: 503–510. [ Links ]
Leopold, A. S. 1983. Fauna Silvestre de México. 2da. ed. Pax–México. A.C., México. 608 p. [ Links ]
McDonald, M. E. 1981. Key to Trematodes reported in waterfowl. Resource publication 142, United States Department of the Interior, U. S. Fish and Wildlife Service, Washington, D.C. 156 p. [ Links ]
Muniz–Pereira, L.C., and S.B. Amato. 1998. Fimbriaria fasciola–ris and Cloacotaenia megalops (Eucestoda, Hymenolepididae), Cestodes from Brazilian Waterfowl. Mem. Inst. Oswaldo Cruz 93: 767–772. [ Links ]
Muñoz, G., V. Valdebenito, y M. George–Nascimento. 2002. La dieta y la fauna de parásitos metazoos del torito Bovichthys chilensis Regan 1914 (Pisces: Bovichthydae) en la costa de Chile centro–sur: variaciones geográficas y ontogenéticas. Rev. Chil. Hist. Nat. Santiago 75: 661–671. [ Links ]
Nowicki, A., D. D. Roby, and A. Wolf. 1995. Gizzard nemato–des of Canada Geese wintering in Southern Illinois. J. Wildl. Dis. 31:307–313. [ Links ]
Olsen, W O. 1974. Animal Parasites. Their Life Cycles and Ecology. University Park Press. Baltimore Maryland. 562 p. [ Links ]
Pérez, A. A., K. J. Gastón, and W M. Kershaw. 2002. Populations trends and priority conservation sites for Mexican duck Anas diazi. Bird Cons. Int. 12:35–52. [ Links ]
RzedowskiJ. 1981. Vegetación de México. Limusa. México. 432 p. [ Links ]
Santiago, B. C, and J. S. Weis. 2008. Increased abundance of snails and trematode parasites of Fundulus heteroclitus (L.) in restored New Jersey wetlands. Wetlands. Ecol. Manage. 16: 173–182. [ Links ]
Schurmans, J. H. 1951. Nematodes parásitos de anfibios, pájaros y mamíferos de la República Argentina. Act. Zool. Lilloana 32:315–400. [ Links ]
Shaw, M. G., and A. A. Kocan. 1980. Helminth fauna of waterfowl in central Oklahoma. J. Wildl. Dis. 16: 59–62. [ Links ]
Smith, K. E, D. E. Sax, and K. D. Lafferty. 2006. Evidence for the role of infectious disease in species extinction and endan germent. Conserv. Biol. 20: 1349–1357. [ Links ]
Spalding, M. G., G. T. Bancroft, and D. J. Forrester. 1993. The epizootiology of eustrongylidosis in wading birds (Ciconii formes) in Florida. J. Wild. Diseas. 29: 237–249. [ Links ]
Tantaleán M., L. Sarmiento, y A. Huiza. 1992. Digeneos (Tre matoda) del Perú. Boletín de Lima 80: 47–84. [ Links ]
Villatoro, F. P., y J. Saenz C. 2005. La fragmentación del hábitat impactos sobre la dinámica huésped–parásito de la avifauna en paisajes agropecuarios de Esparza Costa Rica. Bol. Asoc. Ornitol. de Costa Rica Rev. Ornitol. Costa Rica 9: 3–5. [ Links ]
Williams, S. 1980. The Mexican duck in Mexico: natural history, distribution, and population status. Thesis (Ph.D.) Colorado State University. 284 p. [ Links ]
Wobser, A. G. 2007. Disease in Wild Animals. Investigation and Management. Springer. New York 400 p. [ Links ]
Yorke, M., and R. Maplestone. 1926. The nematode parasites of vertebrates. In: Yorke, M., and R. Maplestone. Churchill Publications, London. 541 p. [ Links ]
Yousuf, M.A., P.M. Das, Anisuzzaman, and B. Banowary. 2009. Gastrointestinal helminths of ducks: Some epidemiologic and pathologic aspects. J. Bangl. Agril. Univ. 7: 91–97. [ Links ]














