Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agrociencia
versão On-line ISSN 2521-9766versão impressa ISSN 1405-3195
Agrociencia vol.44 no.8 Texcoco Nov./Dez. 2010
Ciencia animal
Producción de gas in vitro y desaparición de la materia seca del cultivo sólido con hongos ligninolíticos
In vitro gas production and dry matter dissapearance of solid culture with ligninolytic fungi
Marcela Villegas–Castañeda1* , Marcos Meneses–Mayo1,4, Luis A. Miranda–Romero2, Octavio Loera–Corral3
1 Ganadería. Campus Montecillo. Colegio de Posgraduados. 56230. Montecillo, Estado de México. * Autor responsable: (marcela @colpos.mx).
2 Zootecnia, Universidad Autónoma Chapingo. 56230, Chapingo, Estado de México.
3 Departamento de Biotecnología, Universidad Autónoma Metropolitana Iztapalapa. Avenida Sn Rafael Atlixco No. 186. Colonia Vicentina. 09430. Delegación Iztapalapa.
4 Facultad de Ciencias de la Salud (Nutrición), Universidad Anáhuac, México–Norte. Avenida Universidad Anáhuac No. 46, Colonia Lomas Anáhuac, Huixquilucan, Estado de México. 52786 (mmayo@colpos.mx)
Recibido: Abril, 2010.
Aprobado: Agosto, 2010.
Resumen
La paja de sorgo, un esquilmo agrícola abundante en México y que se usa como alimento para rumiantes, tiene baja digestibilidad por lo que se usan diversos métodos para aumentar su calidad. Por tanto, el objetivo de este estudio fue evaluar las características fermentativas in vitro del cultivo sólido de paja de sorgo tratada con hidróxido de calcio Ca(OH)2 y sin tratar, y fermentada durante 20 d con los hongos Pleurotus sapidus y Fomes fomentarius EUM1. Se usó la técnica de producción de gas in vitro y se midió Vmax, S, L, desaparición de la materia seca, AGV y N–NH3. El diseño experimental fue bloques al azar generalizados y se compararon las medias mediante contrastes. El tratamiento con Ca(OH)2 mostró la mejor producción de gas fraccional (p≤0.05) de 0 a 40 h de fermentación y Vmax (382.10 mL g –1). El tratamiento con F fomentarius EUM1 y Ca(OH)2 mostró el mejor Vmax (311 .51 y 281.20 mL g –1) en comparación con P. sapidus y Ca(OH)2 (217.75 y 264.75 mL g –1). Además, P. sapidus aumentó la formación de biomasa microbiana (p≤0.01) y F fomentarius EUM1 la producción de acido acético 24 h (p≤0.01). Se concluye que el tratamiento con Ca(OH)2 mejoró las características fermentativas de la paja y el tratamiento con hongos influyó en la formación de masa microbiana. Y no existió sinergismo en el tratamiento combinado.
Palabras clave: Fomes fomentarius EUM1, Pleurotus sapidus, digestibilidad, paja de sorgo.
Abstract
Sorghum straw, an abundant agricultural by–product in Mexico, used as food for ruminants, has low digestibility, which is why several methods are used to increase its quality. Therefore, the aim of this study was to evaluate the in vitro fermentative characteristics of solid culture of sorghum straw treated or untreated calcium with hyroxide Ca(OH)2 and fermented for 20 d with the Pleurotus sapidus and Fomes fomentarius EUM1 fungi. The in vitro gas production technique was used, and Vmax was measured, along with S, L, dissapearance of dry matter, VFA and NH3–N. The experimental design was a randomized complete block design and means were compared using contrasts. The treatment with Ca(OH)2 showed the best production of fractional gas (p≤0.05) from 0 to 40 h of fermentation and Vmax (382.10 mL g –1). The treatment with F. fomentarius EUM1 and Ca(OH)2 showed the best Vmax (311.51 and 281.20 mL g –1) in comparison with P. sapidus and Ca(OH)2 (217.75 and 264.75 mL g –1). Likewise, P. sapidus increased the formation of microbial biomass (p≤0.01) and F. fomentarius EUM1 increased the production of acetic acid 24 h (p ≤0.01). The conclusion was that the treatment with Ca(OH)2 imptoved fermentative characteristics of the straw, and the threatment with fungi influenced the formation of microbial mass. Also, there was no synergism in the combined treatment.
Key words: Fomes fomentarius EUM1, Pleurotus sapidus, digestibility, sorghum straw.
INTRODUCCIÓN
La producción anual de grano de sorgo (Sorghum vulgare) en México fue 5 972 628 t (SIAP, 2008), que generaron 10 351 868 t de paja usadas parcialmente en dietas para rumiantes. Esta paja tiene un alto contenido de FDN y baja digestibilidad (Álvarez y Combellas, 2005), por lo cual se usan tratamientos físicos, químicos y biológicos para mejorar su digestibilidad. En algunos tratamientos biológicos se usa el cultivo sólido con hongos de la pudrición blanca como Pleurotus sp. y Fomes sp., que producen celulasas, xilanasas y lacasas (Márquez et al., 2007). Además se ha usado el Ca (OH) como tratamiento químico (Gandi et al., 1997).
La técnica de producción de gas in vitro permite determinar la modificación en la paja por los tratamientos químicos y biológicos, así como los efectos de compuestos secundarios en la actividad microbiana ruminal, describir la cinética de fermentación, analizar efectos asociativos de diversos alimentos, examinar el efecto de aditivos en la fermentación ruminal e identificar la composición de gases de la fermentación (Getachew et al., 2005; Posada y Noguera, 2005). Aiple et al. (1996) indican que el método de producción de gas fue mejor para predecir la energía neta en ingredientes alimenticios. Pero las respuestas son variables al usar pajas tratadas con hongos de la pudrición blanca (Karma y Zadrazil, 1986) o enzimas fibrolíticas exógenas (Tricarico y Dawson, 2005) en estudios de fermentación in vitro. Lo anterior se atribuye a la especificidad enzimática por el sustrato, contenido de humedad en el alimento y la especie de hongo usada para producirlas (Karunananda et al., 1995). El objetivo del presente estudio fue evaluar la fermentación y desaparición de la materia seca mediante la técnica de producción de gas in vitro, de la paja de sorgo tratada con Ca(OH)2, al 0.7 % por 24 h y combinado con el cultivo sólido con Fomes fomentarius EUM1 o Pleurotus sapidus.
MATERIALES Y MÉTOD0S
Tratamiento de la paja de sorgo
La paja de sorgo se cortó en partículas de 2 a 5 cm, una parte (50 g) se remojó con agua destilada y otra (50 g) con una solución alcalina de Ca(OH) al 0.7 % (p/v), para alcanzar una humedad de 80 % a las 24 h. Después se esterilizaron a 121 °C, 15 PSI por 20 min y se enfriaron. Cinco porciones de 10 g cada una se inocularon con P. sapidus y otras cinco con F. fomentarius EUM1, colocando en cada porción cinco cuadros de 1 cm2 de placa de agar paja de sorgo colonizada en 7 d por los hongos. Las porciones inoculadas con P. sapidus se mantuvieron en una estufa de cultivo a 28 °C y las de F. fomentarius EUM1 a 35 °C, por 20 d. La proporción final de Ca(OH)2 en la paja fue de 5 g por cada 100 g MS de paja.
Tratamientos de la producción de gas in vitro
Se usaron tratamientos húmedos y secos. Los tratamientos húmedos fueron paja sin y con Ca(OH)2 tratada con P. sapidus (PL y PLc), o con F. fomentarius EUM1, sin y con Ca(OH)2 (TR y TRc). Los tratamientos testigos fueron paja de sorgo humedecida con agua (D0) o con la solución de Ca(OH) (D0c) preparados 24 h antes de iniciar la prueba de desaparición in vitro de la MS (DIVMS). Los tratamientos secos fueron paja tratada con P. sapidus (PLs), paja tratada con F. fomentarius EUM1 (TRs) y paja sin tratar (PS), los cuales se secaron y molieron antes de la prueba in vitro. Se realizaron cinco repeticiones por tratamiento.
Fermentación y desaparición in vitro de la materia seca
Se usó la técnica de producción de gas (Theodorou et al., 1994) para evaluar la fermentación. Las muestras de paja de sorgo se redujeron a partículas de 1 mm a I cm y se colocaron en frascos de vidrio ámbar con capacidad de 125 mL: 2.5 g para los húmedos y 0.5 g para los secos; se agregó 90 mL de líquido ruminal estandarizado con un flujo continuo de CO2 y se cerraron herméticamente. Se incluyeron tres frascos como blancos, que sólo contenían inoculo ruminal. Los frascos se colocaron en un baño maría a 39 °C y se midió la presión de gas a 0, 1, 2, 3, 5, 7, 9, 12, 15, 18, 24, 30, 36, 42, 48, 60, 72, 96 h de incubación, mediante un manómetro manual (escala de 0 a 1 kg cm–2). Las lecturas de presión (kg cm–2) se transformaron a volumen de gas con la ecuación de regresión lineal V=(P+0.0l45) (0.018)–1 (Orskov y Me Donald, 1979). Los datos de volumen de gas y tiempo de incubación se usaron para obtener el volumen fraccional (Vf). Las variables de la cinética de producción de gas: volumen máximo de gas producido (Vmax), fase de retardo (L) y tasa de producción de gas (S), se obtuvieron mediante un modelo logístico (Pitt et al., 1999). El líquido ruminal se obtuvo de dos vacas Holstein alimentadas con alfalfa y concentrado (70:30). El líquido ruminal se filtró con gasas y se mezcló con una solución mineral reducida en proporción de 1:9 v/v. La solución mineral reducida provee minerales y nutrientes al medio acuoso in vitro para el proceso fermentativo y contenía por L de solución: 4 g Ca2CO3; 0.45 g K2HPO4; 0.45 g KH2 PO4; 0.45g (NH4)2SO4; 0.90 g NaCl; 0.18 g MgSO4; 0.07 g CaCl2; 50 mL de agua destilada; 2 mL NaOH (1N); 0.5 g Na2S04; 0.5 g L–cisteina; una gota de rezarsurina. La incubación fue en baño maría a 39 °C con flujo continuo de CO2. Al final de la incubación se filtró el contenido de los frascos con papel filtro N 541 (Ø poro 10 μm) y se secaron a 60 °C por 24 h; las muestras se pesaron para calcular la MS residual y calcular la DIVMS. En la MS residual se determinó FDN residual (FDNr).
Determinación de ácidos grasos volátiles (AGV) y nitrógeno amoniacal (N–NH3)
Para determinar AGV se tomaron muestras (2 mL) del contenido líquido de los frascos de la prueba de desaparición de la MS de dos repeticiones por tratamiento, a las 12 y 24 h, se mezclaron con ácido metafosfórico (25 % p/v) en una relación 4:1, y se refrigeraron (4 °C). Estas muestras se centrifugaron 20 min a 11 000 rpm, y del sobrenadante de cada muestra se tomó 1 μL y se inyectó en un cromatógrafo de gases (Perkin Elmer, modelo Clarus 500) con columna capilar (Elite PFAP) (Erwin et al,. 1961). Se usó H como gas acarreador a un flujo de 5.5 mL min–1, la temperatura de inyector y detector fue 250 °C, y la del horno 80 °C durante 1 min con incrementos de 20 °C min–1 hasta alcanzar 140 °C, con un tiempo por lectura de 8 min (Kung y Hession, 1995). Para determinar la concentración de N–NH3 se tomaron 20 μLdel mismo sobrenadante y se vertieron en tubos de 10 mL, adicionando 1 mL de fenol (10 %) y 1 mL de hipoclorito de sodio (5 %), se incubaron en baño maría a 38 °C por 30 min. Después en cada tubo se agregó 5 mL de agua destilada. La absorbancia se leyó con un espectrofotómetro (VARIAN, modelo CARY I–E) a 630 nm.
Determinación de energía metabolizable (EM), digestibilidad de la materia orgánica (DMO) y masa microbiana (MM)
Dado que la producción de gas es proporcional a la MS degradada se usó la producción neta de gas a las 24 h de incubación del sustrato a partir de la obtenida por 0.5 g (Menke et al., 1979). Para cada tratamiento y repetición se calculó la EM (EM k y kg–1), DMO (%) y MM (mg g–1) usando los modelos propuestos por Menke y Steingas (1998).
Diseño experimental y análisis de los datos
Se analizó el perfil de producción de gas para evaluar las fracciones de degradación (FI rápida fermentación, FII fermentación intermedia y FIII fermentación tardía) en función de los picos de mayor producción de gas. El diseño experimental fue bloques al azar generalizados (el bloque fue la repetición del experimento en el tiempo). Los valores de volumen fraccional (Vf) para cada pico (FI, FII y FIII) se analizaron con la prueba de comparación de medias de Tukey (p≤0.05) (Steel y Torrie, 1986). Las variables Vmax, L, S, DIVMS, AGV, FDNr, proporción molar de acético, de propiónico y de butírico, EM, DMO y MM, se analizaron con el procedimiento MIXED (SAS, 1999) y la comparación de medias se realizó por contrastes ortogonales (p≤0.01; Cuadro 1) (Steel y Torrie, 1986).
RESULTAD0S Y DISCUSIÓN
La producción de gas resulta de la fermentación de los carbohidratos solubles y estructurales del sustrato, mientras que la fermentación de proteína y lípidos es escasa (Getachew et al., 1998). El perfil del Vf de gas (Figuras 1, 2 y 3) mostró que los tratamientos D0 y D0c producen más gas entre 60 y 80 h de fermentación que PS (Figura 1), pero PS produce más gas de 0 a 25 h de incubación y a las 40 h comienza a disminuir, en comparación con PL, PLc, PLs (Figura 2). Este efecto es poco notorio en TR, TRc y TRs (Figura 3) y en el último tratamiento el secado redujo la producción de gas in vitro (Figura 3).
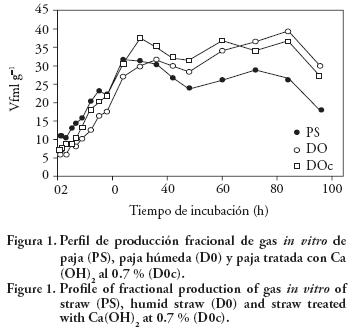


En el Cuadro 2 se presentan los valores medios de la producción de gas (FI, FII y FIII). El FI se presentó entre 5 y 12 h de incubación, FII de 24 a 39 h y FIII de 74 a 84 h. PS produjo más gas (p≤0.05) en FI (23.123 mL g–1) que D0 (13.630) y D0c(9–911); D0c generó más gas (p≤0.05) en FII (37. 433 mL g–1) y FIII (37.425 mL g–1) que PS. Presumiblemente, el tratamiento alcalino causó cambios estructurales en las fases I y II de Vf. Tarkow y Feist (1969) señalan que el tratamiento con álcalis hidroliza la celulosa provocando la pérdida parcial de su fracción cristalina, transformándola en celulosa amorfa, más vulnerable al ataque enzimático y la saponifica mediante la formación de esteres entre ácidos urónidos y hemicelulosa. Además, la acción de los álcalis modifica algunos de los componentes fibrosos de la paja (Chen et al., 2007). El D0 sólo superó la producción de gas a PS en FIII. Así también el tratamiento con P. sapidus (PL, PLc, PLs) disminuyó (p≤0.05) la producción de gas en las fracciones FI, FII y FIII, con respecto a PS (Cuadro 2). Para P. sapidus, la mezcla de tratamientos (PLc) favoreció (p≤0.05) la producción de gas en FII y FIII (11.317 y 23.257 mL g–1) comparado con PL (9.788 y 18.019 mL g–1). El tratamiento con F. fomentarius EUM1 (TR, TRc, TRs) disminuyó (p≤0.05) la producción de gas sólo en FI, con respecto a PS, excepto en TRs que se secó y molió antes de fermentarla in vitro. El tratamiento con hongos o cultivo sólido, redujo la producción del Vf en FI y modificó la fase II (32.496 TR), lo cual muestra el cambio estructural provocado por los hongos. Los hongos de la pudrición blanca como P. sapidus y F. fomentairus EUM1 consumen nutrientes de la paja durante su crecimiento y producen otros metabolitos, como enzimas, durante su desarrollo. Así, Meneses et al. (2009) señalan que la máxima actividad enzimática de xilanasas y celulasas de P. sapidus y F. fomentarius EUM1 en paja de sorgo ocurre antes de la máxima producción de lacasas entre los días 9 y 15. Los tratamientos TR y TRc mostraron mejor actividad de: xilanasas, 79.47±8.69 y 68.95±0.07 U g–1MS; de celulasas, 15.24±0.99 y 12.01 ±0.07 U g–1MS; y lacasas, 2.45 ±00 y 10.66±0.21 U g–1MS. Las celulasas y xilanasas actúan sinérgicamente para hidrolizar mejor las paredes celulares (Bhat y Ha–zlewood, 2001); además, los hongos de la pudrición blanca usan carbohidratos solubles antes de degradar lignina (Krause et al. 2003). Contradictoriamente, para preparaciones enzimáticas (actividad xilanasas y celulasas) de Trichoderma viridae, T. longibrachiatum y Aspergillus niger en heno de pasto, los tratamientos con enzimas estimulan las fases iniciales de degradación del sustrato, pero estos efectos se reducen a medida que aumenta el tiempo de fermentación (Giraldo et al., 2007; Nserko et al., 1999).

En el Cuadro 3 se presentan los valores para Vmax, L, S, DIVMS y FDNr. Para Vmax hubo efecto (p ≤0.01) en Cl, C3, C4, C5, C6 y C7, pero no (p>0.01) para C2 y C8. El tratamiento biológico (Cl) produjo 93 mL g –1 menos de Vmax en comparación al tratamiento alcalino (D0 y D0c). Además los tratamientos TR y TRc muestran mayor Vmax en comparación con los tratamientos con PL y PLc (C6). La variable Vmax se relaciona con la fermentación potencial de un alimento y con la cantidad, disponibilidad y composición química del sustrato. La fase Lag o fase de retardo es el tiempo antes de que los microorganismos inicien la degradación de los componentes del sustrato. Al respecto, Vmax, S y L fueron mayores cuando la paja fue tratada con Ca(OH)2. Las variables de fermentación fueron menores en la paja tratada con P. sapidus y la tratada con F. fomentarius EUM1 y Ca(OH)2.
La producción de gas mejora al incubar forrajes tratados con enzimas exógenas (Colombatto et al., 2003; Carro et al., 2005) y es directamente proporcional a la tasa de degradación del sustrato (France et al., 2000). En el presente estudio la producción de gas se redujo presumiblemente por el consumo de nutrientes por los hongos y debido a que la adición de nuevos metabolitos fúngicos, como proteína enzimática, no fue importante. La velocidad con la cual los microorganismos del rumen fermentan los componentes del alimento o tasa de producción de gas (S), mostró un efecto (p ≤0.01) en C2, C4, C5, C6. El C5 hace suponer que el tratamiento biológico (PLs y TRs) disminuye S y al comparar el tipo de hongo, F. fomentarius EUM1 fermentó más rápidamente (0.02 h –1; p ≤0.01) la paja que P. sapidus (C2 y C6). Además el proceso de secado de la paja antes de la producción de gas in vitro disminuyó S (0.01 h –1) en comparación con los tratamientos húmedos (C4) donde hubo mayor producción (p ≤0.01). En la fase de retardo (L) el tratamiento de la paja con P. sapidus mostró un menor tiempo de retardo de la producción de gas in vitro, en contraste al tratamiento con F. fomentarius EUM1 (C2 y C6). El secado de la paja (PLs y TRs) antes de la producción de gas in vitro redujo el tiempo de retardo (C4). En la DIVMS, contrariamente a Vmax, el tratamiento de la paja con P. sapidus mejoró la digestibilidad en comparación al tratamiento con F. fomentarius EUM1 (C2 y C6). Además, el tratamiento biológico (PLs, PL, TR y TRs) disminuyó la digestibilidad de la paja de sorgo (C3, C5 y C7).
El tratamiento con hongo disminuyó la DIVMS (Cuadro 3), lo cual se atribuye al consumo de nutrientes durante el tiempo de crecimiento del hongo sobre la paja de sorgo. Sin embargo, Peláez et al. (2008) indican que el tratamiento con hongos mejora la DIVMS in vitro; además, Agosin et al. (1985) señalan un aumento de 30 % en la DIVMS de paja de trigo tratada con Dichomitus squalens y Cyathus stercoreus. Pero según Eun y Beauchemin (2007), muchos productos enzimáticos disminuyen la eficiencia de fermentación, así como la materia orgánica degradada por mL de gas producido en 18 h de incubación, y la degradación es proporcional a la cantidad de endoglucanasas usada.
Los AGV totales (Cuadro 4) variaron de 12 a 23 mmol dL –1; el ácido acético varió de 69 a71 mmol dL–1, el ácido propiónico de 19 a 21 mmol dL–1, y el ácido butírico de 8 a 11 mmol dL –1. Las concentraciones de acido acético, propiónico y butírico a 12 h de incubación no se reportan en este documento ya que los contrastes no mostraron diferencias (p>0.01), por lo cual el análisis se orientó a los datos de 24 h. Hubo efecto de bloque y tratamiento (p ≤0.01) en los AGV totales, acético, propiónico y butírico a las 24 h de fermentación. La concentración de AGV totales disminuyó (p ≤0.01) por el tratamiento fúngico de la paja (Cl, C5), pero aumentó (p ≤0.01) debido al tratamiento con Ca(OH)2 (C8). La proporción molar de ácido acético y propiónico fue ligeramente mayor (p ≤0.01) cuando la paja se secó y molió antes de realizar la prueba de fermentación (C4), y fue menor (p ≤0.01) cuando la paja se trató con Ca(OH)2(C8). Este ultimo contraste también fue significativo para ácido butírico. La concentración de N–NH3 (Cuadro 4) entre 12 y 24 h fue similar (15 a 20 mmol dL–1) entre tratamientos (p≥0.01).
La EM y DMO calculadas (Cuadro 5) fueron menores (p ≤0.01) en la paja tratada con P. sapidus y F. fomentarius EUM1, en comparación con los tratamientos húmedos D0 y D0c o PS (C1, C3, C5). La biomasa microbiana (MM) y adherencia (Cuadro 5) fueron mayores cuando la paja fue tratada con P. sapidus y F. fomentarius EUM1, con o sin Ca(OH)2, (C1, C3, C5). Cuando se comparó PL vs TR(C6), PL incrementó (p≤0.01) la MM y la adherencia según los cálculos con los modelos matemáticos de Menke y Steingas (1998). Cuando P. sapidus crece sobre la paja se forman o liberan sustancias nutritivas que pueden actuar como promotores del crecimiento microbiano. Según Martin y Nisbet (1992), los productos de la fermentación con Saccharomyces cerevisiae y Aspergyllus oryzae contienen metabolitos o productos de la fermentación que estimulan el crecimiento de microorganismo ruminales. Varias enzimas fibrolíticas exógenas mejoran algunos componentes de forrajes para rumiantes, con diversos mecanismos de acción: unas aumentan el ataque microbiano y otras mejoran la colonización de la pared vegetal (Newbold, 1997). Sin embargo, algunos efectos no pueden ser equiparables al cultivo sólido ya que éste contiene complejos enzimáticos lignocelulósicos y otros metabolitos derivados del crecimiento de los hongos.
En este estudio no se encontró efecto de secado (C4), el cual puede estar confundido con el efecto de tamaño de partícula. Las muestras en fresco pueden producir menores volúmenes de gas que las secas (Lowman et al., 2002), debido a que el secado modifica los alimentos facilitando el ataque microbiano y la fermentación, lo cual aumenta la producción de gas. Según Rymer et al. (2005), cuando se hidratan muestras antes de la fermentación, aumenta el volumen de gas producido y mejora el inicio de la segunda fase de producción de gas. Además, el hecho de que el humedecimiento de la paja haya reducido Vmax y S, puede deberse a que el tamaño de partícula fue menor en el sustrato seco y mayor en el húmedo. Wimer et al. (1990) mencionan que el tamaño de partícula es un factor importante en la degradación ruminal y ataque de enzimático pues las bacterias ruminales tienen mayor acceso a la superficie de las paredes vegetales, para su subsecuente degradación.
CONCLUSIONES
El tratamiento alcalino mejoró las variables fermentativas. Pero el tratamiento de la paja con Pleurotus sapidus promovió la formación de biomasa microbiana y la producción de AGV totales y ácido propiónico a las 24 h. Aunque el tratamiento fúngico redujo las variables de la producción de gas in vitro, el aumento significativo en la formación de masa microbiana es importante por su contribución al aporte de proteína y la transformación de nutrientes. Pero el sinergismo entre tratamiento alcalino y hongos no mostró resultados significativos en las variables fermentativas.
LITERATURA CITADA
Agosin, E., B. Monties, and E. Odier. 1985. Structural changes in wheat straw components during decay by lignin–degra–ding white–rot fungi in relation to improvement of digestibility for rumiants. J. Sci. Food. Agrie. 36: 925–935. [ Links ]
Aiple, K. P., H. Steingass, and W. Drochner. 1996. Prediction of net energy content of raw materials and compound feeds for rumiants by different laboratory methods. Arch. Anim. Nutr. 23:1508–1513. [ Links ]
Álvarez, R., and J. Combellas. 2005 Evaluation of poultry litter on sorghum straw intake and dry matter disappearance using dry cows. Rev. Bras. Zootec. 34(2): 584–588. [ Links ]
Bhat, M. K., and G. P. Hazlewood. 2001. Enzymology and other characteristics of cellulases andxylanases. In: Bedford, M. R., and G. G. Partridge, (eds). Enzymes in Farm Animal Nutrition. CABI Publishing, Wallingford, Oxon, UK. pp: 11–60. [ Links ]
Carro, M. D., M. J. Ranilla, and M. L. Tejido. 2005. Using an in vitro gas production technique to examine feed additives: effects of correcting values for different blanks. Anim. Feed Sci. Technol. 123–124: 173–184. [ Links ]
Colombatto, D., D. P. Morgavi, A.F. Furtado, and KA. Beau–chemin. 2003. Screening of exogenous enzymes for rumiant diet: relationship between biochemical characteristics and in vitro ruminal degradation.}. Anim. Sci. 81: 2628–2638. [ Links ]
Chen, X. L., J. K. Wang, Y. M. Wu, and J. X. Liu. 2007. Effects of chemical treatments of rice straw on rumen fermentation characteristics. Anim Feed Sci. Technol. 141 (1): 1–14. [ Links ]
Eun, J. S., and K. A. Beauchemin. 2007. Assesment of the efficacy of varying experimental exogenous fibrolytic enzymes using in vitro fermentation characteristics. Anim Feed Sci. Technol. 132: 298–315. [ Links ]
Erwin, E. S., G. T. Marco, and E. M. Emery, 1961. Volatile fatty acid analysis of blood and rumen fluid by gas chromatogra–phy. J. Dairy Sci. 44: 1768–1771. [ Links ]
France, J., J. Dijkstra, M. S. Dhanoa, S. Lopez, and A. Bannink: 2000. Estimating the extent of degradation of ruminant feeds from a description of their gas production profiles observed in vitro: Derivation of models and other mathematical considerations. Br J. Nutr. 83: 143–150. [ Links ]
Gandi, J., M. T. Holtzapple, A. Ferrer, F. M. Byers, N. D. Turner, M. Nagwani, and S. Chang. 1997. Lime treatment of agricultural residues to improve rumen digestibility. Anim. Feed Sci. Technol. 68: 195–211. [ Links ]
Getachew, G., M. Bliimmel, H. P. S. Makkar, and K. Becker. 1998. In vitro gas measuring techniques for assessment of nutritional quality of feeds: A review. Anim. Feed Sci. Technol. 72: 261–281. [ Links ]
Getachew, G., E. J. De Peters, P. H. Robinson, and J. G. Fadel. 2005. Use of an in vitro rumen gas production techinique to evaluate microbial fermentation of ruminat feeds and its impact on fermentation products. Anim. Feed Sci. Technol. 123–124: 547–559. [ Links ]
Giraldo, L. A., M. L. Tejido, M. J. Ranilla, and M. D. Carro. 2007. Effects of exogenous fibrolytic enzymes on in vitro ruminal fermentation of substrates with different forage: concentrate ratios. Anim. Feed Sci. Technol. 16 (2): 25–30. [ Links ]
Karma, D. N., and F. Zadrazil. 1986. Influence of gaseous phase, light and substrate pretreatment on fruit body formation, lignin degradation and in vitro digestibility of wheat straw fermented with Pleurotus sp. Agrie. Wastes 18: 1–17. [ Links ]
Karunananda, K., G. A. Varga, D. E. Akin, L. L. Rigsby, and D. J. Royse. 1995. Botanical fractions of rice straw colonized by white–rot fungi: changes in the chemical composition and structure. Anim. Feed Sci. Technol. 55: 179–199. [ Links ]
Krause, D. O., S. E. Denman, R. Mackie, M. Morrison, A.L. Rae, G.T Attwood, and C.S. McSweeney. 2003. Opportunities to improve fiber degradation in the rumen: microbiology, ecology, and genomics. FEMS Microbiol. Rev. 797: 1–31. [ Links ]
Kung, L. Jr., and A. O. Hession. 1995. Preventing in vitro lactate accumulation in ruminal fermentation by inoculating with Megasphaera ekdenii. J. Anim. Sci. 73: 250–256. [ Links ]
Lowman, R. S., M. K. Theodorou, and D. Cuddeford. 2002. The effect of sample processing on gas production profiles obtained using the pressure transducer technique. Anim. Feed Sci. Technol. 97: 221–237. [ Links ]
Márquez–Araque, A. T., G. D. Mendoza Martínez, S. S. Gonzalez Muñoz, S. E. Búntinx Dios, y O. Loera Corral. 2007. Actividad fibrolítica de enzimas producidas por Trametes sp. EUM1, Pleurotus ostreatus IE8 y Aspergillus niger AD96.4 en fermentación sólida. Interciencia 32 (11):780–785. [ Links ]
Martin, S. A., and D. J. Nisbet. 1992. Effect of direct fed microbials on rumen microbial fermentation. J. Dairy Sci. 75: 1736–1744. [ Links ]
Meneses, M., M. Villegas, S. González, L. Miranda, y O. Loera. 2009. Estudio de la composición nutrimental de paja de sorgo tratada con Trametes sp. EUM1 y Pleurotus sapidus. In: Memorias del XII Congreso Nacional de Biotecnología y Bioingeniería. Guerrero, México. CD. [ Links ]
Menke, K. H., L., Raab, A., Salewski, H., Steingass, D. Fritz, and W Schneider 1979. The estimation of the digestibility and metabolizable energy content of ruminant feedstuffs from the gas production when they are incubated with rumen liquor in vitro. J. Agrie. Sci. (Camb.) 92: 217–222. [ Links ]
Menke K. H., and H. Steingass. 1998. Estimation of the energetic feed value from chemical analysis and in vitro gas production using rumen fluid. Anim. Res. Develop. 28: 7–55. [ Links ]
Newbold, C.J., 1997. Proposed mechanisms of enzymes as modifiers of ruminal fermentation. In: Staple, C.R. (ed). Proc. 8th Annual Florida Ruminant Nutrition Symp, USA. pp: 146–159. [ Links ]
Nsereko, V.L., L.M. Rode, K.A. Beauchemin, T.A. McCallister. D.P. Morgavi, A. Furtado, Y. Wang, A.D. Iwaasa, and W.Z., Yang. 1999. Effect of feeding a fungal enzyme preparation from Trichoderma longibrachiatum on the ruminal microbial population of dairy cows. IX Int. Symp. Rumen Physiol. Pretory. South Africa, pp: 17–22 p. [ Links ]
Ørskov, E.R., and L.M. McDonald. 1979. The estimation of protein degradability in the rumen from incubation measurement weighted according to rate of passage. J. Agrie. Sci. (Cambridge) 92: 499–503. [ Links ]
Peláez, A. A., M. Meneses, R.L. Miranda, R.M. Megias, G.R Barcena, y O. Loera. 2008. Ventajas de la fermentación sólida con Pleurotus sapidus en ensilajes de caña de azúcar. Arch. Zootec. 57(217): 25–33. [ Links ]
Pitt, R. E., T. L. Cross, A. N. Pell, P. Shofield, and P. H. Doane. 1999. Use of in vitro gas production models in ruminal kinetics. Math. Biosci. 159: 145–163. [ Links ]
Posada S. L., y R. R. Noguera. 2005. Técnica in vitro de producción de gases: Una herramienta para la evaluación de alimentos para rumiantes. Liv. Res. Rural Development 17:36. http://www.cipav.org.co/lrrd/lrrd17/4/posa17036.htm. (Consulta: febrero 2009). [ Links ]
Rymer, C, J. A. Huntington, B. A. Williams, and D. I. Givens. 2005. In vitro cumulative gas production techniques: History, methodological considerations and challenges. Anim. Feed Sci. Technol. 123– 24: 9–30. [ Links ]
SAS, 1999. SAS/STAT User's Guide, Version 8. Statistical Analysis System Institute Inc., Cary, NC, USA. [ Links ]
SIAP, 2008 http://www.siap.sagarpa.mx/ar_compec_avan.html (consulta: noviembre 2008). [ Links ]
Steel, G. R., y J. H. Torrie. 1986. Bioestadística: Principios y Procedimientos. 2da edición. Ed. McGraw–Hill. México, D.F. pp: 167–171. [ Links ]
Tarkow, H., and W. C. Feist. 1969. A mechanism for improving the digestibility of lignocellulosic materials with dilute alkali and liquid ammonia. Amer. Chem. Soc. Adv. Chem. Ser. (95): 197–218. [ Links ]
Theodorou, M. K., B. A. Williams, M. S. Dhanoa, A. B., McA llan, and J. France. 1994. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds. Anim. Feed Sci. Technol. 48: 185–197. [ Links ]
Tricarico, J. M., and K. A. Dawson. 2005. Influence of supplemental endoglucanase or xilanase on volatile fatty acid production from rumiant feed by ruminal in vitro cultures. Archiv. Anim. Nutri. 59 (5): 325–34. [ Links ]
Wimer, P. J., López– Guisa, and A. D. French. 1990. Effect of cellulose fine structure on kinetics of its digestion mixed microorganism in vitro. Appl. Environ. Microbiol. 56(26): 1–275. [ Links ]














