Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.7 Texcoco oct./nov. 2010
Fitociencia
Contenido de pigmentos, otros compuestos y capacidad antioxidante en 12 cultivares de tuna (Opuntia spp.) de México
Pigments content, other compounds and antioxidant capacity in 12 cactus pear cultivars (Opuntia spp.) from Mexico
Inés Figueroa–Cares1*, María T. Martínez–Damián2, Enrique Rodríguez–Pérez2, María T. Colinas–León2, Salvador Valle–Guadarrama3, Sweetia Ramírez–Ramírez2, Clemente Gallegos–Vázquez4
1 Departamento de Producción Vegetal, Facultad de Agronomía, Universidad de Concepción. Avenida Vicente Méndez 595. Chillan, Chile. *Autor responsable: (ifigueroa@udec.cl).
2 Departamento de Fitotecnia. Fitotecnia, Universidad Autónoma Chapingo. 56230. km 38.5 Carretera México–Texcoco. Chapingo, Estado de México.
3 Departamento de Ingeniería Agroindustrial. Universidad Autónoma Chapingo. 56230. km 38.5 Carretera México–Texcoco. Chapingo, Estado de México.
4 Centro Regional Universitario Centro Norte. Universidad Autónoma Chapingo. 98060. km 5.5 Carretera Zacatecas–Guadalajara. El Orito, Zacatecas.
Recibido: Enero, 2010.
Aprobado: Octubre, 2010.
Resumen
La tuna (Opuntia spp.) es un recurso fitogenético de México de alto valor nutritivo cuyos cultivares nativos no habían sido caracterizados. El objetivo de este trabajo fue estudiar el contenido de algunos compuestos químicos y el potencial antioxidante en 12 cultivares de tuna: Cristalina, Mansa y Vaquera (O. albicarpa), Amarilla Diamante (O. ficus–indica) y Mango (O. albicarpa), Amarilla Montesa y Pico Chulo (O. megacantha), Pabellón (O. ficus–indica), Rosa de Castilla y Torreoja (O. megacantha) y Cacalote (O. cochinera) y Tapón Aguanoso (O. robusta var Robusta). El estudio se realizó en el Departamento de Fitotecnia de la Universidad Autónoma Chapingo. El diseño experimental fue completamente al azar, se realizó un análisis de varianza y una prueba de comparación de medias de Tukey. El contenido de ácido ascórbico fue superior en Cacalote con 25 mg 100 g–1. Los cultivares de tuna blanca y amarilla presentaron más (p≤0.05) clorofila y la tuna blanca tuvo menos caroteno. El mayor contenido (p≤0.05) de betacianina y betaxantina se encontró en Tapón Aguanoso y Cacalote con 681.94 y 428.96 mg L–1 de betanina, y 276.10 y 249.55 mg L–1de indicaxantina. La mayor concentración de fenoles se presentó en Tapón Aguanoso (420.66 mg L–1), con fruto púrpura, y Amarilla Diamante (348.16 mg L–1) y Mango (328.74 mg L–1), con fruto amarillo. La capacidad antioxidante fue similar en todos los cultivares, con concentraciones entre 6.12 y 9.58 μmol eq TROLOX g–1. Los frutos evaluados, debido a la presencia de betalaínas, podrían utilizarse para extraer pigmentos y usarse en la industria como fuente de pigmentos naturales, o fuente natural de antioxidantes.
Palabras clave: ácido ascórbico, clorofila, carotenos, betalaínas, fenoles, frutos.
Abstract
The cactus pear (Opuntia spp.) is a phytogenetic resource of Mexico of high nutritious value whose native cultivars had not been previously characterized. The aim of this work was to study the content of some chemical compounds and the antioxidant potential in 12 pear cultivars, namely, Cristalina, Mansa and Vaquera (O. albicarpa), Amarilla Diamante (O. ficus–indica) and Mango (O. Albicarpa), Amarilla Montesa and Pico Chulo (O. megacantha), Pabellón (O. ficus–indica), Rosa de Castilla and Torreoja (O. megacantha), Cacalote (O. cochinera) and Tapón Aguanoso (O. robusta var Robusta).The work was conducted in the Departmento de Fitotecnia of the Universidad Autónoma Chapingo. The experimental design was completely randomized, and an analysis of variance and the Tukey mean comparison test were carried out. The ascorbic acid content was higher in Cacalote with 25 mg 100 g –1. The cultivars with white and yellow tuna showed more (p≤0.05) chlorophyll, while white tuna had less carotene. The higher contents (p≤0.05) of betacyanin andbetaxanthin were found in Tapón Aguanoso and Cacalote with 681.94 and 428.96 mg L–1 of betanin and 276.10 and 249.55 mg L–1of indicaxanthin.The highest concentration of phenols was present in Tapón Aguanoso (420.66 mg L–1), with purple fruit, and Amarilla Diamante (348.16 mg L–1) and Mango (328.74 mg L–1), with yellow fruit. The antioxidant capacity was similar in all cultivars, with concentrations between 6.12 and 9.58, μmol eq TROLOX g1. The fruits tested, due to the presence of betalains, could be used to extract pigments and be utilized in industry as a source of natural pigments or natural source of antioxidants.
Key words: ascorbic acid, chlorophyll, carotenes, betalains, phenols, fruits.
INTRODUCCIÓN
México es uno de los centros de origen y dispersión del género Opuntia que por su gran diversidad de especies y cultivares es uno de los recurso vegetales más importantes para los habitantes de las zonas áridas y semiáridas. El color de su fruta (tuna), debido a la presencia de pigmentos carotenoides y betalaínas varía desde rojo–púrpura hasta amarillo pálido, la hace atractiva para consumir fresca y para elaborar diversos productos (Gurrieri et al, 2000; Sáenz, 2006). Los consumidores dan especial atención al valor nutricional de los productos hortícolas, lo cual ha generado la tendencia de producir alimentos de alta calidad nutritiva y funcional, como la tuna (Cevallos–Casals y Cisneros–Zeballos, 2004) que contiene antioxidantes como polifenoles, ácido ascórbico y pigmentos (carotenoides y betalaínas).
La evidencia (Urquiaga et al., 1999) epidemiológica sugiere que el consumo de frutas y verduras puede reducir el riesgo de cáncer y enfermedades cardiovasculares, lo cual se debería en parte a la presencia de compuestos antioxidantes. Por tanto, un aumento en la ingesta de estos antioxidantes dietarios puede proteger de enfermedades crónicas. Además, la industria de alimentos incorpora antioxidantes naturales de tejidos vegetales debido a las restricciones legales para usar colorantes sintéticos (Weller y Lasure, 1982). En las especies del género Opuntia, los pigmentos sólo se encuentran en los frutos y tanto las betalaínas como los carotenoides pueden estar en la piel y pulpa de las diversas variedades. Así, el objetivo de esta investigación fue evaluar el contenido de algunos compuestos químicos, como pigmentos, y la capacidad antioxidante de 12 cultivares de tuna (Opuntia spp.) de la región centro–norte de México.
MATERIALES Y MÉTODOS
Este experimento se realizó en el Departamento de Fitotecnia de la Universidad Autónoma Chapingo, México, con frutos de tuna de 12 cultivares, recolectados en el Centro Regional Universitario Centro Norte (CRUCEN–Zacatecas) de la misma universidad, con madurez comercial, cuando el color de la cascara era característico de cada cultivar. El diseño experimental fue completamente al azar, con 10 frutos por cultivar, y un fruto como unidad experimental. Los cultivares con fruto blanco fueron Cristalina, Mansa y Vaquera (O. albicarpd); con fruto amarillo, Amarilla Diamante (O. ficus–indica) y Mango (O. albicarpd); con fruto anaranjado, Amarilla Montesa y Pico Chulo (O. mega–canthd); con fruto rojo, Pabellón (O. ficus–indica), Rosa de Castilla y Torreoja (O. megacanthd); y con fruto púrpura, Cacalote (O. cochinera) y Tapón Aguanoso (O. robusta var Robusta).
Variables evaluadas
Ácido ascórbico por el método de Tillman (AOAC, 1980)
Se homogenizaron 5 mL de jugo con 50 mL de una solución de ácido oxálico (0.5 %), de la cual se tomó una alícuota de 5 mL y se tituló con solución de Tillman (0.01 %) hasta que una coloración rosa fue visible por 1 min. La cantidad de ácido ascórbico se expresó en mg 100 g–1.
Clorofila total y carotenos por el método de Lichtenthaler (1987)
Diez mL de acetona al 80 % se añadieron a 10 mL de jugo, la solución se filtró y se obtuvo la absorbancia a 663, 646 y 476 nm, con acetona como blanco. Las concentraciones se calcularon con las siguientes fórmulas:
Clorofila a (Ca) = 12.25 A663–2.79 A646
Clorofila b (Cb) = 21.50 A646–5.10A663
Clorofila total (Ca+b) = 7.15 A 663 + 18.71 A646
Carotenos = (1000 A470– 1.63 Ca–104.96 Cb)(221–1)
Betalaínas por el método de Stintzing et al. (2003)
El método se siguió con algunas modificaciones; a 1 mL de jugo de tuna se agregó el volumen necesario de amortiguador Mc Ilvaine (pH 6.5) para que cada muestra tuviera entre 0.8 y 1.0 de absorbancia a 480 nm (indicaxantina) y 538 nm (betanina). El contenido de betanina e indicaxantina se calculó con la fórmula:
BC(mgL–1) = (AxFDxPMx1000)(ε x l)–1
donde, BC = contenido de betanina/indicaxantina; A = absorbancia; FD = factor de dilución; PM = peso molecular (betanina/indicaxantina); s = coeficiente de extinción molar de betanina/indicaxantina; / = anchura de la cubeta del espectrofotómetro (1 cm).
Fenoles totales por el método descrito en Litwack (1967)
A 2 mL de jugo de tuna se adicionaron 0.4 mL de solución extractara compuesta por metanol, cloroformo y agua (2:1:1) y se centrifugaron 15 min a 190 g; al sobrenadante se adicionaron 10 mL de Na2CO3 (10 %), y se incubó 15 min a 38 °C; a 1 mL de esta solución se agregó 1 mL de reactivo Folin–Ciocalteu, se dejó reposar 15 min en oscuridad y se obtuvo la absorbancia a 660 nm. Los datos se expresaron en mg 100 g–1, tomando como referencia una curva estándar de fenol.
Capacidad antioxidante mediante el método dihidrocloruro de N,N–dimetil–p–fenil–N–diamina (DMPD) (Fogliano et al., 1999)
Un mL de una solución de DMPD (209 mg en 10 mL de agua destilada) se agregó a 100 mL de una solución amortiguadora de acetato 0.1 M (pH 5.25). A esta solución se agregaron 0.2 mL de cloruro férrico 0.05 M, con concentración final 0.1 mM. La absorbancia de esta solución se obtuvo a 505 nm, que correspondió a la señal no inhibida (A0). La curva estándar de antioxidante se obtuvo con diferentes concentraciones de TROLOX (1 mg mL –1 de metanol) en 2 mL de la solución DMPD oxidada (púrpura). La mezcla se agitó 10 min y se midió la absorbancia a 505 nm (Af). La absorbancia de cada muestra se expresó como porcentaje de la solución del catión radical no inhibido mediante la ecuación:
A505(%) = (l–Af/A0)*100
donde, A0 = absorbancia del catión radical no inhibido; Af = absorbancia medida 10 min después de haber agregado la solución estándar de TROLOX o la muestra del extracto de jugo.
Con los datos se realizó un análisis de varianza y las medias se compararon con la prueba de Tukey (p≤0.05), usando SAS (1998).
RESULTADOS Y DISCUSIÓN
Acido ascórbico
El contenido de vitamina C, expresado como ácido ascórbico, en ningún cultivar superó los 25–0 mg 100 g–1 (Cuadro 1), un valor menor a los señalados por Sáenz (2006) y Corral–Aguayo et al. (2008) quienes indican que la tuna presenta un nivel alto de ácido ascórbico, hasta 40 mg 100 g–1. Similarmente, Kuti (2004) reporta 45–8 mg 100 g–1 en frutos blancos de O. ficus–indica. Sin embargo, el contenido de ácido ascórbico fue sólo 15.1 ±0.08 mg 100 g–1 de pulpa en tunas de la especie O. elatior, y de 12.1 mg 100 g–1 en O. lindheimeri, de fruto color púrpura (Moreno–Álvarez et al., 2008). Al mismo tiempo, las concentraciones de ácido ascórbico encontradas en la presente investigación fueron similares a las reportadas para variedades comerciales de arándano (Vaccinium spp.) (9.6±0.8 mg 100 g–1), por Prior et al. (1998) y para pitaya (Stenocereus stellatus Riccobono) (12.6 mg 100 g–1) (Beltrán–Orozco et al., 2009), ambas especies consideradas importantes por su contenido de ácido ascórbico.
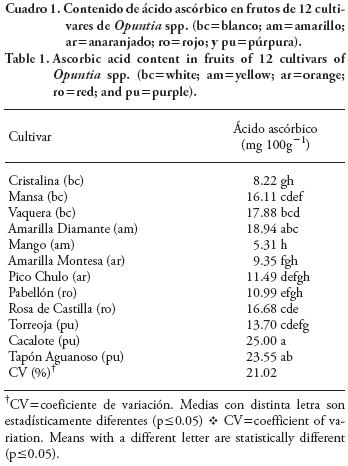
Estas diferencias entre especies y cultivares podrían deberse a las condiciones de cultivo, ya que el género Opuntia al crecer en condiciones limitadas de suelo y agua, podría modificar su composición, principalmente la del fruto.
Clorofila total y carotenos
Los cultivares de tuna blanca y amarilla presentaron el mayor contenido de clorofila total (Cuadro 2), y los rojos y púrpura la menor proporción. Entre los cultivares blancos destaca el Vaquera con 170.2 mg clorofila 100 g–1, en contraste con Rosa de Castilla y Pabellón ambas con 4.3 mg 100 g–1. El contenido de clorofila en los frutos púrpura fue similar al de los anaranjados (Amarilla Montesa y Pico Chulo). Las concentraciones menores de carotenos (0.7 y 1.2 mg 100 g–1) ocurrieron en los frutos blancos (Cristalina, Mansa y Vaquera), y fueron significativamente diferentes a las de Amarilla Diamante, Cacalote y Tapón Aguanoso (132.1 a 158.4 mg 100 g–1). Estos resultados permiten inferir que la relación entre el color de la pulpa y la presencia de clorofila y caroteno es indirecta; por tanto, esta característica es mal indicador del contenido de pigmentos.

Betalaínas
La concentración de betacianinas (rojo–violeta) y betaxantinas (amarillo–naranja) fue mayor en los cultivares de frutos púrpura y menor en las tunas blancas (Cuadro 3). Los cultivares Tapón Aguanoso y Cacalote presentaron contenidos significativamente más altos de betacianinas (682.0 y 429–0 mg L–1) y de betaxantinas (276.1 y 249–6 mg L–1). Estos valores, para ambos pigmentos, fueron similares a los encontrados por Stintzing et al. (2005) en diferentes cultivares de Opuntia spp. en EE.UU. y superiores a O. ficus–indica cv Giallay Rossa (Stintzing et al., 2003).

Fenoles
Los frutos blancos mostraron contenido de fenoles totales significativamente inferior que los demás (Cuadro 4). Esto podría deberse a la presencia de antocianinas, pigmentos responsables de coloraciones anaranjadas a rojas que pertenecen a un grupo de compuestos fenólicos denominados fiavonoides. Así, los frutos blancos tendrían menor concentración de antocianinas, lo que a la vez indicaría un contenido bajo de fenoles totales (Waterman y Mole, 1994). Las concentraciones mayores de fenoles se encontraron en los cultivares Tapón Aguanoso, Amarilla Diamante y Mango (Cuadro 4) y no se observó una relación directa con el color del fruto. Las concentraciones de fenoles son similares a las encontradas por Stintzing et al. (2005) en cuatro cultivares de Opuntia spp. (242 a 660 mg L–1), y también parecidos a los reportados por Moyer et al. (2002) en diferentes genotipos de arándano (Vaccinium spp.) (171 a 961 mg L–1 ) y frutos del género Rubus (126 a 1079 mg L–1) y Ribes (191 a 1342 mg L–1), los cuales se caracterizan por su alto valor nutricional y su capacidad antioxidante debida, en parte, a los compuestos fenólicos.

Existen antecedentes de la presencia de compuestos fenólicos en cladodios de diferentes variantes de Opuntia. Las concentraciones mayores se han obtenido en las de color morado y las menores en formulaciones comerciales en polvo (Guevara–Figueroa, 2010).
Capacidad antioxidante
En este estudio se encontró que con excepción del cultivar Pabellón, que presentó una capacidad antioxidante significativamente menor (2.8 μmol eq Trolox g–1 peso fresco), los cultivares fueron similares en esta característica (p>0.05) (Cuadro 4).
Estos resultados son similares a los encontrados en zanahoria amarilla (Daucus carota L.) (9.51 μmol eq Trolox g–1) por Sun et al. (2009) y superiores a los reportados por Wang et al. (1996) para tomate (Solanum lycopersicum L.), naranja (Citrus sinensis (L.) Osbeck) y manzana (Maluspumila Mili), con valores menores a 5 μmol eq Trolox g–1, y por Scalzo et al. (2005) en diferentes variedades de kiwi (Actinidia chinensis var. deliciosa A. Chev), manzana y durazno (Prunuspérsica L.), con concentraciones promedio de 2.7, 1–6 y 1.22 μmol eq Trolox g–1.
Lo anterior indica que los frutos de los cultivares estudiados presentan capacidad antioxidante alta con respecto a otras especies de alto consumo. Esta característica es importante porque los antioxidantes naturales son elementos esenciales que protegen de la oxidación a las macromoléculas biológicas en el cuerpo humano. Además, la protección antioxidante en el organismo es clave para el control de enfermedades crónicas, lo que tiene gran relevancia en medicina preventiva (Urquiaga et al, 1999). Con respecto a la relación entre la capacidad antioxidante y el color de fruto, Repo y Encina (2008) en un estudio con frutas nativas de Perú que incluyó tuna (O. ficus–indica), muestran que los frutos rojos tienen mayor capacidad antioxidante que los anaranjados y éstos a su vez son superiores que los cultivares de fruto blanco. Sin embargo, en el presente trabajo no se observó esta tendencia y, por tanto no se puede asociar el color de la pulpa con la capacidad antioxidante. Esto podría deberse al efecto del genotipo, tanto de especies como cultivares, así como a las condiciones de cultivo (Scalzo et al., 2005).
CONCLUSIONES
Los cultivares evaluados se pueden consumir como fruto fresco y también se podrían usar para la extracción de betalaínas, para ser incorporadas como colorantes naturales en otros productos alimenticios.
LITERATURA CITADA
Association of Official Analytical Chemists (AOAC). 1980. Official Methods of Analysis. Horwitz, W. (ed). 13th Ed. Benjamin Franklin Station, Washington DC. USA. 1018 p. [ Links ]
Beltrán–Orozco, M. C, T. Oliva–Coba, T. Gallardo–Vázquez, y G. Osorio–Revilla. 2009. Acido ascórbico, contenido fenólico y capacidad antioxidante de las variedades roja, cereza, amarilla y blanca del fruto del cactus de la pitaya (Stenocereus stellatus Riccobono). Agrociencia 43: 153–162. [ Links ]
Cevallos–Casals, B., and L. Cisneros–Zevallos. 2004. Stability of anthocyanin–based aqueous extracts of andean purple corn and red–fleshed sweet potato compared to synthetic and natural colorants. Food Chem. 86: 69. [ Links ]
Corral–Aguayo, R., E. Yahia, A. Carrillo–López, and G. González–Aguilar. 2008. Correlation between some nutritional components and the total antioxidant capacity measured with six different assays in eight horticultural crops. J. Agrie. Food Chem. 56: 10498–10504. [ Links ]
Fogliano, V., V. Verde, G. Randazzo, and A. Ritieni. 1999. Method for measuring antioxidant activity and its application to monitoring the antioxidant capacity of wines. J. Agrie. Food Chem. 47: 1035–1040. [ Links ]
Guevara–Figueroa, T., H. Jiménez–Islas, M. L. Reyes–Escogido, A. G. Mortensen, B. B. Laursen, L.–W. Lin, A. De León–Rodríguez, I. S. Fomsgaard, andA. P. B. Rosa. 2008. Proximate composition, phenolic acids, and flavonoids characterization of commercial and wild nopal (Opuntia spp.). J. Food Composition and Analysis. doi:10.1016/j.jfca.2009.12.003. [ Links ]
Gurrieri S., L. Miceli, C. M. Lanza, F. Tomaselli, R. Bonomo, and E. Rizzarelli. 2000. Chemical characterization of Sicilian prickly pear (Opuntia ficus indica) and perspectives for the storage of its juice. J. Agrie. Food Chem. 48: 5424–5431. [ Links ]
Kuti, J. 2004. Antioxidant compounds from four Opuntia cactus pear fruit varieties. Food Chem. 85: 527–533. [ Links ]
Lichtenthaler, H. K. 1987. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. Meth. Enzymol. 148: 350–382. [ Links ]
Litwack, G. 1967. Bioquímica Experimental. Ediciones Omega S. A. Barcelona, España. 378 p. [ Links ]
Moreno–Álvarez, M. J., D. García, D. Belén, C. Medina, y N. Muñoz. 2008. Análisis bromatológico de la tuna Oputnia ellatior Miller (Cactaceae). Rev. Fac. Agron. (LUZ) (Venezuela) 25: 68–80. [ Links ]
Moyer, R., K. Hummer, C. Finn, B. Frei, and R. Wrolstad. 2002. Anthocyanins, phenolics and antioxidant capacity in diverse small furits: Vaccinium, Rubus and Ribes. J. Agrie. Food Chem. 50: 519–525. [ Links ]
Prior, R., G. Cao, A. Martin, E. Sofic, J. McEwen, C. O'Brien, N. Lischner, M. Ehlenfeldt, W. Kalt, G. Krewer, and C. M. Mainland. 1998. Antioxidant capacity as influenced by total phenolic and anthocianin content, maturity and variety of Vaccinium species. J. Agrie. Food Chem. 46: 2686–2693. [ Links ]
Repo, R., y C. Encina. 2008. Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas. Rev. Soc. Quím. Perú. 74(2): 108–124. [ Links ]
Sáenz, C. (ed.) 2006. Utilización agroindustrial del nopal. Boletín del Servicio Agrícola de la FAO 162. 186 p. [ Links ]
SAS Institute. 1998. Language guide for personal computer release. 6.03 Edition. SAS Institue. Cary. N.C. USA. 1028 p. [ Links ]
Scalzo, J., A. Politi, N. Pellegrini, B. Mezzetti, and M. Battino. 2005. Plant genotype affects total antioxidant capacity and phenolic contents in fruit. Nutrition 21: 207–213. [ Links ]
Stintzing, E, A. Scchieber, and R. Carle. 2003. Evaluation of color properties and chemical quality parameters of cactus juice. Eur. Food Res. Technol. 216: 303–311. [ Links ]
Stintzing, E, K. Herbach, M. Mosshammer, R. Carle, W. Yi, S. Sellappan, C. Akoh, R. Bunch, and P. Felker. 2005. Color, betalain pattern and antioxidant properties of cactus pear (Opuntia spp) clones. J. Agrie. Food Chem. 53:442–451. [ Links ]
Sun, T., P. Simon, and S. A. Tanumihardjo. 2009. Antioxidant phytochemicals and antioxidant capacity of biofortified carrots (Daucus carota L.) of various colors. J. Agrie. Food Chem. 57: 4142–4147. [ Links ]
Urquiaga I., U. Urzúa y F. Leighton. 1999. Antioxidantes Naturales. Impacto en la Salud. 8° Congreso Latinoamericano de Grasas y Aceites. [ Links ]
Wang, H., G. Cao, and R. L. Prior 1996. Total antioxidant capacity of fruits. J. Agrie. Food Chem. 44: 701–705. [ Links ]
Waterman, P., and S. Mole. 1994. Analysis of Phenolic Plant Metabolites. Blackwell Scientific Publications. UK. 238 p. [ Links ]
Weller, T. A., and L. L. Lasure. 1982. Betalains in beet root tissue culture. J. Food Sci. 47(1): 162–163. [ Links ]














