Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Agrociencia
versão On-line ISSN 2521-9766versão impressa ISSN 1405-3195
Agrociencia vol.44 no.6 Texcoco Ago./Set. 2010
Protección vegetal
Producción de chile ancho injertado sobre criollo de Morelos 334 para el control de Phytophthora capsici
Production of ancho chili graft on criollo de Morelos 334 for the control of Phytophthora capsici
Ma. Rocío García–Rodríguez1, Elizabeth Chiquito–Almanza1, P. Damián Loeza–Lara2, Heriberto Godoy–Hernández3, Emiliano Villordo Pineda3, J. Luis Pons–Hernández3, M. Martín González–Chavira3, J. Luis Anaya–López3*
1 Instituto Tecnológico de Celaya. Celaya, Guanajuato, México.
2 Universidad de La Ciénega del Estado de Michoacán de Ocampo. Sahuayo, Michoacán, México.
3 Campo Experimental Bajío. Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias. *Autor responsable:(jose.luis.al@hotmail.com).
Recibido: Abril, 2009.
Aprobado: Agosto, 2010.
RESUMEN
Phytophthora capsici es un oomiceto que ocasiona pérdidas en la producción de chile (Capsicum annuum L.) en el mundo. Actualmente no hay variedades comerciales de chile resistentes a este patógeno y los productos químicos usados para su control promueven el desarrollo de cepas resistentes y daños al ambiente. Por tanto, se usan estrategias como el injerto, que destaca por su inocuidad al ambiente y eficacia para controlar patógenos del suelo. En este estudio se evaluó in vitro la resistencia a P. capsici de cuatro patrones comerciales de chile y del cultivar tipo serrano Criollo de Morelos 334 (CM334). Se seleccionó CM334 por su baja incidencia de síntomas (1%). Se evaluó en invernadero la resistencia a P. capsici de plantas de chile ancho Rebelde sin injertar e injertadas sobre CM334 y se midieron algunas variables morfológicas, así como la producción de frutos comerciales en presencia y ausencia del patógeno. En relación al efecto del patógeno sobre las plantas injertadas, la interacción con P. capsici no afectó el peso de frutos comerciales (FC), pero redujo significativamente el diámetro y área foliar (AF). En ausencia del patógeno las plantas sin injertar tuvieron significativamente mayor altura, peso seco de hojas, AF, peso de FC, y menor índice de cosecha. Sin embargo, todas las plantas de Rebelde sin injertar e inoculadas con P. capsici murieron. El rendimiento de frutos comerciales de Rebelde en ausencia de P. capsici fue 14 t ha–1, mientras que el de Rebelde injertado sobre CM334 fue 11.4 t ha–1 (p<0.01). Estas evidencias indican que el uso de CM334 como patrón tiene potencial para la producción de chile en zonas con alta incidencia de P. capsici.
Palabras clave: injerto, marchitez del chile, patrón, resistencia.
ABSTRACT
Phytophthora capsici is an oomycete that causes losses in the production of chili peppers (Capsicum annuum L.) worldwide. There are currently no varieties of chilles resistant to this pathogen and the chemical products used for its control promotes the development of resistent strains and environmental damages. Therefore, strategies like grafting are used, which stands out for its harmlessness to the environment and its efficiency for controlling soil pathogens. The in vitro resistance of P. capsici from four commercial chili stocks and from the serrano type Criollo de Morelos 334 (CM334), was evaluated in this study. The 334 was chosen due to its low sympton incidence (1%). In green house the resistance of ungrafted and grafted P. capsici chili pepper plants on CM334 was evaluated, and some morphological variables were measured, as well as the production of commercial fruits in the presence and absence of the pathogen. In regard to the effect of the pathogen on the grafted plants, the interaction with P. capsici did not affect the weight of commercial fruits (FC), although it did significantly reduce the foliar area (AF) and diameter. In the absence of the pathogen, ungrafted plants were significantly taller, they had greater dry weights of the leaves, AF, FC weight, and a lower harvest index. However, all the ungrafted Rebelde plants inoculated with P. capsici died. The yield of commercial fruits of Rebelde in the absence of P. capsici was 14 t ha–1, whereas that for Rebelde grafted on CM334 was 11.4 t ha–1 (p<0.01). This evidence shows that the use of CM334 as a patrón has a potential for the production of chili peppers in areas with high incidence of P. capsici.
Key words: graft, pepper wilt, stock, resistance.
INTRODUCCIÓN
En el 2007 la producción mundial de chile (Capsicum spp.) fue poco más de 30 millones de t (FAOSTAT, 2008). México aportó 6.8% del total y se usó 27.5% de la superficie destinada al cultivo de hortalizas, generando más de $ 5 000 millones de pesos, que representó 23% de la producción hortícola nacional (SIACON, 2007).
Phytophthora capsici Leonian es el factor limitante más importante para la producción de chile en el mundo. En función de las condiciones ambientales, la virulencia de los aislados y la cantidad de inóculo de P. capsici en el suelo, este patógeno puede causar de 25 a 40% de las pérdidas del cultivo. Una de las estrategias más comunes para controlar este patógeno es utilizar fumigantes y fungicidas; sin embargo, su uso indiscriminado ha ocasionado el desarrollo de aislamientos resistentes, problemas de contaminación ambiental y de salud pública. Esto ha causado la prohibición de algunos de los productos más usados para controlar P. capsici, como el bromuro de metilo.
Entre los métodos alternativos para controlar P. capsici destaca el injerto sobre patrones resistentes (Santos y Goto, 2004), cuyo uso ha aumentado debido a su eficacia e inocuidad para el ambiente. En Corea se injertaron cerca de 6 millones de plantas de chile para controlar este patógeno (Lee y Oda, 2003).
El chile tipo serrano Criollo de Morelos 334 (CM334) es una de las más eficaces fuentes de resistencia genética a P. capsici. Sin embargo, aunque la resistencia a P. capsici es de carácter dominante (Egea–Gilabert et al., 2008), su herencia es compleja debido a su naturaleza poligénica y a la probable existencia de efectos epistáticos (Minamiyama et al., 2007). Por ello no se han generado cultivares de chile comerciales con una adecuada resistencia a este patógeno. En este sentido, el injerto es una alternativa que permite usar variedades resistentes a P. capsici para la producción de chile, eludiendo la dificultad de incorporar genéticamente esta característica a las variedades productivas.
Según Fernandez–Pavia y Liddell (1998), la resistencia de CM334 es independiente de la variedad injertada y este cultivar se podría usar como patrón. Sin embargo, para considerar el uso de un patrón, es imprescindible determinar, además de la resistencia y la compatibilidad, el rendimiento de frutos comerciales, una característica aún no evaluada en la mayoría de las investigaciones. Por tanto, el objetivo del presente estudio fue determinar la resistencia a P. capsici y el rendimiento de plantas de chile ancho injertadas sobre patrones de CM334.
MATERIALES Y MÉTODOS
Material vegetal
Se evaluaron cinco genotipos de chile tolerantes a P. capsici: los híbridos de pimiento Tresor (Nunhems), Atlante, AR–96030, AR–96058 (Ramiro Arnedo) y Criollo de Morelos 334 (Redondo, 1979). La variedad a injertar fue el híbrido Rebelde (Seminis) de tipo ancho susceptible a P. capsici, el cual se usó como testigo sin injertar en la evaluación de resistencia en invernadero. El híbrido de pimiento Triple Star (Enza Zaden) se usó como testigo susceptible en las evaluaciones de resistencia in vitro para la selección del patrón.
Material fúngico
Se usó el aislado de P. capsici C7P8F7 identificado mediante PCR con iniciadores específicos (Zhang et al., 2006). Este patógeno fue aislado en Dolores Hidalgo, estado de Guanajuato, México, y presentó la mayor virulencia ente 32 aislados monozo–ospóricos obtenidos en un estudio realizado por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) sobre la variabilidad genética de P. capsici en Guanajuato. El aislado se mantuvo y se propagó en medio de cultivo papa dextrosa al 1.5% de agar (PDA; Difco) a 25 °C.
Selección in vitro del patrón resistente a P. capsici
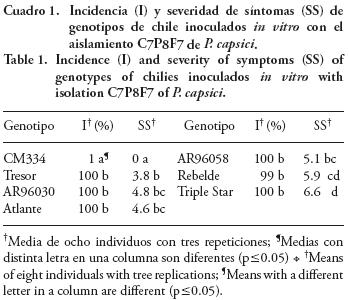
La evaluación in vitro de la resistencia se realizó en una cámara de crecimiento (Lab–Line modelo 844) a 23 °C, 74% de humedad relativa y un fotoperíodo de 16 h luz. Se usaron plantas de cuatro hojas verdaderas germinadas en condiciones estériles sobre agar–agua (AA) al 1.5%, y crecidas en vermiculita esterilizada en autoclave 2 d consecutivos a 121 °C por 30 min. Las plantas se inocularon de acuerdo al modelo de interacción propuesto por Muñoz y Bailey (1998). Se usó la escala de daño reportada por Bosland y Lindsey (1991) y se determinó la incidencia (Wolcan et al., 2001) y severidad de los síntomas (Towsend y Heuberguer, 1943). Las evaluaciones se realizaron cada 24 h después de la inoculación (DI), hasta que las plántulas tuvieron una incidencia de 100% o murieron. El genotipo de chile con menor incidencia y severidad de síntomas a 168 h DI fue seleccionado como patrón resistente a P. capsici.
Preparación del inóculo de P. capsici
La resistencia de las plantas injertadas se evaluó en invernadero mediante inoculación con micelio del aislado C7P8F7 cultivado en vermiculita (Ezziyyani et al., 2004). La cantidad de inóculo se determinó contando las zoosporas mL–1 de P. capsici por g de vermiculita que crecieron en cajas de petri con PDA incubadas por 3 d a 25 °C.
Experimentos en invernadero
Los dos experimentos se realizaron de enero a mayo de 2008 en los invernaderos del INIFAP Campo Experimental Bajío, Celaya, estado de Guanajuato (20° 34' N, 100° 49' O, 1650 m de altura). En el invernadero el promedio de temperatura fue 20.2 °C y de humedad relativa 56.7%.
El injerto se realizó de acuerdo a Lee y Oda (2003). El prendimiento se determinó como el porcentaje de plantas sobrevivientes y vigorosas 20 d después del injerto. Las plantas injertadas se trasplantaron a bancales (5.6 m2 × 20 cm de profundidad) con una densidad de plantación de 4.4 plantas m–2. El sustrato se fumigó con 75 g m–2 de bromuro de metilo. Su textura fue franca arcillosa (29% arena, 35% limo, 36% arcilla) con una densidad aparente de 1.31 g cm–3. El diseño experimental fue completamente al azar con grupos de 20 plantas y tres repeticiones.
En el primer experimento se evaluó el efecto del patrón en las variables morfológicas y la producción, comparando plantas sin injertar e injertadas sobre CM334. En el segundo experimento se evaluó el efecto de P. capsici en las variables morfológicas y la producción de las plantas injertadas, comparando plantas injertadas inoculadas o no con P. capsici a 2 cm de profundidad en la base del tallo con 77.64 × 107 zoosporas mL–1 de P. capsici. Se usó un sistema de fertirriego a 0.10 MPa de presión con cintilla calibre 8000; los goteros fueron de 0.5 L h–1 con separaciones de 20 cm. La tensión de humedad promedio en el suelo fue –18 kPa a 15 cm de profundidad. La fertilización se realizó de acuerdo con los requerimientos nutrimentales del chile ancho (Castellanos et al., 2004).
Variables evaluadas
Se realizaron cortes de frutos 128, 132 y 142 d después del trasplante (DDT). Después del tercer corte se midió el diámetro de tallo (D) a 1 cm encima del sitio de unión del injerto y se cortaron las plantas a ras del suelo. Se midió la altura (A) y el área foliar (AF) de cada planta con un integrador de área LI–3100 (LICOR, Lincoln, NE). Como variables de producción se midió por planta el peso y número de frutos totales (FT) y comerciales (FC); los frutos comerciales se clasificaron de acuerdo con la norma mexicana NMX–FF–025–SCFI–2007. El índice de cosecha (IC) se calculó como la relación del peso seco de frutos totales (PSF) entre el peso seco total de la planta (PSt), determinado como la suma del peso seco de hojas (PSH), tallos (PST) y frutos (PSF).
Análisis estadístico
El análisis de discriminación por pasos con el método Stepwise (valor de entrada y salida de p=0.05) y el de varianza, así como la comparación entre las medias de los tratamientos con la prueba de Tukey (p<0.05), se realizó con SAS (SAS Institute, 2004). Los valores en porcentaje de incidencia y severidad fueron transformados con la fórmula: Y=arcsen(x/100)½.
RESULTADOS Y DISCUSIÓN
Selección in vitro del patrón
En la evaluación de resistencia in vitro los patrones Tresor, Atlante, AR96030 y AR96058 mostraron una incidencia y severidad de síntomas similar a los testigos susceptibles Rebelde y Triple Star (Cuadro 1), mientras que CM334 fue altamente resistente, con una incidencia de 1% a 168 h DI con P. capsici. Este resultado fue consistente con reportes de la resistencia de CM334 a este patógeno (Ares et al., 2005; Egea–Gilabert et al., 2008). En contraste, los híbridos comerciales mostraron síntomas a las 72 h DI (datos no mostrados). Es importante destacar que la evaluación in vitro fue diseñada para favorecer el proceso de infección de P. capsici, y aunque no refleja la interacción natural entre las plantas y el patógeno, permitió seleccionar rápidamente al genotipo altamente resistente.
Efecto del injerto de Rebelde con CM334
De acuerdo con el análisis de Stepwise, las variables que describieron mejor las diferencias entre las plantas sin injertar e injertadas sobre CM334 fueron PSH, D, y A, mientras que el D, PST, y AF describieron el efecto de P. capsici sobre las plantas injertadas (Cuadro 2).

En las plantas injertadas D fue significativamente mayor que el de las plantas sin injertar, pero en PSH y A sucedió lo contrario (Cuadro 3). El diámetro del tallo es un indicativo de cambios fisiológicos debido a las interacciones celulares entre dos genotipos (Kokalis–Burelle et al., 2009); sin embargo, los cambios en el diámetro dependen del genotipo y no siempre se correlaciona con una disminución en la producción (Cürük et al, 2009; Kokalis–Burelle et al, 2009).

La reducción en A y PSH pudo deberse a una compatibilidad parcial entre Rebelde y el sistema radicular de CM334, lo que modificó la absorción de nutrimentos, reguladores de crecimiento y agua de las plantas injertadas como ha ocurrido con berenjena (Solanum melogena L.) y jitomate (Lycopersicon esculentum Mill.) (Leonardi y Giuffrida, 2006; Oda et al., 2005). Sin embargo, en chile se ha estudiado poco, por lo que se deberán evaluar los efectos de la absorción de nutrientes y la compatibilidad vascular en este cultivo. Estas evidencias sugieren que el uso de CM334 como patrón redujo significativamente el vigor, un fenómeno común en el injerto de hortalizas que representa uno de los mayores problemas al injertar pimiento (Miguel, 1997; Santos y Goto, 2004).
Las variables PSH, D y A describieron mejor las diferencias entre las plantas injertadas y sin injertar de acuerdo con el método Stepwise. La comparación de medias del número y peso de FT y FC, IC, AF y PST se incluyó porque describen el fenómeno de producción y hubo diferencias significativas entre los tratamientos.
El número y peso de FT y FC de las plantas sin injertar fue significativamente mayor que el de las plantas injertadas (Cuadro 4). Sin embargo, casi el 90% del peso de FT de las plantas injertadas correspondió a FC, lo cual sugiere que se translocó mayor cantidad de fotoasimilados para la formación de frutos. Por tanto, considerando sólo el peso de FC, el rendimiento de Rebelde sin P. capsici fue 14 t ha–1, en comparación con 11.4 t ha–1 (p<0.01) producido por las plantas injertadas. El IC de las plantas injertadas fue similar al obtenido en pimiento (Jaimez, 2000) y jalapeño (Azofeifa y Moreira, 2004), y significativamente mayor que el IC de las plantas sin injertar, lo cual se debió a que las plantas injertadas tuvieron menos PSt (Cuadro 4).
Esto fue consistente con lo encontrado en chile (C. annuum) en donde la reducción del peso seco total incrementó el índice de cosecha (González–Real et al., 2008). En conjunto, estas evidencias sugieren que el uso de CM334 como patrón disminuyó el vigor y la capacidad de la planta para producir fotoasimilados, disminuyendo la producción.
Efecto de P. capsici en el rendimiento de Rebelde injertado
Las plantas de Rebelde sin injertar no se pudieron usar como testigo ya que murieron aproximadamente 15 d DI (datos no mostrados). En contraste, todas las plantas de Rebelde injertadas sobre CM334 sobrevivieron y completaron su ciclo, lo cual reflejó el nivel de resistencia de CM334 a P. capsici.
La interacción de P. capsici con las plantas injertadas disminuyó el D y AF (Cuadro 5). La reducción del diámetro en la interacción entre plantas de chile injertadas y patógenos ha sido reportada en patrones tolerantes a Meloidogyne incognita (Kokalis–Burelle et al., 2009); sin embargo, se desconoce el motivo de este fenómeno. La interacción de P. capsici con las plantas injertadas no afectó la producción comercial, ya que en comparación con las plantas injertadas sin P. capsici no hubo diferencias significativas en las variables de producción.

Aunque la diferencia en el rendimiento entre las plantas injertadas y sin injertar fue significativa, es importante reiterar que con las condiciones evaluadas ninguna planta sin injertar sobrevivió a la inoculación con P. capsici. Además, se detectaron algunos individuos con una interacción más vigorosa que la media de las plantas injertadas (datos no mostrados). Esta variación en el vigor pudo deberse a la heterogeneidad de CM334; en este cultivar hay variación en la pungencia de los frutos y en la resistencia al virus PYV (Pasko et al, 1992; Gil et al, 2003), lo que abre la posibilidad de identificar individuos de CM334 con una interacción vigorosa similar a la de las plantas sin injertar. Sin embargo, será necesario seleccionar individuos con mayor vigor para aumentar el rendimiento y determinar los requerimientos nutricionales de las plantas injertadas sobre estos patrones.
CONCLUSIONES
La baja incidencia y severidad de síntomas de CM334 en las evaluaciones de resistencia in vitro indicaron que CM334 fue el único genotipo resistente a P. capsici. El uso de CM334 como patrón disminuyó significativamente el vigor y el rendimiento de FC. Sin embargo, fue altamente eficaz para proteger al chile ancho Rebelde del ataque de P. capsici ya que todas las plantas sin injertar murieron al ser inoculadas. La interacción con el patógeno no afectó la producción de frutos comerciales en las plantas injertadas. Este estudio confirma que el uso de CM334 como patrón tiene potencial para la producción de chile en condiciones de infestación por P. capsici.
AGRADECIMIENTOS
Se agradece al Consejo de Ciencia y Tecnología del estado de Guanajuato (CONCYTEG) por el apoyo financiero al proyecto número 07–24–K662–064 y la beca de licenciatura número de convenio 08–24–K119–053, y al Dr. Carlos Alberto Núñez Colín por su valiosa orientación en el análisis estadístico.
LITERATURA CITADA
Ares, A., J. L., A. Rivera M., and J. Fernández P. 2005. Resistance of pepper germoplasma to Phytophthora capsici isolates collected in northwest Spain. Span. J. Agric. Res. 3: 429–436. [ Links ]
Azofeifa, A., y M. A. Moreira. 2004. Análisis de crecimiento del chile jalapeño (Capsicum annuum L. cv. Hot), en Alajuela, Costa Rica. Agron. Costarricense 28: 57–67. [ Links ]
Bosland, P. W., and D. L. Lindsey. 1991. A seedling screen for Phytophthora root rot of pepper Capsicum annuum. Plant Dis. 75: 1048–1050. [ Links ]
Castellanos, J. Z., J. X. Uvalle B., y A. Aguilar S. 2004. Manual de Interpretación de Análisis de Suelos y Aguas. 2da Ed. Colección INCAPA. Celaya, Guanajuato. 201 p. [ Links ]
Cürük, S., H. Y. Dasgan, S. Mansuroglu, S. Kurt, M. Mazmanoglu, O. Antakli, and G. Tarla. 2009. Grafted eggplant yield, quality and growth in infested soil with Verticillium dahliae and Meloidogyne incognita. Pesq. Agropec. Bras. 44: 1673–1682. [ Links ]
Egea–Gilabert, C., G. Bilotti, M. E. Requena, M. Ezziyyani, J. M. Vivo Molina, and M. E. Candela. 2008. Pepper morphological traits related with resistance to Phytophthora capsici. Biol. Plantarum 52: 105–109. [ Links ]
Ezziyyani, M., C. Pérez S., M. E. Requena, A. Sid A., y M. E. Candela. 2004. Evaluación del biocontrol de Phytophthora capsici en pimiento (Capsicum annuum L.) por tratamiento con Burkholderia cepacia. An. Biol. 26: 61–68. [ Links ]
FAOSTAT. 2008. Sistema Estadístico de la Organización de las Naciones Unidas para la Agricultura y la Alimentación. faostat.fao.org/site/567/DesktopDefault.aspx?PageID=567 (consultado: abril 2008). [ Links ]
Fernandez–Pavia, S. P., and C. M. Liddell. 1998. Lack of evidence for translocation of resistance factors between roots and foliage of Capsicum annuum infected by Phytophthora capsici. Capsicum and Eggplant Newsletter 17: 66–68. [ Links ]
Gil O., R., M. S. Arnedo A., M. L. Arteaga, and A. B. Garces C. 2003. 'Serrano criollo de Morelos' a good example of a land variety. Capsicum and Eggplant Newsletter 22: 25–26. [ Links ]
González–Real, M. M., A. Baille, and H. Q. Liu. 2008. Influence of fruit load on dry matter and N–distribution in sweet pepper plants. Sci. Hortic. 117: 307–315. [ Links ]
Jaimez R., E. 2000. Crecimiento y distribución de la materia seca en aji dulce bajo condiciones de déficit de agua. Agron. Trop. 50: 189–200. [ Links ]
Kokalis–Burelle, N., M. G. Bausher, and E. N. Rosskopf. 2009. Greenhouse evaluation of Capsicum rootstocks for management of Meloidogine incognita on grafted bell pepper. Nematropica 39: 121–132. [ Links ]
Lee, J. M., and M. Oda. 2003. Grafting of herbaceous vegetable and ornamental crops. Hort. Rev. 28:61–124. [ Links ]
Leonardi, C., and F. Giuffrida. 2006. Variations of plant growth and macronutrient uptake in grafted tomatoes and eggplants on three different rootstocks. Eur. J. Hortic. Sci. 71(3): 97–101. [ Links ]
Miguel G., A. 1997. Injerto de Hortalizas. Generalitat Valencia. Federico Doménech, S. A. Valencia, España. 88 p. [ Links ]
Minamiyama, Y., M. Tsuro, T. Kubo, and M. Hirai. 2007. QTL analysis for resistance to Phytophthora capsici in pepper using a high density SSR–based map. Breeding Sci. 57: 129–134. [ Links ]
Muñoz, C. I., and A. M. Bailey. 1998. A cutinase–encoding gene from Phytophthora capsici isolated by differential–display RT–PCR. Curr. Genet. 3: 225–230. [ Links ]
Norma Mexicana NMX–FF–025–SCFI–2007. Productos alimenticios no industrializados para consumo humano–chile fresco (Capsicum spp). www.sagarpa.gob.mx/agricultura/info/comp/it/normas/noti/NMX_FF_025_SCFI_2007_15102007.pdf (consultado: agosto 2008). [ Links ]
Oda, M., M. Maruyama, and G. Mori. 2005. Water transfer at graft union of tomato plants grafted onto Solanum roots–tocks. J. Japan Soc. Hort. Sci. 74: 458–463. [ Links ]
Pasko, P., M. L. Arteaga, and R. Gil O. 1992. Difference kind of reactions to PVY–1–2 in Capsicum annuum L., cv. 'SCM–334'. Capsicum Newsletter, special issue: 153–156. [ Links ]
Redondo, J. E. 1979. Búsqueda de fenotipos de chile resistentes al hongo Phytophthora capsici Leonian. Proc. Trop. Reg. Amer. Soc. Hort. Sci. 23: 220–224. [ Links ]
Santos, H. A., e R. Goto. 2004. Enxertia em plantas de pimentao no controle da murcha de fitóftora em ambiente protegido. Hort. Bras. 22: 45–49. [ Links ]
SAS Institute. 2004. SAS/STAT 9.1 User's Guide. SAS Inst., Cary, NC. 5124 p. [ Links ]
SIACON. Sistema de Información Agroalimentaria de Consulta 1980–2007, SAGARPA, D. F., México. www.siap.sagarpa.gob.mx/ventana.php?idLiga=1560 & tipo=0 (consultado: agosto 2008) . [ Links ]
Towsend, G. R., and J. W. Heuberguer. 1943. Methods for estimating losses caused by diseases in fungicide experiments. Plant Dis. Reporter 27: 340–343. [ Links ]
Wolcan, S. M., G. A. Lori, L. Ronco, A. F. Mitidieri, y R. Fernández. 2001. Enanismo y podredumbre basal de Eustoma grandiflorum y su relación con la densidad de Fusarium solani en el suelo. Fitopatol. Bras. 26: 710–714. [ Links ]
Zhang, Z. G., Y. Q. Li, H. Fan, Y. C. Wang, and B. Zheng. 2006. Molecular detection of Phytophthora capsici in infected plant tissue, soil and water. Plant Pathol. 55: 770–775. [ Links ]














