Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.6 Texcoco ago./sep. 2010
Protección vegetal
Análisis cariotípico y diferenciación de cromosomas sexuales en cuatro especies de Anastrepha (Diptera:Tephritidae)
Karyotype analysis and differentiation of sex chromosomes in four Anastrepha species (Diptera:Tephritidae)
Jorge Ibañez–Palacios1, Armando García–Velazquez2*, Cristina S. Zepeda–Cisneros1, Tarsicio Corona–Torres2
1 Campaña Nacional Moscas de la Fruta. Acuerdo SAGARPA–IICA, Tapachula Chiapas.
2 Colegio de Postgraduados, Montecillo, Texcoco México. *Autor responsable: (garciav@colpos.mx).
Recibido: Septiembre, 2009.
Aprobado: Mayo, 2010.
RESUMEN
El género Anastrepha Schiner, endémico en América tropical y subtropical, incluye a la especie Anastrepha ludens, A. obliqua, A. striata y A. serpentina que son polífagas y que parasitan una amplia gama de plantas. Estas especies se estudiaron por su amplia distribución geográfica y por parasitar a diferentes especies de frutas, para lo cual se usaron larvas de tercer estadio desarrolladas en el laboratorio del Programa Moscafrut en Metapa de Domínguez, estado de Chiapas, México. Se disectó el ganglio cerebral en solución acuosa de citrato de sodio 1% (p/v) donde se mantuvo 20 min, se transfirió a metanol: ácido acético 3:1 (v/v), y se maceró en ácido acético 60%. Una gota de este tejido en suspensión se colocó en un portaobjetos sobre una plancha caliente (4550°C). Se observó al microscopio (Zeiss Axioskop 40) con contraste de fases, seleccionando células con cromosomas dispersos. Se fotografiaron con una cámara AxioCam y software Axiovision 4.0 realizando mediciones con el programa Image Tool 3.0. El análisis se realizó con 20 células/sexo/ especie. El centrómero fue observado sin pretratamiento. Se determinaron los cariotipos en: A. ludens  , 2n=12, Xg Xg+VII telo, n. f. 12,
, 2n=12, Xg Xg+VII telo, n. f. 12,  , 2n=12, Xg Yp+VII Telo n. f. 12; A. obliqua
, 2n=12, Xg Yp+VII Telo n. f. 12; A. obliqua  , 2n=12, Xg Xg+VII Telo, n. f. 12,
, 2n=12, Xg Xg+VII Telo, n. f. 12,  , 2n=12, Xg Yg+VII Telo n. f. 12; A. striata
, 2n=12, Xg Yg+VII Telo n. f. 12; A. striata  , 2n=12, Xg Xg+IIII Meta+IIIII Telo n. f. 16,
, 2n=12, Xg Xg+IIII Meta+IIIII Telo n. f. 16,  , 2n=12, Xg Yp+IIII Meta+IIII Telo n. f. 16; A. serpentina
, 2n=12, Xg Yp+IIII Meta+IIII Telo n. f. 16; A. serpentina  , 2n=12, X1 X1 X2 X2+IVII Meta n. f. 20,
, 2n=12, X1 X1 X2 X2+IVII Meta n. f. 20,  , 2n=11 X1 X2, Yg+IVII Meta n. f.22. Se propone que este grupo de especies presenta translocaciones Robertsonianas como mecanismo de especiación, a partir de A. serpentina.
, 2n=11 X1 X2, Yg+IVII Meta n. f.22. Se propone que este grupo de especies presenta translocaciones Robertsonianas como mecanismo de especiación, a partir de A. serpentina.
Palabras clave: Anastrepha ludens, A. obliqua, A. striata, A. serpentina, evolución, genomas, moscas de la fruta.
ABSTRACT
The genus Anastrepha Schiner, endemic to tropical and subtropical América, includes the species Anastrepha ludens, A. obliqua, A. striataandA. serpentina, which are polyphagous and parasite a wide range of plants. These species were studied because of their broad geographic distribution and because they parasite different fruit species. Larvae in their third stage reared in the laboratory of the Programa Moscafrut in Metapa de Domínguez, Chiapas, México, were used. The cerebral ganglia were dissected in an aqueous solution of 1% (w/v) sodium citrate in which they were kept for 20 min, then transferred to methanol:acetic acid (3:1 (v/v) and macerated in 60% acetic acid. One drop of this tissue suspension was placed on a slide on a hot plate (45–50°C) and observed with a microscope (Zeiss Axioskop 40) with phase contrast, and the cells with disperse chromosomes were selected. These were photographed with an AxioCam camera and Axiovision 4.0 software, and measurements were taken with Image Tool 3.0. Twenty cells/sex/species were analyzed. The centromere was observed without pretreatment. Karyotypes were determined in each species: A. ludens 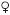 , 2n=12, Xg Xg+VII telo, n. f. 12,
, 2n=12, Xg Xg+VII telo, n. f. 12, 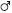 , 2n=12, Xg Yp+VII Telo n. f. 12; A. obliqua
, 2n=12, Xg Yp+VII Telo n. f. 12; A. obliqua 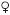 , 2n=12, Xg Xg+VII Telo, n. f. 12,
, 2n=12, Xg Xg+VII Telo, n. f. 12, 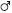 , 2n=12, Xg Yg+VII Telo n. f. 12; A. striata
, 2n=12, Xg Yg+VII Telo n. f. 12; A. striata  , 2n=12, Xg Xg+IIII Meta+IIIII Telo n. f. 16,
, 2n=12, Xg Xg+IIII Meta+IIIII Telo n. f. 16,  , 2n=12, Xg Yp+IIII Meta+IIII Telo n. f. 16; A. serpentina
, 2n=12, Xg Yp+IIII Meta+IIII Telo n. f. 16; A. serpentina  , 2n=12, X1 X1 X2 X2+IVII Meta n. f. 20,
, 2n=12, X1 X1 X2 X2+IVII Meta n. f. 20,  , 2n=11 X1 X2, Yg+IVII Meta n. f.22. It is proposed that this group of species has Robertsonian translocations as a speciation mechanism parting from A. serpentina.
, 2n=11 X1 X2, Yg+IVII Meta n. f.22. It is proposed that this group of species has Robertsonian translocations as a speciation mechanism parting from A. serpentina.
Key words: Anastrepha ludens, A. obliqua, A. striata, A. serpentina, evolution, genomes, fruit flies.
INTRODUCCIÓN
En México se cultivan aproximadamente 1 300 000 ha de árboles frutales y su producción se destina al consumo en fresco o procesado, tanto nacional como extranjero. Las moscas de la fruta del género Anastrepha son uno de los tres principales problemas de la fruticultura en México (Gutiérrez, 2005).
La detección de un espécimen en estado inmaduro de una mosca del género Anastrepha en las zonas libres de México debe considerarse un foco incipiente de expansión con repercusiones económicas en dicha zona. México establece tres zonas fitosanitarias en relación a la presencia de moscas de la fruta: 1) zona bajo control fitosanitario; 2) zona de baja prevalencia; 3) zona libre; y determina hacia donde pueden desplazarse los frutos producidos en el país. Los únicos frutos con movilización ilimitada en el mercado interno e internacional son los producidos en zonas libres de moscas. Los frutos producidos en una zona bajo control fitosanitario sólo pueden venderse localmente y no pueden exportarse (Gutiérrez, 2005).
En México, las moscas de la fruta consideradas de importancia económica son: 1) A. ludens identificada como problema de interés público por los daños a la fruticultura (Diario Oficial Dic. 13 de 1985), principalmente naranja (Citrus sinensis), mandarina (Citrus reticulata) y toronja (Citrusparadisi) con una dominancia de infestación en zonas bajas (menos de 500 m altitud); 2) A. obliqua ataca principalmente mango (Mangifera indica) localizado en zonas a más de 900 m y en ciruelas del género Spondia; 3) A. striata ataca sólo a guayaba (Psidium guajava); y 4) A. serpentina ataca una gran variedad de zapotes como el mamey (Lucuma mammos) y el chicozapote (Manilkara sapota) (Hernández–Ortiz, 1992).
El estudio taxonómico del género Anastrepha es complicado y la identificación de especies se basa principalmente en aspectos morfológicos, ya sea de huevos, larvas o adultos (Aluja, 1994; Norrbom et al., 1999). Además se presentan problemas para determinar el estatus taxonómico de algunas especies de este género, por lo cual es necesario buscar medios alternativos. Los estudios citogenéticos, como las descripciones cariotípicas, son un valioso instrumento en aspectos filogenéticos y evolutivos de las especies.
El número cromosómico más frecuente en el género Anastrepha es 2n=12 (Selivon et al., 2005), aunque se presentan diferencias en el número de brazos mayores o nombre fondamental (Bush, 1962) así como en el mecanismo de determinación sexual; hay especies con mecanismo XY/XX, y otras como A. bistrigata y A. serpentina que exhiben heteromorfismo de los heterocromosomas que involucran X1X2Y/ X1X1X2X2 (Solferini y Morgante, 1987; Selivon et al., 2005).
El análisis cromosómico de especies del género Anastrepha puede ayudar a entender la situación taxonómica y evolutiva de este grupo de moscas de la fruta, especialmente el estudio detallado del cariotipo en Anastrepha ludens, A. obliqua, A. striata y A. serpentina. La descripción de cariotipos y diferenciación de los cromosomas sexuales es importante para planear métodos de control de estas plagas.
MATERIALES Y MÉTODOS
Material biológico
Se usaron larvas en tercer estadio, criadas en laboratorio en Metapa de Domínguez, estado de Chiapas. Las especies A. ludens, A. obliqua, A. striata y A. serpentina se han mantenido por varias generaciones en laboratorio a 26°C±2 y 70–80% de humedad relativa.
Preparaciones citológicas
Para analizar cromosomas en metafase se usó el ganglio cerebral en larvas de tercer estadio con la técnica de secado al aire con tinción Giemsa (Ashburner, 1989). Se disectaron 20 larvas/ sexo en solución acuosa 1% (p/v) de citrato de sodio, donde se mantuvieron 20 min, se transfirieron a metanol: ácido acético (3:1 v/v) por 2 min y se sumergieron en ácido acético 60% para disgregar las células. Con una pipeta se depositó una gota de suspensión de células en un portaobjetos sobre una plancha térmica a 45–50°C, se coloreó con Giemsa 5% en amortiguador de fosfato 0.01M (p/v) y se observó en contraste de fases (Ashburner, 1989).
De cada especie se estudiaron 20 células/20 larvas/sexo, en total 400 células. Las preparaciones se analizaron en un microscopio Carl Zeiss, Axioskop 40. Se seleccionaron células dispersas con cromosomas separados y se capturaron independientemente con una cámara AxioCam HRm y software Axiovision 4.0, realizando las mediciones con el programa ImageTool 3.0.
De cada especie se determinó longitud de brazos y longitud total de cada cromosoma. Con estos datos se calculó longitud total del genoma, tamaño relativo (L%) y relación de brazos (r, ó I/C) de cada cromosoma. Se elaboró el idiograma para cada especie con base al sistema descrito por García (2001).
RESULTADOS Y DISCUSIÓN
Las cuatro especies de Anastrepha en este estudio exhibieron polimorfismo cromosómico en autosomas y heterocromosomas en número y tamaño, así como en el número de brazos mayores o nombre fondamental (n.f.), concepto referido por Jones (1976) al número de brazos mayores: un cromosoma metacéntrico o submetacéntrico se considera que es n.f. = 2 y un cromosoma acrocéntrico o telocéntrico n.f.=1.
La numeración a los pares cromosómicos se estableció asignándo el par I a los cromosomas sexuales (Zacharopoulou, 1986).
Anastrepha ludens
Los cromosomas somáticos son pequeños con ligeras diferencias entre machos y hembras. El cromosoma X es mayor que el Y, los autosomas presentan un orden decreciente (Figura 5): II es el más grande (8.38 μm) y el par VI el más pequeño (4.32 μm) (Cuadro 1). El heterocromosoma Y en A. ludens es junto con el Y de A. striata el cromosoma más pequeño (1.26 μm y 0.93 μm) (Figura 5; Cuadro 1). Estas dimensiones concuerdan con lo observado por García y Bárcenas (1983).
La longitud del genomio de esta especie es el segundo más grande de las cuatro especies estudiadas; menor que A. serpentina (38.0 μm, 48.0 μm).
Los seis pares de cromosomas son telocéntricos (2n=12). Bush (1962) y García y Bárcenas (1983) los describen como acrocéntricos; en este estudio no se observó el brazo corto. Los cromosomas sexuales (Figura 1) son altamente heterocromáticos y el X presenta un extremo obscuro; la separación de cromátidas hermanas es retrasada respecto a los otros cromosomas.
(Figura 2)
Anastrepha obliqua
El cariotipo de A. obliqua presenta dimensiones semejantes a A. ludens (Figura 5; Cuadro 1). El cromosoma X en ambas especies difiere en la presencia de un pequeño brazo corto y el cromosoma Y de A. obliqua es significativamente mayor (4.49 μm) que el de A. ludens (1.26 μm) y que A. striata (0.93 μm). Este heterocromosoma es el segundo más grande en las especies estudiadas; el más grande se observa en A. serpentina (8.23 μm). La hembra de esta especie tuvo el más corto genoma total en este estudio: 27.8 μm vs. 40.5 μm en A. serpentina.
Anastrepha striata
Esta especie presenta un número cromosómico de 2n=12. A diferencia de A. ludens y A. obliqua tiene un cariotipo asimétrico con los cromosomas II y III metacéntricos y el resto telocéntricos. La longitud del par autosómico III (Figura 5) es ligeramente menor que el de A. obliqua y A. ludens (4.98 μm vs. 5.79 μm y 6.45 μm) (Cuadro 1). El par III también se identifica por una constricción secundaria característica en uno de los brazos (Figura 3). El mecanismo de determinación sexual es el mismo de A. ludens y A. obliqua XY/XX, pero el cromosoma Y es tan pequeño como en A. ludens (Cuadro 1).
Anastrepha serpentina
Esta especie presenta el cromosoma Y de mayor tamaño (8.23 μm, Cuadro 1) de las especies de este estudio, e igual tendencia se observó en el X1 y X2 con respecto a los cromosomas X de A. ludens, A. obliqua y A. striata. Además los autosomas II, III, IV y V son metacéntricos, de acuerdo a la clasificación de Levan et al. (1964) y más grandes que en las otras especies estudiadas (Cuadro 1; Figura 5). Estos cinco autosomas metacéntricos influyen en aumentar la longitud total del genoma de esta especie. Las dimensiones de los genomas son 27.8 μm en hembras y 37.3 μm en machos en A. obliqua y las mayores son en A. serpentina (40.5 μm hembras y 48.2 μm machos), lo que constituye diferencias significativas entre estos genomas (Cuadro 1).
Los cromosomas X en hembras son dos de tamaño diferentes X1, X1 y X2, X2 y en los machos X1X2Y. Los cromosomas X1 y X2 son telocéntricos altamente heterocromáticos. Los X1 miden 5.44 μm, los X2 son ligeramente más grandes (6.16 μm; Figura 4). Otra característica que ayuda a diferenciar ambos pares de cromosomas es la presencia de un bloque heterocromático terminal en los X2, pero ausente en los X1 (Figura 4).
El cromosoma Y se reconoce porque es más largo en el genoma (8.23 μm; Cuadro 1) y presenta una constricción centromérica. La identificación de los cromosomas sexuales se basó en el apareamiento somático, o asociación secundaria.
Análisis comparativo de la evolución cariotípica en las cuatro especies de Anastrepha
Las especies A. ludens, A. striata, A. obliqua y A. serpentina tienen los números cromosómicos más frecuentes en el orden Díptera (Bush, 1962; White, 1969). A. ludens y A. obliqua pertenecen al grupo fraterculus y presentan características similares en su cariotipo. Ambas especies tienen un n.f. 12 en hembras y 14 en machos y cromosomas X/Y, aunque el Y de A. obliqua (4.49 μm) es mayor que el de A. ludens (1.26 μm).
Las otras dos especies estudiadas pertenecientes al grupo striata (A. striata) y al grupo serpentina (A. serpentina) presentaron un n.f. mayor: para la primera 16 y 19 y para la segunda; n.f. 20 en hembras y 22 en machos (Cuadro 1).
El número y tamaño de los heterocromosomas de A. serpentina y A. striata (Figura 5) presenta un cambio en estructura: los autosomas en A. ludens y A. obliqua son telocéntricos mientras que los cariotipos de A. serpentina y A. striata cuatro y dos son metacéntricos.
De tales cariotipos se puede considerar que en estas cuatro especies de Anastrepha han ocurrido fusiones–fisiones Robertsonianas que han ocasionado un rearreglo en el genoma de estas especies. Los centromeros no se originan de novo; por tanto, no es factible que A. ludens, A. obliqua o A. striata generaron el cariotipo de A. serpentina.
La evidencia que apoya esta hipótesis se encontró al comparar la longitud total del cromosoma Y de las cuatro especies: de grandes dimensiones en A. serpentina pero muy pequeño en A. ludens. En general la reducción de tamaño del cromosoma Y se ha identificado como su tendencia evolutiva (Rennie, 1993).Esta situación cromosómica sugiere que A. serpentina podría ser la forma ancestral. Hay más evidencia al usar sistemática molecular mediante el gen nuclear period, con base en el cual se construyó el árbol filogenético que presenta al grupo serpentina como ancestral al grupo fraterculus y striata (Barr et al., 2005). Con base a las longitudes totales del genoma se observa que A. serpentina presenta el parámetro de mayor magnitud respecto a las cuatro especies estudiadas, indicando que el proceso evolutivo en este género conlleva la pérdida de material genético (Cuadro 1).
Según Bush (1962), la presencia de un mecanismo X1X1X2X2y de determinación sexual de A. serpentina constituye un caso muy esporádico en Dipteros. Esta característica sólo la comparte con A. bistrigata (Solferini y Morgante, 1987). Dobzhanky (1970) indica que este cariotipo es un caso de no–disyunción. Sin embargo, no se conoce la meiosis en tales machos para detectar el comportamiento de supuestos trivalentes de X1YX2.
Desde el punto de vista evolutivo, al tener en A. serpentina un mayor número de brazos mayores (n.f.) que en las especies restantes puede suponerse que es la forma ancestral que mediante translocaciones Robersonianas dio lugar a los otros cariotipos.
CONCLUSIONES
Las cuatro especies de moscas de la fruta estudiadas (Anastrepha ludens, A. obliqua, A. striata y A. serpetina) y caracterizadas cromosómicamente presentaron sistemas Robertsonianos de fusiones–fisiones que tuvieron efecto en el número cromosómico (2n) y el nombre fondamental (n.f.) en autosomas y heterocromosomas. Se considera que A. serpentina dio lugar a los restantes cariotipos de Anastrepha: A. ludenss, A. obliquia y A. striata.
AGRADECIMIENTOS
Se agradece a La Campaña Nacional Moscas de la Fruta, DGSV SAGARPA–IICA, por haber permitido la realización de este trabajo en el Laboratorio de Sexado Genético, Metapa de Domínguez, Chiapas (México).
LITERATURA CITADA
Aluja, M. 1994. Bionomics and management of Anastrepha. Ann. Rev. Entomol. 39: 155–178. [ Links ]
Ashburner, M. 1989. Drosophila. A Laboratory Manual. Cold Spring Harbor Laboratory Press. USA. 433 p. [ Links ]
Barr, N. B., L. Cui, and B. A. McPheron. 2005. Molecular systematics of the nuclear gene period in genus Anastrepha (Tephritidae). Ann. Entomol. Soc. Am. 98(2): 173–180. [ Links ]
Bush, G. L. 1962. The cytotaxonomy of the larvae of some Mexican fruit flies in the genus Anastrepha (Tephritidae, Diptera). Psyche 69: 87–101. [ Links ]
Dobzhansky, T. 1970. Genetics of the Evolutionary Process. Columbia University Press, New York & London. 505 p. [ Links ]
García–Velazquez, A., y N. M. Bárcenas O. 1983. Cariotipo y mecanismos de determinación sexual en Anastrepha ludens (Loew) (Diptera: Tephritidae). Agrociencia 52: 95–100. [ Links ]
García–Velazquez, A. 2001. Two desynaptic mutants of Rhoeo spathacea (Commelinaceae). Citologia 66: 269–274. [ Links ]
Gutiérrez R., J. M. 2005. Campaña Mexicana Contra Moscas de la Fruta: Situación Actual y Perspectivas. In: Memoria del XVI Curso Internacional Sobre Moscas de la Fruta. 26 Septiembre–14 Octubre. Metapa de Domínguez, Chiapas, México. pp: 7–10. [ Links ]
Hernández–Ortiz, V. 1992. El género Anastrepha Schiner en México. (Díptera: Tephritidae). Taxonomía, distribución y sus plantas huéspedes. Instituto de Ecología Publicación No. 33 Xalapa Veracruz. 162 p. [ Links ]
Jones,K. 1976. Multiple Robertsonian fusions in the evolution of plant genes. In: K. Jones, and P. E. Brandham (eds). Current Chromosome Research. Elsevier/North Holland Amsterdam. pp: 220–221. [ Links ]
Levan, A., K. Fredga, and A. A. Sandberg. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52: 201–220. [ Links ]
Norrbom, A. L., R. A. Zucchi, and V. Hernández–Ortiz. 1999. Phylogeny of the genera Anastrepha y Toxotrypana (Trypetinae: Toxotrypanini) based on morphology. In: Aluja M., y A. L. Norrbom (eds). Fruit flies (Tephritidae) Phylogeny and Evolution of Behavior. CRC Press. USA. pp: 299–342. [ Links ]
Rennie J. 1993. How many genes and Y. Gene mappers find plenty, even in "junk" chromosomes. Sci Am. 268(1): 16–7, 20. [ Links ]
Selivon, D. A., L. P. Perondini, and L. S. Rocha. 2005. Karyotype characterization of Anastrepha fruit flies (Diptera, Tephritidae). Neotropical Entomol. 34(2): 273–279. [ Links ]
Solferini, V. N., and J. S. Morgante. 1987. Karyotype study of eight species of Anastrepha (Diptera:Tephritidae). Caryologia 40: 229–241. [ Links ]
White, M. J. D. 1969. Chromosomal rearrangement and speciation. Ann. Rev. Genet. 3: 75–98. [ Links ]
Zacharopoulou, A. 1986. Cytogenetic analysis of mitotic and salivary gland chromosomes in the medfly Ceratitis capitata. Genome 29: 67–71. [ Links ]














