Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.5 Texcoco jul./ago. 2010
Fitociencia
Manejo integrado de fertilizantes y abonos orgánicos en el cultivo de maíz
Integrated management of inorganic and organic fertilizers in maize cropping
J. David Ávarez–Solís1*, D. Aurora Gómez–Velasco2, N. Samuel León–Martínez1, F. Antonio Gutiérrez–Miceli2
1 Departamento de Agroecología. División de Sistemas de Producción Alternativos. El Colegio de la Frontera Sur (ECOSUR). Apartado Postal 63. San Cristóbal de Las Casas, Chiapas, México. * Autor responsable: (dalvarez@ecosur.mx).
2 Maestría en Ciencias en Ingeniería Bioquímica, Instituto Tecnológico de Tuxtla Gutiérrez, Tuxtla Gutiérrez, Chiapas, México.
Recibido: Marzo, 2009.
Aprobado: Agosto, 2009.
RESUMEN
El mantenimiento de la capacidad productiva del suelo requiere integrar prácticas de nutrición vegetal y de mejoramiento del suelo. Para ello es necesario aplicar prácticas agroecológicas y generar información de sus efectos en las características del suelo. El objetivo del presente trabajo fue evaluar el efecto del manejo integrado de fertilizantes y abonos orgánicos en la actividad de fosfatasas y ureasa, la colonización micorrízica nativa y el rendimiento de maíz (Zea mays L.). El experimento se realizó en condiciones de temporal en Teopisca, estado de Chiapas. El diseño experimental fue de bloques completos al azar con un arreglo factorial (2×4) de tratamientos: dosis de fertilización (60 – 30 y 120 – 60 de N –P), y abonos orgánicos (sin abono o testigo, composta, bocashi y humus de lombriz; dosis, 6 t ha–1). En el crecimiento vegetativo la fosfatasa alcalina fue 74.5% más alta con humus de lombriz, mientras que la fosfatasa ácida fue 41.9% más alta con composta, ambas en relación al testigo. En la floración disminuyó 46.2% la actividad ureasa con la dosis alta de fertilización. El porcentaje de colonización micorrízica fue 1.3 veces más alto con bocashi que sin abono. El rendimiento de grano varió de 2152 a 3616 kg ha–1; el valor más bajo fue para la dosis baja de fertilización sin abono y el más alto para la dosis alta de fertilización con humus de lombriz. Con dosis baja de fertilización el rendimiento aumentó 3.8, 12.7 y 11.5% con composta, bocashi y humus de lombriz, mientras que con dosis alta de fertilización, el incremento fue 17.7, 21.9 y 30.5%. El análisis de los resultados sugiere la importancia del manejo integrado de fertilizantes y abonos orgánicos por su efecto positivo en la actividad enzimática, colonización micorrízica y rendimiento de maíz en temporal en el estado de Chiapas.
Palabras clave: Zea mays, composta, fosfatasa, maíz criollo, micorriza arbuscular, ureasa.
ABSTRACT
Maintenance of the soil's productive capacity requires integration of plant nutrition and soil improvement practices. It is thus necessary to apply agroecological practices and generate information about their effects on soil properties. The objective of this study was to evaluate the effect of integrated management of inorganic and organic fertilizers on phosphatase and urease activity, colonization of native mycorrhizal fungi and corn (Zea mays L.) yield. The experiment was conducted under rainfed conditions in Teopisca, state of Chiapas. The experimental design was complete randomized blocks with a factorial arrangement (2×4) of treatments: inorganic fertilizer levels (60–30 and 120–60 N–P) and organic fertilizer (none or control, compost, bokashi and worm humus; rate 6 t ha– 1). In vegetative growth, alkaline phosphatase was 74.5% higher with worm humus than the control without organic fertilizer, while acid phosphatase was 41.9% higher with compost than the control. During flowering, urease activity decreased 46.2% with the high dosage of fertilization. The percentage of mycorrhizal colonization was 1.3 times higher with bokashi than without organic fertilizer. Grain yield varied from 2152 to 3616 kg ha–1; the lowest value corresponded to the low dosage of inorganic fertilizer without organic fertilizer, while the highest values were obtained with the higher dosage of inorganic fertilizer with worm humus. With the low level of inorganic fertilizer, yield increased 3.8, 12.7 and 11.5% with compost, bokashi and worm humus, while with the high level, the increase was 17.7, 21.9 and 30.5%. The analysis of the results showing positive effects on enzymatic activity, mycorrhizal fungus colonization and corn yield suggest the importance of integrated management of inorganic and organic fertilizers in rainfed maize in the state of Chiapas.
Key words: Zea mays, compost, phosphatase, mycorrhizae, local race maize, urease.
INTRODUCCIÓN
El mantenimiento de la capacidad productiva del suelo requiere integrar prácticas de nutrición vegetal y de mejoramiento del suelo que permitan un manejo adecuado de los nutrimentos para evitar su carencia o pérdidas por lixiviación, y de la materia orgánica para potenciar la biodiversidad edáfica y optimar las variables edáficas ligadas a su conservación (Labrador, 1996). Para este fin se requiere aplicar prácticas agroecológicas, así como generar información de la evolución de las características del suelo en diferentes condiciones de manejo (Astier–Calderón et al., 2002; Bautista–Cruz et al., 2004).
Los abonos orgánicos aportan materia orgánica, nutrimentos y microorganismos, lo cual favorece la fertilidad del suelo y la nutrición de las plantas (Eghball et al., 2004); sin embargo, su capacidad como fuente de nutrimentos es baja, respecto a los fertilizantes. El contenido de N de las compostas es 1–3% y la tasa de mineralización del nitrógeno es cercana al 10% (Sikora y Enkiri, 2001), por lo cual sólo una fracción del N y otros nutrimentos está disponible el primer año después de su aplicación. Para satisfacer las necesidades nutricionales de cultivos como el maíz, se requieren altas cantidades de abonos (López–Martínez et al., 2001), lo que implica una elevada disponibilidad de residuos orgánicos para su elaboración y condiciones adecuadas para su almacenaje y aplicación. Un enfoque alterno es usar bajas cantidades de abonos orgánicos y complementar con fertilizantes inorgánicos.
La mineralización de la materia orgánica implica procesos metabólicos catalizados por enzimas. La actividad enzimática es un indicador de cambios tempranos en la calidad del suelo por sus relaciones con la microflora y la facilidad de su medición y su rápida respuesta a las prácticas de manejo agrícola (De la Paz–Jiménez et al., 2002). La ureasa y las fosfatasas han recibido más atención por sus implicaciones en los ciclos biogeoquímicos y de nutrición (Makoi y Ndakidemi, 2008). La ureasa cataliza la reacción de hidrólisis de los enlaces C–N de algunas amidas y de la urea en amonio y dióxido de carbono. Las fosfatasas catalizan la reacción de hidrólisis de los enlaces ésteres y anhídridos de fosfato. Estas enzimas tienen una función fundamental en el ciclo del P al liberar el ión ortofosfato de compuestos orgánicos e inorgánicos, el cual queda disponible para las plantas.
La micorriza arbuscular es un tipo de simbiosis mutualista que mejora la capacidad de las plantas para absorber agua y nutrimentos, debido a su mayor accesibilidad a recursos distantes del sistema radical (González–Chávez y Ferrera–Cerrato, 1994). El maíz es una planta micotrófica facultativa que responde a la presencia de hongos micorrízicos nativos en suelos con bajo o moderado nivel de fertilidad (Gavito y Varela, 1995; Gavito y Miller, 1998). La fertilización fosfatada disminuye la colonización y los beneficios que podría proveer al cultivo; por el contrario, los abonos orgánicos tienden a aumentar el potencial de inóculo micorrízico del suelo, la colonización y la absorción de nutrimentos (Gosling et al., 2006).
La aplicación de materia orgánica también aumenta la actividad de las fosfatasas al estimular de la biomasa microbiana y la secreción de las raíces (Deng y Tabatabai, 1997; Purakayastha et al., 2006). La fosfatasa ácida es influenciada por la fisiología de la planta y el suministro de P inorgánico: su actividad disminuye con la edad y aumenta cuando hay deficiencia de P (Cruz–Flores et al., 2005). Por el contrario, la actividad de ureasa muestra una respuesta variable a la aplicación de abonos orgánicos y hay una mayor actividad ureasa en suelos con composta que sin ella (Banik et al. 2006, Antonious 2003). Sin embargo, Serra–Wittling et al. (1995) y Crecchio et al. (2001) indican que no hay efecto de la composta en la ureasa, y García–Gil et al. (2000) señalan su inhibición debido a la continua aplicación de compostas elaboradas con desechos municipales. Además se ha observado una inhibición de la actividad ureasa en respuesta a una fertilización nitrogenada (Ajwa et al. 1999; Crecchio et al., 2001; Lalfakzuala et al., 2008). Así, con un manejo integrado de abonos orgánicos y fertilizantes inorgánicos, la actividad de estas enzimas y la colonización micorrízica podría ser reprimida por la presencia de N y P inorgánicos.
Por tanto, el objetivo del presente estudio fue evaluar el efecto de la aplicación de tres abonos orgánicos con dos niveles de fertilización inorgánica en la colonización micorrízica nativa y la actividad de ureasa, fosfatasa ácida y fosfatasa alcalina, así como en el rendimiento de grano del maíz.
MATERIALES Y MÉTODOS
El estudio se realizó durante el ciclo primavera–verano de 2006 en condiciones de temporal en el Centro Universitario de Investigación y Transferencia de Tecnología de la Universidad Autónoma de Chiapas ubicado en Teopisca, estado de Chiapas, a una altitud de 1 800 m. El clima es templado subhúmedo (C(w2) w) con temperatura media anual de 12 a 18 °C y precipitación media anual de 1100 a 1300 mm, con lluvias en verano y época seca de noviembre a mayo (Mera, 1989). El suelo es de textura arcillosa con pH de 5.3 (relación 1/2 en agua) y drenaje deficiente en la temporada lluviosa, con densidad aparente de 1.15 Mg m–3; 3.3% de materia orgánica (Walkley y Black); 0.18% de N total (micro–Kjeldahl); 2.6 mg kg–1 de P–Olsen; 0.30, 4.83 y 2.51 cmol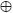 kg–1 de K, Ca y Mg intercambiables (espectrometría de absorción atómica); y 30.1 cmol
kg–1 de K, Ca y Mg intercambiables (espectrometría de absorción atómica); y 30.1 cmol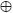 kg–1 de capacidad de intercambio catiónico (acetato de amonio 1N pH 7).
kg–1 de capacidad de intercambio catiónico (acetato de amonio 1N pH 7).
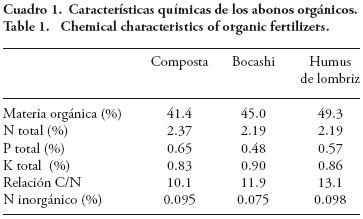
El diseño experimental fue bloques completos al azar con un arreglo factorial (2×4) de tratamientos (cuatro réplicas por tratamiento): dos dosis de fertilización inorgánica (60–30 y 120–60 de N – P), y 6 t ha–1 de cuatro abonos orgánicos (sin abono, composta, bocashi y humus de lombriz). La dosis de fertilizantes minerales se definió con base a la cantidad usada en la zona de estudio. La composta se elaboró con rastrojo y olote de maíz, estiércol de borrego, tierra de monte y ceniza de roble (proporciones aproximadas de 48, 32, 19 y 1% peso seco) y agua. El bocashi se elaboró con 400 kg de la mezcla de la composta más melaza (8 Lt) y levadura (500 g). El humus de lombriz con estiércol de borrego y la adición de lombrices rojas (Eisenia foetida). Para cada abono se determinó: materia orgánica, N, P y K totales y N inorgánico según la Norma Oficial Mexicana (NOM–021–RECNAT–2000). Los resultados del análisis se muestran en el Cuadro 1.
El tamaño de la unidad experimental fue 6 m por 12 m. En los tratamientos con abono la dosis fue 6 t ha– 1 (600 g mata–1) al fondo de la cepa en el surco de siembra. Como fuente de fósforo se usó superfosfato de calcio triple (SPT), y de nitrógeno la urea. El SPT se aplicó al momento de la siembra debajo de la semilla y la urea se incorporó al pie de la mata: la mitad 35 d después de la siembra (dds) y el resto a 90 dds. Para la siembra se depositaron tres semillas de maíz criollo (Zea mays L.) por mata, con distancia de 1 m entre matas y surcos (10 000 matas ha–1, la población normal del maíz criollo en la región).
En la fase temprana de crecimiento vegetativo (30 dds), floración (100 dds) y llenado del grano (150 dds), se recolectaron muestras compuestas de suelo rizosférico a una distancia de 5–10 cm del tallo de la planta y profundidad de 15 cm en cada unidad experimental. Las muestras fueron tamizadas (5 mm). La actividad de las fosfatasas se determinó según Tabatabai y Bremner (1969). Se incubó 1 g de suelo en una solución: 1 mL p–nitrofenil fosfato (p–NPP), 0.2 mL tolueno y 4 mL de amortiguador universal (pH 6.5 para fosfatasa ácida; pH 11 para fosfatasa alcalina), a 37 °C por 1 h. Luego se adicionó 1 mL de CaCl2 0.5 M y 4 mL de NaOH 0.5 M y se filtró con papel Whatman No. 2. La formación de p–nitrofenol (p–NP) se midió en un espectrofotómetro (Beckman Mod. 25–1331) a 420 nm, y su concentración se calculó con una curva patrón con 10, 20, 30, 40 y 50 µg de p–NP.
La actividad de ureasa se determinó como el NH4+ liberado en la reacción de hidrólisis (Tabatabai y Bremner, 1972). Se incubaron 5 g de suelo en una solución: 9 mL Tris (hidroxymetil) aminometano (THAM) 0.05M a pH 9, 0.2 mL tolueno y 1 mL de solución de urea 0.2 M como sustrato, por 2 h a 37 °C. El amonio liberado se determinó mediante la destilación de una alícuota de 20 mL por arrastre de vapor con 0.2 g de MgO calcinado a 700 °C como catalizador (Bremner, 1965).
Para determinar el porcentaje de colonización micorrízica nativa, se recolectó a los 100 dds las raíces de una mata de maíz en cada unidad experimental, las cuales fueron conservadas en FAA (formol–alcohol–ácido acético) hasta su utilización. Las raíces fueron aclaradas con KOH y H2O2, y teñidas con azul tripano en lactoglicerol (Phillips y Hayman, 1970). El registro de la frecuencia de segmentos de raíz con estructuras micorrízicas se realizó con un microscopio óptico compuesto (100x), de acuerdo con Giovannetti y Mosse (1980).
En la madurez fisiológica se cosecharon las mazorcas de maíz en la parte central de las unidades experimentales y se obtuvo el rendimiento de grano.
Los datos fueron analizados mediante análisis de varianza y prueba de separación de medias de Tukey (p<0.05), usando el programa SPSS 8.0 para Windows.
RESULTS Y DISCUSSION
Actividad de las fosfatasas
La actividad de las fosfatasas varió significativamente en los muestreos realizados durante el desarrollo del cultivo (Figura 1). La fosfatasa ácida y la alcalina fueron más activas en la fase inicial de crecimiento vegetativo (30 dds) que en la floración (100 dds) y llenado del grano (150 dds) Los valores medios de los tratamientos con fertilizantes y abonos fueron 285.0, 54.5 y 31.7 µg p–NP g–1 para fosfatasa ácida, y de 169, 35.7 y 12.2 µg p–NP g–1 para fosfatasa alcalina. Bolton et al. (1985) y Acosta–Martínez y Tabatabai (2000) señalan una disminución de la actividad de estas enzimas entre las fechas de muestreo, con valores más altos en la fase temprana del ciclo de crecimiento. La disminución de actividad de la fosfatasa a los 100 y 150 dds puede relacionarse con el desarrollo fisiológico de la planta y el aumento del suministro de P de las fuentes orgánicas e inorgánicas (Cruz–Flores et al., 2005), pero también con el exceso de humedad del suelo en la temporada lluviosa debido al drenaje deficiente. La comparación entre ambas enzimas mostró que la actividad fosfatasa ácida fue 1.7 veces más alta que la de fosfatasa alcalina, lo que coincide con Deng y Tabatabai (1997), quienes señalan que los suelos ácidos tienen valores más altos de fosfatasa ácida que de fosfatasa alcalina. En el presente estudio el pH del suelo fue 5.3.
Ambas enzimas mostraron una diferencia altamente significativa (p<0.01; Figura 1) entre abonos y para la interacción muestreo por abono; la fertilización no tuvo una influencia significativa. El efecto medio de abonos mostró que la fosfatasa alcalina presentó mayor actividad con humus de lombriz (92.1 µg p–NP g–1) que con composta y sin abono (66.1 y 66.4 µ g p–NP g–1), mientras que bocashi tuvo un lugar intermedio (71.2 µ g p–NP g–1). En contraste, la actividad de fosfatasa ácida fue más alta con composta (133.4 µ g p–NP g–1) que sin abono (101.4 µ g p–NP g–1), mientras que bocashi y humus de lombriz tuvieron un lugar intermedio (126.3 y 105.8 µg p–NP g–1). Sin embargo, sólo en el primer muestreo hubo diferencias significativas en la actividad enzimática: la fosfatasa alcalina fue 74.5% más alta con humus de lombriz que sin abono, mientras que composta y bocashi no difirieron del testigo sin abono. Además, la fosfatasa ácida fue 41.9% más alta con composta que sin abono, mientras que bocashi y humus de lombriz no difirieron del testigo (Figura 1).
El efecto del humus de lombriz en la fosfatasa alcalina y el de composta en la fosfatasa ácida, sugiere que la raíz y la microflora rizosférica responden diferencialmente en la síntesis y secreción de estas enzimas. Las raíces producen fosfatasa ácida pero carecen de actividad fosfatasa alcalina, ya que esta enzima se origina principalmente de bacterias, hongos y fauna del suelo (Tabatabai, 1982). Se ha mostrado que la aplicación de materia orgánica incrementa la actividad de fosfatasa alcalina debido a una estimulación de la actividad microbiana (Purakayastha et al., 2006), y por una mayor diversidad de bacterias (Sakurai et al., 2008). Además las lombrices proporcionan sustancias nutritivas (productos de secreción y excreción) que estimulan la actividad microbiana, junto con mediadores químicos liberados por las lombrices y que actúan a bajas concentraciones en el metabolismo microbiano (Bidet et al. 1998). Por tanto, es posible inferir que el humus de lombriz promovió la actividad de los microorganismos del suelo y que la composta estimuló la habilidad de las raíces, en ambos casos, para la síntesis y secreción de las enzimas.
Actividad de la ureasa
La actividad de ureasa no varió significativamente entre niveles de fertilización (p=0.06), ni entre abonos (p=0.13). Sin embargo, se encontró una diferencia significativa (p<0.05) entre muestreos, así como para las interacciones muestreo por fertilización, y muestreo por fertilización por abonos. La actividad de ureasa fue más baja en la fase de crecimiento vegetativo (24.8 µg NH4+ g–1) que en la floración (41.5 µg NH4+ g–1) y llenado del grano (42.6 µg NH4+ g–1). El efecto medio de niveles de fertilización entre muestreos mostró que en el segundo muestreo la actividad ureasa fue 46.2% más baja con dosis alta que con dosis baja de fertilización, mientras que en los otros muestreos no hubo diferencias significativas entre niveles de fertilización (Figura 2). La triple interacción se debió a que sólo en el segundo muestreo hubo diferencias significativas entre tratamientos, principalmente en aquellos sin abono, y con el valor más bajo para la dosis alta de fertilización (Figura 3).


La disminución de la actividad ureasa con la dosis alta de fertilización en el segundo muestreo pudo deberse a un efecto de la época y forma de aplicación del fertilizante nitrogenado. El segundo muestreo se realizó 10 d después de aplicar la segunda fertilización con urea al pie de la mata. La producción de ureasa es reprimida al adicionar NH4+ o NO3– debido a los productos formados por la asimilación microbiana (McCarty et al., 1992). Por tanto, es razonable considerar que la concentración de NH4+ en el tratamiento con dosis alta de fertilización sin abono causó una inhibición de la actividad ureasa, como fue observado por Ajwa et al. (1999), Crecchio et al. (2001) y Lalfakzuala et al. (2008).
Colonización micorrízica nativa
La colonización micorrízica presentó una variación de 29 a 43% entre tratamientos (Cuadro 2). Hubo diferencias significativas (p<0.05) entre abonos, pero no (p>0.30) entre niveles de fertilización, y un efecto marginalmente significativo (p=0.07) para la interacción entre ambos factores. Al promediar ambos niveles de fertilización, el porcentaje de colonización fue 20 y 30% más alto con bocashi que con humus de lombriz y sin abono, mientras que la composta tuvo un lugar intermedio.

No hubo un efecto significativo de la fertilización, pero la comparación de la colonización entre plantas sin y con abono mostró escasa variación (33 a 39%) con dosis baja de fertilización, mientras que con dosis alta de fertilización las plantas sin abono presentaron 29% de colonización y las tratadas con bocashi 43%. La fertilización fosfatada afecta la colonización de plantas micotróficas facultativas como el maíz porque pueden suprimir la formación de la micorriza con una alta disponibilidad de P en el suelo (Gavito y Varela, 1995; Gavito y Miller, 1998). Además, los abonos orgánicos estimulan el desarrollo de la micorriza arbuscular (Gosling et al., 2006).
Rendimiento de grano
El rendimiento de maíz varió de 2152 a 3616 kg de grano ha– 1 entre tratamientos; el valor más bajo fue para la dosis baja de fertilización sin abono, y el más alto para la dosis alta de fertilización con humus de lombriz. Hubo diferencias significativas (p<0.01) para los factores fertilización y abonos, pero la interacción entre los dos no fue significativa. El rendimiento fue 40.7% más alto con la dosis alta de fertilización que con la dosis baja. Al promediar ambos niveles de fertilización, el rendimiento fue 23.1 y 17.9% más alto con humus de lombriz y bocashi que sin abono, y la composta ocupó un lugar intermedio (Cuadro 3).
El efecto positivo de los abonos en el rendimiento de grano puede relacionarse con el suministro de N y P de los abonos (Cuadro 1), lo cual estimula la actividad fosfatasa ácida y alcalina del suelo (Figura 1) y la colonización micorrízica nativa (Cuadro 2). El aporte más importante de N y P de los abonos se da a través del tiempo por mineralización de las formas orgánicas, aspecto no evaluado, mientras que el K es rápidamente disponible. La respuesta a rendimiento por efecto de los abonos pudo deberse, en parte, al aporte de N y P por mineralización ya que al momento de la incorporación su disponibilidad es muy baja.
Cabe señalar que el incremento en rendimiento por efecto de los abonos fue mayor con dosis alta que con dosis baja de fertilización. Con dosis baja de fertilización el rendimiento fue 3.8, 12.7 y 13.6% más alto con composta, bocashi y humus de lombriz que sin abono, mientras que con dosis alta de fertilización el incremento fue 17.7, 21.9 y 30.5%. Ello representa un aumento máximo de 292 y 846 kg de grano ha– 1 con dosis baja y alta de fertilización. Es decir, indistintamente del tipo de abono la fertilización mejoró el rendimiento de grano del maíz, posiblemente debido a una estimulación de la mineralización de los abonos por la mayor disponibilidad de N y P para la biomasa microbiana, según lo observado con una mezcla de urea y composta en un suelo con bajo contenido de N inorgánico (Kyung–Hwa et al., 2004).
CONCLUSIONES
En la fase temprana de crecimiento vegetativo hubo una mayor actividad de la fosfatasa alcalina con humus de lombriz y de la fosfatasa ácida con composta, que sin abono; sin embargo, dicha actividad disminuyó en la floración y el llenado de grano. Por el contrario, la actividad de la ureasa fue mayor en la floración y el llenado de grano que en el crecimiento vegetativo, la cual disminuyó en la floración por efecto de la dosis alta de fertilización.
El rendimiento de grano varió de 2152 a 3616 kg ha– 1, con el valor más bajo para 60–30 de N–P sin abono y el más alto para 120–60 de N–P y humus de lombriz. Con dosis baja de fertilización el rendimiento incrementó 3.8, 12.7 y 11.5% con composta, bocashi y humus de lombriz, mientras que con dosis alta el aumento fue 17.7, 21.9 y 30.5%. El análisis de estos resultados sugiere la importancia del manejo integrado de fertilizantes y abonos orgánicos para mejorar la producción de maíz, asi como la necesidad de estudiar la dinámica de mineralización y aporte de nutrimentos durante el ciclo de crecimiento del cultivo.
AGRADECIMIENTOS
Los autores agradecen a la Universidad Autónoma de Chiapas las facilidades otorgadas para la realización del trabajo, al Fondo Mixto CONACYT–Gobierno del Estado de Chiapas por el apoyo financiero recibido (proyecto con clave: CHIS–2005–CO3–059); y al editor y revisores de Agrociencia las observaciones para el mejoramiento de este artículo.
LITERATURA CITADA
Acosta–Martínez, V., and M. A. Tabatabai. 2000. Enzyme activities in a limed agricultural soil. Biol. Fert. Soils 31:85–91. [ Links ]
Ajwa, H. A., C. J. Dell, and C. W. Rice. 1999. Changes in enzyme activities and microbial biomass of tallgrass prairie soil as related to burning and nitrogen fertilization. Soil Biol. Biochem. 31: 769–777. [ Links ]
Antonious, G. F. 2003. Impact of soil management and two botanical insecticides on urease and invertase activity. J. Environ. Sci. Health 38: 479–488. [ Links ]
Astier–Calderón, M., M. Maass–Moreno, y J. Etchevers–Barra. 2002. Derivación de indicadores de calidad de suelos en el contexto de la agricultura sustentable. Agrociencia 36: 605620. [ Links ]
Banik, P., P. K. Ghosal, T. K. Sasmal, S. Bhattacharya, B. K. Sarkar, and D. K. Bagchi. 2006. Effect of organic and inorganic nutrients for soil quality conservation and yield of rainfed low land rice in sub–tropical plateau region. J. Agron. Crop Sci. 192: 331–343. [ Links ]
Bautista–Cruz, A., J. Etchevers–Barra, F. del Castillo R., y C. Gutiérrez. 2004. La calidad del suelo y sus indicadores. Ecosistemas 2004/2 (URL: http://www.revistaecosistemas.net/articulo.asp?Id=149). (consulta 10/03/2009). [ Links ]
Bidet, F., L. Fayolle, and M. Pussard. 1998. Significance of earthworms in stimulating soil microbial activity. Biol. Fertility Soils 27: 79–84. [ Links ]
Bolton, H. Jr., L. T. Elliot, R. I. Papendick, and D. F. Bezdicek. 1985. Soil microbial biomass and selected soil enzyme activities: Effect of fertilization and cropping practices. Soil Biol. Biochem. 17: 297–302. [ Links ]
Bremner, J. M. 1965. Inorganic forms of nitrogen. In: Black, C. A. (ed). Methods of Soil Analysis. Am. Soc. Agron. Madison, Wis. pp: 1179–1237. [ Links ]
Crecchio, C., M. Curci, R. Mininni, P. Ricciuti, and P. Ruggiero. 2001. Short–term effects of municipal solid waste compost amendments on soil carbon and nitrogen content, some enzyme activities and genetic diversity. Biol. Fertility Soils 34:311–318. [ Links ]
Cruz–Flores, G., D. Flores–Román, G. Alcantar–González, y A. Trinidad–Santos. 2005. Fosfatasa ácida, nitrato reductasa, glutamina sintetasa y eficiencia de uso de fósforo y nitrógeno en cereales. Terra Latinoamericana 23: 457–468. [ Links ]
De la Paz–Jiménez, M., A. M. de la Horra, L. Pruzzo, and R. M. Palma. 2002. Soil quality: a new index based on microbiological and biochemical parameters. Biol. Fertility Soils 35:302–306. [ Links ]
Deng, S. P., and M. A. Tabatabai. 1997. Effect of tillage and residue management on enzyme activities in soils: III. Phosphatases and arylsulfatase. Biol. Fertility Soils 24:141–146. [ Links ]
Eghball, B., D. Ginting, and J. E. Gilley. 2004. Residual effects of manure and compost applications on corn production and soil properties. Agron. J. 96:442–447. [ Links ]
García–Gil, J. C., C. Plaza, P. Soler–Rovira, and A. Polo. 2000. Long–term effects of municipal solid waste compost application on soil enzyme activities and microbial biomass. Soil Biol. Biochem. 32: 1907–1913. [ Links ]
Gavito, E. M., and L. Varela. 1995. Response of "criollo" maize to single and mixed species inocula of arbuscular mycorrhizal fungi. Plant and Soil 176: 101–105. [ Links ]
Gavito, M. E., and M. H. Miller. 1998. Early phosphorus nutrition, mycorrhizae development, dry matter partitioning and yield of maize. Plant and Soil 199: 177–186. [ Links ]
Giovannetti, M., and B. Mosse. 1980. An evaluation of techniques for measuring vesicular–arbuscular mycorrhizal infection in roots. New Phytologist 84: 489–500. [ Links ]
González–Chávez, M. C., y R. Ferrera–Cerrato. 1994. Interacción de la micorriza VA y la fertilización fosfatada en diferentes portainjertos de cítricos. Terra Latinoamericana 12: 338–344. [ Links ]
Gosling, P., A. Hodge, G. Goodlass, and G. D. Bending. 2006. Arbuscular mycorrhizal fungi and organic farming. Agric. Ecosystems Environ. 113: 17–35. [ Links ]
Kyung–Hwa, H., C. Woo–Jung, H. Gwang–Hyun, Y. Seok–In, Y. Sun–Ho, and R. Hee–Myong. 2004. Urea–nitrogen transformation and compost–nitrogen mineralization in three different soils as affected by the interaction between both nitrogen inputs. Biol. Fertility Soils 39:193–199. [ Links ]
Labrador M., J. 1996. La Materia Orgánica en los Agrosistemas. Primera Edición. Ministerio de Agricultura, Pesca y Alimentación & Mundi–Prensa. Madrid. 193 p. [ Links ]
Lalfakzuala, R., H. Kayang, and M. S. Dkhar. 2008. The effects of fertilizers on soil microbial components and chemical properties under leguminous cultivation. American–Eurasian J. Agric. Environ. Sci. 3: 314–324. [ Links ]
López–Martínez, J. D., A. Díaz–Estrada, E. Martínez–Rubin, y R. D. Valdez–Cepeda. 2001. Abonos orgánicos y su efecto en propiedades físicas y químicas del suelo y rendimiento en maíz. Terra Latinoamericana. 19: 293–299. [ Links ]
Makoi, J., and P. A. Ndakidemi. 2008. Selected soil enzymes: examples of their potential roles in the ecosystem. Afr. J. Biotechnol. 7: 181–191. [ Links ]
McCarty, G. W., D. R. Shogren, and J. M. Bremner. 1992. Regulation of urease production in soil by microbial assimilation of nitrogen. Biol. Fertility Soils 12:261–264. [ Links ]
Mera O., L. M. 1989. Condiciones naturales para la producción. In: Parra–Vázquez, M. R. (ed). El Subdesarrollo Agrícola en los Altos de Chiapas. Centro de Investigaciones Ecológicas del Sureste; Universidad Autónoma Chapingo, Estado de México. pp: 21–49. [ Links ]
Norma Oficial Mexicana NOM–021–RECNAT–2000. Que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis. Diario Oficial de la Federación, Martes 31 de diciembre de 2002. [ Links ]
Phillips, J. M., and S. D. Hayman. 1970. Improved procedures for clearing roots and staining parasitic and vesicular–arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Brit. Mycol. Soc. 55: 158–161. [ Links ]
Purakayastha, T. J., S. Bhadraray, P. K. Chhonkar, and V. Verma. 2006. Microbial biomass phosphorus and alkaline phosphomonoesterase activity in the rhizosphere of different wheat cultivars as influenced by inorganic phosphorus and farmyard manure. Biol. Fertility Soils 43: 153–161. [ Links ]
Sakurai, M., J. Wasaki, Y. Tomizawa, T. Shinano, and M. Osaki. 2008. Analysis of bacterial communities on alkaline phosphatase genes in soil supplied with organic matter. Soil Sci. Plant Nutr. 54: 62–71. [ Links ]
Serra–Wittling, C., S. Houot, and E. Barriuso. 1995. Soil enzymatic response to addition of municipal solid–waste compost. Biol. Fertility Soils 20: 226–236. [ Links ]
Sikora, L. J., and N. K. Enkiri. 2001. Uptake of 15N fertilizer in compost–amended soils. Plant and Soil 235: 65–73. [ Links ]
Tabatabai, M. A. 1982. Soil enzymes. In: Page, A. L., R. H. Miller, and D. R. Keeney (eds). Methods of Soil Analysis. Part 2. Chemical and Microbiological Properties. Agronomy monograph No.9, 2da. Ed. ASA–SSSA, Madison, Wisconsin. pp: 903–947. [ Links ]
Tabatabai, M. A., and J. M. Bremner. 1969. Use of p–nitrophenyl phosphate for assay of soil phosphatase activity. Soil Biol. Biochem. 1: 301–307. [ Links ]
Tabatabai, M. A., and J. M. Bremner. 1972. Assay of urease activity in soils. Soil Biol. Biochem. 4: 479–487. [ Links ]














