Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.4 Texcoco may./jun. 2010
Protección vegetal
Análisis de virulencia de la roya amarilla (Puccinia striiformis f. sp. tritici) del trigo (Triticum aestivum L. ) en los Valles Vltos de México
Analysis of wheat (Triticum aestivum L.) yellow rust (Puccinia striiformis f. sp. tritici) virulence in the High Valleys of Mexico
M. Florencia Rodríguez–García1*, Julio Huerta–Espino1, Héctor E. Villaseñor–Mir1, José S. Sandoval Islas2 y Ravi P. Singh3
1 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. CEVAMEX. 56230. Chapingo Texcoco, Estado de México. *Autor responsable: (rodriguez.maria@inifap.gob.mx), E–mail: (huerta.julio@inifap.gob.mx), (hevimir@yaho.com.mx).
2 Fitopatología. Campus Montecillos. Colegio de Postgraduados. 56230. Montecillos Estado de México. (sandoval@colpos.mx).
3 Centro Internacional de Mejoramiento de Maíz y Trigo. 56130. El Batán Texcoco Estado de México. (rsingh@cgiar.org.)
Recibido: Marzo, 2009.
Aprobado: Diciembre, 2009.
RESUMEN
La roya amarilla (Puccinia striiformis f. sp. tritici) del trigo (Triticum aestivum L.) causa pérdidas importantes en rendimiento en los Valles Altos de México, debido a que el hongo puede evolucionar y vencer la resistencia de las nuevas variedades. Por tanto, se estudio la virulencia de este patógeno en los ciclos Primavera–Verano (P–V)/2005, 2006 y 2007 en los Valles Altos de México. Se recolectaron hojas y espigas infectadas con el hongo causante de la roya amarilla de zonas productoras de los estados de Tlaxcala, Hidalgo, Puebla y el Estado de México. Las muestras se procesaron en el Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT) ubicado en El Batán, Texcoco, Estado de México. Para identificar las razas fisiológicas se usaron 14 líneas isogénicas y 10 variedades. Los resultados permitieron identificar 39 razas; la más frecuente fue 219MEX0 (15.6%), identificada en el 2003 y caracterizada por vencer la resistencia del gen Yr1, seguida de 218MEX0 (6.4%) y la raza 91MEX0 (8.2%). Las razas 122MEX0, 377MEX0, 378MEX0, 506MEX0 y 507MEX0 se presentaron en el ciclo P–V/2005 y 2006, mientras que las razas 218MEX0, 219MEX0 y 251MEX0 se presentaron en los ciclos P–V/2006 y 2007. Se determinó que en los Valles Altos de México existe virulencia para los genes Yr1, 2, 3, 6, 7, 8, 9, 17, 27, Poll y YrA y avirulencia para Yr5, 10, 15, 24, 26 y YrSp. Las razas identificadas se caracterizaron también en los set de genotipos diferenciales europeos y mundiales, donde se encontraron las siguientes equivalencias: 730MEX0=6E0, 122MEX0=38E148, 219MEX0=135E6, 472MEX0=134E132, 346MEX0=134E2, 250MEX0=134E22, 216MEX0=134E134, 251MEX0=135E150, 89MEX0=199E0, 248MEX0=6E18, 88MEX0= 6E2, 218MEX0=6E6 y 478MEX0=70E0. Al usar las líneas diferenciales del set mundial se encontró que la equivalencia 134 con virulencia para los genes Yr7, 6, 9+ había sido registrada en Etiopía, Kenia, Siria y Yemen desde 1992. La identificación de razas fisiológicas y conocer la virulencia del patógeno es importante como una herramienta útil en el mejoramiento genético, al crear y liberar nuevas variedades con las combinaciones genéticas más efectivas para controlar la roya amarilla.
Palabras claves: P. striiformis f. sp. tritici, genes, variedades, raza fisiológica, trigo, Yr.
ABSTRACT
Wheat yellow rust (Puccinia striiformis f. sp. tritici) causes major losses in wheat (Triticum aestivum L.) yields in the High Valleys of México because the fungus can evolve and overcome the resistance bred into new varieties. Therefore, the virulence of this pathogen was studied in the High Valleys of México during the spring–summer crop cycles of 2005, 2006, and 2007. Leaves and spikes infected by the fungus causing wheat yellow rust were collected in the production zones of the states of Tlaxcala, Hidalgo, Puebla, and the Estado de México. Samples were processed in the Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT), located in El Batán, Texcoco, Estado de México. To identify the physiological races, 14 isogenic lines and 10 varieties were used. The results indicated the presence of 39 races; the most frequent was 219MEX0, (15.6%) previously identified in 2003, which overcame the resistance of Yr1 gene. Following in frequency were 218MEX0 (6.4%) and 91MEX0 (8.2%). Races 122MEX0, 377MEX0, 378MEX0, 506MEX0, and 507MEX0 were present in the 2005 and 2006 spring–summer cycle, while races 218MEX0, 219MEX0, and 251MEX0 were present in the 2006 and 2007 spring–summer cycles. It was determined that in the High Valleys of México there is virulence for the genes Yr1, 2, 3, 6, 7, 8, 9, 17, 27, Poll and YrA and avirulence for Yr5, 10, 15, 24, 26, and YrSp. The identified races were also characterized in the set of European and world differential genotypes, where the following equivalences were found: 730MEX0=70E0, 122MEX0=38E148, 219MEX0=135E6, 472MEX0=134E132, 346MEX0=134E2, 250MEX0=134E22, 216MEX==134E134, 251MEX0= 135E150, 89MEX0=199E0, 248MEX0=6E18, 88MEX0= 6E2, 218MEX0=6E6, and 478MEX0=70E0. When the differential lines of the world set were used, it was found that the equivalence 134 with virulence for the Yr7, 6, 9+ genes has been recorded in Ethiopia, Kenya, Syria and Yemen since 1992. The identification of physiological races and knowledge of the virulence of the pathogen is important as a useful tool in breeding and releasing new varieties with genetic combinations that are more effective in the control of yellow rust.
Key words: P. striiformis f. sp. tritici, genes, varieties, physiological race, wheat, Yr.
INTRODUCCIÓN
El trigo harinero (Triticum aestivum L.) es el cultivo con mayor superficie en el mundo y el volumen de su cosecha es mayor que el de cualquier otro alimento. En México, las principales zonas productoras de temporal están ubicadas en los Valles Altos de México que comprenden los estados de Tlaxcala, Hidalgo Puebla y Estado de México (Villaseñor, 2000). La producción de este cereal es afectada principalmente por enfermedades fungosas, donde destacan las causadas por el genero Puccinia. Line y Chen (1995) indican que la roya amarilla (Puccinia striiformis f. sp. tritici W.), de la hoja (Puccinia triticina E.) y del tallo (Puccinia graminis f. sp. tritici), son las enfermedades más destructivas del trigo y las que mas pérdidas han causado en el mundo (Zwer y Qualset, 1994; Singh et al., 2005). La roya de la hoja ha ocasionado los mayores daños en la producción de trigo en México; la epidemia en el noroeste durante el 2001, 2002 y 2003 en trigos duros, debido a la nueva raza BBG/BN, causó pérdidas de 32 millones de dólares para los agricultores mexicanos (Herrera–Fossel et al., 2005). La roya del tallo que era el factor limitante para la producción del trigo en México durante la década de 1940 se logró controlar con la liberación de la variedad Yaqui 50 en 1950 (Roelfs y MacVey, 1972), y desde entonces no han aparecido nuevos focos de infección. Sin embargo, existe una amenaza potencial de una raza identificada como Ug99 o TTKS en Uganda, que se ha dispersado en África y parte de Asia y que tiene virulencia para muchos genes de resistencia usados en la mayoría de los programas de mejoramiento de México y el mundo (Singh et al., 2006). Además, la roya amarilla puede llegar a ser tan importante como la de la hoja porque su prevalencia en zonas productoras ha aumentado (Huerta–Espino y Singh, 2000). Las tres especies del género Puccinia causantes de royas constantemente amenazan la producción de trigo en el mundo, dado que pueden vencer la resistencia específica de variedades nuevas por la evolución hacia nuevos biotipos del patógeno o razas fisiológicas con nuevos genes de virulencia. Además se reproducen rápidamente y pueden moverse a distancias muy grandes.
La raza 14E14 fue la más común en las zonas de trigo de temporal y el Bajío en México y se caracterizó por su virulencia para los genes Yr2, 3, 6, 7, Sk y A (Huerta–Espino y Singh, 2000). En las áreas de temporal en México eran importantes tres razas fisiológicas: una vence la resistencia de Temporalera M87, Gálvez M87 y Verano S91; la segunda vence la resistencia de Batán F96 y de variedades que posean el gen Yr9; y la tercera diferencia plantas resistentes y susceptibles en la variedad de triticale Secano TCL96 (Huerta–Espino y Singh, 2000).
En México, la siembra de variedades resistentes ha sido la forma más frecuente para controlar la roya amarilla. Hasta el verano del 2002, las variedades recomendadas por el Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP) para siembras de temporal, tenían resistencia a la enfermedad, a excepción de Temporalera M87, que era moderadamente susceptible (Villaseñor et al., 2007). En el verano del 2003 se observó una nueva raza identificada como MEX03.37 (219MEX0) caracterizada por infectar la espiga de diversas variedades que habían sido resistentes (Rodríguez et al., 2008a). En el verano del 2004 esta nueva raza venció la resistencia de las variedades Zacatecas VT74, Salamanca S75, Pavón F76, Saturno S86, Gálvez M87, Cortazar S94 y Batán F96, y provocó pérdidas de 75% en el rendimiento (Huerta–Espino, 20084). A causa de la problemática presentada por la roya amarilla en los ciclos de producción P–V/2004, 2005 y debido a la necesidad de controlar genéticamente esta enfermedad, el objetivo del presente estudio fue identificar las razas fisiológicas de P. stiiformis f. sp. tritici en las zonas productoras de trigo de temporal de los Valles Altos de México.
MATERIALES Y MÉTODOS
Recolección de muestras
Se recolectaron muestras de hojas y espigas con urediniosporas de roya amarilla en los Valles Altos de México. En el ciclo de cultivo P–V/2005 se recolectaron 13 muestras de los estados de Tlaxcala, Hidalgo, Puebla y Estado de México, durante el ciclo P–V/2006 se recolectaron 253 muestras en Tlaxcala y Estado de México y durante el ciclo P–V/2007 40 muestras fueron recolectadas en Tlaxcala y Estado de México.
Incremento, purificación del inóculo e inoculación
Las muestras se trasladaron al Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMYT) estación experimental El Batán, Estado de México (19° 31'N y 99° 53' O), para su conservación e incremento. Las urediniosporas de las muestras de hojas y espigas se recolectaron usando boquillas especiales conectadas a un compresor, y se almacenaron en cápsulas de gelatina conservadas a –55 °C. Las muestras de roya se incrementaron al inocular la variedad de trigo Morocco +Lr19 sembrada en vasos de unicel, un genotipo resistente a todas las razas de roya de la hoja en México, a excepción de CBJ/QQ) (Huerta– Espino y Singh, 1994), pero susceptible a todas las razas de roya amarilla en México. A los 5 d de sembradas todas las plántulas de Morocco+Lr19 se trataron con ácido maleíco (MH30*) para regular su crecimiento. Para usar aislamientos puros de cada recolección se hicieron inoculaciones artificiales en plántulas de Morocco +Lr19 de 8 d, suspendiendo las urediniosporas en aceite mineral (Sotrol* 170), asperjándose sobre las láminas de las hojas. Las plántulas inoculadas se secaron por 20 min y se pasaron a una cámara de rocío a 4–7 °C por 48 h; después se trasladaron a un invernadero (15–18 °C). Los aislamientos fueron mantenidos en cubículos individuales de plástico para evitar la contaminación entre ellos. A los 15 d después de la inoculación se recolectaron las urediniosporas de cada aislamiento, se almacenaron en cápsulas de gelatina y se conservaron entre 5 y 8 °C.
Siembra de diferenciales y toma de notas
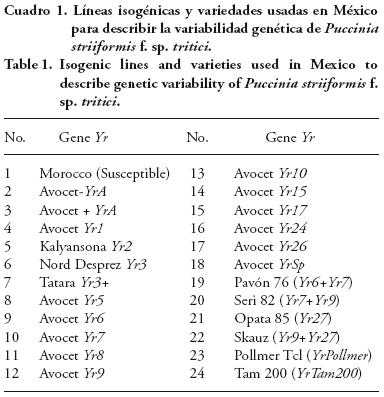
Para identificar las razas fisiológicas se usó un conjunto de 14 líneas isogénicas obtenidas de retrocruzas de trigo Avocet– YrA donde cada isolínea posee un gen de resistencia diferente, y 10 variedades que poseen algunos de ellos más de un gen de resistencia y se usan desde el 2002 (Cuadro 1). La siembra se realizó en charolas de 20 x 30 cm, donde se marcó con una plancha de acero orificios de 1 cm de diámetro por 2 de profundidad. La disposición fue de cuatro hileras y seis columnas y se sembraron seis a ocho semillas de izquierda a derecha. Las charolas se colocaron en un invernadero aislado de plantas infectadas con roya, hasta que la segunda hoja se extendió completamente. La inoculación de los grupos de diferenciales se realizó de la misma manera efectuada en los incrementos y purificaciones de los aislamientos. Entre 15–18 d después de la inoculación se registraron los tipos de infección que se desarrollaron en estado de plántula, para lo cual se usó la escala visual de 0–9 ) (Cuadro 2) propuesta por Roelfs et al. (1992).

Nomenclatura y designación de razas
Para la designación de razas fisiológicas de roya amarilla de trigo en México se usaba el número del aislamiento y el año en que fue identificada, además de la reacción de avirulencia/virulencia mostrada por los genes usados como diferenciales. Ahora se usa la nomenclatura propuesta por Rodríguez et al. (2008b) basada en la clasificación de los genes con base en la avirulencia/virulencia y utilizando la notación binaria. Los genes para los cuales existe virulencia en México con su valor binario son: Yr1(1), Yr2(2), Yr3(4), Yr6(8), Yr7(16), Yr8(32), Yr9(64), Yr17(128) Yr27(256), YrPoll(512) y Yr3+(1024); los genes para los que no existe virulencia son: Yr5(1), Yr10(2), Yr15(4), Yr24(8), Yr26(16) y YrSp(32).
También se usa un grupo suplementario de variedades para corroborar la virulencia de algunos genes, pero a éstos ya no se les da valor. Este grupo incluye: Morocco, AOC–YRA, AOC+YRA, Pavón (Yr6, 7), Seri (Yr2, 9), Skauz (Yr9, 27) y Tam 200(YrTam200). De las razas identificadas, aquéllas detectadas con mayor frecuencia se probaron en el set de diferenciales mundiales y europeos, para comparar la virulencia que existe en la población de P. striiformis f. sp. tritici en los Valles Altos de México con la identificada en otros países.
RESULTADOS Y DISCUSIÓN
En el ciclo P–V/2005, se identificaron ocho razas fisiológicas, en el ciclo P–V/2006 35 y en P–V/2007 cinco como se muestra en el Cuadro 6.
En el Cuadro 3 se presentan las razas y frecuencia con que fueron encontradas en el Estado de México durante los tres ciclos estudiados. La raza con su fórmula avirulencia/virulencia más frecuente en el Estado de México (en seis de las diez localidades muestreadas) fue la 219MEX0 (Yr3, Tat, 8, 27, Poll/ Yr1, 2, 6, 7, 9, 17, A ) con 21%, aunque sólo se presentó en los ciclos 2006 y 2007, siendo más frecuente en el 2007. La segunda raza más frecuente fue la 91MEX0 (Yr3, Tat, 8, 17, 27, Poll/ Yr1, 2, 6, 7, 9, A) con 9%, y sólo se identificó en el ciclo P–V/2006 en Amecameca, Juchitepec y Coatepec. En el Estado de México se encontró mayor variabilidad en Juchitepec con 15 razas diferentes, seguida de Coatepec con 7 y Chapingo con 3; en las otras siete localidades sólo se identificaron dos o una raza. Esto posiblemente se debió a que en Coatepec y Juchitepec se estableció un vivero trampa y se logró recolectar un mayor número de muestras que provenían de germoplasma con diferente base genética. De las cuatro razas detectadas previamente sólo se identificaron dos, la 219MEX0 caracterizada por su virulencia para el gen Yr1 y la 730MEX0 con virulencia para triticales.
En el Cuadro 4 se presenta la variabilidad de razas encontrada durante los ciclos P–V/2005, 2006 y 2007 en 16 localidades del estado de Tlaxcala, donde se identificaron 22 razas diferentes. Las razas 377MEX0, 378MEX0, 382MEX0, 506MEX0 y 1914MEX0 sólo se presentaron en el ciclo P–V/2005 en Tlaxco, Madero, Recova, Calpulalpan, Sanctorum y Cuamantzingo. En este estado la raza más frecuente fue la 219MEX0 con 18%, en los ciclos 2006 y 2007; la segunda más frecuente fue la 91MEX0 con 10% y con 8% la 218MEX0. Las localidades donde se observó mayor variabilidad fue Zotoluca y Soltepec con 14 razas y con seis la localidad de Nanacamilpa. De las razas previamente detectadas sólo se presentaron las razas 219MEX0 y 122MEX0, esta última caracterizada por su virulencia para el gen Yr8 en particular.
En el Cuadro 5 se indican las razas detectadas en dos localidades del estado de Hidalgo y una del estado de Puebla; la raza 122MEX0 fue la única observada en Singuilucan y Tehuacan, además se presentó en el estado de Tlaxcala (Soltepec y Santa Rosa; Cuadro 4). En las cuatro localidades se identificó en los ciclos P–V/2005 y 2006.
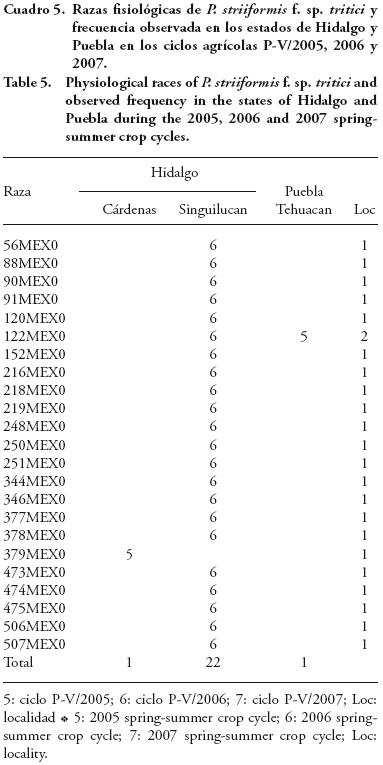
En Singuilucan se encontró mayor variabilidad (22 razas) de P. striiformis f. sp. tritici (Cuadro 5), seguida de Juchitepec, Estado de México, con 15 razas diferentes (Cuadro 3), y con 14 en las localidades de Zotoluca y Soltepec, Tlaxcala (Cuadro 4).
En el Cuadro 6 se presentan las 39 razas fisiológicas identificadas en los ciclos P–V/2005, 2006 y 2007 en los Valles Altos de México, así como su fórmula de avirulencia/virulencia y la frecuencia con que se encontraron en cada ciclo. La raza con mayor frecuencia (16%) fue la 219MEX0 (MEX03.37) identificada por primera vez en el 2003. No se identificó en el ciclo P–V/2005, pero en P–V/2006 y 2007 sí estuvo presente. La segunda más frecuente (8%) fue 91MEX0 que sólo se presentó en el ciclo 2006 y se diferencia de la anterior por su avirulencia para el gen Yr1 . La tercera raza más frecuente (6%) fue la 218MEX0, que sólo se presentó en el ciclo 2006. En el ciclo P–V/2005 se identificaron ocho razas, 35 en P–V/2006 y cinco en P–V/2007. En el ciclo P–V/2006 se encontró mayor variabilidad debido a que el número de localidades muestreadas fue mayor a causa de una alta incidencia de la enfermedad para ese ciclo, y en Singuilucan se encontró la mayor variabilidad. Las razas que se presentaron consecutivamente en los ciclos P–V/2005 y 2006, fueron: 122MEX0, 377MEX0, 378MEX0, 506MEX0 y 507MEX0; las razas 218MEX0, 219MEX0 y 251MEX0 se presentaron en los ciclos P–V/2006 y 2007 (Cuadro 6).
De las 39 razas fisiológicas identificadas, sólo 14 se analizaron por su alta frecuencia en el set de diferenciales mundiales y europeos para comparar su virulencia con la de otros países (Cuadro 7). La raza 14E14 por mucho tiempo fue la más común en zonas trigueras de temporal y el Bajío principalmente (Huerta–Espino y Singh, 2000). Esta raza analizada en el set de diferenciales de México es la 26MEX0 que aunque en la actualidad ya no ha sido detectada, tiene virulencia para los genes Yr2, 6, 7, Sk y A. De las razas detectadas en el 2002, la 730MEX0 se identificó en el Estado de México y se caracteriza principalmente por infectar a triticales y en el set mundial y europeo es la 6E0. La raza 122MEX0 identificada por primera vez en Cd. Obregón, Sonora, con virulencia para Yr2, 6, 7, 8, 9 y A, corresponde a la raza 38E148 en EE.UU. Otras razas muy similares, pero con virulencia para Yr8 y 9 principalmente, se identificaron en el 2000 en California (Chen, 2005).
Si se analizara la presencia de las razas encontradas en México y se compara con las encontradas en otros países, en Canadá se observa virulencia para Compair (Yr8 y Yr19) y Clement (Yr9 y YrCle) desde el 2000 (Su et al., 2003), y en Italia desde 1994 se encontró virulencia para Yr8, según Wang y Pasquíni (1999), lo que indica la llegada de la virulencia para este gen a México. En el 2003 se identificó la raza 219MEX0 en los Valles Altos, caracterizada principalmente por su virulencia para el gen Yr1 ; en el set de diferenciales mundiales y europeos corresponde a la raza 135E6. La virulencia de este gen en Italia fue observada desde 1994 (Wang y Pasquíni, 1999) y en EE.UU. desde el 2000 (Chen, 2005). Tomando en cuenta el set mundial, la raza identificada como 134 con virulencia para los genes Yr7, 6, 9+ fue registrada en Etiopía, Kenia, Siria y Yemen (Louwers et al., 1992).
CONCLUSIONES
Se identificaron 39 razas fisiológicas de roya amarilla de trigo en los Valles Altos de México en los ciclos de cultivo P–V/2005, 2006 y 2007.
De las cuatro razas identificadas antes del presente estudio, sólo se presentaron: 1) la 122MEX0 (MEX02.63), identificada en 2002, caracterizada por infectar al gen Yr8 y se presentó en los ciclos P–V/2005 y 2006; 2) la 219MEX0 (MEX03.37) detectada en el 2003, se caracterizó por infectar al gen Yr1 entre otros y se presentó en los ciclos P–V/2006 y 2007; 3) la 730MEX0 (MEX02.28), caracterizada por infectar a triticales principalmente e identificada en el 2002, se detectó sólo en el ciclo P–V/2007.
En los tres ciclos agrícolas estudiados se muestrearon 29 localidades de los estados de Tlaxcala, Hidalgo, Puebla y Estado de México y las razas más predominantes fueron 219MEX0, 91MEX0 y 218MEX0 en 17, 9 y 7 localidades. De las 29 localidades estudiadas, en Singuilucan (Hidalgo), Juchitepec (Estado de México); Zotoluca y Soltepec (Tlaxcala), se observó mayor variabilidad de P. striiformis f. sp tritici con 22, 15, 14 y 14 razas presentes en los tres ciclos estudiados.
La raza 219MEX0 es la más frecuente en los Valles Altos de México, infecta la espiga y causa pérdidas importantes en trigo de temporal. En los Valles Altos de México existe virulencia para los genes Yr1, 2, 3, 6, 7, 8, 9, 17, 27, Poll y A y avirulencia para los genes Yr5, 10, 15, 24, 26 y Sp. La siembra de variedades resistentes a las razas más agresivas es la manera más eficiente, económica y no contaminante de controlar la roya amarilla en los Valles Altos de México.
LITERATURA CITADA
Chen, X. M. 2005. Epidemiology and control of stripe rust (Puccinia striiformis f. sp. tritici) on wheat. Can. J. Plant Pathol. 27:314–37. [ Links ]
Herrera–Foessel, S. A., R. P., Singh, J., Huerta–Espino, J. Yuen, and A. Djurle. 2005. New genes for leaf rust resistance in CIMMYT durum wheats. Plant Dis. 89:809–814. [ Links ]
Huerta–Espino, J., and R. P. Singh. 1994. First report of virulence to wheat with leaf rust resistance gene Lr19 in Mexico. Plant Dis. 78(6): 640. [ Links ]
Huerta–Espino, J., y R. P. Singh. 2000. Las royas de trigo. In: Villaseñor M. H. E., y R. E. Espitia (eds). El Trigo de Temporal en México. Chapingo, Estado de México, México, SAGAR, INIFAP, CIRCE, CEVAMEX. Libro Técnico Núm. 1. pp: 231–249. [ Links ]
Line, R. F., and X. Chen 1995. Successes in breeding for and managing durable resistance to wheat rusts. Plant Dis. 79(12):1254–1255. [ Links ]
Louwers, J.M., C.H. V. Silfhout, and R.W. Stubbs, 1992. Race analysis of yellows rust in wheat in developing countries, Report 1990–1992,IPO–DLO report 92–11. 23 p. [ Links ]
Rodríguez G. M. F., J. Huerta E, y H. E. Villaseñor M. 2008a. Virulencia de Puccinia striiformis f. sp. tritici en los Valles Altos de México en 2005. In: XXIII Congreso Nacional y II Internacional de Fitogenética. Chapingo, México. pp: 217. [ Links ]
Rodríguez G. M. F., J. Huerta E., y H. E. Villaseñor M. 2008b. Nomenclatura de razas fisiológicas de Puccinia striiformis f. sp. tritici en México. In: XXIII Congreso Nacional y II Internacional de Fitogenética. Chapingo, México. pp: 87. [ Links ]
Roelfs, A. P., and D. V. McVey. 1972. Wheat stem rust races in the Yaqui Valley of Mexico during 1972. Plant Dis. Rep. 56:1038–1039. [ Links ]
Roelfs, A. P., R. P. Singh, y E. E. Saari.1992. Las royas del trigo: Conceptos y métodos para el manejo de esas enfermedades. México, D. F. CIMMYT. 81 p. [ Links ]
Singh, R. P., J. Huerta–Espino, and H. M. William. 2005. Genetics and breeding for durable resistance to leaf and stripe rusts in wheat. Turk J. Agric. For. 29: 121–127. [ Links ]
Singh, R. P., D. Hodson, J. Yuen, J. Huerta–Espino, M. G. Kinyua, R. Wanyera, P. Njau, and R. W. Ward. 2006. Current status, likely migration and strategies to mitigate the threat to wheat production from race Ug99 (TTKS) of stem rust pathogen. CAB Reviews: Perspectives in Agriculture, Veterinary Science, Nutrition and Natural Resources 2006 1, No. 054. [ Links ]
Su, H., R. L. Conner, R. J. Graf, and A. D. Kuzyk. 2003. Virulence of Puccinia striiformis f. s. titici, cause of stripe rust on wheat, in western Canada from 1984 to 2002. Can. J. Plant Pathol. 25:312–319. [ Links ]
Villaseñor, M. H. E. 2000. Importancia del trigo. In: Villaseñor, M. H. E., y R. E. Espitia (eds). El Trigo de Temporal en México. Chapingo, Estado de México, México, SAGAR, INIFAP, CIRCE, CEVAMEX. Libro Técnico Núm. 1. pp: 7–22. [ Links ]
Villaseñor M., H. E., J. Huerta E., A. María R., E. Espitia R., A. Limón O., y M. F. Rodríguez G. 2007. Variedades de trigo para siembras de temporal en el estado de Tlaxcala. INIFAP–CIRCE. S. E. Tlaxcala. Folleto Técnico Núm. 30. 33 p. [ Links ]
Wang, F., and M. Pasquini. 1999. Virulence of wheat stripe rust in Italy. Cereal Rusts and Powdery Mildews Bull. 27: 1–8. [ Links ]
Zwer, P. K., and C. O. Qualset. 1994. Genes for resistance to stripe rust in four spring wheat varieties. Euphytica 74:10–115. [ Links ]
4 Huerta–Espino, J. 2008. Comunicación personal. Investigador Fitopatólogo del INIFAP (huerta.julio@inifap.gob.mx).














