Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.44 n.3 Texcoco Apr./May. 2010
Protección vegetal
Caracterización espacial de la sigatoka amarilla del banano e implicaciones en el muestreo
Spatial characterization of banana yellow sigatoka and its implications for sampling
Otacílio M. da Rocha Júnior1 , Marcos P. Saraiva Câmara2 , Sami J. Michereff2 , Michelle J. de–Oliveira3, Gustavo Mora–Aguilera4* , Noe Ruiz–García5
1 Empresa Pernambucana de Pesquisa Agropecuaria (IPA). 55890–000. Alianca, PE, Brasil.
2 Departamento de Agronomía. Universidade Federal Rural de Pernambuco (UFRPE). 52171–900. Recife, PE, Brasil, Email: (sami@depa.ufrpe.br).
3 Ministerio da Agricultura, Pecuaria e Abastecimento (MAPA). 50630–060. Recife, PE, Brasil.
4 Fitopatología. Campus Montecillo. Colegio de Postgraduados. 56230. México. *Autor responsable: (morag@colpos.mx).
5 Instituto de Ecología, Campus Puerto Escondido, Universidad del Mar. Oaxaca, México.
Recibido: Noviembre, 2008.
Aprobado: Noviembre, 2009.
RESUMEN
La sigatoka amarilla, causada por el hongo Mycosphaerella musicola, es una enfermedad importante del banano (Musa spp.) diseminada ampliamente en Brasil. Este trabajo tuvo como objetivo aplicar criterios de dispersión espacial de la sigatoka amarilla en un sistema de muestreo para estimar la severidad de la enfermedad en el Valle del Siriji, al nordeste de Brasil. El patrón espacial de la enfermedad se caracterizó en tres plantaciones de banano cv. Pacovan, considerando 30 surcos contiguos y 30 plantas por surco, con un total de 900 plantas. La severidad se analizó mediante autocorrelación, índice de Lloyd y mapas interpolativos geoestadísticos. A pesar del reducido rango de severidad entre plantaciones (44.2–34.5 %), éstas presentaron un patrón de moderado a fuertemente agregado con dependencias espaciales continuas del orden 2, 14 y 27 implicando distancias de contagio de 81, 42 y 6 m. Los agregados tuvieron una predominancia alargada en dirección de los surcos con distancias de contagio lateral, en dos de las plantaciones, de 39 a 3 m. Las interpolaciones evidenciaron una generalización espacial de agregados, lo cual concordó con valores bajos del índice de Lloyd (1.01–1.04). Se diseñó un muestreo sistemático con intervalos de selección de surcos (k1) y plantas (k2) de 6 unidades para un total n = 50, con lo cual se exploró toda la unidad productiva pero se priorizó la selección intrasurco, por la propiedad agregativa. Este muestreo se aplicó en 30 i–plantaciones para estimar el tamaño de muestra mediante 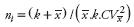 , donde k es un estimador de agregación de la distribución binomial negativa y CV el error aceptable. Con un 5 % de error, ni tuvo un rango de 111–6 plantas y fue inversamente proporcional al nivel de severidad. En un diagnóstico epidemiológico se propone un muestreo sistemático ( k1=6, k2 = 6) con un 5 % de error y n=34 plantas ha–1 lo que representa 3.8 % poblacional.
, donde k es un estimador de agregación de la distribución binomial negativa y CV el error aceptable. Con un 5 % de error, ni tuvo un rango de 111–6 plantas y fue inversamente proporcional al nivel de severidad. En un diagnóstico epidemiológico se propone un muestreo sistemático ( k1=6, k2 = 6) con un 5 % de error y n=34 plantas ha–1 lo que representa 3.8 % poblacional.
Palabras clave: Musa spp., Mycosphaerella musicola, epidemiología, fítopatometría, muestreo.
ABSTRACT
Yellow sigatoka, caused by the fungus Mycosphaerella musicola, is a major disease of banana (Musa spp.) and is widely spread in Brazil. This study was conducted to apply spatial dispersion criteria of yellow sigatoka in a sampling system to estimate the disease severity in the Valley of Siriji in northeastern Brazil. The disease spatial pattern was characterized in three fields of cv Pacovan bananas, where 30 contiguous rows, 30 plants per row were considered, giving a total of 900 plants. Severity was analyzed by autocorrelation, Lloyd index and geostatistical interpolative maps. In spite of the narrow range of severity among plantations (44.2–34.5 %), they exhibited a moderately to strongly aggregate pattern with continuous spatial dependencies of 2, 14, and 27 order, implicating contagious distances of 81, 42, and 6 m. The aggregates had an elongated predominance in direction of the rows with lateral contagious distances of 39 to 3 m in two of the fields. Interpolations evidenced spatial generalization of aggregates, concurring with the low values of the Lloyd index (1.01–1.04). Systematic sampling was designed with intervals of selection of rows (k1) and plants (k2) of 6 units for a total n = 50, with which the entire production unit was explored, but giving priority to intra–row selection by the aggregative property. This sampling method was applied in an additional 30 i–fields to estimate the sample size using 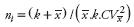 , where k is an estimator of aggregation of the negative binomial distribution and CV the acceptable error. With a 5 % error, ni had a range of 111–6 plants and was inversely proportional to the level of severity. In an epidemiological survey, systematic sampling (k1 =6, k2 = 6) is proposed with a 5 % error and n = 34 plants ha–1 , corresponding to 3.8 % of the population.
, where k is an estimator of aggregation of the negative binomial distribution and CV the acceptable error. With a 5 % error, ni had a range of 111–6 plants and was inversely proportional to the level of severity. In an epidemiological survey, systematic sampling (k1 =6, k2 = 6) is proposed with a 5 % error and n = 34 plants ha–1 , corresponding to 3.8 % of the population.
Key words: Musa spp., Mycosphaerella musicola, epidemiology, phytopathometry, sampling.
INTRODUCCIÓN
Brasil es el segundo mayor productor mundial de banano (Musa spp.), con una área cultivada de 499 230 ha y una producción de 7.1 millones t, siendo superado por la India (11.7 millones t, FAO, 2008). La producción promedio en Brasil 13.6 t ha–1, es menor con respecto a Costa Rica (53–9 t ha–1) y Ecuador (27.6 t ha–1) que son líderes en el mercado global.
La incidencia de enfermedades es la causa principal de la baja productividad del banano en Brasil. Entre éstas, la sigatoka amarilla, causada por el hongo Mycosphaerella musicola Leach (anamorfo Pseudocercospora musae (Zimm.) Deighton), se encuentra en todo el territorio nacional y con gran importancia en las regiones donde las lluvias exceden 1000 mm anuales y la temperatura media es 25 °C (Cordeiro et al., 2005). La infección de este hongo ocurre en las hojas jóvenes, incluyendo la hoja cero (hoja no desplegada), uno, dos, tres y excepcionalmente la cuatro (Stover, 1971). El síntoma inicial de la Sigatoka amarilla consiste en una decoloración leve en forma de punto entre las nervaduras foliares, la cual cambia a una lesión elongada necrótica con un amarillamiento marginal. En ataques severos puede ocurrir la coalescencia de lesiones y se afecta poco más de 50 % del área foliar, lo que causa la muerte prematura de las hojas. En Brasil, las pérdidas debido a la sigatoka amarilla son aproximadamente 50 % de la producción (Cordeiro et al., 2005).
A pesar de la importancia mundial de la enfermedad no hay propuestas de sistemas de muestreo con fundamento epidemiológico para su aplicación en programas de manejo sanitario, lo que dificulta la eficacia de métodos de control (Martínez y Toledo, 1977). La propuesta clásica de evaluar intensidad de enfermedad en 10 plantas/área (Stover, 1971; Martínez y Toledo, 1977; Pereira et al, 1981), tiene una base empírica que excluye atributos espaciales indispensables por el carácter dinámico de la enfermedad. Muestreos con un enfoque epidemiológico incluyen, en una primera etapa, la caracterización de atributos espaciales de la población para fundamentar patrones de muestreo, así como la selección de unidades de muestreo simples o compuestas de forma específica (Ruiz–García et al., 2005; Ruiz–García, 2008). Congruente con la importancia de considerar atributos biológicos, en un sistema de muestreo con fines fitosanitarios, el objetivo del presente estudio fue determinar el patrón espacial de la sigatoka amarilla en condiciones de campo y su implicación en la determinación del tamaño de muestra en condiciones contrastantes de intensidad de la enfermedad.
MATERIAL Y MÉTODOS
Análisis del patrón espacial de la sigatoka amarilla
El experimento se realizó en el 2006 en el Valle del Siriji, estado de Pernambuco, Brasil, en tres plantaciones de banano cultivar Pacovan (E–1, E–2 y E–3) distanciadas entre sí con un mínimo de 5 km. Las plantaciones carecieron de irrigación y fueron manejadas en un sistema de tres generaciones por sitio de plantación (planta madre, hijuelo–1 y hijuelo–2) y con una densidad de plantación de 3 X 3 m. El manejo cultural se efectuó con prácticas regionales, excepto el uso de funguicidas para permitir la máxima expresión de la enfermedad.
En cada plantación se delimitó una subparcela de 30 líneas contiguas y 30 plantas madre por línea; esto es 900 plantas madre con sus respectivos vástagos. La severidad de la sigatoka amarilla fue evaluada en la fase fenológica de fructificación, en las nueve hojas más jóvenes de cada planta madre, usando una escala diagramática de 0 a 6 clases (Orjeda, 1998). La severidad total por planta (STP) se calculó con la ecuación: STP = [ Σ (nb) / (NT)] , donde n = número de hojas por cada clase de la escala de severidad; b=clase de severidad conforme la escala; N=clase máxima de severidad de la escala; T= número total de hojas evaluadas (Orjeda, 1998).
Para examinar la intensidad y la forma de los agregados de plantas enfermas, se hizo un análisis autocorrelativo de los datos de STP con el programa LCOR2 (Gottwald et al, 1992). Para este fin, en cada parcela se generaron mapas bidimensionales de localización [xi, yj] de cada planta madre. La intensidad y forma promedio de los agregados estuvo definida por el número de dependencias espaciales continuas significativas (α = 0.05) dentro y entre surcos a partir de posición [0,0] de la matriz de autocorrelación. La capacidad de contagio de un foco (i.e. plantas enfermas conformando un agregado) en forma discreta se evaluó con las dependencias discontinuas significativas dentro y entre surcos. Además se calculó el índice de agregación de Lloyd (Campbell y Madden, 1990) con el programa MorLloyd ver 1.0 en Microsoft® Excel® (Rivas y Mora–Aguilera, 2008[6]) y se realizaron mapas de interpolación geoestadística mediante Surfer® ver. 6.04 con fines de exploración bi– y tridimensional.
Cálculo del tamaño de la muestra
De abril de 2006 a febrero de 2007 se realizaron muestreos piloto evaluando la severidad de la sigatoka amarilla en 30 plantaciones de banano (S–01 a S–30) cultivar Pacovan, en el Valle del Siriji. La distancia mínima entre plantaciones fue 3.5 km; y el manejo y densidad fue análogo a las plantaciones E1–E3. En cada parcela se delimitó una sub–parcela de aproximadamente 2 ha (100X200 m), conformada por N1=64 surcos y N2 = 32 plantas madre cada una. En esta población se seleccionó una muestra sistemática simple de 50 plantas madre, con n1 = 10 surcos y n2= 5 plantas madre por surco. Con un intervalo de muestreo de k1 = 64/10≈6 surcos y k2 = 32/5≈6 plantas, se seleccionó aleatoriamente el surco r1 = 5 y la planta madre r2 = 3 como primer punto de muestreo; los demás surcos se seleccionaron según r1 + (i— 1) k1 i=1,...,n1, y dentro de cada surco seleccionado a la planta madre ubicada en la posición r2 + (i— 1) k2 i=1,...,n2. El punto de inicio estuvo ubicado en la esquina superior izquierda, desde la cual se evaluó la severidad de las plantas ubicadas en las coordenadas proporcionadas por el esquema de muestreo sistemático. La severidad por hoja y la total por planta (STP) se calculó con el procedimiento ya descrito.
Los datos de severidad de la sigatoka amarilla obtenidos en los muestreos sistemáticos se usaron para estimar el tamaño de muestra (n) por parcela, considerando que el patrón espacial de plantas enfermas se definió como tipo agregado mediante el análisis autocorrelativo. Para este fin, la estimación de n se obtuvo mediante la ecuación:  , donde k es el parámetro asociado a la distribución binomial negativa, descriptiva de la disposición agregada de plantas enfermas, y puede ser estimado como:
, donde k es el parámetro asociado a la distribución binomial negativa, descriptiva de la disposición agregada de plantas enfermas, y puede ser estimado como:  , siendo
, siendo  la severidad media de la enfermedad en 50 plantas y S2 la varianza de la muestra, mientras que
la severidad media de la enfermedad en 50 plantas y S2 la varianza de la muestra, mientras que  es valor de confiabilidad (error aceptable) preestablecido a 3, 5 y 10 % (CV=0.03, 0.05, 0.10) (Karandinos, 1978; Campbell y Madden, 1990).
es valor de confiabilidad (error aceptable) preestablecido a 3, 5 y 10 % (CV=0.03, 0.05, 0.10) (Karandinos, 1978; Campbell y Madden, 1990).
El desempeño del esquema de muestreo sistemático anterior y el tamaño de muestra resultante se evaluó en los tres huertos censados (E1–E3) mediante simulación Montecarlo, en las cuales se conoce la severidad promedio ( ) y varianza y
) y varianza y  verdaderas.
verdaderas.
Los criterios de desempeño usados fueron: exactitud:  eficiencia:
eficiencia:  precisión: porcentaje de simulaciones comprendidos en un intervalo de 95 % para media verdadera, donde
precisión: porcentaje de simulaciones comprendidos en un intervalo de 95 % para media verdadera, donde  son el promedio de la severidad y su varianza obtenida de 200 simulaciones, programado en PROC IML (SAS, 2001). Para analizar el posible efecto en la estimación de n debido a la edad de la plantación y a la intensidad de severidad de la enfermedad por plantación, se realizó un análisis de correlación de Pearson.
son el promedio de la severidad y su varianza obtenida de 200 simulaciones, programado en PROC IML (SAS, 2001). Para analizar el posible efecto en la estimación de n debido a la edad de la plantación y a la intensidad de severidad de la enfermedad por plantación, se realizó un análisis de correlación de Pearson.
RESULTADOS Y DISCUSIÓN
Patrón espacial de la sigatoka amarilla
La severidad promedio de la sigatoka amarilla varió entre 34.5 % y 44.2 % en las plantaciones de banano establecidas para la caracterización espacial (Cuadro 1). Las tres áreas presentaron un patrón uniformemente agregado de plantas enfermas (Figura 1). Mediante autocorrelación, la mayor intensidad de agregación se encontró en E–1 seguido de E–2 y E–3 (Cuadro 1).

La forma de los agregados tuvo una clara predominancia alargada en sentido de los surcos (Figura 1). Las dependencias espaciales continuas en dirección a lo largo de los surcos fueron 27, 14 y 2 plantas, lo cual implica una capacidad de contagio del hongo, desde el centro de foco de la enfermedad, de 81, 42 y 6 m. La capacidad de expansión lateral de los focos desde el eje principal del agregado sólo se observó en E–1 y E–2. En estos casos, las dependencias continuas fueron 13 y 1, lo cual correspondió a 39 y 3 m (Cuadro 1). Las interpolaciones geoestadísticas evidenciaron una generalización espacial de agregados lo cual concordó con valores bajos del índice de Lloyd (1.01–1.04; Cuadro 1; Figura 1). El patrón de dispersión, en agregados con un amplio rango de dispersión del inoculo, es congruente con la biología de patógenos y sus mecanismos de diseminación aérea. En el presente caso existen dos tipos de esporas, la sexual (M. musicola) y asexual (P. musae), con similar importancia en el proceso de dispersión (Cordeiro et al., 2005). Sin embargo, el patrón predominante en dirección a los surcos sugiere la implicación de prácticas de manejo en el incremento de la diseminación del inoculo. Además, en este patosistema hay un proceso de autoinfección desde las hojas más viejas a las jóvenes, tanto dentro del dosel como entre la planta madre y los hijuelos a través del escurrimiento de agua de lluvia (Cordeiro et al., 2005).
El manejo intensivo y continuado del cultivo en el Valle del Siriji sugiere la presencia de una alta presión de inoculo primario en el cultivar Pacovan, considerado altamente susceptible, y la subsiguiente inducción de un mayor número de ciclos secundarios durante el desarrollo del cultivo. Este proceso explica la alta severidad promedio observada (39.2 %) en las hojas fotosintéticamente más activas al inicio de la fructificación, lo que además explica pérdidas de hasta 50 % (Cordeiro et al., 2005).
La contribución de inoculo externo en un proceso de aloinfección en la sigatoka amarilla no se detectó con las evaluaciones realizadas en la etapa de fructificación. La importancia e intensidad de este proceso no se excluye y requeriría estudios durante fases fenológicas previas como la de desarrollo foliar.
Tamaño de la muestra para la cuantificación de la sigatoka amarilla
El tamaño de muestra n necesario para determinar la severidad promedio de la sigatoka amarilla, con 3, 5 y 10 % de error, estuvo en intervalos de 308–16, 111–6 y 28–2 plantas ha–1 (Cuadro 2), valores que representaron 34.2–1.7 %, 12.3–0.6 % y 3.1–0.2 % de la población total. Las consideraciones fundamentales en estos resultados son: 1) el tamaño de muestra n se calculó considerando la condición agregada de las plantaciones E1–E3 y en este caso se incorporó a los cálculos del parámetro k de la función de distribución binomial negativa propuesto por Karandinos (1978), enfoque usado en varios patosistemas probando su viabilidad principalmente con condiciones de moderada a alta intensidad de enfermedad (Michereff et al., 1998; Tavares et al, 2000); 2) la selección de plantas para constituir una muestra piloto se realizó mediante un esquema sistemático de n–surcos y n–plantas; por tanto, la aplicación práctica de un tamaño de muestra n debe realizarse con el mismo criterio sistemático para reducir problemas de exactitud y precisión debido a la heterogeneidad espacial del atributo medible. A un mismo tamaño de muestra n, la selección de unidades de muestreo mediante diferentes esquemas sistemáticos o con un criterio aleatorio genera diferentes niveles de precisión (Hau et al, 1982; Ruiz–García, 2008). Sin embargo, debido a que n de la muestra piloto es generalmente distinto a n del tamaño calculado, para fines operativos es necesario modificar los intervalos de muestreo k1 y k2 para surco y planta. Una alternativa para evitar variaciones en el esquema de muestreo sistemático, incluyendo los intervalos de muestreo k1, es el uso de métodos simulativos con porcentajes de N prefijados. Este enfoque se ha probado para condiciones de baja prevalencia de enfermedad (Ruiz–García, 2008).
La variabilidad del tamaño de muestra n obtenida de las 30 plantaciones indica que depende de los atributos poblacionales específicos de un área, los cuales tienen una variación espacio–temporal. Así, la severidad de la sigatoka amarilla estuvo en un intervalo de 5.3 a 46.7 % (Cuadro 2), siendo más dependiente del estado fenológico, una condición temporal, que de la edad de la plantación (p = 0.05). La severidad promedio asociada con los estados fenológicos de floración y fructificación fue 27 % contrastando con el 14.2 % observado para el estado de desarrollo foliar. Esta tendencia de incremento de la severidad con el desarrollo del cultivo explica la correlación negativa entre esta variable y el tamaño de muestra (r = —0.60), debido a la reducción de la intensidad de agregación y en consecuencia de la varianza. Por tanto, a mayor severidad de sigatoka amarilla se requiere menor número de plantas para conformar una muestra con un valor análogo de precisión. Esto se ha mostrado para otros patosistemas (Jong, 1995; Michereff et al., 1998; Tavares et al., 2000).
Considerado lo anterior, para seleccionar un tamaño de muestra n–general con un nivel de error de 5 % para cuantificar la severidad de la sigatoka amarilla, primero se consideraron promedios de n por categoría fenológica de desarrollo foliar, floración y fructificación y los valores fueron 33, 34 y 33 plantas ha–1 . Estos valores promedio subestimaron ( n–promedio < n i, donde i=1 a 30 plantaciones) en 3/4, 2/6 y 7/20 casos. Mientras que subestimar ni puede incrementar el error, sobrestimar afecta el costo y eficiencia de muestreo; así, ambas condiciones no son deseables. La evaluación del esquema de muestreo sistemático y del tamaño de muestra promediado por evento fenológico (n = 33), mediante simulación Montecarlo con datos de las huertas E1–E3, mostraron un sesgo de —0.02 a 0.07 %, eficiencia de 0.95 a 1.04, y precisión de 42 a 63–5 %. Estos resultados indican que se podría calcular la severidad en campo con error de 5 % en 42 a 63–5 % de las veces debido a la gran variabilidad de la severidad de la enfermedad.
Un segundo criterio para generar una n–general fue usar la media de las ni y se tuvieron 92, 33 y 8 plantas ha–1 para 3, 5 y 10 % de error (Cuadro 2). Con este criterio se subestimó en 13/30, 13/30 y 11/30 casos, lo que implica un intervalo 43.3–36.6 % de riesgo de usar un n inferior al requerido para determinar adecuadamente la severidad de la enfermedad. Un tercer criterio (datos no mostrados) fue calcular un n general que considera categorías de severidad relativa; por ejemplo, <12 %, 12–25 % y >25 %, lo cual implica una inspección piloto en campo y requeriría experiencia en la evaluación de la enfermedad.
La definición del nivel de error y un tamaño de muestra general depende del propósito del muestreo. En estudios regionales epidemiológicos, niveles de 5 y 10 % son convencionales y un tamaño de muestra promedio de 33 u 8 plantas ha–1 sería aceptable. Para establecer programas de control químico se recomienda una precisión de 5 %. Este caso implicaría además considerar plantaciones con severidad reducida para operar efectivamente sobre la infección (p.e. 12 % o menor). Así, un tamaño de muestra promedio de 66 plantas ha–1 sería aceptable (Cuadro 2). Otras consideraciones pueden incluir manejo, variedad y condiciones climáticas, así como el propósito (Martínez y Toledo, 1977; Southwood, 1978; Perry 1994), para generar un sistema de muestreo con validez biológica.
CONCLUSIONES
La sigatoka amarilla (M. musicola) se presentó en banano cultivar Pacovan con una severidad promedio de 5.3 a 46.6 %, en el Valle del Siriji, Brasil. La enfermedad presentó un patrón agregado de plantas enfermas. La forma de los agregados fue alargada con dirección a los surcos; en esta dirección, la dependencia espacial continua fue hasta 81 m mientras que lateralmente fue hasta 39 m. La determinación del tamaño de muestra n incorporó el parámetro k de la función de distribución de la binomial negativa, con el fin de considerar la condición agregada y un muestreo sistemático en bandas para incorporar el efecto de direccionalidad del surco. El análisis de los resultados muestra que en condiciones de alta heterogeneidad espacial existe riesgo de subestimar la precisión con un tamaño de muestra n general. En un diagnóstico epidemiológico con 95 % de precisión se propone una muestra sistemática de n = 33 plantas ha–1 , lo que equivale aproximadamente a un intervalo de muestreo de 6x6 (k1, surcos X k2 plantas), que representa 3.8 % de la población.
LITERATURA CITADA
Campbell, C. L., and L. V. Madden. 1990. Introduction to Plant Disease Epidemiology. John Willey & Sons. New York. 532 p. [ Links ]
Cordeiro, Z. J. M., A. P. Matos, e H. Kimati. 2005. Doencas da bananeira (Musa spp.). In: Kimati, H., L. Amorim, A. Bergamin Filho, L. E. A. Camargo, e J. A. M. Rezende (eds). Manual de Fitopatología. Doencas das Plantas Cultivadas. Agronómica Ceres. 4 ed. Sao Paulo, Brasil, v. 2. pp: 99–117. [ Links ]
FAO. 2008. Crops & Livestock Primary & Processed. <http://www.fao.org.br>. May, 2008. [ Links ]
Gottwald, T. R., S. M. Richie, and C.L. Campbell. 1992. LCOR2 – Spatial correlation analysis software for the personal computer. Plant Dis. 76: 213–215. [ Links ]
Hau, F. C, C.L.Campbell, and M.K.Beute. 1982. Inoculum distribution and sampling methods for Cylindrodadium crotahtria in peanut field. Plant Dis. 66: 568–571. [ Links ]
Jong, P. D. 1995. Sampling for detection: leek rust as an example. International J. Pest Manage. 41: 31–35. [ Links ]
Karandinos, M. G. 1978. Optimum sample size and comments on some published formulae. Bull. Entomol. Soc. Am. 22: 417–421. [ Links ]
Martínez, J. A., e A. C. D. Toledo. 1977. Estudo do comportamento de produtos químicos no combate ao "Mal de sigatoka", com especial destaque à eficiência e fitotoxidez. In: Anais do Congresso Brasileiro de Fruticultura. Salvador, BA, Brasil, pp: 65–74. [ Links ]
Michereff, S. J., R. A. Pedrosa, M. A. Noronha, R. B. Martins, e F. V. Silva. 1998. Escala diagramática e tamanho de amostras para avaliação da severidade da mancha parda da mandioca (Cercosporidium henningsií). Agrotrópica 10: 143–148. [ Links ]
Orjeda, G. 1998. Evaluación de la Resistencia de los Bananos a las Enfermedades de Sigatoka y Marchitamiento por Fusarium. INIBAP, Montpellier, Francia. 63 p. [ Links ]
Pereira, L. V., E. J. Alves, and R. C. Caldas. 1981. Método de amostragem e avaliação de área foliar da bananeira afetada por Cercospora musae. Pesquisa Agropec. Br. 16: 665–667. [ Links ]
Perry, J. N. 1994. Sampling and applied statistics for pests and diseases. Aspects Appl. Biol. 37: 1–14. [ Links ]
Rossi, V., and P. Battilani. 1989. Assessment of intensity of Cercospora disease on sugarbeet.J. Phytopathol. 124: 67–70. [ Links ]
Ruiz–García, N., G. Mora–Aguilera, P. Rivas–Valencia, D. Ochoa–Martínez, C. Góngora–Canul, E. Loeza–Kuk, A. Gutiérrez–Espinosa, and R. Alvarez–Ramos. 2005. Probability model of Citrus tristeza virus detection in the tree canopy and reliability and efficiency o direct immunoprinting–ELISA. In: Proc. 16th Conf. IOCV. IOCV, Riverside, CA. pp: 196–204. [ Links ]
Ruiz–García, N. 2008. Detección, dispersión y muestreo en la erradicación del Citrus tristeza virus en plantaciones comerciales de cítricos. Tesis Doctoral. Colegio de Postgraduados. Montecillo, México. 104 p. [ Links ]
SAS Institute Inc. 2001. SAS/IML User's Guide. Version 8. SAS Institute Inc. Cary NC. 856 p. [ Links ]
Southwood, T. R. E. 1978. Ecological Methods. 2 ed. Chapman & Hall, London. 524 p. [ Links ]
Stover, R. H. 1971. A proposed international scale for estimating intensity of banana leaf spot (Mycosphaerella musicola Leach). Trap. Agrie. 48: 185–195. [ Links ]
Tavares, L. A., S. J. Michereff, R. M.Souza, e R. L. R. Mariano. 2000. Plano de amostragem para quantificação da murcha bacteriana do tomateiro no campo. Summa Phytopathol. 26: 306–310. [ Links ]














