Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.2 Texcoco feb./mar. 2010
Protección vegetal
Crecimiento poblacional de la cochinilla Dactylopius coccus Costa criada en cinco cultivares de nopal Opuntia ficus–indica Mill
Growth parameters of cochineal Dactylopius coccus Costa reared in five cactus pear cultivars Opuntia ficus–indica Mill
S. de Jesús Méndez–Gallegos1,* , L. Antonio Tarango–Arámbula1, Aurelio Carnero2, Riziero Tiberi3, Ovidio Díaz–Gómez4
1 Campus San Luis Potosí, Colegio de Postgraduados. 78600. San Luis Potosí. *Autor responsable: (jmendez@colpos.mx).
2 Sezione di Entomología, Dipartimento Biotecnología Agraria, Universitá degli Studi de Firenze. Piazzale delle Cascine 18. Firenze, Italia.
3 Departamento de Protección Vegetal. Instituto Canario de Investigaciones Agrarias. 38006, La Laguna, España.
4 Facultad de Agronomía, Universidad Autónoma de San Luis Potosí. Km 14.5 Carretera San Luis Potosí– Matehuala. Ejido Palma de la Cruz, Soledad de Graciano Sánchez, 78321. San Luis Potosí. México.
Recibido: Enero, 2009.
Aprobado: Noviembre, 2009.
Resumen
La cochinilla (Dactylopius coccus Costa) es considerada una de las principales fuentes de colorante natural en el mundo, por lo cual ha sido introducida a varios países para su explotación comercial. No obstante, se desconoce el comportamiento del insecto y la calidad del colorante obtenido en aquellos hospederos diferentes a los de su habitat natural, donde se desarrolla. Para clarificar lo anterior, se evaluó la supervivencia y reproducción de D. coccus y su calidad (porciento de ácido carmínico) en cinco cultivares de nopal (Blanco Moscatel, Colorado Moscatel, Offer, Portolano y Sicilia Bianca) de diferente origen geográfico. El estudio se realizó en cámaras de cría a 24 ±1 °C, 65 ±5 % HR y fotoperiodo de 14:10 (L:O) y se utilizó la técnica demográfica de tablas de vida y fecundidad, para obtener los parámetros que caracterizan la dinámica poblacional de D. coccus. Los cultivares de nopal suministrados como substrato alimenticio causaron un efecto diferencial sobre la supervivencia, reproducción y calidad de ácido carmínico. Los valores más altos de la tasa intrínseca de incremento (rm) fueron obtenidos en las cohortes desarrolladas en los cultivares Offer, Portolano y Sicilia Bianca con 0.025, 0.021 y 0.003 hembras d–1. Las poblaciones de D. coccus desarrolladas en los cultivares Colorado Moscatel y Blanco Moscatel no originaron descendencia. No obstante, en este último cultivar se obtuvo el porcentaje más alto de ácido carmínico (19.1 %). El estudio permitió diferenciar cultivares que pueden ser usados como substrato para la generación de pie de cría o bien en la producción de ácido carmínico o con ambos propósitos.
Palabras clave: ácido carmínico, cochinilla, reproducción, supervivencia, tablas de vida.
Abstract
Cochineal (Dactylopius coccus Costa) is considered one of the main sources of natural coloring worldwide; therefore, it has been introduced into several countries for commercial exploitation. Nevertheless, insect behavior and coloring quality obtained from hosts, other than those of the natural habitat where they develop, are not known. To clarify the aforesaid, survival and reproduction of D. coccus and their quality (percentage of carminic acid) in five cactus pear cultivars (Blanco Moscatel, Colorado Moscatel, Offer, Portolano, Sicilia Bianca) of different geographic origin, were assessed. The study was carried out in breeding chambers, at 24±1 °C, 65±5% HR, and photoperiod 14:10 (Darkness:Light), using the demographic technique of life and fertility tables for obtaining the parameters that characterize D. coccus population dynamics. Cactus pear cultivars provided as nutritional substrate caused differential effect on survival, reproduction, and carminic acid. The highest values of intrinsic rate of increase (rm) were achieved in the cohorts developed in the cultivars: Offer, Portolano, and Sicilia Bianca, with 0.025, 0.021, and 0.003 females d–1. The D. coccus populations reared in cultivars Colorado Moscatel and Blanco Moscatel did not have progeny. However, in the latter cultivar, the highest percentage of carminic acid was obtained (19.1 %). In this study, it was possible to differentiate cultivars which could be used as substrate for generating breeding stock or for carminic acid production, or serving both purposes.
Key words: carminic acid, cochineal, reproduction, survival, life tables.
INTRODUCCIÓN
La grana o cochinilla del nopal (Dactylopius coccus Costa) pertenece al orden Hemiptera, familia Dactylopiidae, que contiene nueve especies nativas de Norte y Sudamérica (Rodríguez et al, 2001). Los miembros de esta familia son importantes como fuente de colorante natural (Méndez et al., 2004) y como agentes de control biológico del nopal, considerado como una maleza invasora en Australia y Sudáfrica (Pérez–Guerra, 1991).
Dactylopius coccus tiene gran importancia social y económica debido a que del cuerpo seco de la hembra se obtiene el ácido carmínico (AC) (Méndez–Gallegos et al., 2003), que es una hidroxi antraqui–nona ligada a una unidad de glucosa, ampliamente usado como principio colorante en alimentos, bebidas, textiles y en la industria farmacéutica y cosmética (Baranyovits, 1978). El AC se considera inocuo (Sugimoto et al., 1998), tiene propiedades antivirales (Krabill et al., 1993), anticancerígenas (Tütem et al., 1996) y antibióticas (Allevi et al, 1998). La FDA, en los EE.UU. (US Government, Code of Federal Regulations 21) y el Consejo del Parlamento en la Unión Europea (EU, Community Directive 94/36/ EC) han autorizado el uso del AC como colorante natural (González et al., 2002). Considerando las políticas en materia de seguridad alimentaria y a las presiones de los consumidores por el uso de aditivos alimentarios inocuos en alimentos, productos farmacéuticos y cosméticos, los subproductos obtenidos a partir de D. coccus podrán incrementar su consumo (Méndez–Gallegos et al, 2003).
La grana se produce comercialmente en Bolivia, Chile, España, México y Perú (Gallegos–Vázquez y Méndez–Gallegos, 2000), siendo este último país el mayor productor y exportador. Debido a la creciente demanda de D. coccus como fuente de colorante natural se ha introducido a otros países (Campos–Figueroa y Llanderal–Cázares, 2003) que tienen condiciones agroecológicas aptas para la cría intensiva; pero no existe información, respecto a los hospederos potenciales que pueden ser usados como substrato en su producción. Al respecto se han probado diversos hospederos de nopal (Tovar et al, 2005), pero no se tiene información del rendimiento del insecto y la producción de AC. Por ello se debe efectuar un monitoreo detallado del comportamiento y la calidad del insecto en hospederos diferentes a los usados en su medio natural. El objetivo de este estudio fue determinar la influencia de cinco cultivares de nopal, Opuntia ficus–indica, en la supervivencia y reproducción de D. coccus, así como en la cantidad de AC en función del peso seco del insecto.
MATERIALES Y MÉTODOS
El estudio se desarrolló en condiciones de laboratorio, durante 2003 y 2004, en el Departamento de Protección Vegetal del Instituto Canario de Investigaciones Agrarias (ICIA) en La Laguna, España, localizado a 28° 17' N y 16° 50' O y a una altitud de 150 m.
Preparación de cladodios y obtención del pie de cría utilizados en el estudio
Se usaron cladodios de un año de edad de los cultivares de nopal (O. ficus–indica): Blanco Moscatel (Islas Canarias), Colorado Moscatel (Islas Canarias), Offer (Israel), Portulano (Italia) y Sicilia Bianca (Italia). Los cladodios seleccionados se cortaron y colocaron en cajas de madera (90x120x30 cm, ancho, largo y alto) que fueron introducidas en cámaras de cría a 24 ± 1 °C, HR de 65±5 % y un fotoperiodo 14:10 (L:0). La luz se proveyó por lámparas de sodio de alta presión de 45 W (F20 T12–PL; GRO and SHO P. L., General Electric).
Para el proceso de infestación se usaron contenedores de tul, con 1 g de hembras grávidas obtenidas de una colonia de insectos desarrollada previamente, para asegurar que las hembras tuvieran la misma edad (65 d). Los contenedores permanecieron adheridos por 48 h al cladodio, mediante un palillo de dientes y después se retiraron. En cada cultivar de nopal se usaron ocho repeticiones y se consideró como unidad experimental el cladodio.
Determinación de la supervivencia y reproducción de D. coccus
Para obtener las tablas de vida, cada tercer día se registró el número de insectos sobrevivientes por intervalo de edad en todas las cohortes, hasta que los insectos murieron. También se cuantificó la proporción hembras: machos al inicio del estado de pupa. Con esta información se estableció la duración del ciclo biológico.
Para determinar la tasa de reproducción, de aquellas hembras de D. coccus que alcanzaron el estado adulto en cada cohorte, al inicio de la reproducción se seleccionaron 15 hembras al azar y se aislaron en una caja petri. Los huevos y las ninfas recién nacidas se registraron y recolectaron diariamente, mañana y noche, hasta que la reproducción finalizó. Con esta información se obtuvieron las variables fecundidad total (huevos–hembra–1), fecundidad diaria (huevos –hembra–1 d–1) y duración del periodo reproductivo. El diseño experimental fue completamente al azar, considerando a las cohortes como tratamientos y las hembras individuales como repeticiones. Los datos se analizaron con el procedimiento AN OVA (SAS Institute, 1999) y las diferencias entre medias fueron determinadas mediante la prueba de Tukey (p<0.05).
Con los valores de supervivencia y reproducción de cada cohorte se obtuvieron la tasa de supervivencia (lx) y la tasa de fecundidad (mx), los cuales sirvieron para determinar: tasa neta de reproducción (Ro)=Σ lxmx, tasa intrínseca de incremento natural (rm) = ln (Ro)/T, tiempo de duplicación (TD) = ln 2/rm, tasa finita de incremento (λ) = erm, y tiempo medio de generación (G) = ln Ro/rm mediante las ecuaciones propuestas por Birch (1948) y Krebs (1985). Para determinar las diferencias entre las curvas de supervivencia de D. coccus se usó la prueba de log rank (α=0.01). Las diferencias entre la tasa intrínseca de incremento de cada cohorte se determinaron mediante la prueba de traslapo de intervalos (α=0.05) (Vera y Sotres, 1991) usando el software SUFERTI (Colunga y Vera, 1991).
Determinación del contenido de ácido carmínico en D. coccus
Para cuantificar la producción de AC se tomó una muestra de 125 mg de las hembras secas de cada población, se molió en un mortero y se agregaron 30 mL de acido clorhídrico 2 N y se homogenizó por 1 min. Las muestras se extrajeron en baño maría a 60 °C por 35 min, se enfriaron y centrifugaron 15 min a 7000 rpm (g=9329.6). Este proceso se repitió y los sobrenadantes se mezclaron y diluyeron en 250 mL de agua destilada. El AC se determinó a 494 nm en un espectrofotómetro Shimadzu (Modelo UV–160 A) en tres repeticiones para cada población. Se construyó una curva de calibración midiendo la absorbancia en una serie de concentraciones conocidas de AC y como blanco se usó una muestra de HCL 2N.
RESULTADOS Y DISCUSIÓN
Supervivencia y reproducción de D. coccus
La supervivencia de D. coccus varió en función del substrato suministrado. Las tablas de vida indicaron que la probabilidad de supervivencia (lx), desde la infestación hasta el proceso de muda al estado adulto (a los 42 y 45 d de desarrollo en el caso de las hembras y entre 40 y 48 d para los machos) fue más alta en aquellas cohortes desarrolladas en los cultivares Portolano (29 %), Offer (21 %) y Blanco Moscatel (18 %); es decir, de cada 100 individuos de la población inicial solo 29, 21 y 18 hembras, lograron llegar al estado adulto. En la Figura 1 se observa que los cultivares Sicilia Bianca y Colorado Moscatel presentaron el efecto contrario, ya que sólo 12 % y 11 % de la población, alcanzó el estado adulto.
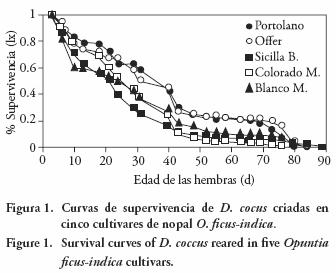
Los valores de supervivencia obtenidos en las cinco cohortes fueron bajos, comparados con Méndez–Gallegos et al. (1993) quienes registraron una supervivencia de 35 % usando como substrato nopal de castilla, considerado el hospedero natural de D. coccus, en México. Todas las curvas de supervivencia presentaron una tendencia exponencial negativa, tipo II, que indica un patrón de mortalidad constante independientemente de la edad.
Los cultivares de nopal suministrados como substrato alimenticio, influyeron sobre las valores de supervivencia de D. coccus. La prueba de log rank (X2= 6.635; g.l.= 1; α=0.01) detectó diferencias altamente significativas cuando se compararon las curvas de las cohortes obtenidas entre Portolano y Sicilia Bianca (61.80), y cuando se confrontó Portolano con Colorado Moscatel (87–78) y Portolano con Blanco Moscatel (23–32). Similar comportamiento se observó al comparar las curvas de las poblaciones entre Offer y Sicilia Bianca (93–02) y Offer contra Colorado Moscatel (134.99) y Offer con Blanco Moscatel (48.60).
Aunque las ninfas recién emergidas de D. coccus aceptaron los cultivares de nopal suministrados, en todos los substratos se presentó una mortalidad de 40 a 60 % durante los primeros 24 d de desarrollo. Esto fue más evidente en la cohorte Blanco Moscatel donde se registró una mortalidad cercana al 40 % durante los primeros 10 d del ciclo de desarrollo (Figura 1). La mortalidad de D. coccus tiende a disminuir conforme aumenta la edad de las poblaciones y cuando los individuos llegan a adultos la mortalidad es casi cero. En condiciones naturales D. coccus está sujeta a una elevada mortalidad debido a factores físicos y biológicos limitantes que influyen en la supervivencia y reproducción, entre ellos, la especificidad del insecto por un restringido número de especies y cultivares de nopal. El estado fisiológico y nutricional e incluso la edad de la penca limitan la producción de D. coccus (Campos–Figueroa y Llanderal–Cázares, 2003).
En todas las colonias el número de machos adultos fue al menos dos veces menor que el de las hembras, ya que la relación hembras:machos osciló de 2.4:1 a 4.2:1, por lo que la proporción sexual media obtenida fue 0.35– Pérez–Guerra (1991) consigna una relación de 0.5. a favor de las hembras. Con respecto a la fecundidad, cada hembra de D. coccus ovipositó en promedio 167–3 huevos durante el periodo reproductivo, con una duración media de 13 d; en promedio 12.4 individuos d–1 hembra–1 (Cuadro 1). Los cultivares de nopal usados causaron diferencias significativas en fecundidad total y fecundidad diaria de D.coccus, pero no en la duración del periodo reproductivo. Según Ramírez–Cruz et al. (2008), la fecundidad de D. coccus puede ser considerada como baja en función de las ovariolas presentes y en el número de huevos depositados. Al respecto, hay notables diferencias ya que Llanderal y Nieto (2001) determinaron que una hembra de D. coccus puede depositar en promedio 100 huevos, pero Mazzeo et al. (1998) y Pérez–Guerra (1991) registraron valores más altos (255 y 430 huevos hembra–1). En la presente investigación se constató que las hembras de D. coccus presentan de manera recurrente la reproducción ovovivípara, en la que los huevos eclosionan dentro del cuerpo de la madre y por tanto es posible observar a las ninfas neonatas salir del oviducto.
El análisis de los resultados indica la posibilidad de que los cultivares Blanco Moscatel y Colorado Moscatel cuenten con mecanismos de resistencia para el establecimiento de D. coccus, dado que las cohortes desarrolladas sobre estos dos hospederos mostraron altas tasas de mortalidad y no originaron descendencia.
Esto puede estar ligado a aspectos químicos (presencia de compuestos secundarios), fisiológicos (estatus hídrico y nutricional) y morfológicos (grosor de la cutícula, presencia de oxalatos de calcio), que no fueron considerados en este estudio.
Aunque la oviposición durante el periodo reproductivo presentó oscilaciones día a día, fue más frecuente durante la fase inicial de ese periodo, ya que más del 50 % de las crías fueron paridas durante los primeros 5 d (Figura 2). Cabe resaltar que las hembras desarrolladas en el cultivar Sicilia Bianca presentaron un segundo pico de oviposición entre los días 11 y 13. Lo anterior concuerda con lo observado por Ramírez–Cruz et al. (2008) quienes indican que D. coccus presenta ovariolas con diferentes grados de madurez lo cual ocasiona una oviposición continua durante algunos días, aunque éstas se encuentren separadas de la planta hospedara.

La tendencia observada en la fase reproductiva de D. coccus es que conforme avanza la fase reproductiva la oviposición tiende a declinar. El conocimiento preciso de la reproducción permite llevar a cabo la selección rigurosa del pie de cría y lograr una buena producción de D. coccus (Aldama–Aguilera y Llanderal–Cázares, 2003).
La prueba de traslapo de intervalos detectó diferencia estadística entre las tasas de incremento de las cohortes en estudio (Portolano vs Sicilia Bianca, y Offer vs Sicilia Bianca). El valor más alto de rm se registró en la cohorte desarrollada en el cultivar Offer (0,025 hembras d–1); teóricamente, el tamaño de esta población podría incrementarse 2.5 veces d–1 (Cuadro 2). Este valor fue bajo en comparación con el observado 0.055 hembras d–1 por Méndez–Gallegos et al. (1993).

En contraste el valor más bajo (rm=0.003) se obtuvo en la cohorte criada en el cultivar Sicilia Bianca. Los valores de R, y G indican que la población de D. coccus desarrollada en el cultivar Offer podría incrementarse 5–8 veces en 68 d.
Contenido de ácido carmínico en D. coccus
El contenido de AC osciló entre 15 y 19 % en función del peso seco del insecto (Figura 3). El valor más alto se obtuvo en la población desarrollada en el cultivar Blanco Moscatel (19–1 ±0.2); Pero esta población presentó los valores más bajos de supervivencia y no tuvo descendencia. La cohorte del cultivar Offer, con los valores de crecimiento poblacional más altos, produjo el menor porcentaje de AC (Figura 3).

Estos resultados confirman que los hospederos y su estado nutricional pueden influir en el contenido de AC como lo señalan Rodríguez et al. (2005). Aunque los contenidos en AC obtenidos en este estudio se ubican dentro del intervalo registrado por Barbera e Inglese (1997), Sugimoto et al. (1998) y Schul (2000); se debe considerar que a diferencia de otros estudios, en la presente investigación la cría del insecto fue en cladodios aislados sin suministro adicional de agua ni nutrimentos, lo cual pudo afectar la producción de AC.
A pesar de que las poblaciones desarrolladas en los cultivares Offer y Portolano obtuvieron valores bajos de AC, éstos pueden ser útiles para la producción de pie de cría. El cultivar Sicilia Bianca, obtuvo valores intermedios de supervivencia, fecundidad y un adecuado porcentaje de AC, resultados que lo colocan como un hospedero con características sobresalientes.
CONCLUSIONES
La supervivencia y fecundidad de D. coccus y producción de AC fueron afectadas por el tipo de substrato alimenticio.
En función de la supervivencia y fecundidad de D. coccus así como la producción de AC registrada, el estudio permitió diferenciar aquellos cultivares útiles en la generación de pie de cría, cultivares Portolano y Offer, para la producción de AC, cultivares Blanco y Colorado Moscatel y de ambos propósitos cultivar Sicilia Bianca.
Las tablas de vida y fecundidad representan una herramienta adecuada para identificar aquellos cultivares de nopal que pueden ser potencialmente útiles en la implementación de programas de cría intensiva del insecto.
AGRADECIMIENTOS
El primer autor expresa su agradecimiento al programa ANUIES–SEP–SUPERA, por la beca para realizar sus estudios doctorales. También agradece particularmente al Dr. Eladio González–Díaz por proporcionar el material vegetativo de su colección de nopal de la Estación Experimental Güimar–ICIA, Tenerife, España, para poder realizar esta investigación.
LITERATURA CITADA
Aldama–Aguilera, C. y C. Llanderal–Cázares. 2003. Grana cochinilla: comparación de métodos de producción en penca cortada. Agrociencia 37(1):11–19. [ Links ]
Allevi, P., M. Anastasia, S. Bingham, P. Ciuffreda, A. Fiecchi, G. Cighetti, M. Muir, and J. Tyman. 1998. Synthesis of carminie acid, the colourant principle of cochineal. J. Chem. Soc. Perkin Trans 1 (3):575–582. [ Links ]
Baranyovits, F. L. C. 1978. Cochineal carmine: an ancient dye with a modern role. Endeavour 2(2):85–92. [ Links ]
Barbera, G., and P. Inglese. 1997. The breeding of Dactylopius coccus (Costa) under controlled conditions in Sicily. In: Memorias del VII Congreso Nacional y V Internacional sobre el Conocimiento y Aprovechamiento del Nopal. Monterrey, N. L. México, pp: 186. [ Links ]
Birch, L. C. 1948. The intrinsic rate of natural increase on an insect population. J. Anim. Ecol. 17: 15–26. [ Links ]
Campos–Figueroa, M., y C. Llanderal–Cázares. 2003. Producción de grana–cochinilla Dactylopius coccus Costa (Homoptera: Dactylopiidae) en invernadero. Agrociencia 37(2): 149–155. [ Links ]
Colunga G., M., y J. Vera G. 1991. SUFERTI. Programa de computación para estimar y comparar algunas estadísticas demográficas en insectos. In: Resúmenes XXVI Congreso Nacional de Entomología. Sociedad Mexicana de Entomología. Oaxaca, México 1991. pp: 137–138. [ Links ]
Gallegos–Vázquez, O, y S. de J. Méndez–Gallegos. 2000. La tuna. Criterios y Técnicas para su Producción Comercial. Universidad Autónoma Chapingo – Colegio de Postgraduados–Fundación PRODUCE–Zacatecas A.C. Ed. México. pp:13. [ Links ]
González, M., J. Méndez, A. Carnero, M. G. Lobo, and A. Afonso. 2002. Optimizing conditions for the extraction of pigments in cochineals (Dactylopius coccus Costa) using response surface methodology. J. Agric. Food Chem. 50:6968–6974. [ Links ]
Krabill, K., J. M. Jamison, J. Gilloteaux, and J. L. Summers. 1993. Subcellular localization and antiviral activity of carminic acid/poly r (A–U) combinations. Cell Biol. Int. 17(10):919–933. [ Links ]
Krebs, C. J. 1985. Ecology. The Experimental Analysis of Distribution and Abundance. 3rd. Ed. Harper Int. New York. 754 p. [ Links ]
Llanderal C., C., y R. Nieto H. 2001. Características biológicas de la grana cochinilla del nopal Dactylopius coccus Costa. In: Producción de grana cochinilla. Llanderal C., C., y R. Nieto H. (eds) Colegio de Postgraduados. Texcoco, México, pp: 23–30. [ Links ]
Mazzeo, G., A. Russo, and P. Suma. 1998. Rilievi sulla biología della cocciniglia del carminio in ambienti protetto. In: Atti XVIII Congresso Nazionale Italiano di Entomología. Maratea 21–26 giugno 1998. Italia, pp: 137. [ Links ]
Méndez–Gallegos, S. de J., J. Vera–Graziano, H. Bravo–Mójica, y J. López–Collado. 1993. Tasas de supervivencia y reproducción de la grana–cochinilla Dactylopius coccus Costa (Homoptera: Dactylopiidae) a diferentes temperaturas. Agrociencia. Serie Protección Vegetal 4(1):7–22. [ Links ]
Méndez–Gallegos, S. de J., T Panzavolta, and R. Tiberi. 2003. Carmine cochineal Dactylopius coccus Costa (Rhynchota: Dactylopiidae): Significance, production and use. Adv. Hort. Sci. 17(3): 165–171. [ Links ]
Méndez, J., M. González, G. Lobo, and A. Carnero. 2004. Color quality of pigments in cochineals (Dactylopius coccus Costa), geographical origin characterization using multivariate statistical analysis. J. Agric. Food Chem. 52(5):1331–1337. [ Links ]
Pérez–Guerra, G. 1991. Biosystematics of the family Dactylopiidae (Homoptera: Coccinea) with emphasis on the life cycle of Dactylopius coccus Costa. Ph. Dissertation. Virginia Polytechnic Institute and State University. Blacksburg, Virginia. 168 p. [ Links ]
Ramírez–Cruz, A., C. Llanderal–Cázares, and R. Racotta. 2008. Ovariole structure of the cochineal scale insect, Dactylopius coccus. 5pp. J. Insect Sci. 8:20, available online: insectscience.org/8.20. [ Links ]
Rodríguez L. C, M. A. Méndez, and H. M. Niemeyer. 2001. Direction of dispersion of cochineal (Dactylopius coccus Costa) within Americas. Antiquity 75:73–77. [ Links ]
Rodriguez L. C, E. Faúndez, J. Seymour, C. Escobar, L. Espinoza, M. Petroutsa, A. Ayres, y H. N. Niemeyer. 2005. Factores bióticos y concentración del ácido carmínico en la cochinilla (Dactylopius coccus Costa) (Homoptera: Dactylopiidae). Agric. Téc. 65(3):323–329. [ Links ]
SAS Institute. 1999. SAS System for Windows. V. 8.0. SAS Institute Inc. Cary, NC. 27513. USA. [ Links ]
Schul, J. 2000. Carmine. In: Lauro G. J., and F. J. Francis (eds). Natural Foods Colorants: Science and Technology. Marcel Dekker. New York, pp: 1–10. [ Links ]
Sugimoto, N., Y. Goda, J. Suzuki, M. Kuroyanagi, T. Yamada, K. Yoshihira, and T. Maitani. 1998. Structures of minor pigments in cochineal dye. Natural Medicines 52(2):135–139. [ Links ]
Tovar, A., M. Pando–Moreno, and C. Garza. 2005. Evaluation of three varieties of Opuntia ficus–indica (L) Miller as hosts of the cochineal insect Dactylopius coccus Costa (Homoptera: Dactylopiidae) in a semiarid area of northeastern Mexico. Economic Bot. 59(l):3–7. [ Links ]
Tütem, E., R. Apak, and K. Sozgen. 1996. The interaction of antitumor–active anthraquinones with biologically important redox couples: I. Spectrophotometric investigation of the interaction of carminic acid and mitoxantrone with the iron (II, III) and copper (I, II) redox couples. J. Inorg. Biochem. 61(2):79–96. [ Links ]
Vera G., J., y D. Sotres R. 1991. Prueba de traslapo de intervalos para comparar tasas instantáneas de desarrollo poblacional. Agrociencia. Serie Protección Vegetal 2(2):7–13. [ Links ]














