Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.44 no.1 Texcoco ene./feb. 2010
Protección vegetal
Validación de dos compuestos feromonales para el monitoreo de la cochinilla rosada del hibisco en México
Validation of two pheromonal compounds for monitoring pink hibiscus mealybug in Mexico
Ernesto González–Gaona1, Guillermo Sánchez–Martínez1 *, Aijun Zhang2, Julio Lozano–Gutiérrez3, Felipe Carmona–Sosa3
1 Campo Experimental Pabellón, INIFAP. 20660. km 32.5 Carretera Aguascalientes–Zacatecas. Pabellón de Arteaga, Aguascalientes. *Autor responsable:(eggaona@yahoo.com.mx) (sanchezm.guillermo@inifap.gob.mx).
2 USDA. ARS Plant Science Institute. Chemicals Affecting Insect Behavior Laboratory. 10300. Beltesville, MD, USA.
3 Universidad Autónoma de Zacatecas. Unidad Académica de Agronomía. 98179. km 15.5 Carretera Zacatecas–Guadalajara, Zacatecas, México.
Recibido: Septiembre, 2008.
Aprobado: Julio, 2009.
Resumen
En 2004 se detectó una infestación de la cochinilla rosada del hibisco (Maconellicoccus hirsutus [Green]), en el Valle de Banderas, municipios de Bahía de Banderas, Nayarit y Puerto Vallarta, Jalisco, México, afectando árboles frutales, plantas nativas y ornamentales. Este insecto plaga es de origen asiático–australiano y tiene importancia económica en varios países. El método más utilizado para detectar a M. hirsutus en nuevas localidades consiste en la inspección ocular de las plantas; sin embargo, con este método la detección ocurre hasta que la infestación es muy evidente. Un método alternativo para esta tarea puede ser el uso de la feromona atrayente de machos de M. hirsutus, compuesta por esteres de lavandulil y maconellil. En el presente estudio se evaluó el efecto atrayente de la feromona de M. hirsutus en Valle de Banderas, en una plantación de teca (Tectona grandis L.), en un rodal natural de parota (Enterolobium cyclocarpum [Jacq.] Griseb.), en una huerta de mango (Mangifera indica L. cv Ataúlfo) y en una huerta de guanábana (Anona muricata L.). Además, la feromona se usó para determinar la dispersión geográfica de la plaga desde el lugar donde se detectó por primera vez. Se encontró que la mezcla de lavandulil y maconellil en proporción 1:5 atrajo significativamente a machos de M. hirsutus y resultó muy específica. Con el uso de esta feromona pudo mapearse la distribución de esta especie a una escala regional.
Palabras clave: Anona muricata, Enterolobium cyclocarpum, Maconellicoccus hirsutus, Mangifera indica, Tectona grandis, monitoreo de plagas exóticas.
Abstract
In 2004 an infestation of pink hibiscus mealybug (Maconellicoccus hirsutus [Green]) was detected in Valle de Banderas, Nayarit and Puerto Vallarta, Jalisco, Mexico, affecting fruit trees, native and ornamental plants. This insect pest is of Asian–Australian origin and has economic importance in several countries. The method most often used to detect M. hirsutus in new localities consists of the ocular inspection of the plants; however, with this method detection occurs when the infestation is very evident. An alternative method for this task can be the use of the male attracting pheromone of M. hirsutus, composed of esters of lavandulyl and maconellyl. In the present study an evaluation was made of the attraction effect of the pheromone of M. hirsutus in Valle de Banderas, in a teak (Tectona grandis L.) plantation, in a natural guanacaste stand (Enterolobium cyclocarpum [Jacq.] Griseb.), in a mango (Mangifera indica L. cv Ataulfo) and in a soursop orchard (Anona muricata L.). Furthermore, the pheromone was used to determine the geographic dispersal of the pest from the place where it was first detected. It was found that the mixture of lavandulyl and maconellyl in a 1:5 ratio significantly attracted males of M. hirsutus and was very specific. With the use of this pheromone it was possible to map the distribution of this species on a regional scale.
Key words: Anona muricata, Enterolobium cyclocarpum, Maconellicoccus hirsutus, Mangifera indica, Tectona grandis, monitoring of exotic pests.
INTRODUCCIÓN
La cochinilla rosada del hibisco (Maconellicoccus hirsutus [Green]), es un insecto plaga de origen asiático–australiano (Goolsby et al, 2002) que afecta a más de 200 géneros de plantas (Meyerdirk et al, 2003). A mediados de la década de 1990 invadió las islas del Caribe y entre 1999 a 2000 se detectó en Belice, México (Mexicali), EE.UU. (California y Florida) y Venezuela (Cermeli et al, 2002; Ojeda, 2004a).
Una nueva detección de M. hirsutus en México ocurrió en 2004 en el Valle de Banderas en los municipios de Bahía de Banderas, Nayarit y Puerto Vallarta (SAGARPA, 2004). Desde su detección en México se han establecido dispositivos nacionales de emergencia (Diario Oficial de la Federación, 2000, 2007) y particularmente en Valle de Banderas se implemento una campaña emergente de control que incluye el monitoreo y control cultural, físico, químico, biológico y legal (SAGARPA, 2004; Diario Oficial de la Federación, 2007).
El daño ocasionado por M. hirsutus consiste en la deformación de las hojas, yemas, brotes y frutos de las plantas infestadas. Mientras el insecto se alimenta, excreta una mielecilla sobre la que se desarrolla fumagina, deteriorando la calidad del producto agrícola o forestal. El insecto invade tallos, ramas, hojas, brotes, frutos y aún raíces. Si el hospedero atacado es débil puede marchitarse y llega a morir en casos de defoliación persistente (Ojeda, 2004a; APHIS, 1997).
El método más usado para determinar la presencia de M. hirsutus consiste en la inspección ocular y toma de muestras vegetales de los hospederos potenciales (Ojeda, 2004b; Meyerdirk et al, 2003) seguida por la determinación taxonómica de los individuos recolectados (Hodges, 2005; Hodges y Hodges, 2005). Sin embargo, con la inspección ocular la captura de los primeros especímenes ocurre cuando la presencia del insecto ya es muy evidente. Otro método consiste en utilizar trampas cebadas con hembras vírgenes que sirven como señuelos atrayentes de machos (Serrano et al, 2001; Meyerdirk et al, 2003), pero es impráctico por la dificultad de obtener este tipo de hembras, por su corto periodo de vida, por el riesgo de aumentar accidentalmente las poblaciones de la plaga y por no ser aplicable en zonas libres de la plaga colindantes con las zonas infestadas.
Zhang et al (2004a y b) identificaron, aislaron y sintetizaron la feromona sexual femenina de M. hirsutus que atrae a los machos de esta especie. Esta feromona tiene dos componentes (por sus nombres comunes): (R)–lavandulil (S)–2–metilbutanoato y (R)–maconellil (S)–2–metilbutanoato en proporción 1:5 (Zhang et al, 2004a; Zhang y Nie, 2005). Además de ser una feromona muy específica, las pruebas del dispositivo de liberación (septo gris de caucho) sugieren un efecto atrayente en campo hasta de aproximadamente seis meses en dosis de 1 µg por septo o hasta 12 meses en dosis de 10 µg por septo (Zhang y Amalin, 2005). Pero Francis et al. (2007) encontraron que en dosis de 1 µg por septo la cantidad de feromona disminuye conforme el señuelo se avejenta, manteniendo el mismo efecto atrayente sólo durante las primeras siete semanas. El objetivo del presente estudio fue evaluar el efecto atrayente de la feromona de M. hirsutus (Zhang et al., 2004a y b) en las condiciones locales de Valle de Banderas y probar su utilidad para monitorear la dispersión geográfica regional de este insecto.
MATERIALES Y MÉTODOS
Evaluación del efecto atrayente
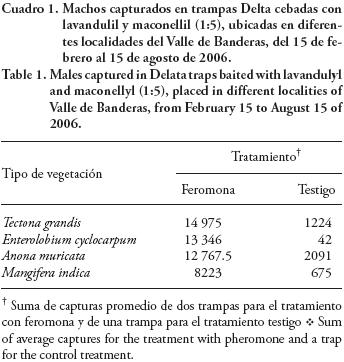
Se evaluó la efectividad de la feromona sexual de hembras de M. hirsutus, compuesta por (R)–lavandulil (S)–2–metilbutanoato y (R)–maconellil (S)–2–metilbutanoato en proporción 1:5, en la atracción de machos de esta especie, dentro de la zona afectada de Valle de Banderas. Se estableció un experimento con un diseño de parcelas apareadas con dos tratamientos (feromona y testigo) y cuatro repeticiones representadas por cuatro tipos de vegetación: 1) rodal de parota (Enterolobium cyclocarpum (Jacq.) Griseb.), conformado por árboles de 20 m de altura, con una infestación de M. hirsutus, sin manejo agronómico, ubicado a 20° 47' 14" N y 105° 12' 19" O; 2) huerto comercial de mango (Mangifera indica L. cv Ataulfo) sin infestación aparente de M. hirsutus, con manejo agronómico y control de plagas, localizado a 20° 46' 20" N y 105° 16' 06" O; 3) plantación comercial de teca (Tectonagrandis L.), con infestación de M. hirsutus y manejo integral por la Comisión Nacional Forestal (CONAFOR), ubicada a 20° 45' 52" N y 105° 16' 21" O; 4) huerto de guanábana (Anona muricata L.), con infestación de M. hirsutus, ubicada a 20° 46' 05" N y 105° 19' 20" O.
El 15 de febrero de 2006, en cada tipo de vegetación se instalaron tres trampas delta Biolure® de color rojizo, cuya base interior contiene pegamento. La distancia entre trampas fue variable pero siempre mayor a 20 m. En las dos trampas de los extremos se colocó un septo gris de caucho impregnada con la feromona (1µg), mientras que la trampa central sirvió como testigo sin la feromona. Los septos de caucho liberadoras de la feromona fueron preparadas en el Laboratorio de Químicos que Modifican el Comportamiento de Insectos (USDA–ARS–Plant Science Institute, Betesville, MD, USA).
Las trampas se colgaron de los árboles a una altura de 1.5 a 3.0 m, usando ganchos de alambre acerado, excepto en la plantación de teca donde se colgaron de un alambre acerado sostenido entre dos árboles. El periodo de captura de insectos fue del 15 de febrero al 15 de agosto de 2006. Las trampas fueron reemplazadas cada dos semanas y los septos con feromona se cambiaron cada dos meses, siendo cautelosos respecto a la duración del efecto atrayente señalada por Zhang y Amalin (2005) y Francis et al. (2007).
El conteo de los machos capturados en las trampas se realizó con un microscopio estereoscópico marca Motic® en el laboratorio de Entomología y Control Biológico de la Universidad Autónoma de Zacatecas. Para corroborar la taxonomía del insecto, de cada trampa se removió una muestra de 5 a 10 ejemplares mediante la adición de una gota de gasolina blanca seguida de un reposo de 5 min. Después los especímenes fueron sumergidos 24 h en una solución de KOH (1.0 g hojuelas en 100 mL agua) y se transfirieron a agua con safranina para su coloración y montaje en un portaobjetos con glicerina. Se usó un microscopio compuesto para su identificación, con base en las características morfológicas de la cápsula genital descritas por Hodges (2005).
El efecto de los tratamientos se determinó mediante una prueba de t apareada, utilizando como variable de respuesta la diferencia entre la suma del número de machos de M. hirsutus capturados en las trampas cebadas con feromona y la suma del número de machos de M. hirsutus capturados en las trampas testigo, en cada tipo de vegetación. Para el análisis estadístico se usó el programa JMP IN ver. 3.2.1 (SAS, 1996).
Determinación de la dispersión geográfica
En 2006 se establecieron cuatro rutas de muestreo para determinar la distribución geográfica de M. hirsutus: 1) Compostela–Puerto Vallarta; 2) Las Varas–San Blas–Santiago Ixcuintla; 3) Puerto Vallarta–El Tuito; 4) Puerto Vallarta–Las Palmas. Las rutas se determinaron usando como referencia el sistema carretero (Carreteras 80, 110, 200, 15, 3, 68, 28, y una sin número en el trayecto San Blas–Santiago Ixcuintla). Con el cartón encerado Tetrapack®, de envases de leche de 1 L, se fabricaron trampas tipo delta para capturar al insecto. En el interior de cada trampa se colocó una lámina del mismo material (14.5X8.7 cm) impregnada con una capa de Stickem® y se instaló un septo gris de caucho con la feromona de M. hirsutus, del mismo lote usado en la prueba de atracción. Las trampas se colgaron de árboles a los costados de las carreteras. La distancia entre trampas fue de 4 a 6 km. Las coordenadas geográficas de cada sitio se registraron con un GPS Magellan® Meridian Platinum® para facilitar la localización de las trampas al momento de la recolección y para incorporar la información en ambiente de Sistema de Información Geográfica, usando Arc GIS 9.0 (ESRI, 1999).
El tiempo de exposición de las trampas fue aproximadamente 48 h, basado en observaciones preliminares que indicaron que en sólo 24 h se obtenían capturas suficientes. Las rutas de muestreo se completaron en dos recorridos, uno en septiembre y otro en noviembre de 2006. Cuando se quitaron las trampas se removió la laminilla pegajosa y se envolvió con plástico adherible Bolsipack®. Los insectos se contaron en el Laboratorio de Entomología del Campo Experimental Pabellón, Aguascalientes, corroborando la identidad taxonómica mediante el procedimiento descrito por Hodges (2005).
En 2007 se realizó un monitoreo más intensivo de M. hirsutus en la zona de Valle de Banderas. Se usó como guía una rejilla con cuadrantes de 2.0 km2 , instalando una trampa cebada con la feromona dentro de cada cuadrante. Para conocer los límites de los cuadrantes en condiciones de campo y para localizar las trampas, se navegó con un GPS Magellan® Meridian Platinum®. Adicionalmente se establecieron dos rutas de muestreo de mayor cobertura geográfica, con base en denuncias de la presencia de M. hirsutus: 1) Tepic, Nayarit–Rosario, Sinaloa (denuncia en Acapo–neta, Nayarit); 2) Guadalajara–Cihuatlán–Tomatlán–Colima (denuncia en Cihuatlán), abarcando los estados de Jalisco y Colima. Las distancias entre trampas en estas rutas variaron entre 10 y 20 km y el tiempo de exposición de las trampas entre 24 a 36 h.
RESULTADOS Y DISCUSIÓN
Efecto atrayente de la feromona
La diferencia entre el número de machos de M. hirsutus capturados en las trampas cebadas con feromona fue significativamente superior en comparación con las capturas en las trampas testigo sin feromona (media de la diferencia = 11319, t = 7.92, p = 0.002) (Cuadro 1). Este resultado corrobora que, en condiciones de campo, la feromona sintética desarrollada por Zhang et al. (2004a y b) atrae a los adultos machos de M. hirsutus en diferentes escenarios de vegetación y es acorde con los resultados reportados por Zhang y Amalin (2005) y Francis et al. (2007). Para cuestiones prácticas de monitoreo, la disponibilidad de esta feromona sintética significa una ventaja sobre el uso de hembras vírgenes, como lo señalan Serrano et al. (2001).
Al graficar las capturas de M. hirsutus se obtuvo un patrón de captura que sugiere que el periodo de máxima actividad de este insecto en el área de estudio ocurre de mediados de mayo a mediados de julio, precedido de un periodo de actividad moderada de principios de marzo a principios de mayo (Figura 1). Zhang y Amalin (2005) y Vitullo et al. (2007) señalan que en Florida (EE.UU.) la máxima actividad de M. hirsutus ocurre a mediados de verano. Cualquier diferencia observada en los picos de máxima actividad pueden deberse a las condiciones climáticas propias de cada localidad.

Dispersión geográfica
En 2006 se encontró que M. hirsutus se mantuvo principalmente dentro del área cuarentenada impuesta por las autoridades locales en Jalisco y Nayarit, aunque rebasó ligeramente tres Puntos de Verificación Interna (PVI) (Figura 2). Las capturas mayores se registraron en los sitios cercanos a Las Varas, Nayarit. En los sitios donde de manera secuencial no se registró la presencia de M. hirsutus, el avance de la plaga es aparentemente limitado por barreras de vegetación natural y por cambios de clima asociados con la altitud. Por ejemplo, hacia el sur de Puerto Vallarta, el insecto no se registró en las áreas montañosas de clima templado donde crecen pinos y encinos; lo mismo que ocurrió al este de Bahía de Banderas. Según Chong et al. (2008) las temperaturas menores de 15 °C son perjudiciales para la sobrevivencia de M. hirsutus, lo cual puede explicar la ausencia de este insecto en las áreas montañosas. Se percibió también que aquellas trampas que en secuencia no capturaron insectos, se encontraban alejadas de centros de población humana.
En 2007 aunque M. hirsutus aún se encontró en la zona de Valle de Banderas, las mayores capturas se registraron en los sitios dentro o cercanos Acaponeta, Nayarit, sin registrarse en el estado de Sinaloa (Figura 3). En los estados de Jalisco y Colima los casos de captura fueron incipientes, concentrándose ligeramente en Cihuatlán, en los límites de estas dos entidades, por la zona costera (Figura 4).
En 2007 nuevamente se percibió una asociación entre la presencia de M. hirsutus y los centros de población humana en las zonas costeras. Esto puede deberse a que la diseminación de este insecto ocurre principalmente a través del transporte de material vegetal infestado (Roltsch et al., 2006). Hacia el interior de Jalisco, Nayarit y Colima, la dispersión de este insecto parece estar limitada por los cambios en altitud y vegetación, de tal forma que no se encontró en los sitios cuya vegetación corresponde a bosque de clima templado.
CONCLUSIONES
La feromona compuesta por (R)–lavandulil (S)–2– metilbutanoato y (R)–maconellil (S)–2–metilbu–tanoato en proporción 1:5 (Zhang et al., 2004a y b), es altamente específica y permite determinar con facilidad la presencia o ausencia de M. hirsutus en áreas de interés agrícola, forestal y urbano. Además, mediante esta feromona y el sistema de muestreo usado, en pocos días puede determinarse la distribución de este insecto a diferentes escalas geográficas. Por tanto, la feromona evaluada constituye una valiosa herramienta para el monitoreo de M. hirsutus en México.
AGRADECIMIENTOS
El presente estudio fue posible gracias al financiamiento otorgado por el Consejo Nacional de Ciencia y Tecnología y la Comisión Nacional Forestal, a través del proyecto CONAFOR–2004–C01–07. Se agradece a Francisco Esquivel Villagrana, ex investigador del INIFAP, por su apoyo en la logística de los viajes y asistencia en los recorridos de campo. A José Luis Covarrubias Arreóla y Miguel Hernández B., por su apoyo en los recorridos de campo dentro del área de Valle de Banderas y a Rafael Hernández Ávila por su ayuda en campo y en el trabajo de laboratorio. A Jaime Villa Castillo (Gerente de Sanidad de la CONAFOR) por su apoyo y sugerencias.
LITERATURA CITADA
APHIS, 1997. Look out for the pink hibiscus mealybug. Animal and Plant Health Inspection Service. USDA Program Aid No. 1606. 11 p. [ Links ]
Cermeli, M., P. Morales V, F. Godoy, R. Romero, y O. Cárdenas. 2002. Presencia de la cochinilla rosada de la cayena Maconellicoccus hirsutus (Green) (Hemiptera: Pseudococcidae) en Venezuela. Entomotropica 17: 103–105. [ Links ]
Chong, J. H., A. L. Roda, and C. M. Mannion. 2008. Life history of the mealybug, Maconellicoccus hirsutus (Hemiptera: Pseudococcidae), at constant temperatures. Environ. Entomol. 37: 323–332. [ Links ]
Diario Oficial de la Federación. 2000. Acuerdo por el que se instrumenta el dispositivo nacional de emergencia con el objeto de prevenir el ingreso de la cochinilla rosada Maconellicoccus hirsutus (Green) e instrumentar las medidas fitosanitarias para monitorear y erradicar brotes eventuales de la plaga. Secretaria de Agricultura, Ganadería y Desarrollo Rural. México. 7 de febrero de 2000. 11 p. [ Links ]
Diario Oficial de la Federación. 2007. Acuerdo por el que se instrumenta el Dispositivo Nacional de Emergencia en los términos del artículo 46 de la Ley Federal de Sanidad Vegetal, con el objeto de controlar y mitigar el riesgo de dispersión de la cochinilla rosada del hibisco (Maconellicoccus hirsutus)en México. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. México. 31 de diciembre de 2007. 9 p. [ Links ]
ESRI. 1999. Arc View GIS Ver. 3.2. [ Links ]
Francis, A., K. A. Bloem, A. L. Roda, and S. L. Lapointe. 2007. Development of trapping methods with a synthetic sex pheromone of the pink hibiscus mealybug, Maconellicoccus hirsutus (Hemiptera: Pseudococcidae). Florida Entomol. 90:440–446. [ Links ]
Goolsby, J. A., A. A. Kirk, and D. E. Meyerdirk. 2002. Seasonal phenology and natural enemies of Maconellicoccus hirsutus (Hemiptera: Pseudococcidae) in Australia. Florida Entomol. 85: 494–498. [ Links ]
Hodges, G. 2005. PHM Male identification, quick and dirty mounts 4/15/04. FDACS–DPI. In: Materials Developed for the Pink Hibiscus Mealybug Workshop. University of Florida 23–24 of June. USDA–APHIS–NPB–NPDN–IPM. USA. 5 p. [ Links ]
Hodges, G. S., and A. Hodges. 2005. Pink Hibiscus Mealybug Maconellicoccus hirsutus. Training Manual. National Plant Diagnostic Network. USDA APHIS National IPM, University of Florida. 132p. [ Links ]
Meyerdirk, D. E., R. War, K., B. Attavian, E. Gersabeck, A. Francis, M. Adams, y G. Francis. 2003. Manual del proyecto para el control biológico de la Cochinilla Rosada del Hibisco. USDA–APHIS, PPQ. Segunda edición traducida por IICA, Costa Rica. 245 p. [ Links ]
Ojeda A., A. 2004a. La cochinilla rosada. Ficha técnica CNRPF–04/17. Centro Nacional de Referencia en Parasitología Forestal. México. 4 p. [ Links ]
Ojeda A., A. 2004b. Cómo identificar a la cochinilla rosada (CRH). Ficha técnica CNRPF–04/19. Centro Nacional de Referencia en Parasitología Forestal. México. 4 p. [ Links ]
Roltsch, W. J. 2006. Classical biological control of the pink hibiscus mealybug, Maconellicoccus hirsutus (Green), in southern California. Biol. Control 37: 155–166. [ Links ]
SAGARPA. 2004. Aplicará gobierno federal $28 millones en fortalecimiento de medidas fitosanitarias en zona agrícola y forestal de Nayarit para control del insecto "cochinilla rosada". Boletín Núm. 166/04. Dir. Gen. Com. Soc. 2 p. http://www.sagarpa.gob.mx/cgcs/boletines/2004/julio/B/66pdf.htm (Consultado: 11 de mayo, 2009). [ Links ]
SAS Institute. 1996. JMP IN Version 3.2.1 for Windows. Duxbury Press. 521 p. [ Links ]
Serrano, M. S., S. L. Lapointe, and D. E. Meyerdirk. 2001. Attraction of males by virgin females of the mealybug Maconellicoccus hirsutus (Hemiptera: Pseudococcidae). Environ. Entomol. 30: 339–345. [ Links ]
Vitullo, J., S. Wang, A. Zhang, C. Mannion, and J. C. Bergh. 2007. Comparison of sex pheromone traps for monitoring pink hibiscus mealybug (Hemiptera: Pseudococcidae). J. Econ. Entomol. 100: 405–410. [ Links ]
Zhang, A., J. Nie, and A. Khrimian. 2004a. Chiral synthesis of maconelliol: a novel cyclobutanoid terpene alcohol from Pink Hibiscus Mealybug Maconellicoccus hirsutus. Tetrahedron Letters 45: 9401–9403. [ Links ]
Zhang, A., D. Amalin, S. Shirali, M. S. Serrano, R. A. Franqui, J. E. Oliver, J. A Klun, J. R. Aldrich, D. E. Meyerdirk, and S. L. Lapointe. 2004b. Sex pheromone of the Pink Hibiscus Mealybug, Maconellicoccus hirsutus, contains an unusual cyclobutanoid monoterpene. PNAS 101: 9601–9606. [ Links ]
Zhang, A., and D. Amalin. 2005. Sex pheromone of the female Pink Hibiscus Mealybug, Maconellicoccus hirsutus (Green) (Homoptera: Pseudococcidae): Biological activity evaluation. Environ. Entomol. 34: 264–270. [ Links ]
Zhang, A., and J. Nie. 2005. Enantioselective synthesis of the female sex pheromone of the Pink Hibiscus Mealybug, Maconellicoccus hirsutus. J. Agrie. Food Chem. 53: 2451–2455. [ Links ]














