Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.43 n.1 Texcoco Jan./Feb. 2009
Protección vegetal
Evaluación de la calidad e incidencia de hongos en frutos refrigerados de zapote mamey (Pouteria sapota (Jacq.) H. E. Moore and Stearn
Evaluation of refrigerated sapote mamey [Pouteria sapota (Jacq.) H.E. Moore and Stearn] quality and incidence of fungi
Rafael Gómez–Jaimes1, Daniel Nieto–Ángel1*, Daniel Téliz–Ortiz1, J. Antonio Mora–Aguilera1, M. Teresa Martínez–Damián2, Mateo Vargas–Hernández2
1 Fitopatología. Campus Montecillo. Colegio de Postgraduados. 56230. Montecillo, Estado de México. * Autor responsable: (farrag9@hotmail.com).
2 Departamento de Fitotecnia y Suelos. Universidad Autónoma Chapingo. 56230. Chapingo, Estado de México.
Recibido: Noviembre, 2007.
Aprobado: Noviembre, 2008
Resumen
El bajo nivel tecnológico en la producción del zapote mamey (Pouteria sapota (Jacq.) H. E. Moore and Stearn) hace necesario implementar nuevas alternativas de manejo postcosecha como las temperaturas bajas de almacenamiento, con el propósito de prolongar la vida de anaquel de los frutos y mantener su calidad. El efecto de las temperaturas de almacenamiento en la calidad se evaluó en frutos cosechados en madurez fisiológica. Los frutos fueron almacenados (7d) a temperatura ambiente (aproximadamente 25 °C) (testigo), y a 10, 13 y 15 °C por 13, 18 y 24 d. Después del almacenamiento los frutos fueron evaluados a los 0, 3 y 6 d a temperatura ambiente. La mejor temperatura de refrigeración en frutos de mamey fue 13 °C, ya los frutos mostraron firmeza, color [valor de L* (brillo), índice de saturación de color (chroma) y ángulo de tono (hue)], sólidos solubles totales (°Brix) y acidez, así como pérdida de peso en fruto, similares a las obtenidas en los frutos testigo en madurez de consumo. En los frutos almacenados a 13 °C a los 18 d hubo 10 % de pudrición, y 10 a 30 % a los 24 d. Los frutos a 15 °C entraron en senescencia después de 13 d de almacenamiento y presentaron la mayor pudrición. Los frutos expuestos a 10 °C no maduraron y no hubo cambios en firmeza, sólidos solubles totales y color de la pulpa. Con base en sus características morfológicas y moleculares los hongos que indujeron pudriciones en frutos se identificaron como Pestalotiopsis paeoniicola y Lasiodiplodia theobromae.
Palabras clave: Almacenamiento, calidad, hongos, maduración, pudrición.
Abstract
The low technology production of sapote mamey [Pouteria sapota (Jacq.) H.E. Moore and Stearn] makes it necessary to implement new alternatives, such as low storage temperatures, for postharvest management to prolong shelf life and preserve fruit quality. The effect of storage temperatures on quality of fruits harvested at physiological maturity was studied. Control fruits were stored (7 d) at room temperature (approximately 25 °C), and experimental fruits were stored at 10, 13, and 15 °C for 13, 18, and 24 d. After storage, the fruits were evaluated at room temperature on days 0, 3, and 6. The best cold storage temperature for mamey fruits was 13 °C; fruits exhibited firmness, color [L* (luminosity), color saturation index (chroma), and hue angle)], total soluble solids (°Brix) and acidity, as well as weight loss, similar to those of the control fruits at eating ripeness. At 13 °C, 10 % fruit rot occurred at 18 d, and 10 to 30 % at 24 days. At 15 °C, fruits began senescence after 13 d of storage and exhibited the most rotting. Fruits exposed to 10 °C storage did not ripen, and there were no changes in firmness, total soluble solids or pulp color. Based on their morphological and molecular characteristics, the fungi that induced rotting in fruits were identified as Pestalotiopsis paeoniicola and Lasiodiplodia theobromae.
Key words: Storage, quality, fungi, ripening, rot.
INTRODUCCIÓN
El zapote mamey (Pouteria sapota (Jacq.) H. E. Moore and Stearn) es un fruto con un comportamiento climatérico y tasa alta de respiración. Las pérdidas importantes en postcosecha se debe a la maduración rápida y susceptibilidad a pudriciones internas inducidas por hongos (Díaz et al., 2001; Ergun et al., 2005). Los hongos reportados en frutos de mamey como causales de pudriciones son Lasiodiplodia spp. y Pestalotia spp. (Bautista et al., 2002; Yahia y Ariza, 2003; Ariza–Flores et al., 2005). En México, la fruta rara vez es refrigerada y no recibe tratamientos postcosecha (Díaz et al., 2000). La temperatura baja es una de las principales herramientas para prolongar la vida útil de los frutos, ya que mantiene su calidad y aumenta el tiempo de conservación (Gamage y Rahman, 2003). Sin embargo, bajas temperaturas de almacenamiento producen desórdenes fisiológicos en tejidos, modifican la fase climatérica y afectan la madurez de los frutos (Thompson, 1998). La exposición de frutos de mamey a temperaturas menores a 10 °C induce severos daños por frío, lo que causa oscurecimiento y lignificación de la pulpa, maduración desigual y adherencia de la pulpa a las semillas (Díaz et al., 2000; Alia et al., 2002). La Cañada de Huamuxtitlan, en la montaña baja del estado de Guerrero, es una importante zona productora de mamey con bajo nivel tecnológico, con productividad y rentabilidad incipiente. Pero su rentabilidad podría mejorar aplicando nuevas alternativas de manejo postcosecha como las temperaturas bajas de almacenamiento, para prolongar la vida de anaquel de los frutos, sin afectar su calidad. Alia et al. (2005a, 2005b) y Díaz et al. (2000) probaron temperaturas de refrigeración en frutos de mamey a 10 y 15 °C. Los resultados sugieren la necesidad de evaluar temperaturas intermedias para mejorar su efecto en la incidencia de enfermedades postcosecha. Por tanto, el presente trabajo tuvo como objetivo determinar las temperaturas óptimas de almacenamiento de los frutos de mamey y evaluar su repercusión en la calidad postcosecha y en la incidencia de enfermedades inducidas por hongos, así como la identificación morfológica y molecular de los patógenos.
MATERIALES Y MÉTODOS
Frutos de mamey (Pouteria sapota) fueron recolectados de árboles en la comunidad de Alpoyeca, Guerrero, México, en mayo de 2006. La verificación del momento de cosecha se realizó con base en la experiencia de los productores de la zona, quienes retiran una porción de cáscara de la base y ápice del fruto para observar la coloración naranja de la pulpa, como indicador de que el fruto está listo para cosecharse y alcanzar su madurez de consumo con calidad óptima. Hubo cuatro temperaturas de almacenamiento para los frutos: ambiente (aproximadamente 25 °C) testigo por 7 d; y 10, 13 y 15 °C por 13, 18 y 24 d, con humedad relativa de 85 a 90%. Los frutos fueron evaluados a temperatura ambiente (aproximadamente 25 °C) a los 0, 3 y 6 d después del almacenamiento (DDA) en cada temperatura; y a 0, 3, 6 y 7 d de almacenamiento para el testigo.
Variables de calidad
Firmeza de la pulpa
Fue evaluada con un penetrómetro Chatillon® con puntal cónico (11 mm diámetro y 5 mm altura), con capacidad de 0 a 12 kg. Las lecturas de cada fruto fueron registradas en kg cm–2.
Color de la pulpa
L* (brillo), índice de saturación (chroma) y ángulo de tono (hue) se determinaron con un colorímetro Hunter Lab®, el cual indicó los valores L*, a* y b*. Los cambios de color se determinaron calculando la relación b*/a*, para obtener el ángulo de tono (arc tan b*/a*) e índice de saturación [(a*2 + b*2)1/2] (McGuire, 1992).
Sólidos solubles totales (°Brix)
Fueron determinados con la metodología de la A.O.A.C. (1984) con un refractómetro digital marca ATAGO– Pelete PR–101® (0 a 45%). El resultado se expresó en unidades °Brix.
Acidez titulable
Fue medido por la técnica de la A.O.A.C. (1984). Se licuaron 20 g de pulpa en 100 mL de agua destilada, se tituló con hidróxido de sodio al 0.1 N con pH final de 8.1 y se expresó en porcentaje de ácido málico.
Pérdida de peso de los frutos
Los frutos fueron pesados en una balanza digital y el peso inicial se comparó en cada fecha de evaluación y se calculó el porcentaje de pérdida de peso del fruto

Diseño del experimento
En frutos almacenados a temperatura ambiente (caracterización del testigo) se usó un diseño completamente al azar, donde los días de almacenamiento (0, 3, 6 y 7) fueron los tratamientos; la unidad experimental fue un fruto con 10 repeticiones. Para evaluar el efecto de la temperatura en frutos almacenados se utilizó un diseño en cuadro latino; las unidades experimentales (un fruto) se ubicaron en bloques en función de los gradientes de variabilidad: tres tratamientos (10, 13 y 15 °C), días de almacenamiento (13, 18 y 24) y DDA (0, 3 y 6) con 10 repeticiones. Se hizo un análisis de varianza (ANOVA) y comparación de medias (Tukey; p<0.05) usando SAS (SAS Institute, Inc., 1996).
Incidencia e identificación de hongos en frutos
Pudrición de frutos (%)
Los frutos utilizados para evaluar el efecto de las temperaturas en las pudriciones fueron los usados en las variables de calidad. Los frutos testigo fueron evaluados a los 6, 7 y 10 d de almacenamiento a temperatura ambiente. La incidencia de hongos fue considerada como el número de frutos con pudriciones en la pulpa (ennegrecimiento y presencia de micelio) y expresada en porcentaje del total de los frutos utilizados para cada fecha de evaluación en cada temperatura de almacenamiento: frutos a temperatura ambiente, a 10, 13 y 15 °C.
Identificación de hongos
Se hizo a partir de fragmentos de pulpa con pudrición que se desinfestaron con hipoclorito de sodio al 1.5% por 3 min de inmersión; fueron lavados 1 min en agua destilada estéril y secados en papel absorbente estéril. El agua y el papel fueron esterilizados 15 min en una olla de presión a 121 °C. La pulpa fue sembrada en cajas de petri de plástico con medio de cultivo de papa zanahoria agar (PCA: 20 g papa, 20 g de zanahoria, 18 g agar, y 1000 mL agua destilada). Las cajas fueron incubadas en luz negra continua con una lámpara de 40 W, a 25±1 °C en el día. De los aislamientos purificados se realizaron cultivos monospóricos en agar–agua (AA: 18 g agar en 1000 mL agua destilada), y se incrementaron en PCA. Las claves usadas para la identificación de Pestalotiopsis fueron la de Sutton (1980) para género y la de Wei et al. (2005) para la especie. Para la identificación de Lasiodiplodia se usaron las claves de Punithalingam (1976), Sutton (1980) y Burgess et al. (2006).
Imágenes para microscopía
Flores de mamey inoculadas con una suspensión de 1X106 conidios mL–1 de Pestalotiopsis se fijaron en glutaraldehído al 3 % en amortiguador de fosfatos Sorensen's 0.1M pH 7.2 por 24 h. Los tejidos se deshidrataron gradualmente en soluciones acuosas de etanol (30, 40, 50, 60 y 70%) por 1 h en cada concentración. Cortes longitudinales de los pétalos se hicieron en las muestras en etanol al 70%, y la deshidratación continúo en etanol a 80 90 y 100%. Las muestras fueron secadas en una secadora de punto critico (Sandri–780A®), montadas sobre porta muestras con cinta adhesiva de cobre y recubiertas con oro por 4 min en una ionizadora (Ion Sputter JFC–1100, Jeol, Fine Coat®). Las muestras se observaron en un microscopio electrónico de barrido (JEOL JSM 6390®) a 15 Kv. Las imágenes de esporas de Lasiodiplodia se tomaron con un microscopio de luz (III CARL ZEISS®) con cámara digital para microscopía (PAX cam 3®).
Caracterización molecular de aislamientos
De cada cultivo monospórico de Pestalotiopsis y Lasiodiplodia se extrajo ADN con la técnica de Ahrens y Seemüller (1992). Las regiones internas ITS1 e ITS2 fueron amplificados por reacción en cadena de la polimerasa (PCR) con la combinación de iniciadores ITS5 (GGAAGTAAAAGTCGTAACAAGG)/ITS4. (TCCTCCGCT TATTGATATGC), según Ahrens y Seemüller (1992), con la siguiente modificación: agua ultra pura estéril (13.22 µL), solución amortiguadora TBE 1X (2.5 µL) MgCl2 a 2.5 mM (2.08 µL), dNTPs A 0.2 Mm (2 µL), iniciadores ITS4 e ITS5 a 20 ρmol (2 µL de cada uno), ADN polimerasa (Biogenica®) a 1 U (0.2 µL) y muestra de ADN a 80 ng (1 µL). El producto amplificado fue purificado con el kit Wizard (Promega®) y enviado para su secuenciación a la Facultad de Biología Celular de la Universidad Autónoma de México. Las secuencias se analizaron con el software Lasergene® 2001, V5 (DNASTAR, Inc.) y se alinearon con la base de datos del Banco de Genes del Nacional Center for Biotechnology Information (NCBI), USA (www.ncbi.nlm.nih.gov/). Las secuencias con el valor más alto de similaridad se consideraron para su comparación con las obtenidas en este estudio.
RESULTADOS Y DISCUSIÓN
Los frutos almacenados a temperatura ambiente alcanzaron su madurez de consumo 7 d después de la cosecha. Los atributos de calidad como firmeza, color, sólidos solubles totales, acidez y pérdida de peso cambiaron durante el almacenamiento (p<0.05) (Cuadro 1; Figura 1). La firmeza de los frutos disminuyó al aumentar el tiempo de almacenamiento de 9 kgcm–2 en madurez fisiológica a 0.3 kgcm–2 en madurez de consumo, coincidiendo con Díaz et al. (2000 y 2003).

Efecto de las temperaturas bajas de almacenamiento
Firmeza de la pulpa
Los frutos almacenados a 10 °C presentaron mayor firmeza en los periodos de almacenamiento (13, 18 y 24 d); mientras que los expuestos a 13 y 15 °C no fueron diferentes en casi todas las evaluaciones, excepto a los cero DDA en 13 y 24 d de refrigeración (Cuadro 2). Los frutos refrigerados a 13 °C y 15 °C disminuyeron su firmeza en todas las evaluaciones (0, 3 y 6 DDA) en cada periodo de almacenamiento (Figura 2), lo cual fue similar a la firmeza obtenida en los frutos testigo. Sin embargo, los frutos a 15 °C una vez transferidos a temperatura ambiente mostraron una disminución de la firmeza a partir de los cero DDA y, como consecuencia, presentaron una menor vida de anaquel. Los frutos almacenados a 10 °C al no disminuir su firmeza, no alcanzaron la madurez de consumo en los periodos de almacenamiento (13, 18 y 24 d), debido probablemente a daño por frío. Resultados similares fueron observados en frutos de mamey sometidos a temperaturas de 10 °C o menores (Díaz et al., 2000 y 2003; Thompson, 2003).

Color de la pulpa
La pulpa de los frutos almacenados a 10 °C mostraron los valores mayores de brillo (valor de L*), debido a que los frutos no maduraron normalmente. Los frutos almacenados a 13 y 15 °C no fueron diferentes a los 13 d en los cero DDA y 18 días de almacenamiento en 3 y 6 DDA; en los demás días los frutos a 15 °C registraron un brillo menor (Cuadro 2). La disminución del brillo en frutos refrigerados a 15 °C pudo deberse al oscurecimiento de la pulpa, debido a su estado senescente. Hubo resultados similares en frutos de mamey almacenados a 15 °C (Alia et al., 2005b). Para el índice de saturación (chroma) 13 y 18 d de almacenamiento, los frutos presentaron una pureza similar del color en los tratamientos de 10, 13 y 15 °C; sin embargo, los frutos mantenidos a 10 °C tuvieron los cambios menores a 24 d de almacenamiento (Cuadro 2). Alia et al. (2002) indicaron que el índice de saturación de los frutos disminuye a medida que los frutos maduran, ya que la pulpa se opaca y obscurece. Los frutos a 15 °C tuvieron los cambios mayores a los 24 d de almacenamiento debido a su avanzado estado de senescencia. En ángulo de tono (hue), los frutos almacenados a 10, 13 y 15 °C no fueron diferentes (Cuadro 2). Este comportamiento también fue observado por Díaz et al. (2000) y Alia et al. (2007).
Sólidos solubles totales
Los sólidos solubles totales (°Brix) aumentaron durante el almacenamiento y presentaron diferencias significativas entre tratamientos (p<0.05). Los frutos almacenados a 15 y 13 °C tuvieron mayor contenido de sólidos solubles totales y a 10 °C se presentó el menor valor, a excepción de los 13 d de almacenamiento en 0 y 6 DDA y 18 d a los 3 DDA, donde los sólidos solubles totales de los frutos fueron similares en las tres temperaturas (Cuadro 3). Los frutos almacenados a 13 y 15 °C, iniciaron con 11 °Brix y terminaron en un intervalo de 29 a 33 en madurez de consumo, resultados similares a los de los frutos almacenados a temperatura ambiente (aproximadamente 25 °C). De manera similar, Díaz et al. (2000, 2001 y 2003) mencionaron que el contenido de sólidos solubles totales en la madurez de consumo de los frutos de mamey puede fluctuar de 27 a 36 °Brix. Los frutos almacenados a 10 °C no alcanzaron la madurez de consumo, lo cual influyó en la disminución de la concentración de azúcares.
Acidez
La acidez evaluada en ácido málico, que se encuentra en mayor concentración en frutos de mamey (Thompson, 2003), cambió debido al almacenamiento a 10, 13 y 15 °C (Cuadro 3). Villanueva et al. (2000), Thompson (2003) y Alia et al. (2007) mencionaron que el mamey es un fruto con bajo porcentaje de acidez y generalmente decrece durante el proceso de maduración. El contenido inicial de ácido málico fue 0.49 % y 0.25 % el mínimo. Valores similares de ácido málico fueron observados en frutos de mamey almacenados a 5, 10 y 15 °C (Alia et al. 2001). El porcentaje menor de acidez se presentó en frutos expuestos a 10 °C y el mayor ocurrió a 24 d de almacenamiento a 10, 13 y 15 °C (Cuadro 3).
Pérdida de peso de los frutos
Hubo diferencias significativas entre tratamientos (p<0.05) durante el almacenamiento. La pérdida de peso fue (23 %) mayor en los frutos almacenados a 15 °C y fue menor en los refrigerados a 10 °C (5 a 14 %) y 13 °C (9 a 18 %), excepto a los cero DDA en 13 d de refrigeración (Cuadro 3). Alia et al. (2007) mencionaron que en frutos de mamey almacenados entre 10 y 15 °C y 90 % de humedad relativa, se disminuye la pérdida de peso al reducir y mantener una transpiración menor. La mejor temperatura de almacenamiento refrigerado fue 13 °C, ya que los frutos maduraron de forma similar a los expuestos a temperatura ambiente, con buena apariencia visual y calidad comercial, que se prolongó hasta los 24 d de refrigeración y 3 DDA. Resultados similares fueron reportados por Kader (2002) y Thompson (2003). Los frutos almacenados a 10 °C mostraron la menor pérdida de peso, pero su maduración fue desigual.
Incidencia e identificación de hongos en frutos
En los frutos de mamey almacenados a 10 °C por 18 y 24 d la pudrición fue 10 % en la última evaluación (6 DDA). En los frutos refrigerados a 13 °C la pudrición fue 10 % a los 18 d de almacenamiento y 10 a 30 % a los 24 d (a los 3 y 6 DDA). En los frutos a 15 °C la pudrición fue 10 a 50 % en los periodos de almacenamiento (13, 18 y 24 d) en las evaluaciones a 0, 3 y 6 DDA (Figura 3). En los frutos testigo la pudrición fue 100 % a los 10 d de almacenamiento.
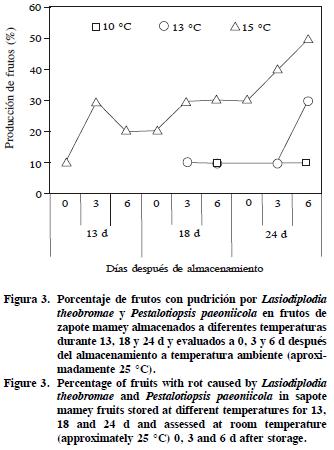
Las pudriciones en los frutos iniciaron con la presencia de micelio blanco cerca de la base del pedúnculo y que se extendió a todo el fruto, principalmente entre la pulpa y la cáscara. Al madurar los frutos y entrar en senescencia, la pulpa se tornó negra y se desarrolló una pudrición total. Con los aislamientos se identificó a Lasiodiplodia theobromae y Pestalotiopsis paeoniicola, cuyo hongo no ha sido reportado en frutos de mamey. L. theobromae (Figura 4) desarrolló abundante micelio, septado, ramificado y de gris oscuro a negro; los conidios fueron inicialmente unicelulares hialinos, granulosos, subovoides a elipsoides oblongos con pared delgada y base truncada; al madurar desarrollaron una pared gruesa y septa a la mitad, café oscuro y frecuentemente estriados longitudinalmente (20.5–26.8 x 12.4–15.0 µm; media 24.4 x 14.1 µm). Estas observaciones coincidieron con las de Punithalingam (1976), Sutton (1980), Burgess et al. (2006). P. paeoniicola presentó micelio superficial, septado y ramificado; acérvulos con masas de esporas negras conspicuas y errumpentes de forma oval o irregular; conidios con 5 células, fusiformes, alargados o ligeramente curveados en la mitad (18.3–27.8 x 6.3–7.9 µm; media 24.9 x 7.15 µm); 3 células intermedias (13.5 – 19.1 µm; media 17 µm); 2 a 3 apéndices apicales sin ramificaciones, (15.8 – 27.5 µm; media 22.6 µm de largo); 1 apéndice basal céntrico no ramificado (3.41 – 6.26 µm; media 5.0 µm de largo) (Figura 5). Sutton (1980), Wei et al. (2005), Keith et al. (2006) y Liu et al. (2007) registraron medidas similares de los conidios. Lasiodiplodia spp. y Pestalotiopsis spp. pueden desarrollarse de 15 a 30 °C (Bautista et al., 2002; Sommer et al., 2002), y su temperatura óptima de desarrollo es 25 a 30 °C para Lasiodiplodia (Zhang y Swingle, 2005; Bautista et al., 2002) y de 22 a 28 °C para Pestalotiopsis (Keith et al., 2006). Estos resultados explican porqué en los frutos almacenados a 15 °C hubo mayor pudrición que a 10 y 13 °C. Las pudriciones de frutos almacenados a 13 °C ocurrieron debido al estado avanzado de madurez de los frutos. Pestalotiopsis spp. y Lasiodiplodia spp. pueden ser patógenos oportunistas que atacan en condiciones de estrés o en órganos deteriorados de las plantas (Sommer et al., 2002; Keith et al., 2006 y Guang et al., 2007). En los frutos almacenados a 10 °C hubo menor pudrición, pero la pulpa no tuvo calidad para el consumo.
Caracterización molecular
Las secuencias genéticas de los hongos fueron depositadas en el banco de genes (NCBI) para su homologación; Pestalotiopsis spp. con número de acceso EU400221 tuvo 99 % de similitud con P. paeoniicola, y Lasiodiplodia spp. con número de acceso AY662402.1 tuvo 99 % de similitud con L. theobromae.
En los frutos almacenados a 15 °C y 13 °C no hubo efectos en su maduración; sin embargo, después de 13 d de almacenamiento los frutos a 15 °C entraron en senescencia y presentaron la mayor pudrición. La mejor temperatura de almacenamiento fue 13 °C ya que se retardó la maduración hasta los 24 d de refrigeración y 3 DDA. La pulpa de los frutos mostró características en firmeza, color valor de L* (brillo), índice de saturación (chroma) y ángulo de tono (hue), sólidos solubles totales (°Brix) y acidez, así como pérdida de peso en fruto, similares a las obtenidas en los frutos testigo en madurez de consumo (7 d de almacenamiento). La pudrición de frutos se inició a los 18 d y el daño fue sólo 10 % a los 24 d de refrigeración y 3 DDA. Los frutos a 10 °C mostraron maduración desigual después de exponerse a temperatura ambiente y no hubo cambios deseables en firmeza, color y sólidos solubles totales; por tanto, los frutos no alcanzaran la calidad de consumo. Los frutos testigo a los 10 d de almacenamiento presentaron 100% de pudrición. Con base a sus características morfológicas y moleculares, los hongos asociados a pudrición de fruto se identificaron como Pestalotiopsis paeoniicola y Lasiodiplodia theobromae.
LITERATURA CITADA
Ahrens, U., and E. Seemüller. 1992. Detection of DNA of plant pathogenic mycoplasmalike organisms by polimerase chain reaction that amplifies a sequence of 16S rRNA gene. Phytopathology 82: 828–832. [ Links ]
Alia T. I., M. T. Colinas L., M. T. Martínez D., and M. R. Soto H. 2002. Physiological, biochemical and quality factors in sapote mamey (Pouteria sapota Jacq. H.E. Moore & Stearn) fruits during postharvest. Rev. Chapingo Serie Hort. 8:263–281. [ Links ]
Alia T., I., M. T. Colinas L., M. T. Martínez D., y M. R. Soto H. 2005a. Daños por frío en zapote mamey (Pouteria sapota (Jacq.) H. E. Moore and Stearn). I. Cambios en volátiles, firmeza y azúcares totales. Rev. Fitotec. Mex. 28:17–24. [ Links ]
Alia T., I., M. T. Colinas L., M. T. Martínez D., y M. R. Soto H. 2005b. Daños por frío en zapote mamey (Pouteria sapota (Jacq.) H. E. Moore and Stearn).II. Cambios en fenoles totales y actividad enzimática. Rev. Fitotec. Mex. 28:25–32. [ Links ]
Alia T., I., R. Villanueva A., C. Pelayo Z., M. T. Colinas L., V. López M., and S. Bautista B. 2007. Postharvest physiology and techology of sapote mamey fruit (Pouteria sapota (Jacq.) H.E. Moore & Stearn. Postharvest Biol. and Technol. 45: 285–297. [ Links ]
A.O.A.C. 1984. Official Methods of Analysis of the Association of Official Analytical Chemists. 14 th. ed. Arlington, Virginia. USA. 1140 p. [ Links ]
Ariza F., R., A. Barrios A., E. Vázquez G., S. Navarro G., A. Michel A., y A. Otero G. 2005. Tecnología de Postcosecha en Mango, Papaya y Sapote Mamey. INIFAP. Libro Técnico No. 2. México. 221 p. [ Links ]
Bautista B., S., J. C. Díaz P, and L. L. Barrera N. 2002. Postharvest fungal rots of sapote mamey Pouteria sapota (Jacq.) H.E. Moore & Stearn. Postharvest Biol. and Technol. 24:197–200. [ Links ]
Burgess, I. T., A. P. Barber, S. Mohali, W. Beer, and J. M. Wingfield. 2006. Three new Lasiodiplodia spp. from the tropics, recognized based on DNA sequence comparisons and morphology. Mycologia 98: 423–435. [ Links ]
Díaz P., J. C., S. Bautista, and R. Villanueva. 2000. Quality changes in sapote mamey fruit during ripening and storage. Postharvest Biol. and Technol. 18: 67–73. [ Links ]
Díaz P., J. C., S. Bautista, R. Villanueva, and R. López G. 2003. Modeling the ripening of sapote mamey (Pouteria sapota (Jacq.) H.E. Moore and Stearn) fruit at various temperatures. Postharvest Biol. and Technol. 28:199–202. [ Links ]
Ergun, M., S. A. Sargent, A. J. Fox, J. H. Crane, and D. J. Huber. 2005. Ripening and quality responses of mamey sapote fruit to postharvest wax and 1–methylcyclopropene treatments. Postharvest Biol. and Technol. 36:127–134. [ Links ]
Guang, W. J., X. Tong, L. D. Guo, A. R. Liu, Y. Zhang, and X. H. Pan. 2007. Endophytic Pestalotiopsis species with plants of Podocarpaceae, Theaceae and Taxaceae in southern China. Fungal Diversity 24: 55–74. [ Links ]
Kader, A. A. 2002. Postharvest biology and technology: An overview. In: Kader, A. A. (ed). Postharvest Technology of Horticultural Crops. Ed. University of California Agricultural and Natural Resources, Publication 3311. pp: 39–54. [ Links ]
Keith, L. M., M. E. Velásquez, and F. T. Zee. 2006. Identification and characterization of Pestalotiopsis spp. causing scab disease of guava, Psidium guajava, in Hawaii. Plant Dis. 90: 16–23. [ Links ]
Liu, A. R., T. Xu, and L. D. Guo. 2007. Molecular and morphological description of Pestalotiopsis hainanensis sp. Nov., a new endophyte from a tropical region of China. Fungal Diversity 24: 23–36. [ Links ]
McGuire, R. G. 1992. Reporting of objective color measurements. HortScience 27: 1254–1255. [ Links ]
Punithalingam, E. 1976. Botryodiplodia theobromae. CMI descriptions of pathogenic fungi and bacteria. No. 519. Commonwealth Mycological Institute, Kew, Surrey, England. [ Links ]
SAS Institute Inc. 1996. SAS User's Guide. Statistics. Release 6.12 ed. SAS Institute, Inc. Cary, NC. 1028 p. [ Links ]
Skrede, G. 1996. Fruits. In: Jeremiah, L. E. (ed). Freezing Effects on Food Quality. Ed. Marcel Dekker, Inc. New York, USA. pp: 183–245. [ Links ]
Sommer, N. F., R. J. Fortlage, and D. C. Edwards 2002. Postharvest diseases of selected commodities. In: Kader, A.A. (ed). Postharvest Technology of Horticultural Crops. Ed. University of California Agricultural and Natural Resources, Publication 3311. pp: 197–249. [ Links ]
Sutton, B. C. 1980. The Coleomycetes: Fungi Imperfecti with Pycnidia, Acervuli and Stromata. Commonwealth Mycological Institute, Kew, Surrey, England. 700 p. [ Links ]
Thompson, A. K. 1998. Controlled Atmosphere Storage of Fruit and Vegetables. Cab International. Wallingford, UK. 278 p. [ Links ]
Thompson, A. K. 2003. Fruit and Vegetables Harvesting, Handling and Storage. Blackwell Publishing Ltd. 460 p. [ Links ]
Villanueva A., R., S. Evangelista L., M. L. Arenas O., J. C. Díaz P., and S. Bautista B. 2000. Biochemical and physics changes during development and postharvest of sapote mamey fruit (Pouteria sapota (Jacq.) H.E. Moore & Stearn). Rev. Chapingo Serie Hort. 6:63–72. [ Links ]
Wei, J. G., T. Xu, L. D. Guo, and X. H. Pan. 2005. Endophytic Pestalotiopsis species from Southern China. Mycosystema 24:481–493. [ Links ]
Yahia, E. M., and R. Ariza. 2003. Postharvest hot air treatments effect on insect mortality and quality of sapote mamey fruit (Pouteria sapota). Acta Horticulturae 604:691–695. [ Links ]
Zhang, J. X., and P. P. Swingle. 2005. Effects of curing on green mold and stem–end rot citrus fruti and its potencial application under Florida parking system. Plant Dis. 89:834–840. [ Links ]














