Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.8 Texcoco nov./dic. 2008
Fitociencia
Indicadores morfológicos y fisiológicos del deterioro de semillas de tomate de cáscara
Morphological and physiological markers of seed deterioration in husk tomato
Ignacio Pérez-Camacho1, Óscar J. Ayala-Garay1*, Víctor A. González-Hernández1, José A. Carrillo-Salazar1, Aureliano Peña-Lomelí2, Gabino García-de los Santos1
1 Campus Montecillo. Colegio de Postgraduados. 56230. Km. 36.5 Carretera México-Texcoco. Montecillo, Texcoco, Estado de México. *Autor responsable. (oayala@colpos.mx).
2 Departamento de Fitotecnia. Universidad Autónoma Chapingo. 56200. Km. 38.5 Carretera México-Texcoco. Texcoco, Estado de México.
Recibido: Septiembre, 2007.
Aprobado: Septiembre, 2008.
Resumen
En México, el tomate de cáscara (Physalis ixocarpa Brot) ocupa el quinto lugar entre las especies hortícolas pero la investigación en esta especie es escasa, en especial la relacionada con el deterioro de la semilla. Por tanto, se estudió el efecto del deterioro por envejecimiento natural en semillas de tomate de cáscara var CHF1-Chapingo, almacenadas 1, 2, 3 y 5 años a 18.2±5 °C y 41.2 ±10% de humedad relativa. Después de 5 años, la viabilidad decreció de 84.5 a 50.8%, la velocidad de emergencia de la radícula de 79 a 34.3 radículas d-1, la velocidad de emergencia en arena de 29.1 a 15.3 plántulas d-1 y la conductividad eléctrica subió de 31 a 80 µS cm-1. Además, el peso de mil semillas bajó de 1360 a 1140 mg a los 5 años y el peso de 20 plántulas después de 10 d de sembradas disminuyó de 1306 a 876 mg. Las pérdidas en germinación de la semilla aumentaron linealmente al aumentar el tiempo de almacenamiento, con una tasa de reducción de 8.7% anual. La semilla de tomate de cáscara sólo se puede conservar en esas condiciones por 3 años con un vigor medio y 65.8% de germinación, y sólo por un año con un alto vigor y 80% de germinabilidad.
Palabras clave: Physalis ixocarpa, deterioro de semillas, germinación, membranas celulares, respiración, vigor.
Abstract
In México, husk tomato (Physalis ixocarpa Brot.) is ranked the fifth among horticultural species. However, little research on this species has been done, particularly that referring to seed deterioration. This paper describes the effects of deterioration caused by natural aging on husk tomato seed, var. CHF1-Chapingo, which was kept in storage for 1, 2, 3 and 5 years at 18.2±5 °C, and 41.2±10% relative humidity. After five years of storage viability decreased 84.5 to 50.8%; speed of rootlet emergence decreased by 79 to 34.3 rootlets d-1; speed of emergence in sand decreased from 29.1 to 15.3 seedlings d-1; electrical conductivity increased from 31 to 80 µS cm-1 g-1. Also, weight of 1000 seeds decreased from 1360 to 1140 mg after five years, and 10 days after planting weight of 20 seedlings decreased from 1306 to 876 mg. Germination losses increased linearly as the storage period lengthened, at an annual reduction rate of 8.6%. Under these temperature and humidity conditions, after three years of storage husk tomato seed will have average vigor and 65.8%, and high vigor and 80% germinability after one year.
Key words: Physalis ixocarpa, seed aging, germination, cell membranes, respiration, vigor.
INTRODUCCIÓN
Durante el almacenamiento, mecanismos de deterioro de la semilla disminuyen la germinación, la velocidad de crecimiento de la plántula y la tolerancia a condiciones adversas (Bradford, 2004). Otros síntomas de la semilla deteriorada incluyen: crecimiento anormal, daños en estructuras principales de las plántulas, pérdida de compuestos solubles debido a excesiva permeabilidad de la membrana, reducción de la actividad enzimática, daño oxidativo al ADN y a las proteínas y producción de sustancias tóxicas como ácidos grasos libres (Basavarajappa et al., 1991). La generación de radicales libres y la peroxidación de lípidos daña la integridad física de las membranas que, a su vez, causa pérdida de compartimentación celular y la expulsión de solutos (Bradford, 2004).
El deterioro de la semilla está asociado con cambios en su metabolismo; por ejemplo, la disminución de carbohidratos que ocurre con la edad de la semilla podría resultar en insuficiencia de sustratos respiratorios para la germinación o en la incapacidad para usarlos; así, un signo del deterioro de la semilla es una disminución significativa de su tasa respiratoria (Bernal y Leopold, 1992; Cruz-Pérez et al., 2003). La relación entre la actividad respiratoria de una semilla durante las primeras horas de germinación y su estado de deterioro es difícil de establecer, pero se aprecia más claramente después de la emergencia de la radícula (Cruz-Pérez et al., 2003).
México es centro de origen de las especies del género Physalis, las cuales forman parte de sus platillos desde épocas precolombinas, sobre todo en salsas y ensaladas. La superficie cosechada de tomate de cáscara (Physalis ixocarpa Brot) ha aumentado desde 1932, adquirió importancia en los setenta y desde los ochenta se exporta en fresco o industrializado a los EE.UU. (Pérez y Granados, 2001). En México, el tomate de cáscara ocupa el quinto lugar entre las especies hortícolas, con una superficie sembrada en 2003 de 48 639 ha en 26 Estados, con un rendimiento medio de 12.362 t ha-1 (SAGARPA, 2003).
La investigación en esta especie es escasa, en especial en relación con la calidad de la semilla y su deterioro. Empíricamente se calcula que por cada año de almacenamiento la semilla pierde hasta 20% de su germinación. Este aspecto es importante en los programas de mejoramiento genético y de conservación de germoplasma. El conocimiento detallado de las características morfológicas y fisiológicas de la semilla de esta especie podría ayudar a identificar los factores involucrados en su deterioro. Por ello, el objetivo de este trabajo fue cuantificar el efecto del envejecimiento de la semilla de tomate de cáscara almacenada sin control climático sobre sus características de germinación, vigor, disponibilidad de reservas, respiración, integridad y permeabilidad de membranas.
MATERIALES Y MÉTODOS
En el estudio se usó semilla de tomate de cáscara de la variedad CHF1-Chapingo, producida durante el temporal en primavera-verano del 2000, 2002, 2003 y 2004 (equivalentes a 5, 3, 2 y 1 años de almacenamiento) en el Campo Experimental de la
Universidad Autónoma Chapingo, en Texcoco, Estado de México, a 2250 m de altitud. El manejo del cultivo fue el mismo en cada año de producción; trasplante a campo abierto en la primera semana de abril, a una densidad de 30 000 plantas ha-1 y cosecha en la segunda semana de junio. La semilla cosechada fue secada al ambiente durante dos semanas, limpiada en una mesa de gravedad (Seedburo Inc., EE.UU.) y almacenada en botes de aluminio abiertos en una bodega sin control de clima (18.2± 5 °C; 41.2± 10% humedad relativa).
Experimentos y variables medidas
Los análisis de calidad física, fisiológica, cinética de imbibición, respiración, y permeabilidad de las membranas de semillas se hicieron en mayo y junio del 2005 en los laboratorios de Análisis de Semillas, Fisiotecnia y Microscopía Electrónica del Colegio de Postgraduados, en Montecillo, Estado de México. Los tratamientos fueron las cuatro edades de la semilla tomada de lotes mediante muestreos independientes, usando 100 semillas por parcela. El diseño experimental fue completamente al azar con cuatro repeticiones.
Características físicas de las semillas
El porcentaje de humedad de la semilla fue calculado con la fórmula de Bewley y Black (1994). Las semillas fueron deshidratadas 72 h a 72 °C en una estufa (Thelco 31480, EE.UU.) y después se determinó el peso de la biomasa seca.
Para obtener el peso de mil semillas (P1000S) se usó el procedimiento estándar de la ISTA (2004), con ocho repeticiones de 100 semillas, las cuales fueron pesadas en una balanza Ohaus (Pine Brook, China), con precisión de 0.001 g.
Calidad fisiológica de las semillas
Para la prueba de germinación, las semillas fueron depositadas en cajas petri con papel filtro humedecido y colocadas en una germinadora SD8900 (Seedburo Inc., EE.UU.) a 25±1 °C en oscuridad por 8 d, según las normas de la ISTA (2004). La velocidad de emergencia de radícula (VErad) fue medida con la fórmula de Maguire (1962), contando cada 24 h el número de radículas emergidas. Al final de la prueba fueron medidos los porcentajes de germinación (G) y viabilidad (Vi) que considera el número de plántulas normales y plántulas anormales.
La prueba de velocidad de emergencia en arena fue usada para evaluar el vigor de las semillas, las cuales fueron sembradas en un semillero con arena esterilizada a 1 cm de profundidad a humedad a saturación. Cada 24 h las plántulas emergidas fueron registradas y la velocidad de emergencia de plántulas (VEA) fue calculada con la fórmula de Maguire (1962). Al final de la prueba (10 d después de la siembra) se evaluó el porcentaje de emergencia (PE). Al azar, 20 plantas por repetición fueron secadas en una estufa modelo 31480 (Thelco, EE.UU.) y fue pesada su biomasa seca (PS, en mg).
Cinética de imbibición (CI) y respiración
Para evaluar la CI las 100 semillas fueron colocadas al azar en cajas petri cada 24 h por 7 d y en cada muestreo fue pesada la biomasa fresca y seca para calcular el contenido de humedad. Los resultados fueron graficados para obtener la curva de CI durante la germinación.
Antes de secar las semillas, la actividad respiratoria de la semilla (nmol CO2 g-1 s-1) en cada repetición fue medida con un aparato de fotosíntesis CI-301PS (CID Inc., Canadá) y el promedio de la tasa de respiración por tratamiento fue calculado.
Permeabilidad de las membranas
El efecto de los años de almacenamiento en la permeabilidad de las membranas celulares fue determinado en la solución de imbibición de las semillas mediante conductividad eléctrica (CE) y potencial osmótico (PO). La CE (μScm-1 g-1) fue medida en las semillas que fueron pesadas y colocadas en 60 mL de agua desionizada a 25 °C por 24 h, con un aparato de conductividad Modelo 72729 (Oakton, Singapur).
Cuatro repeticiones de 200 semillas fueron tomadas al azar para medir PO en 2 mL de agua desionizada a 24 °C por 24 h, con un osmómetro calibrado de presión de vapor modelo 5500 (Wescor Inc., EE.UU.). Los resultados fueron convertidos a MPa con la fórmula de Van't Hoff (1887, citado por Salisbury y Ross, 1994).
Análisis estadístico de los datos
Para todas las variables fueron calculados promedios y desviaciones estándar por tratamiento usando Microsoft Excel 2003. Con los promedios se calcularon curvas polinomiales mediante el programa Curve Expert version 1.31 (Daniel Hyams, EE. UU.).
Estudio histológico de las membranas
Las membranas fueron observadas en un microscopio electrónico de transmisión Carl Zeiss (EM9, Alemania), usando 20 semillas al azar por tratamiento embebidas por 24 h. Muestras de tejido fueron fijadas por 30 min a 4 °C en una solución de glutaraldehido a 25% y amortiguador fosfato 0.1 M, a pH 7.1. Las resinas fueron preparadas con dióxido de vinilciclohexano, eter diglicidil de polipropileneglicol, anhidro succínico nonenil y dimetilaminoetanol. Los cortes (60 a 90 nm espesor) fueron hechos con un ultramicrótomo Reichert (Mod 570, Austria) con navaja de diamante; la tinción se hizo con acetato de uranilo y citrato de plomo. Las imágenes fueron impresas con película Kodak 4489 electrón 7X7 cm (EE.UU.).
RESULTADOS Y DISCUSIÓN
Efecto del deterioro en la germinación y vigor de la semilla
El contenido de humedad no varió entre edades de la semilla, lo cual significa que todas estuvieron en equilibrio con el ambiente; su valor promedio fue 5.2% considerado bajo y no interviene en la evolución de las otras variables. En cambio, todas las variables de germinación y vigor disminuyeron linealmente durante los años de almacenamiento, como lo evidencian tasas constantes de deterioro, excepto en el peso seco de la plántula (Figura 1). Todos los modelos lineales tuvieron un alto grado de ajuste (R2>0.97), o sea, fueron confiables para predicción en las condiciones experimentales; además, son inéditos en esta especie.
Estos resultados concuerdan con Delouche (2002) quien señaló que la semilla de cualquier especie presenta su más alto nivel de vigor y potencial germinativo en la madurez fisiológica, desde la cual se inicia un proceso continuo e irreversible de deterioro hasta perder su capacidad germinativa. Así, el deterioro de una semilla se podría entender como una serie de cambios en el tiempo, que afecta funciones vitales y su desempeño, hasta causar su muerte (Bradford, 2004).
La germinación tuvo un valor inicial de 89% a la cosecha y disminuyó 8.7% por año en las condiciones experimentales (Figura 1A y Cuadro 1). Esto significa que en dos años, las semillas de tomate de cáscara reducen su germinabilidad en 30%, y probablemente habría baja emergencia en campo.
Para el mismo lote de semillas la viabilidad inicial a la cosecha fue 93.5% y la tasa anual de pérdida 8.3% (Figura 1B y Cuadro 1). Entonces, cerca de 5% de las semillas vivas no germinan en una plántula normal en las condiciones de una prueba estándar de germinación. Así, la tasa de pérdida de viabilidad fue ligeramente menor que la de germinación.
El porcentaje de emergencia (PE), inicial a la cosecha fue 72.4% (Cuadro 1). Es decir, la germinabilidad en este sustrato fue 17% inferior a la germinación estándar; pero la tasa de pérdida anual en emergencia fue 6.9%, menor que las tasas de pérdida en germinación y viabilidad (Cuadro 1). Las diferencias entre germinación y emergencia son debidas a que las condiciones de la prueba de germinación son más estables (25 ±1 °C) que las del semillero donde se hizo la prueba de vigor (21.4±10.4 °C). Además, en arena la plántula debe vencer la resistencia del sustrato, ya que en el semillero la profundidad de siembra fue 1 cm y las plántulas tuvieron que crecer más para ser registradas como emergidas (Bradford, 2004). Finalmente, el envejecimiento también causó pérdidas en el peso seco de plántulas derivadas de la semilla (Figura 1F) pero no lineales como en los casos anteriores, sino que hubo un mayor deterioro entre el segundo y tercer año de almacenamiento.
Contenido de reservas de la semilla
El peso de 1000 semillas (P1000S) de tomate de cáscara disminuyó exponencialmente (Figura 2) y la mayor reducción ocurrió en los primeros dos años. Según el modelo matemático, al momento de la cosecha el P1000S debió ser 1846.3 mg, es decir, en dos años perdió 35% de sus reservas. Tal reducción debió causar la disminución de 20% en el peso seco de la plántula, entre los 2 y 3 años de edad (Figura 1F).
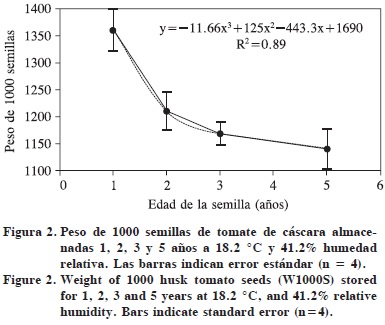
Según Copeland y McDonald (2001), una causa de la pérdida de germinación en lotes almacenados durante varios años, es el consumo de reservas de la semilla. Durante el envejecimiento natural de la semilla de maíz se reduce el contenido total de reservas, como carbohidratos y proteínas (Basavarajappa et al., 1991), que es una causa importante de los efectos en el crecimiento y desarrollo de la nueva plántula al avanzar el deterioro de la semilla. Sin embargo, Cruz-Pérez et al. (2003) detectaron semillas de maíz sin cambios significativos en el peso seco del endospermo, es decir, las reducciones de reservas no siempre ocurren.
Otra variable relacionada con el vigor de la semilla es la respiración, la cual es controlada por la cantidad de sustratos respirables como los glúcidos (Lambers et al., 1991). En el tomate de cáscara las semillas secas (antes de ser embebidas) tuvieron una tasa promedio de 1.1 nmol CO2 g-1 s-1, sin diferencias estadísticas entre años de almacenamiento (datos no mostrados), mientras que el promedio de la respiración de las semillas a los 6 d de la imbibición fue 11.1 nmol CO2 g-1 s-1 (Figura 3), debido a la reactivación del metabolismo. Entonces, durante el almacenamiento las semillas estaban respirando a tasas equivalentes al 10% de la respiración a los 6 d de la imbibición.

Además, el almacenamiento redujo la tasa respiratoria de semillas medida en el día 6 de la imbibición, con una tendencia cinética no lineal (Figura 3), ya que en el año 5 la tasa respiratoria fue sólo 46% de la de semillas de 1 ó 2 años. Esta cinética respiratoria también muestra que desciende después de los 2 años de edad de la semilla, lo cual sugiere que la tasa respiratoria cambió cuando las reservas de la semilla disminuyeron 35%, es decir, cuando cada semilla pesó menos de 1.25 mg (Figura 2), considerando el peso de la semilla como un indicador de su contenido de reservas.
La respiración de la semilla provee energía requerida para la germinación (De Viseer et al., 1990; Stewart et al., 1990) y su intensidad depende de la funcionalidad de las mitocondrias (Morohashi et al., 1981; Bewley y Black, 1994). Por tanto, las semillas vigorosas requieren mayor aporte energético que las no vigorosas (Ram y Wiesner, 1988). Puesto que en el presente estudio la respiración no fue medida directamente en mitocondrias aisladas, no se puede saber si la disminución en la respiración por envejecimiento de la semilla podría deberse a anomalías en la utilización de las reservas usadas como sustratos, a la disponibilidad de éstas o al estado físico y fisiológico de las mitocondrias. Ferguson et al. (1990) también observaron que el deterioro de la semilla de soya (Glycine max L.) redujo la tasa respiratoria y la velocidad de emergencia de radícula, respuestas asociadas con la pérdida del vigor de la semilla.
Además se encontró que conforme la semilla del tomate de cáscara envejecía, la radícula tardaba más en emerger, en particular al envejecer de 3 a 5 años (Figura 4).
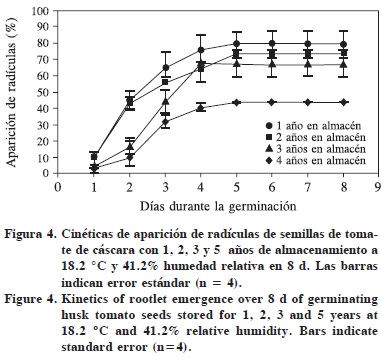
Permeabilidad de membranas y cinética de imbibición
La conductividad eléctrica (CE) de la solución de imbibición aumentó linealmente con la edad de las semillas a una tasa de 12.55 /íScm-1 g-1 año-1 (Figura 5A), a la vez que el PO decrecía a una tasa de 0.43 MPa año-1. La pérdida de vigor se ha asociado con una permeabilidad creciente de las membranas celulares, y los lotes de semillas que muestran una alta germinación en laboratorio pero liberan grandes cantidades de electrolitos son considerados de bajo vigor en condiciones de estrés. Por tanto, la CE se ha aceptado como indicador del vigor en semillas de algunas especies. En pepino (Cucumis sativa L.), la pérdida de viabilidad de semillas envejecidas a 38 °C y 100% humedad relativa, estuvo asociada con el aumento de la CE y la peroxidación de lípidos de la membrana (Smith y Berjak, 1995). Tanto el aumento en CE como la reducción en PO se consideran evidencias de un incremento en la permeabilidad de las membranas celulares de la semilla, y sería pérdida de su integridad fisiológica o física. Según Bewley y Black (1994), el deterioro de las membranas en semillas se debe a una disminución de fosfolípidos, carbohidratos y proteínas, así como a la reducción en la actividad de la peroxidasa, durante el secado en la maduración.
La cinética de imbibición no fue diferente (p>0.05) entre las edades de la semilla de tomate de cáscara (Figura 6), es decir, la hidratación no varió entre las semillas viejas y nuevas. En contraste, Cruz et al. (1995) observaron una relación directa entre la cinética de imbibición y el deterioro en semilla de maíz (Zea mays L). Según Gatica et al. (1995) y Cruz et al. (1995), la absorción de agua presenta una cinética trifásica en las semillas de diferentes especies. En tomate de cáscara sólo se encontraron dos fases: la primera de las 0 a las 24 h y se llega a un máximo de absorción; la segunda inició a las 24 h y el contenido de humedad de la semilla tendió a mantenerse constante. Es posible que la primera fase de absorción de agua no se haya detectado en este experimento ya que el intervalo de mediciones fue 24 h, y la primera fase ocurre de 8 a las 12 h. Antes de imbibición (0 h), todas las semillas tenían un bajo contenido de agua (5%). La reparación de membranas celulares y del ADN y la síntesis de proteínas que usan los ARNm ocurren durante las primeras 8 a 12 h y, según Bewley (1997), la síntesis de mitocondrias y proteínas ocurre después de las 12 h, mientras que la movilización de reservas de la semilla, el alargamiento y división celular se dan después de 50 h de iniciada la imbibición.

Las observaciones histológicas realizadas al microscopio electrónico no evidenciaron diferencias anatómicas significativas de las membranas entre los tratamientos (Figura 7): en semillas nuevas (Figura 7a) y viejas (Figura 7b) se detectaron poros en la membrana celular discontinua en frecuencias similares. Lo anterior contrasta con lo señalado por Robert y Sherlie (1985) quienes afirmaron que en semillas de soya existe una ruptura de membranas ocasionada por el envejecimiento de las semillas. En tomate de cáscara, la integridad física de las membranas y paredes celulares en la semilla no sufrió cambios observables al aumentar el periodo de almacenamiento hasta 5 años. Es decir, el deterioro de la semilla de tomate de cáscara no se debió al daño físico de membranas de la semilla, pero sí a su mayor permeabilidad a los solutos debida probablemente a la peroxidación de los lípidos de las membranas, observada en semillas de especies como maíz, cebolla y berenjena (McDonald, 2000).
CONCLUSIONES
La semilla de tomate de cáscara almacenada a 18.2±5 °C y 41.2±10% humedad relativa por 1, 2, 3, y 5 años tuvo deterioros y reducciones en la germinación (8.7% anual), viabilidad (8.3% anual) y emergencia de plántula en arena (6.9% anual). Dichas reducciones pueden ser explicadas por la disminución de las reservas y de la energía disponible para los procesos de crecimiento, así como daños en las membranas celulares. El peso de mil semillas disminuyó 35% en los primeros dos años y la respiración sólo se redujo hasta el tercer año de almacenamiento.
El daño ocasionado en la membrana por el deterioro causó un aumento de 12.5 µS cm-1 g-1 año-1 en la conductividad eléctrica de la solución de imbibición y una reducción de 0.43 MPa en el potencial osmótico, pero no hubo diferencias entre edades de la semilla en la cinética de imbibición y en la integridad física de estas membranas. Por tanto, es evidente que el deterioro de las semillas de tomate de cáscara provoca cambios en la composición química de las membranas que permiten escapar solutos.
AGRADECIMIENTOS
Los autores agradecen a la Dra. Elizabeth Cárdenas Soriano de Fitosanidad del Colegio de Postgraduados, por su valiosa ayuda en la realización e interpretación de los resultados del estudio de microscopía electrónica.
LITERATURA CITADA
Basavarajappa, B. S., H. S. Shetty, and H. S. Prakash. 1991. Membrane deterioration and other biochemical changes associated with accelerated ageing of maize seeds. Seed Sci. Technol. 19: 279-286. [ Links ]
Bradford K. J. 2004. Seed Production and Quality. 1st edition. Department of Vegetable Crop and Weed Science. University of California. Davis, CA. USA. 134 p. [ Links ]
Bernal, L. I., and A. C. Leopold. 1992. Changes in soluble carbohydrates during seed storage. Plant Physiol. 98: 1207-1210. [ Links ]
Bewley, J. D. 1997. Seed germination and dormancy. Plant Cell 9: 1055-1066. [ Links ]
Bewley, J. D., and M. Black. 1994. Seeds, Physiology of Development and Germination. Plenum Press. Second Ed, New York. USA. 445 p. [ Links ]
Copeland, O. L., and M. B. Mcdonald. 2001. Principles of Seed Science and Technology. 4th edition. Kluwer Press, New York. USA. 488 p. [ Links ]
Cruz, G. F., V. A. González-Hernández, J. C. Molina, M., and J. M. Vázquez, R. 1995. Seed deterioration and respiration as related to DNA metabolism in germinating maize. Seed Sci. Technol. 23: 477-486. [ Links ]
Cruz-Pérez, A. B., V. A. González-Hernández, M. A. Mendoza-Castillo, y M. L. Ortega-Delgado. 2003. Marcadores fisiológicos de la tolerancia al envejecimiento de semilla en maíz. Agrociencia 37: 371-381. [ Links ]
Delouche, J. C. 2002. Germinación, deterioro y vigor de semillas. Seed News 6: 6 [ Links ]
De Visser, R., H. M. Dekhuijzen, and D. R.Verkerke. 1990. Control of seed respiration and growth in Vicia fava by oxygen and temperature: No evidence for an oxygen diffussion barrier. Plant Physiol. 93: 668-672. [ Links ]
Ferguson, J. M., D. M. TeKrony, and D.B. Egli. 1990. Changes during early soybean seed and axes deterioration: I. Seed quality and mitocondrial respiration. Crop Sci. 30: 175-179. [ Links ]
Gatica, V. M., J. C. Molina M., A. Carballo C., y V. A. González-Hernández. 1995. Tasa respiratoria y vigor de semillas de girasol. Rev. Fitotecnia Mex. 18: 25-34. [ Links ]
ISTA (International Seed Testing Association). 2004. International Rules for Seed Testing. Rules 2004. ISTA editions, Zurich, Switzerland. 243 p. [ Links ]
Lambers, H., A. van der Werf, and H. Konings. 1991. Respiratory patterns in roots in relation to their functioning. In: Waisei, Y., P. Eshel, and U. Kafkaki (eds). Plant Roots. The Hidden Half. Marcel Dekker Inc., New York. USA. pp: 229-263. [ Links ]
McDonald, M. B. 2000. Seed priming. In: Black M., and J. D. Bewley (eds). Seed Technology and its Biological Basis. Sheffield Academic Press, London. England. pp: 287-325. [ Links ]
Maguire, J. 1962. Speed of germination-aid in selection and evaluation for seedling emergence and vigor. Crop Sci. 2: 176. [ Links ]
Morohashi, Y., J. D. Bewley, and E. C. Yeung. 1981. Biogenesis of mitochondria in imbibed peanut cotiledons: Influence of the axis. J. Exp. Bot. 32: 605-613. [ Links ]
Pérez, M., L., y J. Granados A. 2001. Fertilización nitro-fosfórica en tomate de cáscara (Physalis ixocarpa Brot) de riego en Irapuato, Guanajuato, México. Acta Universitaria 11: 19-25. [ Links ]
Ram, C., and L. E. Wiesner. 1988. Effects of artificial ageing on physiological and biochemical parameters of seed quality in wheat. Seed Sci. Technol. 16: 579-587. [ Links ]
Robert, L. T., and H. W. Sherlie. 1985. Reversal of the effects of aging in soybean seeds. Plant Physiol. 77: 584-586. [ Links ]
SAGARPA (Secretaria de Agricultura, Ganaderia, Desarrollo Rural, Pesca y Alimentación). 2003. Anuario estadístico de la producción agrícola de Mexico. Centro de Estadística Agropecuaria. SAGARPA. D. F. México. 909 p. [ Links ]
Salisbury, F. B., y C. W. Ross. 1994. Difusión, termodinámica y potencial hídrico. In: Salisbury F., y C. Ross (eds). Fisiologia Vegetal. Grupo Editorial Iberoamérica, S.A. de C.V. México, D.F. pp: 29-46. [ Links ]
Smith, M. T., and P. Berjak. 1995. Deteriorative changes associated with the loss of viability of stored desiccation - tolerant and desiccation sensitive seeds. In: Kigel J., and G. Galili (eds). Seed Development and Germination. Marcel Dekker Inc., New York. USA. pp: 701-746. [ Links ]
Stewart, R. C., A. Martin, L. Reding, and S. Cerwick. 1990. Respiration and alternative oxidase in corn seedling tissues during germination at different temperatures. Plant Physiol. 92: 755-760. [ Links ]














