Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.42 n.6 Texcoco Aug./Sep. 2008
Protección vegetal
Especies de Colletotrichum en chirimoya (Annona cherimola Mill.)
Species of Colletotrichum in cherimoya (Annona cherimola Mill.)
Ramón Villanueva–Arce1 , María de J. Yáñez–Morales2,* , Ana M. Hernández–Anguiano2
1 Unidad Profesional Interdisciplinaria de Biotecnología. Instituto Politécnico Nacional. 07340. Avenida Acueducto s/n. Ticomán, México, D. F. (rarce@ipn.mx).
2 Fitopatología. Campus Montecillo. Colegio de Postgraduados. 56230. Km. 36.5 Carretera México–Texcoco. Texcoco, Estado de México. *Autor responsable: (yanezmj@colpos.mx)
Recibido: Septiembre, 2007.
Aprobado: Julio, 2008.
Resumen
Dado que hay pocos estudios fitosanitarios en el cultivo de chirimoya, el objetivo de este estudio fue generar información sobre las especies de Colletotrichum asociadas con diferentes síntomas de enfermedad en frutos y hojas de chirimoya. En medios de cultivo papa–dextrosa–agar y papa–zanahoria–agar se seleccionaron seis aislamientos de Colletotrichum de frutos y hojas recolectados en el Estado de Medra y Michoacán. Se identificaron y analizaron molecularmente tres especies de Colletotrichum considerando las estructuras morfológicas asexuales y sexuales, las diferencias en cultivo, la identificación molecular de los genes rARN por PCR–ITS y las pruebas de patogenicidad. En frutos se identificó C. fragarie, C. gloeosporioides y C. orbiculare como causantes de antracnosis, y C. gloeosporioides, de mancha negra y pudrición de pedúnculo. En hoja se encontró C. gloeosporioides asociado con síntomas de antracnosis. Las identificaciones se corroboraron molecularmente y las secuencias se depositaron en el Banco de Genes del NCBI. La especie C. orbiculare así como los síntomas de antracnosis, mancha negra y pudrición de pedúnculo constituyen nuevos reportes fitosanitarios en frutos y hojas de chirimoya.
Palabras clave: Antracnosis, mancha negra, pudrición de pedúnculo.
Abstract
Given that there are few phytosanitary studies of the cherimoya crop, the objective of this study was to generate information of the species of Colletotrichum associated with different symptoms of disease in fruits and leaves of cherimoya. In culture media of potato–dextrose–agar and potato–carrot–agar, six isolates of Colletotrichum were selected of fruits and leaves collected in the State of México and Michoacán. Three species of Colletotrichum were identified and molecularly analyzed, considering the asexual and sexual morphological structures, the differences in culture, the molecular identification of the genes rRNA by PCR–ITS and the pathogenicity tests. In fruits, C. fragariae, C. gloeosporioides and C. orbiculare were identified as causes of anthracnosis, and C. gloeosporioides as causes of black spot and stem–end rot. In the leaf, C. gloeosporioides was found associated with symptoms of anthracnosis. The identifications were confirmed molecularly and the sequences were deposited in the Gene Bank of the NCBI. The species C. orbiculare, along with the symptoms of anthracnose, black spot and stem–end rot constitute new phytosanitary reports in fruits and leaves of cherimoya.
Key words: Anthracnose, black spot, stem–end rot.
INTRODUCCIÓN
En regiones tropicales y subtropicales Colletotrichum causa antracnosis en cereales, frutales, hortalizas, leguminosas y pastos (Freeman, 2000). En frutales, otros síntomas son: muerte descendente de ramas jóvenes en cítricos (Citrus spp.), tizón de flores en mango (Mangifera indica L.), y pudrición de corona en plátano (Musa spp.) (Waller, 1992). Varias especies de Colletotrichum pueden infectar un mismo hospedante, como en fresa (Fragaria xananassa Duch.), donde C. acutatum Simmonds ex Simmonds, C. fragariae Brooks y C. gloeosporioides (Penz.) Penz. & Sacc. causan pudrición en frutos, estolones, hojas y pecíolos (Smith y Black, 1990; Gunnell y Gubler, 1992). En cítricos, C. acutatum y C. gloeosporioides ocasionan caída de frutos pequeños, manchas foliares y pudriciones en postcosecha (Zulfiqar et al., 1996). Una misma especie de Colletotrichum puede infectar a más de un cultivo, como C. gloeosporioides, patógeno de postcosecha que infecta aguacate (Persea americana Miller), mango, papaya (Carica papaya L.), plátano y otros cultivos (Dickman et al., 1994; Ploetz, 1994; Prusky, 1994). En California y Florida, C. gloeosporioides y otras especies de Colletotrichum no identificadas causan antracnosis y pudrición de frutos en chirimoya (Annona cherimola Mill.) (Farr et al., 1989). En Michoacán, este patógeno, además de inducir síntomas en frutos, también ocasiona antracnosis en hojas (Nava–Díaz et al., 2000; Villanueva–Arce et al., 2005). La producción nacional de chirimoya se da en huertos establecidos principalmente en Morelos (232 ha), Michoacán (157 ha) e Hidalgo (10 ha) (CEA, 2004), y en árboles dispersos en traspatio en el Estado de México.
Hay poca información de los problemas fitosanitarios en chirimoya, en particular de las enfermedades relacionadas con hongos, que es necesaria para establecer un buen manejo del cultivo que resulte en productos con calidad comercial competitivos en mercados internacionales. Por tanto, el objetivo de este estudio fue generar información sobre las especies de Colletotrichum asociadas con diferentes síntomas de enfermedad en frutos y hojas de chirimoya mediante la identificación y caracterización molecular de genes ribosomales rARN, con la hipótesis de que más de una especie de Colletotrichum causa antracnosis en este cultivo.
MATERIALES Y MÉTODOS
Muestreos y síntomas
De julio a septiembre de 2003 se hicieron tres viajes a Coatepec Harinas, Estado de México y a Salvador Escalante, Michoacán. En campo se registró la incidencia de enfermedad en frutos de 1000 árboles, 10 frutos por árbol, seleccionados al azar. En cada localidad se recolectaron 25 frutos maduros e inmaduros con síntomas de antracnosis, pudrición de pedúnculo y mancha negra; y en Salvador Escalante, 25 hojas de chirimoya con síntomas de enfermedad. Los síntomas se caracterizaron visualmente y se registró la severidad de daño. En frutos, la severidad se determinó con una escala predeterminada de 1 a 8 y transformada a porciento (0–50); y en hojas, calculando el área total enferma expresada en porcentaje.
Identificación y patogenicidad
Aislamientos
De cada uno de los 25 frutos y hojas recolectadas, por muestreo y localidad, se tomaron tres trozos de tejido sintomático (600 trozos en total), se desinfestaron con hipoclorito de sodio a 1.5% por 3 min, se lavaron tres veces con agua destilada estéril, se secaron y sembraron en cajas Petri con papa–dextrosa–agar (PDA, Bioxon®). Después de 3 d a 25±2 °C en luz blanca continua (LBC) de lámparas de 40 W (480 nm) (Solar®), los aislamientos de Colletotrichum desarrollados se purificaron por cultivo monoconidial y preservaron a —85 °C por suspensión de conidios en glicerol a 20%.
Especies identificadas
De cada aislamiento de Colletotrichum purificado se seleccionaron seis colonias representativas para su identificación, con base en sus estructuras morfológicas asexual (anamorfo) y sexual (teleomorfo). En aislamientos de 10 d de edad (dd) se seleccionaron al azar 50 estructuras asexuales: conidios, setas y apresorios. De cada estructura se registró la forma, el color y el tamaño (ítm). Para inducir la formación de apresorios se colocó una gota de agua destilada estéril con conidios en un portaobjeto y se incubó a temperatura ambiente (Villanueva–Arce et al., 2005). De cultivos de 14 a 20 d se seleccionaron 50 peritecios (estructuras sexuales) y se caracterizó la forma, el color y el tamaño de 50 ascosporas, de cada uno. La identificación del anamorfo se hizo con: para género con las claves de Barnett y Hunter (1998); para especie con las de Sutton (1980, 1992) y referencias descriptivas de diversos autores; y la del teleomorfo con la descripción de Mordue (1971).
Pruebas de patogenicidad
Con cada especie identificada se inocularon, sin herida, cuatro frutos inmaduros y sanos de chirimoya variedad Concha Lisa. Para esto se depositó una gota de 50 µL de agua destilada estéril con 1 x 105 conidios (obtenidos de colonias 8 dd) sobre la superficie de cada fruto, lavado y desinfestado con hipoclorito de sodio a 1.5% por 3 min. Como testigo hubo cuatro frutos inoculados con 50 µL de agua destilada estéril. Después de la inoculación, los frutos se colocaron en cámara húmeda a 25 °C. A los 10 d, se midió el diámetro y la profundidad del tejido infectado y se hicieron reaislamientos en cultivo puro para su identificación.
Diferencias en cultivo entre aislamientos
Durante el cultivo de aislamientos (tratamientos) de Colletotrichum se evaluó velocidad de crecimiento, forma de la colonia y esporulación para su caracterización cultural (cultivo). El diseño experimental fue completamente al azar con un arreglo factorial: 6 aislamientos (MEX–1, MEX–2, MEX–3, MICH–1, MICH–2 y MICH–3), 2 medios de cultivo [PDA y PCA (papa–zanahoria–agar, 20 g L–1)] y 5 condiciones de incubación [I, II y III en LBC y temperatura de 27±1, 25±3, y 21 ±1 °C; y, IV y V en luz negra continua (LNC) de lámparas de 40 W (365 nm) (Solar®) y 25±3 y 21 ±1 °C]; y 4 repeticiones por tratamiento. Cada tercer día y hasta el llenado del medio con crecimiento del hongo, se midió el diámetro de colonia (cm), se registró el tipo de micelio aéreo o raso, y el color por el anverso y reverso de la caja.
Análisis estadístico
Se hizo un análisis de varianza con los datos y una prueba de comparación de medias (Tukey, p<0.05) usando SAS (1988).
Caracterización molecular
De los 6 aislamientos se obtuvieron cultivos monoconidiales para extraer ADN de micelio producido en caldo de papa (200 g papa, 20 g dextrosa y 1000 mL agua destilada) y en agitación constante a 200 rpm por 72 h. La extracción de ADN se hizo de acuerdo a Ahrens y Seemüller (1992), la evaluación de la calidad por electroforesis en gel de agarosa (Ultrapure, Gibco, USA) a 1%, y la cuantificación en un espectrofotómetro Perkin Elmer® (Lambda BIO 10). Para la amplificación de las regiones internas ITS1 e ITS2 se usaron los iniciadores universales ITS1 (TCCGTAGGTGA–ACCTGCGG) e ITS4 (TCCTCCGCTTATTGATATGC) (White et al., 1990). La mezcla de reacción de PCR constó de: agua ultrapura estéril, 13.22 µL; solución amortiguadora 1X, 2.5 µL; MgCl2 2.5 mM, 2.08 µL; dNTPs 0.2 mM, 2 µL; iniciadores ITS1 e ITS4 20 pMol cada uno, 2 fih por iniciador; Taq–DNA polimerasa 1 U (Biotecnologías Universitarias®), 0.2 µL; y muestra problema de ADN 80 ng, 1 µL, con volumen final de 25 µL. La reacción se efectuó en un termociclador Perkin–Elmer (Mod. CT 2400) con el siguiente programa: desnaturalización inicial a 95 °C, por 2 min; 30 ciclos de desnaturalización a 95 °C, por 1 min; alineamiento a 50 °C, por 30 s; extensión inicial a 72 °C por 2 min; y una extensión final a 72 °C por 10 min. El producto de PCR se analizó por electroforesis en gel de agarosa (1 %) y tiñó con bromuro de etidio. El producto amplificado se visualizó en un transiluminador (Gel Doc 2000, BIO RAD®). La purificación del fragmento amplificado se hizo con QIAquick® PCR Purification Kit, según el protocolo de la compañía. El producto se secuenció en dos direcciones (5' 3' y 3
3' y 3 5') en un equipo ABI PRISM 3700®. La secuencia se analizó con el software Lasergene® 2001 Versión 5 (DNASTAR, 2001), y se alineó con la base de datos del Banco de Genes del National Center for Biotechnology Information (NCBI). De los valores cuantitativos generados, se consideró el de mayor valor y se generó un índice de similaridad con el programa de alineamiento para dos secuencias por "Martinez NW Method" de DNASTAR. El análisis filogenético de las secuencias se hizo con el programa MEGA 4: Molecular Evolutionary Genetics (Kumar et al., 2004), el método de Neighbor–Joining, modelo Kimura 2–parameter, y considerando 5000 réplicas de Bootstrap; se incluyó, la secuencia NCBI con número de registro EF672242 como raíz. Las secuencias de estudio se depositaron en el Banco de Genes del NCBI.
5') en un equipo ABI PRISM 3700®. La secuencia se analizó con el software Lasergene® 2001 Versión 5 (DNASTAR, 2001), y se alineó con la base de datos del Banco de Genes del National Center for Biotechnology Information (NCBI). De los valores cuantitativos generados, se consideró el de mayor valor y se generó un índice de similaridad con el programa de alineamiento para dos secuencias por "Martinez NW Method" de DNASTAR. El análisis filogenético de las secuencias se hizo con el programa MEGA 4: Molecular Evolutionary Genetics (Kumar et al., 2004), el método de Neighbor–Joining, modelo Kimura 2–parameter, y considerando 5000 réplicas de Bootstrap; se incluyó, la secuencia NCBI con número de registro EF672242 como raíz. Las secuencias de estudio se depositaron en el Banco de Genes del NCBI.
RESULTADOS Y DISCUSIÓN
Síntomas
En frutos se registraron síntomas de antracnosis, mancha negra y pudrición de pedúnculo. La antracnosis se caracterizó por presentar lesiones necróticas circulares (diámetro 1 mm a 4 cm) o irregulares, por coalescencia, hundidas con bordes levantados, por hundimiento del tejido, y con masas de conidios salmón–naranja (Figura 1b) formando acérvulos (Figuras 1a, 1c 1d). En algunos frutos las lesiones se extendieron a la pulpa. La mancha negra se presentó como áreas oscuras en la epidermis, brillantes e irregulares y de tamaño variable (Figura 1e). La pudrición de pedúnculo consistió de lesiones necróticas circulares alrededor de la base del pedúnculo, sin bordes definidos, 2 cm de diámetro y con formación de masas naranja de conidios; el daño se extendió a la cáscara y la pulpa (Figura 1f). La mayor incidencia de enfermedad fue la antracnosis (85%) en Michoacán, seguida de pudrición de pedúnculo (10%) y mancha negra (3%); con grados de severidad de 17 a 46% (Cuadro 1). El alto porcentaje de incidencia y severidad de antracnosis en Michoacán podría relacionarse con el mayor número de huertos establecidos, la mayor densidad de árboles ha–1, y el manejo del cultivo (CEA, 2004); en contraste, en el Estado de México la producción se da en árboles dispersos en traspatio y hubo un bajo porcentaje.
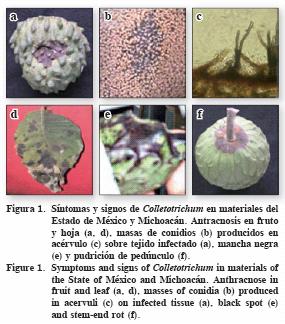
En fruto se encontró a C. fragariae y a C. gloeosporioides ocasionando antracnosis en Michoacán y en el Estado de México. Farr et al. (1989) reportaron sólo a C. gloeosporioides como el agente causal de antracnosis en frutos cultivados en EE.UU.; y Nava–Díaz et al. (2000) reportaron a C. gloeosporioides como el agente causal de un síntoma similar a mancha negra en hojas de chirimoya en Michoacán. Sin embargo, un análisis más detallado realizado en el presente estudio, indicó que este síntoma es en realidad antracnosis, por su típica sintomatología que presenta.
Identificación y patogenicidad
Especies identificadas
De 150 frutos con síntoma de antracnosis recolectados en ambas localidades, se aislaron tres especies de Colletotrichum: C. fragariae (100%), C. gloeosporioides (40%) y C. orbiculare (100%) (Cuadro 1). Sin embargo, C. orbiculare se aisló de material del Estado de México y C. fragariae de Michoacán. Probablemente C. orbiculare y C. fragariae correspondan a alguna de las especies reportadas para Colletotrichum spp. por Farr et al. (1989). Hasta 1992, el único hospedante consignado de C. fragariae era fresa (Gunnell y Gubler, 1992), pero Villanueva–Arce et al. (2005) reportaron a esta especie en chirimoya. En hojas sólo se aisló a C. gloeosporioides (100%), especie asociada también con mancha negra (42%) y pudrición de pedúnculo (100%).
Morfología de especies
Se encontraron diferencias y similitudes en las estructuras asexuales producidas por C. fragariae, C. gloeosporioides y C. orbiculare. En general los conidios encontrados fueron hialinos, aseptados, cilíndricos y rectos, formando masas mucilaginosas de color salmón a naranja. Los conidios de C. gloeosporioides, presentaron extremos obtusos pero algunos angostados; los de C. orbiculare, con un extremo obtuso y otro angostado, al igual que los de C. fragariae. Sin embargo, en esta especie los conidios fueron menos anchos pero igual de largos que los del aislamiento MEX–3 de C. gloeosporioides (Cuadro 2, Figura 2c). En contraste los conidios de C. orbiculare fueron menos largos (Figura 2b).
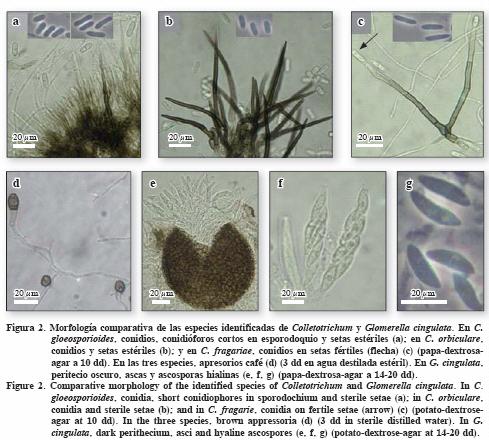
Las setas formadas por C. fragariae, fueron fértiles y largas (hasta 290 µm) con producción apical de conidios (Figura 2c) (Gunnell y Gubler, 1992); en contraste, las de las otras dos especies fueron cortas (11–155 µm) y estériles (Figura 2a, b). Dos aislamientos de C. gloeosporioides no produjeron setas (Cuadro 2). Sutton (1992) menciona que no todos los aislamientos de C. gloeosporioides producen setas y que su formación está en función de la humedad relativa y de las condiciones de incubación del aislamiento. Por definición, las setas son hifas de crecimiento determinado, de pared gruesa, oscura y estériles (no producen conidios) (Kirk et al., 2001). De acuerdo con los principios de conidiogénesis, las setas fértiles poseen una célula conidiogénica apical con un sólo lóculo conidiogénico en la punta (Figura 2c), a diferencia de las setas estériles (Figura 1a, b). Así, las setas no pueden considerarse como criterio taxonómico para aislamientos de C. gloeosporioides o para diferenciar Colletotrichum de Gloeosporium (otro género relacionado) (Sutton, 1992).
Los apresorios formados por las tres especies de Colletotrichum fueron cafés y de forma y tamaño similar, lo cual concuerda con Sutton (1980, 1992). Además, Walker et al. (1991) señalan que los apresorios no son determinantes en la identificación de estas tres especies (Cuadro 2).
En cuanto a las estructuras sexuales, sólo los aislamientos MEX–1 y MEX–3, de C. gloeosporioides, produjeron peritecios, café–oscuros, esféricos e inmersos, en PCA y PDA, a partir de los 5 dd y en todas las condiciones de incubación (Figura 2e). Por tanto, estos aislamientos se identificaron como Glomerella cingulata (Stoneman) Spauld. & H. Schrenk, de acuerdo con las descripciones de Mordue (1971) y Uecker (1994). Los peritecios formaron ascosporas hialinas, unicelulares, curvadas y fusiformes a los 7–14 dd (Figura 2e, f, g).
Según Bombhe et al. (1988), algunos aislamientos de C. gloeosporioides son heterotálicos (requieren aparearse aislamientos compatibles), mientras que otros son homotálicos (autofértiles) y que las condiciones de incubación para producir peritecios varía entre aislamientos de la misma especie (Bryson et al., 1992). Lo anterior explica el porqué no todos los aislamientos de C. gloeosporioides produjeron a G. cingulata. Sutton (1992) señala que en algunas especies de Colletotrichum, como C. fragariae y C. orbiculare se desconoce su teleomorfo.
Pruebas de patogenicidad
De las tres especies aisladas, sólo C. fragariae y C. orbiculare resultaron patogénicas al reproducir los síntomas de enfermedad en frutos después de 10 d de inoculación; sin embargo, C. fragariae ocasionó lesiones más grandes (9x6 mm, diámetro por profundidad), que C. orbiculare (1x2 mm). Estas especies se reaislaron en cultivo puro. Posiblemente las condiciones de incubación no favorecieron el desarrollo de la enfermedad por C. gloeosporioides, pues se ha documentado su patogenicidad en frutos y hojas de chirimoya (Farr et al., 1989; Nava–Díaz et al., 2000). Esto se infiere porque en las mismas condiciones de incubación las otras dos especies resultaron patogénicas. En otros experimentos con objetivos diferentes (no señalados aquí), C. fragariae y C. orbiculare ocasionaron pudrición total del fruto; por tanto, se espera que frutos cosechados con alguna de las enfermedades ocasionadas por estas especies y en almacenaje inadecuado presenten pudrición total.
Diferencias de cultivo entre aislamientos
Los tres factores evaluados para determinar la velocidad de crecimiento fueron significativos para aislamiento y condición de incubación (p<0.001), y para medio de cultivo (p<0.005). De todos los aislamientos, MICH–3 de C. gloeosporioides registró el mayor crecimiento, 35% más con respecto a MEX–2 de C. orbiculare que tuvo el menor crecimiento; seguido, en orden decreciente de MICH–2 de C. fragariae, MEX–3, MEX–1 y MICH–1 de C. gloeosporioides, en igual tiempo de incubación (10 dd) (Cuadro 3). En PC A el crecimiento fue mayor (0.6 cm) que en PDA y en condición de luz blanca y negra, a 25 y 27 °C (condición I, II, IV), donde los aislamientos no fueron diferentes (p>0.05); en contraste, el menor crecimiento fue a 21 ±1 °C y luz negra (condición V). En general, la respuesta de crecimiento fue proporcional entre aislamientos a cada condición de incubación. Debido a que el valor en crecimiento de MICH–2 de C. fragarie no fue diferente (p>0.05) al de MEX–3 de C. gloeosporioides, el crecimiento no puede ser considerado como un factor de separación entre estas dos especies. Estos resultados están de acuerdo con lo reportado por Smith y Black (1990) y Gunnell y Gubler (1992), quienes indican que la característica de crecimiento no es criterio suficiente para separar a estas dos especies.
En PDA, la forma de la colonia varió entre repeticiones, aislamientos, edad y condición de incubación (Figura 3). En C. gloeosporioides el micelio fue de raso o ligeramente aéreo, a denso y aéreo; y en C. fragariae y C. orbiculare, de poco denso a denso y aéreo. Las tres especies desarrollaron micelio, que al inicio fue blanco o blanquecino (según la condición de incubación) cambiando a salmón, salmón–naranja–rosa, gris o gris–olivo. En todas las condiciones probadas, MICH–2 de C. fragariae y MEX–1 de C. gloeosporioides formaron colonias oscuro intenso; MICH–1 de C. gloeosporiodes colonias claras; y MEX–2 de C. orbiculare, colonias gris–oscuro a casi negro (Figura 3). En PCA la variación en el color de las colonias fue menor. La coloración de colonias se usa como un criterio para la caracterización de especies de Colletotrichum (Sutton, 1980, 1992). En este estudio, las colonias de MICH–2 de C. fragariae presentaron una coloración similar a la de MEX–1 de C. gloeosporioides. Esto indica, en parte, porqué durante algún tiempo C. fragariae se consideró como sinónimo de C. gloeosporioides (Sutton, 1992).
En PCA se registró mayor esporulación (producción) de conidios que en PDA. Esta producción fue inicialmente en conidióforos en micelio aéreo y después en esporodoquios de colonias jóvenes (3–5 dd) (Figura 2a). En MEX–1 y MEX–3 de C. gloeosporioides hubo escasa producción de conidios; sin embargo, estos aislamientos presentaron fase sexual, la cual se ha relacionado con la liberación de ciertas sustancias que inhiben la formación de conidios (Wheeler, 1956).
Las diferencias de cultivo obtenidas entre aislamientos de C. gloeosporioides son comunes en esta especie, considerada compleja, heterogénea y con gran variabilidad en medio de cultivo (Sutton, 1992). Los aislamientos de esta especie se han agrupado en al menos nueve formas por sus diferencias de cultivo (Sutton, 1980). En síntesis, la mejor respuesta de crecimiento de los aislamientos fue en PDA en las condiciones de incubación I, II, IV; sin embargo, todas las condiciones y ambos medios fueron adecuados para la formación del teleomorfo e indujeron esporulación. En PCA no hubo una clara diferenciación en las características de cultivo.
Caracterización molecular
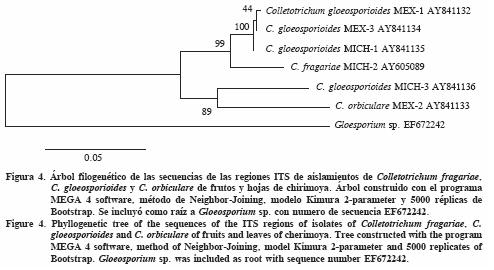
Las secuencias de MEX–1, MEX–3, MICH–1 y MICH–3 de C. gloeosporioides, MICH–2 de C. fragarie, y MEX–2 de C. orbiculare se alinearon con las secuencias de estas mismas especies depositadas en el Banco de Genes del NCBI (Cuadro 4). Con excepción de MICH–3, el índice de similaridad de nucleótidos entre las secuencias de los aislamientos de Colletotrichum de este estudio, respecto al de las especies alineadas en el Banco de Genes, fue 99.6 a 100%; para MICH–3 fue 97.6%. El árbol filogenético mostró la agrupación de todas las secuencias de Colletotrichum en una rama y la secuencia de Gloeosporium (usada como raíz) en otra (Figura 4). Las secuencias de C. gloeosporioides, C. fragarie, y C. orbiculare estuvieron en diferentes subramas, reafirmando la identificación de las tres especies de Colletotrichum (Figura 4). Las secuencias de MEX–1, MEX–3 y MICH–1 de C. gloeosporioides (aislamientos de frutos) se ubicaron en una misma subrama (100% Bootstrap); la de MICH–3 de C. gloeosporioides (aislamiento de hojas), en otra subrama, junto con MEX–2 de C. orbiculare (89% de Bootstrap). Debido a que MICH–3 de C. gloeosporioides mostró diferencias en cultivo, se diferenció molecularmente de los otros tres aislamientos de su misma especie y se aisló sólo de hojas; MICH–3 se propone como una forma diferente del resto de los aislamientos de C. gloeosporioides. Como ya se indicó, estas diferencias están acorde con la gran variabilidad mostrada por C. gloeosporioides en caracteres de cultivo (culturales), morfología, patogenicidad y rango de hospedantes (Sutton, 1980). El árbol filogenético también mostró que genéticamente Gloeosporium y Colletotrichum son géneros totalmente diferentes.
CONCLUSIONES
Más de una especie de Colletotrichum se encontró como causantes de enfermedades en el cultivo de chirimoya. En frutos con síntomas de antracnosis se aisló e identificó a C. gloeosporioides, C. fragariae y C. orbiculare. La especie C. gloeosporioides también se aisló de frutos con síntomas de mancha negra y pudrición de pedúnculo; y de hojas con síntomas de antracnosis. Las identificaciones se corroboraron molecularmente y las secuencias se depositaron en el Banco de Genes del NCBI. Este estudio de C. orbiculare, así como los síntomas de antracnosis, mancha negra y pudrición de pedúnculo, constituyen nuevos reportes fitosanitarios en frutos y hojas de chirimoya.
LITERATURA CITADA
Ahrens, U., and E. Seemüller. 1992. Detection of DNA of plant pathogenic mycoplasmalike organisms by polymerase chain reaction that amplifies a sequence of the 16S rRNA gene. Phytopathology 82: 828–832. [ Links ]
Barnett, H. L., and B. B. Hunter. 1998. Illustrated Genera of Imperfect Fungi. 4th edition. American Phytopathological Society Press. St. Paul, Minnesota, USA. 218 p. [ Links ]
Bombhe, B. B., S. R. Potdukhe, and J. G. Raut. 1988. Peritecial development by the isolates of Colletotrichum. Indian Phytopathol. 41: 627–628. [ Links ]
Bryson, R. J., C. E. Caten, D. W. Hollomon, and J. A. Bailey. 1992. Sexuality and genetics of Colletotrichum. In: Bailey, J. A., and M. J. Jeger (eds). Colletotrichum: Biology, Pathology and Control. CAB International. Wallingford, UK. pp: 27–46. [ Links ]
CEA (Centro de Estadística Agropecuaria). 2004. Sistema de Información Agropecuaria de Consulta (SIACON) V. 1.1: http://www.siea.sagarpa.gob.mx:80//sistemas/siacon/SIACON.html (consultado en enero, 2008). [ Links ]
Dickman, M. B. 1994. Anthracnose. In: Ploetz, R. C., G. A. Zentmyer, W. T. Nishijima, K. G. Rohrbach, and H. D. Ohr (eds). Papaya Diseases Caused by Fungi. Compendium of Tropical Fruit Diseases. American Phytopathological Society Press, St. Paul, Minnesota, USA. pp: 58–59. [ Links ]
DNASTAR, 2001. Lasergene. Expert Sequence Analysis Software. User's Manual. Versión 5. DNASTAR, Inc. Madison, Wisconsin, USA. 475 p. [ Links ]
Farr, D. F., G. F. Bills, G. P. Chamuris, and A. Y. Rossman. 1989. Fungi on Plants and Plant Products in the United States. American Phytopathological Society Press. St. Paul, Minnesota, USA. 1252 p. [ Links ]
Freeman, S. 2000. Genetic diversity and host specificity of Colletotrichum species on various fruits. In: Prusky, D. S. Freeman and M. Dickman (eds). Colletotrichum: Host Specificity, Pathology, and Host–Pathogen Interaction. American Phytopathological Society Press. St. Paul, Minnesota. USA. pp: 131–144. [ Links ]
Gunnell, P. S., and W. D. Gubler. 1992. Taxonomy and morphology of Colletotrichum species pathogenic to strawberry. Mycologia 84: 157–165. [ Links ]
Kirk, P. M., P. F. Cannon, J. C. David, and J. A. Stalpers. 2001. Dictionary of the Fungi. CAB International. Oxon, UK. 655 p. [ Links ]
Kumar, S, K. Tamura, and M. Nei. 2004. Mega 3: Integrated software for molecular evolutionary genetics analysis and sequence alignment. Briefings in Bioinformatics 5: 150–163. [ Links ]
Mordue, J. E. M. 1971. Glomerella cingulata. In: C.M.I. Descriptions of Pathogenic Fungi and Bacteria No. 315. Commonwealth Agriculture Bureaux. The Eastern Press. Great Britain, U. K. 2 p. [ Links ]
Nava–Díaz, C., S. Osada–Kawasoe, G. Rendón–Sánchez, y V. Ayala–Escobar. 2000. Organismos asociados a chirimoyo (A. cherimola Mill.) en Michoacán, México. Agrociencia 34: 217–226. [ Links ]
Ploetz, R. C. 1994. Anthracnose. In: Ploetz, R. C., G. A. Zentmyer, W. T. Nishijima, K. G. Rohrbach, and H. D. Ohr (eds). Mango disease caused by fungi. Compendium of Tropical Fruit Diseases. American Phytopathological Society Press. St. Paul, Minnesota, USA. pp: 35–36. [ Links ]
Prusky, D. 1994. Anthracnose. In: Ploetz, R. C., G. A. Zentmyer, W. T. Nishijima, K. G. Rohrbach, and H. D. Ohr (eds). Avocado. Compendium of Tropical Fruit Diseases. American Phytopathological Society Press. St. Paul, Minnesota, USA. pp: 72–73. [ Links ]
SAS (Statistical Analysis System). 1988. SAS User's Guide: Statistics. Release 6.03. SAS Institute, Inc. Cary, North Carolina, USA. 1028 p. [ Links ]
Smith, B. J., and L. L. Black. 1990. Morphological, cultural, and pathogenic variation among Colletotrichum species isolated from strawberry. Plant Dis. 74: 69–76. [ Links ]
Sutton, B. C. 1980. The Coelomycetes: Fungi Iimperfecti with Picnidia, Acervuli and Stromata. Commonwealth Mycological Institute. Kew, Surrey, England. 696 p. [ Links ]
Sutton, B. C. 1992. The genus Glomerella and its anamorph Colletotrichum. In: Bailey J. A., and M. J. Jeger (eds). Colletotrichum: Biology, Pathology and Control. CAB Internacional. Wallingford, UK. pp: 1–26. [ Links ]
Uecker, F. A. 1994. Ontogeny of the ascoma of Glomerella cingulata. Mycologia 86: 82–88. [ Links ]
Villanueva–Arce, R., A. M. Hernández–Anguiano, M. J. Yáñez–Morales, D. Téliz–Ortiz, A. Mora–Aguilera, E. Cárdenas–Soriano, y A. Castañeda–Vildózola. 2005. Caracterización e identificación de Colletotrichum fragariae en frutos de chirimoya. Agrociencia 39: 93–106. [ Links ]
Walker, J., A. Nikandrow, and G. D. Millar. 1991. Species of Colletotrichum on Xanthium (Asteraceae) with comments on some taxonomic and nomenclatural problems in Colletotrichum. Mycological Res. 95: 1175–1193. [ Links ]
Waller, J. M. 1992. Colletotrichum diseases of perennial and other cash crops. In: Prusky, D., S. Freeman, and M. Dickman (eds). Colletotrichum Host Specificity, Pathology, and Host–Pathogen Interaction. American Phytopathological Society Press. St. Paul, Minnesota, USA. pp: 167–185. [ Links ]
Wheeler, H. E. 1956. Sexual versus asexual reproduction in Glomerella. Mycologia 48: 349–353. [ Links ]
White, T. J., T. Bruns, S. Lee, and J. Taylor. 1990. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis, M. A., D. H. Gelfand, J. J. Sninsky, and T. J. White (eds). PCR Protocols: A Guide to Methods and Applications. Academic Press. San Diego, California, USA. pp: 315–322. [ Links ]
Zulfiqar, M., R. H. Brlansky, and L. W. Timmer. 1996. Infection of flower and vegetative tissues of citrus by Colletotrichum acutatum and C. gloeosporioides. Mycologia 88: 121–128. [ Links ]














