Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.42 no.5 Texcoco jul./ago. 2008
Fitociencia
Caracterización morfológica, molecular y fisicoquímica del almidón de plátano oxidado y lintnerizado
Morphological molecular and physicochemical characterization of oxidized and lintnerized banana starch
Mayra Rivas–González, M. Guadalupe C. Méndez–Montealvo*, Mirna M. Sánchez–Rivera, M. Carmen Núñez–Santiago y Luis A. Bello– Pérez
Centro de Desarrollo de Productos Bióticos del IPN. Apartado Postal 24, 62731, Yautepec, Morelos, México. * Autor responsable: (cmendez@ipn.mx)
Recibido: Noviembre, 2006.
Aprobado: Mayo, 2008
Resumen
Se hizo una caracterización morfológica, molecular y fisicoquímica del almidón extraído de plátano "macho" (Musa paradisiaca L.), modificado químicamente por oxidación y por lintnerización. Se empleó el almidón de plátano nativo como referencia. El nivel de modificación se evaluó mediante microscopía de luz polarizada, difracción de rayos X, espectroscopía infrarroja y el perfil de viscoamilografía. El almidón oxidado presentó un grado de sustitución de 0.13 y 0.03% de grupos carbonilo y carboxilo. El almidón nativo y los modificados mostraron la cruz de Malta (birrefringencia) indicando una organización cristalina. Los tres almidones presentaron patrones de difracción entre los tipos A–y B–. La espectroscopía infrarroja reveló la presencia de un alto nivel de organización dentro de los gránulos: 1.678, 1.689 y 1.883 para los almidones nativo, oxidado y lintnerizado. No hubo diferencias (p>0.05) en el perfil de viscosidad de los almidones nativo y oxidado, mientras que el almidón lintnerizado presentó valores menores debido a una probable hidrólisis provocada durante la modificación. El almidón lintnerizado también presentó los menores cambios en sus entalpías (ΔH) de gelatinización y retrogradación, sugiriendo la formación de cristales más pequeños e imperfectos. La caracterización realizada a los almidones de plátano modificados podrá sugerir sus posibles aplicaciones industriales.
Palabras clave: Almidón de plátano, almidón modificado, estructura molecular, lintnerizado.
Abstract
A morphological, molecular and physicochemical characterization was made of the starch extracted from the banana (Musa paradisiaca L.), chemically modified by oxidation and by lintnerization. Native banana starch was used as reference. The modification level was evaluated through polarized light microscopy, X–ray diffraction, infrared spectroscopy and the viscoamylographic profile. The oxidized starch presented a substitution degree of 0.13 and 0.03% of carbonyl and carboxyl groups. The native and modified starches presented the Maltese cross (birefringence) indicating a crystalline organization. The three starches presented diffraction pattern between A– and B–types. Infrared spectroscopy revealed the presence of a high level of organization within the granules: 1.678, 1.689 and 1.883 for the native, oxidized and lintnerized starches. There were no differences (p>0.05) in the viscosity profile of the native and oxidized starches, whereas the lintnerized starch presented lower values due to a probable hydrolysis provoked during the modification. The lintnerized starch also presented the least changes in its enthalpies (ΔH) of gelatinization and retrogradation, suggesting the formation of smaller and more imperfect crystals. The characterization made on the modified banana starches could suggest their possible industrial applications.
Key words: Banana starch, modified starch, molecular structure, lintnerized.
Introducción
El almidón es la principal fuente de carbohidratos sintetizada por las plantas superiores. En la célula se organiza en partículas discretas (gránulos), cuyo tamaño puede variar de 1 a 100 µm (Freitas et al., 2004). Un gránulo de almidón contiene proporciones variables de amilosa y amilopectina (Munhoz et al., 2004). Ambos polisacáridos están constituidos de cadenas de D–glucosa unidos mediante enlaces α (l–4). La amilosa es esencialmente lineal, mientras que la amilopectina está altamente ramificada mediante enlaces α (1–6). La amilopectina forma cristales polimórficos tipo A– y B– que influyen en el arreglo de sus dobles hélices (Imberty y Pérez, 1998). Los cristales tipo A producen hélices relativamente compactas con una menor proporción de agua, mientras que los B dan lugar a una estructura más abierta conteniendo un núcleo helicoidal hidratado. Los estudios de difracción rayos X, permiten conocen este tipo de arreglos (Tester et al., 2004).
Los almidones nativos tienen limitaciones de uso ya que son sensibles al pH, a la temperatura y a los esfuerzos de corte extremos; otra desventaja es que son poco solubles. Para mejorar sus características y diversificar sus aplicaciones, los almidones pueden modificarse por diversos tratamientos (Thirathumthavorn y Charoenrein, 2005). La modificación produce una alteración en una o más de las propiedades físicas, químicas o estructurales del almidón, debido a la incorporación de un componente ajeno a su estructura, o a su degradación controlada por una modificación ácida (Rogols, 1986).
Las regiones amorfas de los gránulos de almidón sometidos a tratamientos con agentes químicos como el hipoclorito de sodio (NaOCl) o el ácido clorhídrico (HC1), son más susceptibles a sufrir una hidrólisis que las zonas cristalinas. Además, los tratamientos de degradación por hidrólisis ácida o lintnerización disminuyen la masa molar del almidón, lo que permite obtener moléculas lineales o escasamente ramificadas (Shin et al., 2004).
Los almidones oxidados se obtienen empleando hipoclorito de sodio con pH y temperatura controladas. Durante este tratamiento los grupos hidroxilo (OH–) del almidón son oxidados primero a grupos carbonilo (C=O) y luego a grupos carboxilo (COOH) (Wang y Wang, 2003); estos últimos son productos primarios de la reacción de oxidación. Los almidones oxidados y lintnerizados se usan en las industrias alimentaria, del papel, textil y farmacéutica (Wang y Wang, 2003). Estas empresas requieren más y mejores almidones modificados para desarrollar nuevos productos (Rogols, 1986).
Técnicas como la difracción de rayos X, la espectroscopía de infrarrojo y la calorimetría de barrido diferencial se usan para evaluar los cambios estructurales de los almidones nativos y modificados. Estos análisis contribuyen al conocimiento de la relación estructura–función, a explicar las propiedades funcionales de los almidones modificados y a sugerir sus posibles aplicaciones. Por ello, el objetivo del presente trabajo fue modificar el almidón de plátano macho (M. paradisiaca L.) por métodos químicos como la oxidación y lintnerización, y caracterizarlos con técnicas morfológicas, moleculares y fisicoquímicas.
MATERIALES Y MÉTODOS
Aislamiento del almidón
Se usaron frutos fisiológicamente inmaduros de plátano macho (M. paradisiaca L.) adquiridos en la Central de Abasto de Cuautla, Morelos. El almidón se aisló en planta piloto según el protocolo reportado por Flores–Gorosquera et al. (2004). El almidón se tamizó en malla 100 U. S.
Almidones modificados por lintnerización y oxidación
Los almidones fueron modificados por lintnerización y oxidación según los métodos reportados por Shin et al. (2003) y Wang y Wang (2003). La lintnerización se efectuó en un reactor de 4L. Se colocaron 500 g de almidón y se adicionó 1 L de HCL 1 M. La mezcla se estabilizó a 35 °C y se agitó a 50 rpm por 6 h. Se adicionó 1 L de hidróxido de sodio (NaOH) 1 M y se ajustó el pH a 6.0. Los sólidos de almidón se lavaron 6 veces con 10 L de agua destilada durante cada ciclo. Finalmente el almidón se secó en una estufa a 37 °C (Shin et al., 2003).
El almidón oxidado se obtuvo en un reactor de 4 L, agitando una dispersión acuosa de almidón al 40% a pH 9.5 ajustado con NaOH y a 35 °C. Para promover la oxidación se adicionó una solución de NaOCl con 1 % de cloro activo por 30 min (0.3 mL–1 min), manteniendo el pH con NaOH 1 N. La reacción se mantuvo 30 min más hasta completar 1 h. Se tomó una alícuota de 24 mL para neutralizarla con ácido sulfúrico (H2SO4) 1 N. Los sólidos se lavaron en 4 etapas con agua destilada, y se centrifugaron 5 min a 3500 g. Una vez eliminado el exceso de los reactivos, los almidones se secaron 24 h a 40 °C.
Grado de sustitución
El contenido de grupos carbonilo (C = O) y carboxilo (COOH) del almidón oxidado se determinó según la metodología reportada por Sánchez–Rivera et al. (2005). Para los grupos carbonilo se preparó una dispersión de 4 g de almidón en ebullición, se enfrió a 40 °C y se ajustó el pH a 3.2 con HCl 0.1 N. Se adicionaron 15 mL de hidroxilamina (25 g en 100 mL de NaOH 0.5 N y 400 mL de agua) y la suspensión se agitó por 4 h. El exceso de hidroxilamina se determinó por titulación (Smith, 1967) y el contenido de grupos C = O se calculó con la ecuación:

Los grupos carboxilo se cuantificaron agitando 2 g de almidón oxidado en 25 mL de HCl 0.1 N por 30 min. La mezcla se filtró y se lavó con 450 mL de agua destilada. Se agregaron 300 mL de agua calentando la mezcla hasta ebullir por 20 min, en un baño de agua con agitación constante. Luego, se adicionaron 150 mL de agua destilada y se tituló con NaOH 0.01 N estandarizado a pH 8.3 (Chattopadhyay et al., 1997). El contenido de COOH se calculó con las siguientes ecuaciones:

Amilosa aparente
Se determinó por el método descrito por Hoover y Ratnayake (2002). Se disolvieron 100 mg de almidón en 15 mL de dimetilsulfóxido (DMSO) al 90 %. La mezcla se agitó por 20 min y se calentó 15 min en un baño de agua a 85 °C. La disolución se enfrió a temperatura ambiente y la mezcla se diluyó con 25 mL de agua. Se tomó una alícuota de 600 mL, se adicionaron 5 mL de solución I–KI (I2 2.5 mM y KI 6.5 mM), se ajustó el volumen a 50 mL con agua destilada y se dejó reposar 15 min a temperatura ambiente. La absorbancia se leyó a 600 nm.
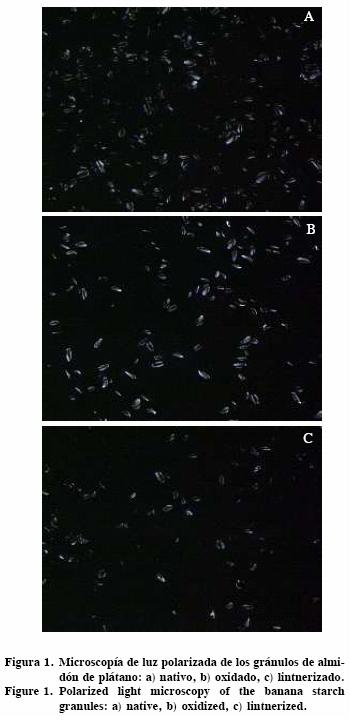
Microscopía de luz polarizada
Se usó un microscopio de luz polarizada (Leitz, Wetzlar, Alemania) con un objetivo 40X y una cámara digital. Las muestras de almidón se espolvorearon en un portaobjeto, se adicionó una gota de agua destilada, se mezcló con una espátula y se colocó un cubreobjeto (Kuakpetoon y Wang, 2008). La captura de las imágenes se hizo con un software Pixela Image Mixer ver 3.0 (Pixela Corporation, Japón).
Difracción de rayos X
Se usaron muestras de 20 mg mantenidas 4 d en una atmósfera con cloruro de potasio (KCl) a 82% de humedad relativa, hasta alcanzar 20 a 25% de humedad. Se utilizó un difractómetro de Rayos–X (Bruker, UK D5005) de ángulo ancho equipado con una fuente de cobre, operado a 40 KV y 40 mA que produjo una radiación de CuKa con una longitud de onda de 1.54 Å. Los datos se recolectaron en un intervalo de 4–38° cada 0.1° con una velocidad de 60 s/o. La línea base del difractograma fue corregida en el intervalo de barrido y el vector fue normalizado con el programa EVA 5.0 (Bruker, UK). El porcentaje de cristalinidad se calculó con la ecuación (Millán–Testa et al., 2005):

Espectroscopía de infrarrojo
Se usó un espectrofotómetro de infrarrojo (Bruker, UK) y una celda térmica de simple reflactancia con un diamante (Graseby–Specac Ltd., UK). Para minimizar las pérdidas de humedad durante las mediciones, se usó una cubierta de zafiro sellada con un anillo de goma. Se recolectaron 32 barridos para cada muestra con una resolución de 4 cm–1 y a 25 °C. Se usó el programa OPUS 3.0 (Bruker, UK) para analizar los datos. A partir de las longitudes de onda 1045 y 1022 cm–1 se determinó la proporción de zonas cristalina y amorfa (Smits et al., 1998). Cocientes 1045/1022 mayores a 1.0 se asociaron a una mayor proporción de material cristalino, mientras que los menores a 1.0 a una mayor proporción de material amorfo.
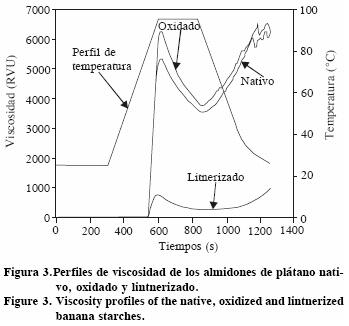
Análisis rápido de viscosidad (ARV)
Se prepararon dispersiones de las muestras al 1 % (p/v) de sólidos totales en base seca y se estudiaron en un analizador rápido de viscosidad (ARV) (Newport Scientific Pty. Ltd, Australia). La etapa de calentamiento se inició a 25 °C y se llevó hasta 95 °C (cocción) manteniéndose 7 min a esa temperatura; se enfrió a 50 °C por 1 min. La velocidad de calentamiento–enfriamiento fue 2.5 °C min–1 y la velocidad de rotación del tazón fue 160 rpm (AACC, 2000).
Análisis térmico
Se usó un calorímetro de barrido diferencial DSC 7 (Perkin–Elmer, U.K) calibrado con indio y ciclohexano. Se pesaron 11 mg de muestra en base seca en una charola de aluminio y se adicionaron 35 µL de agua destilada. La charola se selló herméticamente y se equilibró por 12 h en un agitador de rodillos. Como referencia se empleó una charola vacía. La velocidad de calentamiento fue 10 °C min–1 y los datos se analizaron con el programa Pyris Specific Heat Software (Perkin–Elmer, U.K). Las muestras gelatinizadas se almacenaron por 24 (tiempo cero), 120 y 312 h a 4 °C. Las determinaciones se hicieron por duplicado.
Análisis estadístico
Se hizo un análisis de variancia de una vía de (p<0.05); cuando se encontraron diferencias significativas se usó la prueba de Tukey (Walpole et al., 1999).
RESULTADOS Y DISCUSIÓN
Grupos carbonilo y carboxilo
El almidón oxidado presentó un grado de sustitución de grupos C=O y COOH de 0.013 y 0.03; los grupos COOH se encontraron en mayor proporción que los C=O debido al pH alcalino usado en la reacción (Wang y Wang, 2003). Estos resultados son equivalentes a los reportados por Sánchez–Rivera et al. (2005), quienes usaron la misma fuente de C1 con una concentración 1% de C1 activo. Kuakpetoon y Wang (2001) oxidaron diferentes tipos de almidón empleando una concentración de NaOCl de 0.8%. Ellos determinaron grados de sustitución de grupos COOH y C=O para diferentes fuentes de almidones modificados encontrando valores de 0.21 y 0.03%; 0.05 y 0.03 % y 0.07 y 0.03% para almidones de papa, maíz y arroz. Así el grado de oxidación depende de la fuente botánica indicando la versatilidad de usos de los almidones según su respuesta a la modificación.
Amilosa aparente
Los contenidos de amilosa aparente para los almidones nativo, oxidado y lintnerizado fueron 36.39, 38.48 y 44.20%. No hubo diferencias significativas (p > 0.05) entre el almidón nativo y el oxidado, pero sí entre éstos y el almidón lintnerizado. Aparicio–Saguilán et al. (2005) reportaron resultados similares para almidones nativos (37.0%) y lintnerizados (44.8%) de plátano. Con estos datos se refuerza el hecho que la lintnerización produce más cambios en el almidón que la oxidación. Esto se atribuye a que durante el tratamiento ácido de la lintnerización, se rompen las cadenas de amilosa, así como los puntos de ramificación de la amilopectina, fenómeno conocido como despolimerización (Jayakody y Hoover, 2002). Sin embargo, la hidrólisis ácida no degrada completamente la estructura cristalina de los gránulos de almidón (Franco et al., 2002), lo cual podría producir un almidón resistente a la hidrólisis por las enzimas digestivas (Aparicio–Saguilán et al., 2005).
Microscopía de luz polarizada
En los tres almidones se observó la cruz de Malta (birrefringencia) (Figura 1), indicando la presencia de cierto orden en las moléculas que forman el almidón, pero sin hacer referencia a alguna forma cristalina. Así, los dos procesos de modificación aplicados al almidón de plátano no alteraron completamente la estructura molecular del almidón. Esta característica permite tener gránulos de almidón parcialmente despolimerizados con un cierto porcentaje de la estructura cristalina intacta. La estructura de los almidones modificados se caracterizó por la presencia de gránulos que aún mostraban anillos de crecimiento, rodeados por gránulos fragmentados. Resultados similares se obtienen al lintnerizar almidones cerosos de papa y maíz (Bertoft, 2004).
Difracción de rayos X
El patrón de difracción de los tres almidones analizados podría considerarse como una mezcla de los tipos A– y B– (Figura 2). Sin embargo, Zobel (1988) indica que el patrón B presenta dos picos característicos 2θ=5° y 2θ=18°, mientras que en este estudio sólo se encontró el segundo (20 = 18°); pero Millán–Testa et al. (2005) observaron un patrón tipo C– para el almidón nativo de plátano (Musa paradisiaca), debido a que sí mostraron el pico a 2θ=5°, aunque en almidones nativos aislados de otras especies de plátano se han reportado patrones de difracción tipo B– (Faisant et al., 1995).
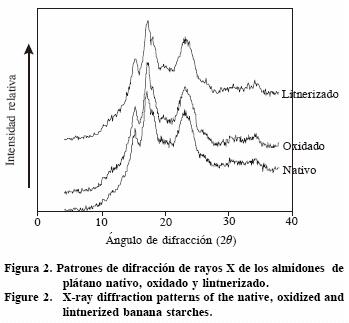
Las modificaciones químicas no afectaron el patrón de difracción pero sí el porcentaje de cristalinidad del almidón, el cual fue diferente (p<0.05) en todos los casos: 19.40% para el almidón nativo, 21.19% para el oxidado y 21.79% para el lintnerizado. Una explicación del aumento observado en los almidones oxidados es que durante la oxidación puede ocurrir un cierto grado de despolimerización como efecto secundario (Kuakpetoon y Wang, 2008). Esto permite obtener cadenas lineales de amilosa que se rearreglan en una estructura ordenada (Morrison et al., 1993; Raja, 1994). El proceso de lintnerización fue desarrollado para aumentar el grado de cristalinidad del almidón (Bertoft, 2004). A pesar de que esa tendencia se encontró en este estudio, el efecto no fue tan drástico debido a que las condiciones de reacción aplicadas no fueron suficientes para obtener mayor cristalinidad (6 h reacción). Con almidones de tapioca (39.53% de cristalinidad) Atichokudomchai et al. (2001) reportaron aumentos de 41.59% y 57.75% en almidones lintnerizados durante 12 y 768 h. Lo anterior indica que se puede variar el tiempo de reacción de lintnerización para obtener el grado de cristalización requerido según las necesidades de la industria.
Espectroscopía de infrarrojo
De la relación 1045/1022 se obtuvieron los siguientes valores para los almidones: nativo 1.678, oxidado 1.689 y lintnerizado 1.883. Esto indica que la mayor cantidad de material cristalino se encontró en la litnerización, lo cual coincide con lo reportado para un almidón de papa hidrolizado con ácido (con un valor de la relación >1.5) (Sevenou et al., 2002). No hubo diferencias significativas entre el almidón nativo y el oxidado pero sí (p<0.05) entre estos dos y el lintnerizado, pese a que la oxidación introduce los grupos funcionales de carbonilo y carboxilo en las cadenas de amilosa y amilopectina; la región cristalina es la menos afectada. Para almidones nativos de maíz de dos variedades los valores son 1.36 y 1.47 (Agama–Acevedo et al., 2005) y 1.37 y 1.12 para almidones nativos de okenia y de plátano (Millán–Testa et al., 2005). Estos últimos son menores a los encontrados en el presente estudio. Los porcentajes de cristalinidad obtenidos mediante la técnica de rayos X fueron similares para los almidones oxidado y lintnerizado. Sin embargo, con la técnica de infrarrojo el lintnerizado mostró una mayor proporción de zonas cristalinas. Esta diferencia puede deberse a sensibilidad de la técnica, ya que la de infrarrojo mide el ordenamiento de corto alcance (a nivel de los enlaces) en la estructura de los almidones y la de rayos X es de largo alcance (ordenamiento de las cadenas de la amilopectina) (Van Soest et al., 1995).
Viscosidad de las pastas por ARV
El almidón lintnerizado presentó las más bajas viscosidades de pico y de cocción de la pasta (Figura 3), debido probablemente a una mayor hidrólisis de las regiones amorfas del almidón y aumento de las zonas cristalinas (Sevenou et al., 2002). En la etapa isotérmica a la temperatura máxima del experimento (95 °C), la viscosidad de los almidones tuvo una gran disminución, un comportamiento característico del rompimiento de la estructura granular del almidón (Thomas y Atwell, 1999). Durante el enfriamiento se observó la reasociación de las moléculas disueltas durante el calentamiento. En el almidón lintnerizado la reasociación fue menor debido a la producción de cadenas cortas durante esta modificación (Han y Hamaker, 2001). Las modificaciones químicas producen almidones con diferentes propiedades funcionales, y más aún cuando éstos provienen de diferentes fuentes. Kuakpetoon y Wang (2001) reportaron, para el almidón de papa modificado con 0.8% de cloro activo, una viscosidad de pico menor que en almidón sin modificar, mientras que el almidón de maíz modificado en las mismas condiciones tuvo una viscosidad de pico mayor con respecto a su almidón nativo.
Propiedades térmicas
La temperatura de gelatinización (Tp) no mostró diferencias estadísticas entre el almidón nativo y los modificados, pero sí (p<0.05) entre estos últimos (Cuadro 1). Al analizar la diferencia entre la temperatura final y la inicial (intervalo de gelatinización, IG), el almidón lintnerizado presentó el valor mayor (13.53 °C), comparado con el nativo y el oxidado (11.50 y 11.75 °C). Entre estos últimos no hubo diferencias significativas, pero sí con el lintnerizado (p<0.05). Un valor mayor de IG sugiere un material más ordenado (Jayakody y Hoover, 2002).
El almidón lintnerizado presentó el menor cambio de entalpía de gelatinización (ΔH) a pesar de tener mayor cristalinidad, pero posiblemente sus cristales son más pequeños e imperfectos, requiriendo menor energía para desorganizarse (Paredes–López et al., 1994). El almidón oxidado presentó la ΔH de gelatinización más alta debido a que los grupos C=O y COOH estabilizan la estructura a través de puentes de hidrógeno, requiriendo mayor energía para su desorganización.
La Tp de transición de fase de la amilopectina retrogradada (Cuadro 2) fue menor a la de gelatinización debido a que los cristales formados durante la retrogradación fueron más pequeños e imperfectos (Paredes–López et al., 1994). La tendencia fue similar para la ΔH de transición durante el almacenamiento, logrando su valor máximo a las 120 h, y luego se mantuvo constante. Esta entalpía fue menor a la de gelatinización para cada almidón, es decir su estructura fue diferente, durante su recristalización. El almidón lintnerizado presentó los valores más bajos de ΔH de transición de fase y de Tp; además tuvo el menor nivel de reorganización como se observó en el perfil de viscosidad. El almidón nativo presentó la mayor tendencia a retrogradar, propiedad que disminuyó al modificar el almidón.
CONCLUSIONES
Los almidones nativo, oxidado y lintnerizado mostraron birrefringencia, indicando la presencia de una organización estructural. El almidón lintnerizado presentó un mayor grado de cristalinidad, una menor entalpía de gelatinización y formó pastas con viscosidades menores que el almidón oxidado. Esto indica la formación de cristales imperfectos o más pequeños. Así, estos almidones podrían tener aplicación industrial: el almidón lintnerizado podría ser usado en productos de panificación y el almidón oxidado para elaborar aderezo para ensalada y mermeladas.
AGRADECIMIENTOS
Se agradece el apoyo económico al SIP–IPN, COFAA–IPN y EDI–IPN. Uno de los autores (MRG) agradece la beca otorgada por el CONACYT.
LITERATURA CITADA
AACC. 2000. Approved Methods of the American Association of Cereal Chemists. American Association of Cereal Chemists. 10TH ed Vol. II. St. Paul, M. N. pp: 58. [ Links ]
Agama–Acevedo, E., M. A. Ottenhof, A. F. Imad, y O. Paredes–López. 2005. Aislamiento y caracterización del almidón de maíces pigmentados. Agrociencia. 39: 419–429. [ Links ]
Aparicio–Saguilán, A., E. Flores–Huicochea, J. Tovar, F. García–Suárez, F. Gutiérrez–Meraz, and L. A. Bello–Pérez. 2005. Resistant starch–rich powders prepared by autoclaving of native and lintnerized banana starch: partial characterization. Starch/ Stärke. 57: 405–412. [ Links ]
Atichokudomchai, N., S. Shobsngob, P. Chinachoti, and S. Varavinit. 2001. A study of some physicochemical properties of high–crystalline tapioca starch. Starch/Stärke. 53: 577–581. [ Links ]
Bertoft, E. 2004. Lintnerization of two amylose–free starches of A–and B– crystalline types, respectively. Starch/Stärke. 56: 167–180. [ Links ]
Chattopadhyay, S., R. S. Singhal and P. R. Kulkarni. 1997. Optimization of conditions of synthesis of oxidized starch from corn and amaranth for use in film–forming applications. Carbohydr. Polym. 34: 203–212. [ Links ]
Faisant, N., D. J. Gallant, B. Bouchet, and M. Champ. 1995. Banana starch breakdown in the human small intestine studied by electron microscopy. Europ. J. Clin. Nutr. 49: 98–104. [ Links ]
Flores–Gorosquera, E., F. J. García–Suárez, E. Flores–Huicochea, M. C. Núñez–Santiago, R. A. González–Soto, y L. A. Bello–Pérez. 2004. Rendimiento del proceso de extracción de almidón a partir de frutos de plátano (Musa paradisiaca). Estudio en planta piloto. Acta Cient. Vene. 55(1):86–90. [ Links ]
Franco, C. M. L., R. A. F. Cabral, and D. Q. Tavares. 2002. Structural and physicochemical characteristics of lintnerized native and sour cassava starches. Starch/Stäerke. 54(10):469–475. [ Links ]
Freitas, R. A., P. C. Paula, J. P. A. Feitosa, S. Rocha, and M. R. Sierakwski. 2004. Amylose contents, rheological properties and gelatinization kinetics of yam (Discorea alata) and Cassava (Manihot utilissima) starches. Carbohydr. Polym. 55: 3–8. [ Links ]
Han, X., and B. R. Hamaker. 2001. Amylopectin fine structure and rice starch paste breakdown. J. Cereal Sci. 34(3): 279–284. [ Links ]
Hoover, R., and W. Ratnayake. 2002. Starch characteristics of black bean, chick pea, lentil, navy bean and pinto bean cultivars grown in Canada. Food Chem. 78: 489–498. [ Links ]
Imberty, A., and S. Pérez. 1998. A revisit to the three–dimensional structure of B–type starch. Biopolymers 27: 1205–1221. [ Links ]
Jayakody, L., and R. Hoover. 2002. The effect of lintnerization on cereal starch granules. Food Res. Int. 35(7):665–680. [ Links ]
Kuakpetoon, D., and Y. Wang. 2001. Characterization of different starches oxidized by hypoclorite. Starch/Stärke. 53:211–218. [ Links ]
Kuakpetoon, D., and Y. Wang. 2008. Locations of hypochlorite oxidation in corn starches varying in amylose content. Carbohydr. Research. 343:90–100. [ Links ]
Millán–Testa, C. E., M. G. Méndez–Montealvo, M. A. Ottenhof, I. A. Farhat, and L. A. Bello–Pérez. 2005. Determination of the molecular and structural characteristics of okenia, mango and banana starches. J. Agric. Food Chem. 53: 495–501. [ Links ]
Morrison, W. R., R. F. Tester, M. J. Gidley, and J. Karkalas. 1993. Resistance to acid hydrolysis of lipid complexed amylose and lipidfree amylose in linterized waxy and non–waxy barley starch. Carbohydr. Res. 245: 289–302. [ Links ]
Munhoz, M. P., F. H. Weber, and Y. K. Chang. 2004. Influencia de hidrocoloides na texture de gel de amido de milho. Cién. Tecnol. Altment. Campinas. 24(3): 403–406. [ Links ]
Paredes–López, O., L. A. Bello–Pérez, and M. G. López. 1994. Amylopectin structural gelatinization and retrogradation studies. Food Chem. 50:414–417. [ Links ]
Raja, K. C. M. 1994. Modified properties of lintnerized cassava and maize starches. Carbohydr. Research. 24: 85–90. [ Links ]
Rogols, S. 1986. Starch modifications: A view into the future. Cereal Foods World. 31(12): 869–874. [ Links ]
Sánchez–Rivera, M. M., F. J. L. García–Suárez, M. Velásquez del Valle, F. Gutiérrez–Meraz, and L. A. Bello–Pérez. 2005. Partial characterization of banana starches oxidized by different levels of sodium hypoclorite. Carbohydr. Polym. 62: 50–56. [ Links ]
Sevenou, O., S. E. Hill, I. A. Farhat, and J. R. Mitchell. 2002. Organization of the external region of starch granules as determined by infrared spectroscopy. Int. J. Biol. Macrom. 31: 79–85. [ Links ]
Shin, M., K. Woo, and P. A. Seib. 2003. Hot water solubilities and water sorptions of resistant starches at 25 °C. Cereal Chem. 80(5): 564–566. [ Links ]
Shin, S., J. Bien, K. H. Park, and T. W. Moon. 2004. Effect of partial acid hydrolisis and heat–moisture treatment on formation of resistant tuber starch. Cereal Chem. 81(2): 194–198. [ Links ]
Smith, R. J. 1967. Production and use of hypochlorite oxidized starches. In: Whistler R. L. and E. F. Paschall (eds). Starch Chemistry and Technology. Academic Press, New York. pp: 620–625. [ Links ]
Smits, A. L., F. C. Ruhnau, J. F. Vliegenthart, and J. J. Van Soest. 1998. Ageing of starch based systems as observed with FT–IR and solid–state NMR spectroscopy. Starch/Stärke. 50: 478–483. [ Links ]
Tester, R.F., J. Karkalas, and X. Qi. 2004. Starch–composition, fine structure and architecture. J. Cereal Sci. 39: 151–165. [ Links ]
Thirathumthavorn, P., and S. Charoenrein. 2005. Thermal and pasting properties of acid–treated rice starches. Starch/Stärke. 57: 217–222. [ Links ]
Thomas, D. J., and W. A. Atwell. 1999. Starches: Practical Guides for the Food Industry. St. Paul, M N. USA. Egan Press Handbook Series AACC. pp: 19–22. [ Links ]
Van Soest, J. J. G., H. Tournois, D. de Wit, and J. F. G. Vliegenthart. 1995. Short–range structure in (partially) crystalline potato starch determined with attenuated total reflectance Fourier–transform IR spectroscopy. Carbohydr. Research. 279: 201–214. [ Links ]
Walpole, R. E., R. H. Myers, y S. L. Myers. 1999. Probabilidad y Estadística para Ingenieros. 6ª ed. Prentice–Hall Hispanoamericana. México. pp: 481–482. [ Links ]
Wang, Y., and L. Wang. 2003. Physicochemical properties of common and waxy corn starches oxidized by different levels of sodium hypochlorite. Carbohydr. Polym. 52: 207–217. [ Links ]
Zobel, H. F. 1988. Starch crystal transformation and their industrial importance. Starch/Stärke. 40:1–7. [ Links ]














